Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
Appunti di Cardiochirurgia
Capitolo 5
Patologie valvolari acquisite
1
pagina 1
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 2
Nel corso degli anni le patologie valvolari cardiache hanno avuto importanti cambiamenti inerenti
l’epidemiologia, le procedure diagnostiche e terapeutiche e quindi la prognosi.
Dal punto di vista epidemiologico, nei paesi più sviluppati la riduzione della malattia reumatica ha causato
di riflesso una drastica riduzione di valvulopatie ad essa correlate, che comunque rimangono frequenti nei
paesi meno sviluppati.
Peraltro con l’innalzamento dell’età media si è assistito ad un incremento delle patologie di tipo
degenerativo in particolare, a carico della valvola aortica.
Dal punto di vista diagnostico l’esame di riferimento è l’ecocardiogramma color-doppler per via transtoracica, che permette di effettuare una valutazione adeguata della maggior parte delle patologie valvolari
cardiache. L’ecocardiogramma color-doppler per via trans-esofagea, l’ecocardiogramma color-doppler
sotto sforzo (eco-stress con dobutamina), e più raramente la risonanza magnetica completano il quadro
diagnostico in casi particolari.
Dal punto di vista terapeutico la terapia chirurgica ha avuto negli anni importanti progressi soprattutto
nelle tecniche di riparazione valvolare, con un notevole miglioramento della prognosi, anche a lungo
termine dei pazienti sottoposti a intervento di chirurgia valvolare.
Patologia valvolare mitralica
Stenosi mitralica.
Eziologia:
la stenosi mitralica è tra i vizi valvolari acquisiti quello maggiormente connesso eziologicamente alla cardite
reumatica. Negli ultimi decenni con il calo degli episodi di reumatismo articolare acuto la stenosi mitralica
ha subito un’importantissima riduzione nei paesi sviluppati, ma rimane diffusa nei paesi in via di sviluppo.
Anatomia patologica:
dal punto di vista morfologico la stenosi mitralica è caratterizzata da lembi valvolari diffusamente ispessiti
con tessuto fibroso, (figura 5. 1) e frequentemente interessato da apposizioni calcifiche. Le commessure
sono fuse, le corde tendinee sono accorciate, retratte e fuse tra loro. Dal punto di vista funzionale i lembi
valvolari diventano ipomobili e rigidi, con restringimento della valvola, che assume una forma ad imbuto.
2
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 3
Fig 5.1 versante atriale e ventricolare di una valvola mitralica stenotica post reumatica
Fisiopatologia, sintomatologia e segni clinici:
il restringimento dell’area valvolare genera un aumento del gradiente diastolico di pressione transmitralico: è questo l’aspetto emodinamico fondamentale della stenosi mitralica, da cui derivano le
successive alterazioni fisiopatologiche. Quanto più la stenosi valvolare è marcata, tanto maggiore sarà il
gradiente di pressione trans-mitralico.
L’aumento di pressione a livello dell’atrio sinistro provoca a sua volta un incremento di pressione a carico
delle vene e dei capillari polmonari; questa congestione venosa polmonare provoca aumento della rigidità
del polmone ed è la causa della dispnea da sforzo.
Figura 5,2 adattamento del circolo polmonare alla stenosi mitralica nella netterimage.com
3
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 4
Un ulteriore aumento di pressione a livello dei capillari polmonari, in particolare se acuto, comporta una
trasudazione all’interno degli alveoli, con conseguente edema polmonare. Un altro aspetto conseguente
all’ipertensione polmonare è la rottura di connessioni venose polmonari-bronchiali, che causa emottisi.
Inoltre la dilatazione atriale sinistra conduce all’insorgenza di fibrillazione atriale.
La ritenzione di liquidi, e i sintomi legati all’ insufficienza del ventricolo destro sono reperti tipici della
patologia in fase avanzata e non trattata (stenosi mitralica tricuspidalizzata).
Il reperto ascultatorio principale è il soffio (rullio) diastolico, in alcuni casi associato a schiocco di apertura
della valvola.
Ulteriori sintomi sono l’insorgenza di fibrillazione atriale e l’embolia sistemica.
Diagnostica strumentale:
la radiografia del torace può mostrare un aumento progressivo del II arco di sinistra (cono della polmonare)
in corso di Ipertensione polmonare secondaria a stenosi mitralica. Inoltre è spesso riscontrabile una
congestione del circolo polmonare.
L’elettrocardiogramma può essere normale, nei casi avanzati si possono osservare segni di ipertrofia del
ventricolo destro o fibrillazione atriale.
L’esame diagnostico di riferimento è, come detto in precedenza, l’ecocardiogramma color-doppler transtoracico, attraverso cui è possibile stimare l’area valvolare, il gradiente trans-valvolare, eventuali
apposizioni calcifiche e, se sussiste, il grado di insufficienza associata.
Si considera una stenosi mitralica lieve con area planimetrica valvolare maggiore di 1,5 cmq, moderata con
area tra 1,5 e 1 cmq, severa con area inferiore a 1 cmq.
Il gradiente trans-valvolare di una stenosi mitralica severa è maggiore di 10 mmHg.
La pressione arteriosa polmonare è maggiore di 30 mmHg.
Terapia medica: consiste nell’attuazione della profilassi dell’endocardite, terapia antiartmica,
anticoagulazione orale in caso di fibrillazione atriale, terapia diuretica.
Indicazioni e opzioni terapeutiche.
Indicazioni: vi è indicazione ad intervenire nei casi di stenosi mitralica severa in presenza di sintomi ad essa
riconducibili e nei pazienti asintomatici con ipertensione polmonare.
Le opzioni terapeutiche della stenosi mitralica consistono nella dilatazione percutanea o nell’intervento a
cuore aperto.
La dilatazione percutanea è da considerare solo nei casi che non presentino né calcificazioni né
insufficienza.
In caso di indicazione all’intervento chirurgico a completamento diagnostico viene eseguita una
coronarografia nei pazienti maschi di età maggiore di 40aa e nelle donne con età maggiore di 50aa, o nei
pazienti in cui si sospetti la presenza di cardiopatia ischemica (tale esame viene eseguito anche per tutte le
altre patologie valvolari cardiache con indicazione chirurgica).
4
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 5
L’intervento chirurgico si esegue a cuore aperto con l’ausilio della circolazione extracorporea. L’accesso
chirurgico si effettua in sternotomia mediana o in toracotomia destra.
Fig. 5. 3-4 accesso sternotomico .
Fig. 5.5 accesso toracotomico
L’esposizione della valvola mitrale può essere ottenuta in due modi:
con un’atriotomia trans-settale, cioè aprendo l’atrio destro, poi il setto interatriale, e quindi il tetto
dell’atrio sinistro, o con un’incisione parasettale a livello del solco di Sondergaard, quest’ultimo si raggiunge
dissecando tra atrio destro e atrio sinistro a 4 cm dalla vena polmonare superiore destra. Individuato tale
solco (o piano di Sondergaard) si esegue un’incisione sopra la vena polmonare superiore destra fino a sopra
la vena polmonare inferiore destra.
5
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 6
Figura 5;6 atriotomia sinistra secondo Sondergaard www.edwards.com.
L’intervento chirurgico consiste di solito nella sostituzione della valvola nativa con una protesi poiché, a
causa dei rimaneggiamenti dell’apparato valvolare e sub-valvolare, che spesso nella stenosi mitralica si
riscontrano, non vi è la possibilità di un intervento conservativo.
Nei casi in cui non vi sia insufficienza e si riscontri la sola fusione delle cuspidi si può eseguire una
dilatazione valvolare a cuore aperto.
6
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 7
Insufficienza mitralica.
L’insufficienza mitralica è una condizione di alterazione anatomo-funzionale a carico dell’apparato valvolare
e/o subvalvolare mitralico in cui, per la mancanza di adeguata coaptazione dei lembi valvolari, sussiste un
passaggio di sangue dal ventricolo all’atrio sinistro. Se l’entità del rigurgito è rilevante, dal punto di vista
fisiopatologico si verificano sovraccarico e congestione a carico del circolo polmonare, e una progressiva
dilatazione a carico sia dell’atrio che del ventricolo sinistro con evoluzione verso l’insufficienza cardiaca.
Classificazione
Vi sono diverse modalità di classificare l’insufficienza mitralica.
In base all’eziologia:
Insufficienza mitralica primitiva (organica) da alterazioni dell’apparato valvolare e sottovalvolare, come
la degenerazione mixomatosa, endocarditi o la malattia reumatica.
Insufficienza mitralica funzionale (secondaria) da causa ischemica, o da disfunzione ed alterata
geometria del ventricolo sinistro come nella cardiomiopatia dilatativa.
In base alla modalità di insorgenza:
cronica come nel caso di degenerazione mixomatosa, malattia reumatica, cardiopatia dilatativa
idiopatica o post-ischemica.
acuta come nel caso di rottura del muscolo papillare quale complicazione di un infarto miocardico,
o rottura di corde tendinee causata da un processo endocarditico.
Fisiopatologia.
A) Insufficienza mitralica cronica:
nell’insufficienza mitralica si ha un coinvolgimento della camera cardiaca a valle e di quella a monte della
valvola mitrale: questa è la differenza essenziale rispetto alla stenosi mitralica. A livello del ventricolo
sinistro si crea un sovraccarico di volume: infatti ad ogni diastole ritorna al ventricolo sinistro, oltre alla
quantità di sangue proveniente dal circolo polmonare in atrio sinistro, anche la quantità di sangue
rigurgitata dal ventricolo all’atrio sinistro nella sistole precedente.
Nel tempo il ventricolo si adatta dilatandosi e ipertrofizzandosi.
7
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 8
La quantità di sangue espulso in aorta, cioè la gittata cardiaca, tende a ridursi, causando quindi una
riduzione della portata cardiaca. Nelle fasi iniziali della malattia la frazione di eiezione, che è un indice
comunemente usato della contrattilità ventricolare, è di solito conservata
(F.E. = vol. telediastolico – vol. telesistolico/vol. telediastolico).
Tuttavia col passare del tempo il ventricolo sinistro, sottoposto al sovraccarico di volume, va incontro a un
deficit contrattile, con il progressivo aumento della pressione telediastolica; mentre la dilatazione del
ventricolo sinistro causa una dilatazione dell’anulus mitralico con aumento secondario del rigurgito. Si
instaura quindi un circolo vizioso che porta allo scompenso cardiaco.
A livello dell’atrio sinistro il rigurgito mitralico causa effetti differenti, soprattutto in relazione alla modalità
di insorgenza dell’insufficienza mitralica: acuta o cronica. Nel caso di insufficienza cronica si verifica una
progressiva dilatazione dell’atrio, con rischio di insorgenza di fibrillazione atriale.
B) Insufficienza mitralica acuta:
in presenza di un’insufficienza mitralica acuta, come nel caso di rottura di corde tendinee in corso di
endocardite infettiva, o di rottura di un muscolo papillare in caso di infarto miocardico, il rigurgito massivo
associato ad un’insorgenza acuta non consente la dilatazione graduale dell’atrio sinistro. Si ha quindi una
salita repentina della pressione atriale sinistra, e conseguentemente delle pressioni venose polmonari, che
comporta l’instaurarsi con una certa rapidità del quadro clinico di edema polmonare acuto.
Figura 5.7 adattamento fisiopatologico nell’insufficienza mitralica.
8
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 9
Sintomatologia e segni clinici: le manifestazioni cliniche sono già state accennate. In caso di insufficienza
mitralica acuta il quadro clinico è spesso instabile, con un’evoluzione rapida verso l’edema polmonare.
Possono aversi ulteriori complicazioni emodinamiche nel caso di rottura postinfartuale del muscolo
papillare, o settiche nel caso di un’endocardite.
Nel caso di insufficienza mitralica cronica i sintomi variano in funzione dell’entità del rigurgito e dello stato
di avanzamento della patologia; in molti casi il rilievo è puramente auscultatorio ed ecocardiografico, con
assenza di sintomi. Col tempo possono cominciare a instaurarsi dispnea da sforzo e ulteriori sintomi legati
allo scompenso cardiaco. La dilatazione
a carico dell’atrio sinistro può determinare insorgenza di
palpitazioni ed evolvere in fibrillazione atriale.
Il segno clinico principale è un soffio sistolico auscutabile alla punta e irradiato all’ascella.
Diagnostica strumentale.
Radiografia del torace: può mostrare un aumento del profilo atriale e ventricolare sinistro.
È spesso riscontrabile anche in questo caso una congestione del circolo polmonare.
L’elettrocardiogramma può essere normale, può a volte mettere in evidenza alcune aritmie, quali
extrasistoli ventricolari, tachiaritmie sopraventricolari e nei casi avanzati fibrillazione atriale.
L’esame diagnostico di riferimento è l’ecocardiogramma color-doppler trans-toracico, attraverso cui è
possibile stimare l’entità del rigurgito, l’area dell’orificio rigurgitante, e altri parametri che concorrono a
quantificare la gravità dell’insufficienza, il meccanismo con cui si realizza l’insufficienza (vedi
successivamente la classificazione di Carpentier) , eventuali apposizioni calcifiche e, se presente, il grado di
stenosi valvolare associata.
In base all’entità del rigurgito, all’area dell’orificio rigurgitante, e ai valori di vena contracta distinguiamo
l’insufficienza mitralica di grado lieve, moderato, e severo:
insufficienza mitralica funzionale
rigurgito Area orificio
rigurgitante
lieve
moderata
30ml <
20mm2<
Insufficienza mitralica organica
Vena
contracta
<3mm
Rigurgito
lieve
3-6.9 mm
moderata
severa
>30 ml
>20mm2
>7mm
severa
Tabella 5;1 parametri ecocardiografici dell’insufficienza mitralica.
9
20%< area
AS
>20-40%
area AS
oppure
<60ml
>60 ml
Area orificio
rigurgitante
<20mm2
Vena
contracta
<3mm
>20-40<mm2
3-6.9 mm
>40mm2
>7mm
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 10
Terapia medica consiste nella somministrazione di Diuretici, ACE-inibitori a basse dosi
(per la prevenzione del rimodellamento ventricolare), terapia delle aritmie (FA), digitale.
Indicazioni all’intervento chirurgico:
trovano indicazione al trattamento chirurgico tutti i pazienti con insufficienza mitralica severa e
concomitante presenza di sintomi ad essa riferibili. Tuttavia, considerando che l’evoluzione della patologia
è a volte subdola, vi è indicazione all’intervento chirurgico anche nei pazienti asintomatici con iniziali segni
ecocardiografici di disfunzione ventricolare sinistra quali:
-
frazione di eiezione al di sotto del 60%,
-
diametro telesistolico del ventricolo sinistro > 40 mm, in particolare se, dai dati a disposizione, si
prevede la possibilità di riparazione della valvola stessa.
In base al movimento dei lembi classifichiamo l’insufficienza mitralica in tre tipi
(classificazione
secondo
Carpentier;
figura5;8)
tipo 1: movimento dei lembi normale, come nel caso di una perforazione a carico di un lembo, secondaria a
un processo endocarditico.
tipo 2: movimento dei lembi prolassante, come nel caso della degenerazione mixomatosa o nella rottura di
corde tendinee.
tipo 3: lembi retratti (tethering) a sua volta suddiviso in 3A retrazione in diastole, 3B retrazione in sistole.
L’atteggiamento retratto dei lembi mitralici (tethering) si riscontra in caso di cardiopatia dilatativa
idiopatica o post-ischemica.
10
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 11
Tecniche di riparazione chirurgica della valvola mitrale
Anche in questo caso l’intervento chirurgico si esegue a cuore aperto con l’ausilio della circolazione
extracorporea. L’accesso chirurgico si effettua in sternotomia mediana o in toracotomia destra.
Le tecniche di esposizione della valvola sono le stesse descritte per la stenosi mitralica (incisione
biatriotransettale o parasettale dell’atrio sinistro).
A seconda del meccanismo dell’insufficienza esistono diversi tipi di tecniche riparative.
In caso di prolasso isolato del lembo posteriore le tecniche riparative proposte sono:
la resezione quadrangolare del lembo posteriore (figura5;7 ),
la resezione triangolare del lembo posteriore (figura5;9),
Figura 5;10 (Maurice Enriquez-Sarano, 07 April 2009 Lancet)
11
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
l’
-
impianto
di
neocorde
tendinee
in
pagina 12
goretex
figura
5;11
Zussa
JHVD
.
In presenza di cleft questi possono essere suturati con un 5-0 in monofilamento se sono
profondi.
Figura 5;12 Sliding plasty
-
In caso di un prolasso coinvolgente tutto il lembo posteriore, in cui vi sia un rialzo importante
dello stesso, rispetto al lembo anteriore, può essere applicata la sliding plasty . In tal caso, oltre
alla resezione quadrangolare di P2, tutto il lembo posteriore viene disinserzionato dall’anulus
poi rianastomizzato con una sutura continua di prolene 4/0. La ricostruzione del lembo
posteriore termina con la sutura centrale che colmerà lo spazio lasciato dalla resezione
quadrangolare. In questo modo può essere resecata una maggior quantità di lembo, e
abbassato l’intero lembo posteriore a livello dell’anteriore.
12
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 13
Un’altra tecnica proposta per il prolasso del LPM con rialzo importante rispetto al LAM è la folding Plasty
questa tecnica consiste nell’eseguire la resezione quadrangolare del posteriore, e utilizzare i due margini
mediali residui del lembo resecato per colmare lo spazio lasciato dalla resezione, ruotando verso l’anulus i
margini della resezione e suturando all’anulus stesso la parte di margine della resezione più vicina
all’anulus. Il rimanente tessuto viene suturato con una continua per chiudere la distanza della restante
parte dei margini della resezione. È una tecnica che può essere utilizzata solo se è presente una ridondanza
importante del LPM con quantità di tessuto del lembo sufficiente per eseguire la rotazione dei due margini
verso l’anulus e la chiusura dello spazio rimanente. Questa tecnica abbassa l’altezza del LPM verso il LAM e
riduce il rischio di SAM.
fig 5; 13 folding plasty(Dr Grossi NY University Medical Center Ann Thorac Surg 487 2010 ;89:485–9 MITRAL
F)
-
In caso di semplice dilatazione dell’anulus valvolare come in caso di insufficienza mitralica
funzionale si esegue un’anuloplastica con impianto di anello completo rigido
Fig 5;14 anuloplastica mitralica(Ctsnet.org)
13
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 14
Altre metodiche sono:
Plastica valvolare con rimodellamento di un muscolo papillare e accorciamento dell’apparato tensore
(corde tendinee) (fig 5. 15)
Plastica valvolare con accorciamento di corda tendinea ridondante (fig 5.16).
-
Nei casi di insufficienza mitralica acuta, secondaria a rottura di un muscolo papillare o ad endocardite
si valuta, a seconda dell’anatomia riscontrata, la possibilità di una riparazione o di una sostituzione valvolare;
tenendo conto della criticità del paziente e la necessità di un intervento che dovrà essere più rapido possibile,
spesso si opta per la sostituzione.
14
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 15
Patologia valvolare aortica
Stenosi valvolare aortica
La stenosi aortica degenerativa è diventata il più frequente tipo di valvulopatia in Europa e Nord America.
La stenosi aortica che un tempo era più frequente nella forma reumatica, attualmente si presenta come
calcifica solitamente negli adulti di età avanzata (2–7% della popolazione >65 anni).
Anatomia patologica:
la stenosi aortica degenerativa, è dovuta al deterioramento della valvola, compare in seguito a un
progressivo processo di fibrosi e calcificazione a carico delle cuspidi valvolari
fig 5 17 stenosi valvolare aortica sclerocalcifica.
Queste ultime non possono quindi aprirsi normalmente, determinando un ostacolo all’uscita dal ventricolo
sinistro. Esistono alcune alterazioni congenite come la bicuspidia aortica (presente in circa il 2 % della
popolazione generale) che, determinando un flusso turbolento a livello valvolare, predispongono allo
sviluppo della stenosi.
Fisiopatologia:
il restringimento dell’ostio valvolare costituisce un ostacolo all’eiezione del sangue. Per vincere questa
resistenza e mantenere un flusso di sangue normale, la pressione sistolica nel ventricolo sinistro deve
sempre essere maggiore della pressione in aorta. Tale differenza si definisce gradiente pressorio transvalvolare aortico. Tanto più la valvola è stenotica, tanto maggiore è il gradiente.
L’aumento del gradiente trans-valvolare aortico determina un adattamento del ventricolo sinistro che
sviluppa un’ipertrofia concentrica, con notevolmente ispessimento delle pareti.
L’ipetrofia concentrica miocardica ha come conseguenze:
a) aumento del consumo di O2 nel miocardio . A ciò si aggiunge un’accentuata compressione delle
arterie coronarie per l’aumento della pressione endocavitaria, che ne ostacola il flusso soprattutto
in diastole. Ne può conseguire una ischemia miocardica anche in assenza di ostruzioni coronariche;
15
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 16
b) si riduce la compliance cioè la distensibilità delle pareti del ventricolo sinistro, con incremento
della pressione diastolica ventricolare. Quindi, affinché il ventricolo sinistro si riempia
completamente, l’atrio sinistro deve contrarsi maggiormente e anch’esso si ipertrofizza.
La contrazione atriale diventa così essenziale per una buona funzione cardiaca.
In caso di episodio di fibrillazione atriale o di un blocco atrioventricolare, tale situazione di precario
equilibrio potrebbe peggiorare rapidamente.
figura 5, 18 adattamento nella stenosi aortica. netter images
16
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 17
Sintomatologia e segni clinici:
classicamente i sintomi tipici della stenosi aortica sono: la dispnea, l’angina, la sincope,
spesso in correlazione allo sforzo fisico.
A. dispnea da sforzo:
si verifica poiché durante uno sforzo aumenta la pressione ventricolare sistolica e conseguentemente il
post-carico, fin quando il ventricolo non riesce più a eiettare in sistole tutto il sangue ricevuto in diastole. Si
verifica quindi una rialzo della pressione in atrio sinistro e nel circolo polmonare, con comparsa di
congestione polmonare.
B. angina da sforzo:
si verifica in quanto il fabbisogno di O2 a livello miocardico aumenta considerevolmente durante uno
sforzo. Contestualmente il flusso coronarico è ostacolato dalla compressione estrinseca esercitata dal
miocardio ipertrofico in tensione.
C. sincope: sotto sforzo la pressione sistolica all’interno del ventricolo sinistro sale e aumenta il flusso di
sangue in funzione dell’esercizio muscolare. Ciò determina la stimolazione dei barocettori intra-ventricolari,
i quali di riflesso provocano una brusca vasodilatazione periferica.
Tale meccanismo nelle persone normali ha lo scopo di impedire pericolosi aumenti della pressione intraventricolare, riducendo le resistenze periferiche. Nel paziente con stenosi aortica, il punto di massima
resistenza è l’ostio della valvola stenotica che non si può modificare. Il riflesso dei barocettori ventricolari
ridurrà le resistenze sistemiche, senza però ridurre la pressione intraventricolare.
Poiché la riduzione delle resistenze può venir compensata da un adeguato incremento della portata
cardiaca, per via dell’ostruzione all’efflusso la pressione sistemica crolla bruscamente - anziché aumentare
come accade nei soggetti sani durante lo sforzo- sino a provocare segni di ipoperfusione cerebrale quali
lipotimia e sincope.
L’insorgenza di aritmie ventricolari può protrarre la sincope o, in alcuni casi, esserne la causa anche a
riposo.
L’aspettativa di vita, per i pazienti sintomatici con stenosi aorta severa è piuttosto bassa.
In assenza di intervento chirurgico la mortalità è del 90% a tre anni dall’inizio dei sintomi.
Obbiettivamente si riscontra un soffio sistolico eiettivo rude, in crescendo decrescendo (a Diamante),
auscultabile sul focolaio aortico, irradiato al giugulo.
Classificazione: in relazione alla area valvolare e ad altri parametri emodinamici distinguiamo la stenosi
aortica in tre gradi, lieve, moderata e severa.
Lieve: area valvolare > 1,5 cmq, gradiente trans-valvolare medio inferiore a 25 mmHg.
Moderata: area valvolare compresa tra 1 cmq e 1,5 cmq, gradiente trans-valvolare medio tra 25 e 40
mmHg.
17
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 18
Severa: area valvolare < 1 cmq, gradiente trans-valvolare medio maggiore di 40 mmHg,
velocità massima > 4 m/s.
Critica: area valvolare < 0.75 cmq.
Peraltro, è richiesto un giudizio clinico più approfondito in caso di sospetto di stenosi aortica severa
quando il gradiente trans-valvolare medio è < 40 mmHg, e la funzione contrattile del ventricolo sinistro è
ridotta.
Infatti in presenza di basso flusso, può essere riscontrata una pressione più bassa in pazienti con stenosi
aortica severa, cioè una stenosi aortica con basso flusso – basso gradiente. In questi casi un’ecografia
cardiaca sottosforzo (eco-stress con dobutamina) può essere dirimente.
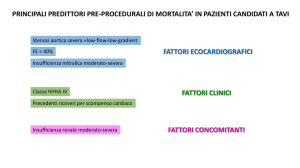
L’indicazione alla sostituzione valvolare chirurgica si pone nei paziente sintomatici con stenosi severa.
L’intervento chirurgico si esegue a cuore aperto con l’ausilio della circolazione extracorporea. L’accesso
chirurgico si effettua in sternotomia mediana o in ministernotomia.
Fig 5.19 schema ministernotomia
L’esposizione della valvola aortica è ottenuta con l’aortotomia dell’aorta ascendente eseguita 2 cm al di
sopra dell’ostio coronarico destro. Dopo di che si effettua l’asportazione dei lembi valvolari e si sutura
sull’anulus nativo la protesi valvolare.
TAVI (impianto di valvola aortica trans-catetere).
Il primo impianto di protesi aortica per via percutanea è stato effettuato da Alain Cribier nel 2002. Da
allora, sono stati perfezionati ed introdotti in commercio diversi tipi di dispositivi per il trattamento
transcatetere della valvulopatia aortica, con diverse peculiarità per quanto riguarda le caratteristiche e la
tecnica di impianto.
Il trattamento consiste nell’impianto di una protesi biologica in sede aortica tramite catetere attraverso un
accesso da un’arteria periferica solitamente l’arteria femorale, oppure tramite un accesso trans-apicale
cardiaco attraverso una minitoracotomia sinistra.
La procedura viene effettuata in sala operatoria ibrida (dotata di radioscopio, iniettore per il mezzo di
contrasto, lettino radiotrasparente ect.), oppure in una sala di emodinamica o di radiologia interventistica. I
vantaggi di tale metodica sono l’approccio mini-invasivo e il fatto che si evita la circolazione extracorporea.
Gli svantaggi consistono in un aumentato rischio di ictus cerebrale su base embolica, complicanze del sito di
accesso vascolare, la possibilità di mal posizionamento del dispositivo e la dislocazione dello stesso. Inoltre,
essendo una metodica recente, sarà da accertare la durata nel tempo di tali protesi, prima che vadano
incontro al processo di degenerazione proprio di tutte le protesi biologiche.
18
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 19
Fig 5;20 impianto AVI trans-apicale. Fig 5;21 e 22 impianto TAVI trans-femorale
Raccomandazioni all’uso.
L’ utilizzo di una valvola aortica trans-catetere deve essere considerate solo con un ‘heart team’
multidisciplinare, che includa cardiologi, cardiochirurghi e se necessario altri specialisti,
e deve essere eseguita in ospedali con una unità operativa di cardiochirurgia.
È indicata in pazienti con stenosi aortica severa sintomatica, che non siano operabili secondo la valutazione
dell’ ‘heart team’, e che possano avere un miglioramento della qualità di vita e un’aspettativa di vita > 1
anno dopo aver considerato le comorbilità.
Controindicazioni per l’ impianto delle valvole aortiche trans-catetere.
Assolute controindicazioni: assenza dell’ ‘heart team’ e assenza di una cardiochirurgia.
Appropriatezza dell’impianto di valvola aortica trans-catetere, come alternativa all’intervento chirurgico,
non confermata dall’ ‘heart team’.
Controindicazioni cliniche: aspettativa di vita <1 anno.
Non significativo miglioramento della qualità di vita apportato dall’ impianto di valvola aortica transcatetere a causa delle comorbilità.
Contestuale presenza di altra severa patologia primaria, trattabile solo chirurgicamente, che sia concausa
importante della sintomatologia del paziente.
Insufficienza valvolare aortica
Nell’insufficienza aortica una parte del sangue eiettato in sistole ritorna nel ventricolo sinistro in diastole.
Ciò si verifica per lesioni a carico delle cuspidi valvolari, oppure per alterazioni della radice aortica tali da
inficiare la normale coaptazione dei lembi valvolari. L’insufficienza valvolare si può instaurare in modo
cronico o acuto. Nel primo caso il ventricolo ha il tempo di adattarsi al rigurgito, nel secondo il ventricolo
19
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 20
non ha il tempo di adattarsi: questo comporta spesso l’ insorgenza di un quadro clinico da scompenso
sinistro acuto.
Fisiopatologia: per via che il sangue rigurgitato in diastole verrà espulso alla sistole successiva insieme alla
normale quota di sangue proveniente dall’atrio sinistro, il ventricolo sinistro dovrà pompare un volume
maggiore di sangue ad ogni sistole.
Perciò il ventricolo si adatta, dilatandosi con incremento del volume diastolico (precarico). Ne deriva che,
poiché le miocellule iniziano a contrarsi da una lunghezza maggiore, per la legge di Starling si assiste
almeno inizialmente ad un incremento della capacità contrattile del ventricolo.
Fig 5, 23 adattamento nell’insufficienza aortica
20
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 21
Contestualmente alla dilatazione, per la legge di Laplace, aumenta anche la tensione di parete (postcarico).
Per controbilanciare questo fenomeno
il ventricolo si adatta ipertrofizzandosi, aumentando cioè lo
spessore parietale. Nella stenosi aortica, l’ipertrofia è di tipo concentrico, dunque senza dilatazione della
cavità. Nell’insufficienza aortica si instaurano contestualmente sia l’ ipertrofia che la dilatazione, e il cuore
può raggiungere in taluni casi , dimensioni enormi, “cor bovinum”.
Sintomatologia: il paziente con insufficienza aortica può essere asintomatico per molti anni, durante i quali
il ventricolo sinistro si dilata e si ipertrofizza e il vizio aortico progressivamente si aggrava.
Il sintomo che compare più precocemente è di solito la dispnea da sforzo, poi ortopnea e dispnea
parossistica notturna, man mano che peggiora la contrattilità cardiaca . L’angina pectoris da sforzo è tipica
anche nei pazienti con coronarie normali, in quanto per l’ ipertrofia si incrementa il fabbisogno di ossigeno
dei miociti, e contestualmente la bassa pressione diastolica inficia il flusso a livello delle arterie coronariche.
Tipicamente nell’insufficienza aortica si osserva, assieme alla dispnea e all’angina, la sudorazione profusa .
Segni clinici: il reperto auscultatorio principale è un soffio diastolico su focolaio aortico.
La durata del soffio è proporzionale alla severità del rigurgito; frequentemente è associato un soffio
sistolico eiettivo, provocato dall’incremento del volume di sangue eiettato dal ventricolo. È inoltre possibile
apprezzare il soffio di Austin-Flint, un rullio diastolico causato dal getto di sangue rigurgitato che,
incontrando il lembo anteriore della mitrale, lo spinge posteriormente determinane una restrizione della
valvola mitrale.
In caso di insufficienza aortica acuta in genere i pazienti appaiono in condizioni generali compromesse: si
rilevano tachicardia, ipoperfusione periferica, shock e congestione/ edema polmonare.
Diagnostica strumentale: sono riscontrabili all’elettrocardiogramma segni di ipertrofia ventricolare sinistra
con onde R alte nelle derivazioni sinistre, aritmie ventricolari e alterazioni della conduzione.
Alla radiografia del torace si potranno rilevare segni di dilatazione del ventricolo sinistro. Nelle forme
croniche avanzate o acute si potranno vedere segni di congestione polmonare compatibili con un quadro di
scompenso o edema polmonare.
L’ecocardiogramma è anche in questa patologia l’esame cardine per quantificare l’entità del rigurgito e il
meccanismo da cui è provocato, nonché gli adattamenti cui le camere cardiache sono andate incontro.
I parametri ecocardiografici che identificano una insufficienza aortica severe sono: vena contracta>6 mm,
area dell’orificio rigurgitante >30 mm2, volume del rigurgito> di 60 ml per battito.
Indicazioni all’ intervento chirurgico.
L’intervento chirurgico è indicato nei pazienti con insufficienza aortica severa, sintomatici, ma pure nei
pazienti asintomatici, con iniziali segni di disfunzione del ventricolo sinistro quali diminuzione della frazione
di eiezione, o aumento dei diametri ventricolari: diametro tele-diastolico > 70mm o diametro tele-sistolico>
50 mm.
21
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 22
Classificazione dell’insufficienza aortica proposta da El Khoury: è fatta in relazione al meccanismo
dell’insufficienza e alla tecnica riparativa. Tale classificazione è centrata sull’idea che la valvola aortica, sia
costituita da due componenti maggiori: i lembi e la radice aortica intesi come unità funzionale. Orbene la
radice aortica è costituita dall’anulus aortico, dai seni di Valsalva e dalla giunzione sino-tubulare.
Immagine 5.24 anatomia della radice aortica
Si distinguono tre tipi di insufficienza aortica:
Tipo I il movimento dei lembi è normale e l’insufficienza è causata da
un’alterazione dell’anulus funzionale o da perforazione delle cuspidi
Tipo II
Tipo III
meccanismo
Tipo I A
dilatazione della
aorta ascendente
(con dilatazione
della giunzione
sino-tubulare).
Tipo I B
dilatazione dei
seni di Valsalva e
della giunzione
sino tubulare.
Tipo I C:
dilatazione della
giunzione
ventricoloaortica.
Tipo I D :
perforazione
delle cuspidi.
prolasso dei
lembi causato da
ridondanza del
tessuto delle
cuspidi o da
rottura.
restrizione dei
lembi che può
essere riscontrata
nella bicuspidia
aortica, o causata
da malattia
reumatica o da
degenerazione
fibro-calcifica
Tecnica
riparativa
primaria
sostituzione
dell’aorta
ascendente con
rimodellamento
della GST
Valve sparing
Reimplantation o
Remodelling,
Valve sparing
Reimplantation
Riparazione con
patch pericardico
plicatura,
resezione
triangolare,
risospensione,
impianto di patch
solitamente è
eseguita la
sostituzione con
protesi; in
alternativa
shaving e
decalcificazione
dei lembi e/o
impianto di un
patch.
Anuloplastica
subcommissurale
Anuloplastica
subcommissurale
Anuloplastica
subcommissurale
Tecnica
ripartiva
secondaria
Anuloplastica
subcommissurale
anuloplastica
subcommissurale.
Anuloplastica
della giunzione
sino tubulare
Tab5;2 classificazione dell’insufficienza aortica secondo El Khoury
22
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 23
Tipo I: il movimento dei lembi è normale, l’insufficienza è causata da un’alterazione dell’anulus funzionale o
da perforazione delle cuspidi;
Tipo IA: dilatazione della aorta ascendente (con dilatazione della giunzione sino-tubulare).
Tecnica proposta: sostituzione dell’Aorta Ascendente con rimodellamento della GST.
Tipo IB:
dilatazione dei seni di Valsalva e della giunzione sino tubulare. tecnica: Valve sparing
Reimplantation o Remodelling, con eventuale anuloplastica sub-commissurale.
Tipo IC: dilatazione della giunzione ventricolo-aortica. Tecnica: Valve sparing Reimplantation con
Anuloplastica sub-commissurale. Secondo El Khoury un intervento di rimodellamento della valvola aortica
richiede, in aggiunta alla reimplantation, l’Anuloplastica sub-commissurale per la stabilizzazione prossimale
dell’anulus e della giunzione ventricolo-aortica, e la riduzione dell’ ampiezza del triangolo fra le cuspidi (cioè
si riduce la distanza fra le cuspidi e aumenta la superficie di coaptazione).
Tipo ID: perforazione delle cuspidi. Tecnica Riparazione con patch pericardico.
Tipo II: prolasso dei lembi causato da ridondanza del tessuto delle cuspidi o da rottura. Si possono eseguire
plicatura, resezione triangolare, risospensione, impianto di patch.
Tipo III: restrizione dei lembi che può essere riscontrata nella bicuspidia aortica, o causata da malattia
reumatica o da degenerazione fibro-calcifica. Solitamente si esegue una sostituzione valvolare con una
protesi. In alternativa El Khoury propone lo shaving con decalcificazione dei lembi, ed eventuale impianto
di un patch.
Tecniche di sostituzione della radice aortica con preservazione della valvola aortica.
Indicazioni: dilatazione della radice aortica, dilatazione dell’anulus aortico in presenza di cuspidi
morfologicamente normali. In letteratura sono descritte due tecniche principali:
A) tecnica di rimodellamento della radice aortica secondo Yacoub (figura5;22): è indicata per i casi di
dilatazione dei seni di Valsalva senza dilatazione dell’anulus aortico. Consiste nell’asportare i seni di
Valsalva e l’eventuale ulteriore porzione di aorta ascendente aneurismatica. Quindi si sutura
ciascuna commissura valvolare a una protesi di dacron che è stata tagliata longitudinalmente per
formare tre neoseni separati. Queste tre lingue di tessuto protesico vengono direttamente suturate
al margine di tessuto aortico con tre emicontinue di prolene 4 zeri. A ciò segue l’anastomosi degli
osti coronarici ai neoseni e l’anastomosi prossimale della protesi sull’ aorta. Il punto chiave di
questa tecnica è che ripristina la fisiologica morfologia della radice aortica.
23
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 24
webcast.aats.org
fig 5;25 tecnica di rimodellamento della radice aortica
B) Reimpianto della valvola aortica secondo David. (figura5;23)È indicata nei casi di dilatazione della
radice aortica, compreso l’anulus valvolare con insufficienza aortica associata. L’intera valvola
aortica con l’anulus è reinserita in un tubo protesico in dacron di calibro appropriato. Prima la
protesi è fissata all’anulus appena al disotto del livello delle cuspidi con punti a materassaio
ethibond 3 zeri. La valvola è poi impiantata nella protesi utilizzando tre suture emicontinue di
prolene 4 zeri. In fine i bottoni degli osti coronarici vengono anastomizzati alla protesi. Un aspetto
chiave di questa tecnica è che l’anulus aortico, fissato alla protesi, previene la dilatazione
dell’anulus nel tempo.
openi.nlm.nih.gov
Fig 5;26 Tecnica di reimpianto della valvola aortica secondo David
Tecnica di sostituzione della radice aortica secondo Bentall-DeBono. È indicata nei casi di dilatazione della
radice aortica e/o aorta ascendente tubulare e con vizio valvolare aortico contestuale non passibile di
riparazione valvolare (stenosi aortica o insufficienza con lembi valvolari alterati). Consiste nella sostituzione
sia della valvola che della prima parte dell’aorta ascendente con un tubo protesico di dacron già provvisto
24
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 25
di una protesi valvolare. In tal modo il chirurgo impianta con la stessa sutura la protesi valvolare e la protesi
tubulare di dacron.
Fig 5;27 tubo protesico valvolato. Fig 5;28 sostituzione della radice aortica secondo Bentall-De Bono
Patologia valvolare tricuspidalica
Stenosi tricuspidalica
La stenosi tricuspidalica severa è solitamente di origine reumatica: non è frequente e di solito si associa ad
una stenosi mitralica.
Sintomatologia. L’incremento del gradiente trans-valvolare tricuspidalico può comportare l’instaurarsi di
congestione venosa sistemica, ne conseguono facile affaticabilità, sensazione di distensione addominale
(per epatomegalia e ascite) e di pulsazione al collo (per via della distensione delle vene giugulari).
Segni clinici: il reperto auscultatorio tipico consiste in un rullio diastolico udibile al IV spazio sulla linea
parasternale destra.
Diagnosi strumentale: all’ECG spesso si riscontra fibrillazione atriale secondaria all’ingrandimento atriale.
La radiografia del torace ha come reperto radiologico tipico la dilatazione dell’atrio destro (prominenza
dell’arco inferiore destro), che prosegue cefalicamente con la vena cava superiore anch’essa dilatata.
L’ecocardiogramma è l’esame di riferimento, viene definita severa una stenosi tricuspidalica quando il
gradiente trans-valvolare supera i 5 mmHg.
25
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 26
Indicazioni chirurgiche della valvola tricuspide
L’intervento sulla valvola tricuspide è indicato in pazienti sintomatici con stenosi tricuspidalica severa (la
dilatazione percutanea può essere provata come primo approccio se la stenosi tricuspidalica è isolata), sia
isolata che associata a una indicazione per valvulopatia sinistra. In quest’ultimo caso si considera
l’intervento sulla tricuspide anche in caso di stenosi moderata.
L’intervento consiste solitamente nella sostituzione della valvola con una bioprotesi.
Tecnica di sostituzione: si conserva buona parte del lembo settale per evitare di applicare punti nella parte
di anello sotto cui decorre il fascio di His. La restante parte della valvola viene asportata e la protesi viene
fissata con punti staccati ethibond due zeri.
Insufficienza tricuspidalica
Eziologia: come per la valvola mitrale anche l’insufficienza tricuspidalica si distingue in primitiva (organica)
e secondaria (funzionale).
L’insufficienza tricuspidalica primitiva può essere congenita, come nella malattia di Ebstein, o acquisita.
Tra le cause di insufficienza tricuspidalica primitiva acquisita ricordiamo la malattia reumatica (solitamente
contestuale a una valvulopatia mitralica); la degenerazione mixomatosa dei lembi e delle corde tendinee
con prolasso dei lembi;
l’endocardite infettiva, e i traumi.
L’insufficienza della tricuspide è più comunemente secondaria, ed è causata dalla dilatazione del ventricolo
destro e dell’anulus che non permette più la normale coaptazione dei lembi.
Figura5;29 modalità di dilatazione dell’anulus tricuspidale.
Di solito la dilatazione del ventricolo è causata dall’ipertensione polmonare, che può essere a sua volta
primitiva o secondaria a diverse cause: a una valvulopatia sinistra in genere mitralica, a una cardiopatia
congenita con iperafflusso polmonare (come un difetto interventricolare), a cuore polmonare cronico o ad
un infarto ventricolare destro.
26
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 27
Fisiopatologia.
Nell’ insufficienza tricuspidale primitiva si instaura progressivamente un
sovraccarico di volume del
ventricolo destro che ad ogni diastole riceve il sangue del ritorno venoso sistemico, a cui si somma il
volume rigurgitato in atrio destro durante la sistole precedente. L’evoluzione verso lo scompenso destro è
di solito lenta, anche quando l’insufficienza tricuspidale si verifica in modo acuto come nell’endocardite
infettiva, a differenza dall’insufficienza mitralica acuta che ha un’evoluzione piuttosto rapida.
Nel tempo si instaura una riduzione della funzione ventricolare destra e compaiono quindi i segni dello
scompenso destro.
Nell’ insufficienza tricuspidale funzionale o secondaria, questa compare in un quadro di dilatazione del
ventricolo destro preesistente. Dunque l’ instaurarsi del vizio valvolare esacerba i segni e sintomi di
scompenso destro spesso già presenti.
Sintomatologia. L’ insufficienza primitiva di solito è ben tollerata dai pazienti.
Nell’ insufficienza secondaria, riducendosi la portata cardiaca si aggravano i sintomi della congestione del
circolo venoso sistemico quali facile affaticabilità, astenia, tensione addominale e dolenzia da distensione
epatica.
Segni clinici. All’auscultazione si può apprezzare un soffio sistolico al IV spazio intercostale sulla linea
parasternale destra.
Potranno poi essere presenti i segni tipici della congestione venosa e dello scompenso destro quali ascite,
epatomegalia, edemi declivi.
Diagnostica strumentale: all’elettrocardiogramma spesso si rileva fibrillazione atriale con segni di ipertrofia
del ventricolo destro.
Radiografia del torace: si possono apprezzare i segni della dilatazione dell’atrio destro ed eventualmente i
segni di una contestuale valvulopatia sinistra.
All’ecocardiogramma viene considerata severa una insufficienza tricuspidalica con i seguenti reperti
ecografici:”vena contracta”≥ 7 mm, inversione del flusso ematico in sistole a livello delle vene epatiche, un’
area effettiva dell’orifizio rigurgitante > 40 mm, volume rigurgitato 45 ml per battito. Tali reperti sono per
lo più associati ad allargamento dell’atrio destro, della vena cava inferiore, e del ventricolo destro.
Indicazioni all’intervento chirurgico.
L’intervento sulla valvola tricuspide è indicato in pazienti con insufficienza tricuspidalica severa primaria o
secondaria, che devono essere sottoposti ad intervento su valvola cardiaca sinistra.
L’intervento è inoltre indicato in pazienti sintomatici con insufficienza tricuspidalica severa primaria isolata,
senza severa disfunzione del ventricolo destro.
L’intervento può essere considerato in pazienti asintomatici o lievemente sintomatici con insufficienza
tricuspidalica severa primitiva isolata, e progressiva dilatazione del ventricolo destro o deterioramento
della funzione del ventricolo destro .
27
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 28
Inoltre l’intervento può essere considerato in pazienti con insufficienza tricuspidalica secondaria di grado
lieve o moderato con anulus dilatato (≥40 mm o >21 mm/m²) che devono essere sottoposti ad intervento
su valvola cardiaca sinistra. Secondo Dreyfus (Annals Thoracic surgery 2005) l’indicazione si pone quando
alla misurazione diretta l’anulus tricuspidalico è ≥ a 70 mm.
Tecniche riparative della valvola tricuspide.
La chirurgia della tricuspide è associata ad un intervento concomitante a carico di una valvola sinistra,
solitamente la mitrale. Per questo motivo la porzione di intervento a carico della tricuspide può avvenire sia
durante il tempo di clampaggio che a cuore battente durante la riperfusione, dopo aver eseguito la
porzione di intervento riguardante la parte sinistra. L’accesso si esegue attraverso l’atrio destro con un’
atriotomia obliqua, con partenza dell’incisione vicino all’auricola destra, ed estensione dell’incisione in
direzione della vena cava inferiore vicino alla quale termina. In caso di concomitante intervento sulla
valvola mitrale può essere eseguito un accesso trans-settale: dopo aver eseguito l’atriotomia destra si
esegue un’ incisione a livello della fossa ovale, estesa superiormente attraverso il setto interatriale.
Anuloplastica: quando deve essere eseguita una anuloplastica la lunghezza della base del lembo settale
della tricuspide o l’area del lembo anteriore vengono misurate con un calibratore per scegliere il diametro
dell’anello. Gli anelli utilizzati sono incompleti per lasciare libera la porzione di anulus sotto cui decorre il
fascio di His, cioè tra la commissura antero-settale e il punto medio del lembo settale.
Tecnica riparativa secondo De Vega: si utilizza una sutura continua di prolene 2/0 o 3/0 con partenza dalla
commissura postero-settale, si prosegue in senso antiorario con punti a materassaio fino alla commissura
antero-settale, a tale livello dopo aver messo un pledget di teflon la sutura viene doppiata in senso inverso
fino alla commissura postero-settale dove viene stirata per ottenere la riduzione dell’anulus, e i fili dopo
essere stati fatti passare attraverso un pledget vengono annodati. La parte settale dell’anulus non viene
trattata, perche non viene coinvolta nel processo di dilatazione dell’anulus, e per evitare danni al tessuto di
conduzione.
28
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 29
Endocarditi
L’endocardite è un processo infiammatorio dell’endocardio, caratterizzato dalla formazione di vegetazioni a
livello dell’endocardio stesso.
Fig 5.30 e 31 esempi di lesioni endocarditi che aortica e mitralica endocarditi (cardiac surgery 3° ediz.
Churcill Livingston)
Può essere primitiva (infettiva) o secondaria (da lupus o altre malattie reumatiche).
Endocardite infettiva: consiste nell’ invasione e moltiplicazione di microorganismi a livello dell’endocardio,
ed è una malattia rara con un’incidenza stimata di 30-100 episodi per milione di pazienti per anno.
Il 40-50% dei casi può essere trattato con la sola terapia medica, mentre i restanti necessitano di un
intervento chirurgico.
L’endocardite acuta è una severa forma di endocardite infettiva causata da microrganismi piogeni virulenti
come streptococco emolitico e stafilococchi. Può diventare pericolosa per la vita in pochi giorni.
Endocardite subacuta: è una forma di endocardite infettiva che si sviluppa sottilmente in un periodo
variabile da settimane a mesi. Può produrre sintomi per mesi prima che il danno alle valvole cardiache o un
episodio di embolia chiarisca la diagnosi. Di solito è causata da Streptococcus viridans o Streptococcus
faecalis .
Endocardite attiva: consiste nella presenza di evidente infezione a livello cardiaco.
Si manifesta con infiammazione, vegetazioni attive, ascessi, seni scavati, o fistole .
Endocardite guarita: indica l'assenza di evidente infezione cardiaca e d’infiammazione, generalmente dopo
il trattamento antibiotico e presunta eradicazione di microrganismi. È caratterizzata dalla mancanza
d’infiammazione locale; possono essere presenti vegetazioni, generalmente endotelizzate, e gli ascessi
compresi seni e fistole, sono esitati in cavità ben definite e stabili.
29
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 30
Distinguiamo le endocarditi che coinvolgono la valvola nativa propria del paziente e
quelle che coinvolgono una valvola cardiaca protesica impiantata chirurgicamente .
Criteri diagnostici maggiori: evidenza all’ecocardiografia di vegetazione, di ascessi o di lesioni valvolari.
Positività di emocolture per microorganismi tipici.
Criteri diagnostici minori: febbre, condizioni cardiache predisponenti o utilizzo di stupefacenti ev, embolia
periferica, fenomeni immunologici quali glomerulonefriti o fattore reumatoide, emocolture positive non
rispondenti ai criteri maggiori, ecocardiogramma non rispondente ai criteri maggiori.
Classificazione secondo la mobilità delle vegetazioni:
1 )Mobilità assente: vegetazione fissa senza evidenza di movimento indipendente.
2) Mobilità bassa: vegetazione con base fissa, ma con margine libero mobile.
3) Mobilità moderata: vegetazione peduncolata che rimane nella stessa camera attraverso il ciclo cardiaco
4) Mobilità severa: vegetazione prolassante che oltrepassa il piano di coaptazione dei lembi valvolari
durante il ciclo cardiaco.
Pazienti con vegetazioni > di 10 mm (1 cm) hanno una incidenza del 60% di embolia.
Pazienti con vegetazioni mobili di ampie dimensioni (> di 1,5 cm) hanno una incidenza dell’85 % di
complicanze emboliche.
Indicazioni
Si pone indicazione all’intervento chirurgico in regime di emergenza nei casi di: instabilità emodinamica da
insufficienza valvolare acuta, fistola cardiaca, protesi basculante, rischio di blocco completo di una protesi
meccanica.
Si pone indicazione all’intervento chirurgico in regime di urgenza (da operare nell’arco di giorni) nei
seguenti casi:
Endocardite su valvola nativa con preesistente insufficienza cardiaca, segni di compenso labile (scarsa
tolleranza emodinamica), o ascesso.
Endocardite su valvola protesica con preesistente insufficienza cardiaca, segni di compenso labile, o
ascesso.
Endocardite su valvola protesica causata da stafilococchi o organismi Gram-negativi.
Vegetazione sinistra con diametro >1,0 cm con un evento embolico.
Vegetazione sinistra con diametro >1,0 cm e mobilità della stessa prima dell’inizio della terapia antibiotica.
Vegetazione sinistra ad alto rischio con episodio di embolizzazione nonostante la terapia antibiotica.
Vegetazione sinistra con diametro >1,5 cm specialmente se si può fare un intervento riparativo.
Ascesso di importanti dimensioni e/o coinvolgimento perianulare con infezione incontrollata.
30
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 31
Intervento elettivo durante il ricovero:
Severa insufficienza aortica o mitralica con insufficienza cardiaca e buona risposta alla terapia medica.
Endocardite su valvola protesica con deiscenza valvolare e insufficienza cardiaca e buona risposta alla
terapia medica.
Presenza di ascesso o estensione perianulare.
Persistenza di infezione quando foci extra cardiaci sono esclusi.
Infezioni fungine o altre infezioni resistenti alla terapia medica.
Le complicazioni neurologiche sono molteplici: ictus ischemico o emorragico, TIA, embolia cerebrale silente,
aneurismi micotici cerebrali sintomatici o asintomatici, ascessi cerebrali, meningiti, encefalopatia tossica e
crisi epilettiche.
In caso di ictus emboligeno con complicazione emorragica l’intervento è rimandato solitamente di 4
settimane.
In condizioni di stabilità l’intervento si dovrebbe effettuare dopo sei settimane di terapia antibiotica.
La mortalità nell’immediato post-operatorio varia dal 5% al 30%, a 5 anni la sopravvivenza è dell’80%, a 10
anni è del 60%. Questa differenza, soprattutto nell’immediato post-operatorio, è determinata dalla
condizione preoperatoria di endocardite fredda o in fase attiva. Nel caso di endocardite fredda i risultati
sono paragonabili a quelli di una normale sostituzione valvolare.
La mortalità è inoltre influenzata dal grado di estensione del processo destruente a carico delle strutture
perivalvolari come ascessi perivalvolari a carico dell’anulus aortico, alterazioni della conduzione A-V, o
eventi embolici cerebrali nel preoperatorio.
31
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 32
Protesi valvolari cardiache.
Si distinguono essenzialmente due tipi di protesi, le protesi meccaniche e le protesi di origine biologica.
Protesi meccaniche
Attualmente sono costituite da due dischi di carbonio e berillio, che si muovono su un supporto in relazione
alle fasi del ciclo cardiaco.
Questi materiali non sono soggetti a degenerazione, per cui se non si instaurano complicanze (quali
trombosi a carico delle parti basculanti o apposizione di panno trombotico sul supporto dei dischi) possono
rimanere impiantate per il resto della vita del paziente. Tuttavia necessitano dell’anticoagulazione orale
per tutto il tempo in cui la valvola rimane impiantata nel paziente.
Al fine di evitare complicanze trombo-emboliche il valore di INR è da mantenere tra 2 e 3 per le protesi
meccaniche impiantate in sede aortica e tra 2,5 e 3,5 per protesi meccaniche impiantate in sede mitralica.
fig 5;32 protesi valvolare meccanica (medtronic.com).
Protesi valvolari biologiche
Possono essere di origine umana o animale (porcina o bovina). Esse vengono ricoperte dalle cellule
endoteliali del ricevente, hanno quindi una ridotta trombogenicità, necessitano pertanto di
anticoagulazione orale solo nei primi tre mesi dall’impianto.
Il loro limite maggiore è la durata, infatti sono soggette a degenerazione.
La durata media è di circa dieci anni per le bioprotesi di origine animale impiantate in sede mitralica, e
quindici per quelle in sede aortica.
Tale durata è peraltro condizionata ad alcuni fattori quali insufficienza renale e l’età del paziente: più il
paziente è giovane più la bioprotesi tende a deteriorarsi precocemente. Quando la bioprotesi è degenerata
è necessario sostituirla con un nuovo intervento.
Recentemente le valvole impiantabili trans-catetere possono essere utilizzate con la procedura nota come
“valve in valve” in cui la valvola trans-catetere è impiantata all’interno del supporto della bioprotesi
degenerata.
32
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 33
fig 5;33 protesi valvolare biologica
Protesi stentless
Le protesi stentless sono delle bioprotesi di origine animale (porcina o bovina) che differiscono dalle protesi
convenzionali poiché non hanno il supporto rigido su cui vengono inserite le cuspidi valvolari. A parità di
calibro rispetto a una protesi convenzionale la protesi stentless ha una maggiore area dell’orifizio valvolare
e quindi migliori parametri emodinamici e non necessita di anticoagulazione orale. Tuttavia il loro impianto
è tecnicamente più difficile e la loro durata è paragonabile alle bioprotesi convenzionali.
Non vi sono delle indicazioni specifiche per il loro utilizzo rispetto alle bioprotesi convenzionali. Possono
essere vantaggiose in pazienti con una radice aortica di piccole dimensioni e nelle endocarditi.
Fig. 5.34 Bioprotesi stentless bovina fig 5,35 bioprotesi stentless porcina
Valvola aortica omologa (Homograft)
Consiste nella radice aortica prelevata da un donatore in cui il cuore non risulti idoneo per il trapianto.
Viene in genere criopreservata e conservata presso una banca di tessuti.
Le caratteristiche emodinamiche sono simili a quelle delle protesi stentless. La durata degli delle valvole
aortiche omologhe è di circa 20 anni. La tecnica di impianto è complessa e difficile. Non è necessaria di
anticoagulazione orale
Le situazioni per cui può essere considerato il loro utilizzo sono alcuni casi di endocarditi aortiche con
estensione del processo infettivo alla radice aortica, pazienti giovani con controindicazione alla
anticoagulazione orale.
33
Appunti di Cardiochirurgia Capitolo 5 Patologie valvolari acquisite
pagina 34
fig 5,36 homograft aortico.
Intervento di Ross
Consiste in una sostituzione valvolare aortica mediante l’utilizzo della valvola polmonare del paziente
(autograft)
Si asporta la radice dell’arteria polmonare e la si impianta in sede aortica con il successivo reimpianto degli
osti coronarici. In sede polmonare viene impianto un homograft.
Il vantaggio cruciale di questo intervento è che l’autograft cresce con il paziente.
Per tale ragione questo tipo di intervento viene eseguito soprattutto nei pazienti pediatrici.
Fig5.37, 38, 39, 40 fasi dell’intervento di Ross
34