INTRODUZIONE ................................................................................................................. 4
STORIA DELLA RISONANZA MAGNETICA FUNZIONALE ........................................ 6
ASPETTI FISICI DEL SEGNALE: BOLD vs ASL ............................................................... 8
Segnale BOLD .............................................................................................................................................. 8
Segnale ASL (Arterial Spin Labeling) ......................................................................................................10
AREE ELOQUENTI STUDIATE DALL’FMRI ................................................................ 13
Aree Motorie ..............................................................................................................................................13
Utilizzo dell’ fMRI nella predizione dei pazienti verso un trattamento chirurgico......................14
Mappature corticali sensitivo-motorie effettuate in condizioni di riposo .....................................16
Aree sensitive.............................................................................................................................................19
Studi di fMRI rivolti all’attivazione della corteccia visiva attraverso stimoli sensitivi in soggetti
divenuti ciechi in età adulta...................................................................................................................19
Mappaggio corticale preoperatorio: batteria integrata di funzioni visive, motorie, sensitive e
linguistiche ...............................................................................................................................................23
Aree del linguaggio..................................................................................................................................28
Utilizzo fMRI nell’individuazione di differenti aree corticali in soggetti bilingui precoci e
tardivi........................................................................................................................................................28
Adattamenti e neoformazione di reti linguistiche cerebrali in pazienti con gliomi a basso grado
...................................................................................................................................................................31
Aree visive...................................................................................................................................................34
Studio della plasticità visiva tramite fMRI in soggetti affetti da neuriti ottiche unilaterali .........34
Aree uditive ................................................................................................................................................39
Risposte mono e bi acustiche in giovani sani e pazienti sordi ........................................................40
Organizzazione tonotopica della corteccia uditiva ...........................................................................40
Attivazioni funzionali delle cortecce uditive primarie e secondarie correlato al tasso di parole
per minuto ...............................................................................................................................................43
ASPETTI TECNICI DELL FMRI....................................................................................... 45
Limiti e sfide della risonanza magnetica funzionale ..............................................................................45
fMRI e risoluzione spaziale .......................................................................................................................45
Il rumore nella fMRI ..................................................................................................................................46
Disomogeneità di campo statico ..............................................................................................................47
Alterazione fisiologica del segnale BOLD ..............................................................................................48
Decadimento del segnale nelle sequenze GE .........................................................................................49
1
IL RUOLO DELLA fMRI NELLA PIANIFICAZIONE DEI TRATTAMENTI
CHIRURGICI ....................................................................................................................... 50
Primo obbiettivo: valutazione del rischio di deficit neurologico e di operabilità di una
lesione ................................................................................................................................ 51
fMRI e individuazione aree eloquenti .................................................................................................52
fMRI e individuazione aree eloquenti in pazienti con lesioni anatomicamente destruenti ........52
fMRI come marker per la plasticità neurale ......................................................................................52
Secondo obbiettivo: selezione dei pazienti per stimolazione corticale intraoperatoria .....53
Terzo obbiettivo: integrazione della fMRI ai sistemi di neuronavgazione ............................54
Successo tecnico della fMRI .....................................................................................................................58
L’influenza dei tessuti tumorali nella formazione del segnale BOLD ................................................58
Discriminazioni delle aree eloquenti da quelle sacrificabili: utilizzo integrato di fMRI e
stimolazione magnetica transcranica (TMS) ...........................................................................................60
fMRI, DWI, DTI, FT e HDFT: un approccio multimodale per lo studio delle lesioni
cerebrali.......................................................................................................................................................61
DWI (diffusion weighted imaging) ..............................................................................................................61
DTI (Diffusion Tensor Imaging) ................................................................................................................61
FT (fiber tractography) ...............................................................................................................................63
HDFT (High-Definition Fiber Tractography) ...........................................................................................65
LOW GRADE GLIOMA ....................................................................................................... 67
Pianificazione prechirurgica attraverso l’fMRI .......................................................................................67
Soggetti e apparecchiature .........................................................................................................................68
Paradigmi......................................................................................................................................................69
Discussione ..................................................................................................................................................70
Caso 1 .......................................................................................................................................................70
Caso 2 .......................................................................................................................................................74
Caso 3 .......................................................................................................................................................78
Caso 4 .......................................................................................................................................................80
IL RUOLO DEL TSRM NELLE PROCEDURE DI fMRI ................................................ 82
Preparazione del paziente: la simulazione ...............................................................................................82
Paziente, TSRM e fMRI .............................................................................................................................83
Posizionamento e sequenze ......................................................................................................................83
Elaborazione dei dati ..................................................................................................................................85
Preprocessing ..........................................................................................................................................86
Slice scan time correction .................................................................................................................87
2
Correzione del movimento ..............................................................................................................88
Filtraggio spaziale...............................................................................................................................90
Normalizzazione intensità del segnale ............................................................................................92
Segmentazione....................................................................................................................................93
Analisi statistica.......................................................................................................................................96
Coregistrazione .......................................................................................................................................97
CONCLUSIONI ................................................................................................................. 103
BIBLIOGRAFIA ................................................................................................................. 104
SITOGRAFIA...................................................................................................................... 108
NOTE INTEGRATIVE ..................................................................................................... 110
3
INTRODUZIONE
Ho scelto di trattare questo argomento come tesi conclusiva della mia laurea in quanto ho
ritenuto questo progetto inerente in modo al corso di laurea che precedentemente avevo
affrontato: Scienze Motorie.
Le competenze acquisite in questo corso erano rivolte preferenzialmente al recupero
funzionale delle abilità motorie in tutti quei soggetti che avevano ricevuto una lesione
permanente o temporanea di queste.
Nel corso della riabilitazione in palestra spesso mi sono trovato a trattare con pazienti
traumatizzati e neurolesi, con pazienti affetti da patologie degenerative del SNC o SNP.
Durante le sedute di trattamento mi capitava sovente di sentirmi dire: “riuscirò a muovere la
mano? potrò ancora scrivere? quando sarò capace di alzarmi?”.
Altri pazienti erano affetti da disturbi cognitivi derivanti da traumi, da neoplasie o patologie
degenerative, e si sfruttava il movimento al fine di rallentare il decorso della malattia, e
l’aggravarsi del quadro clinico.
Non riuscivo però a conoscere l’entità reale del danno legato alla funzione e quale effetto
produceva realmente l’allenamento.
Come migliorare il recupero? Come adattare l’allenamento ed il gesto in relazione alla storia
clinica di ogni paziente? Cosa cambiare e cosa sperimentare?
Non conoscevo le “skill” della risonanza magnetica funzionale.
Quando successivamente nel corso di laurea per TSRM ho avuto la fortuna di scoprire le
potenzialità di questa nuova tecnica e l’applicazione a una quasi infinita gamma di casi
clinico-diagnostici, sono stato subito incuriosito e stuzzicato ad apprendere in modo più
approfondito le dinamiche di questa branchia della risonanza e la possibilità forse futura di
vederla applicata come indagine integrativa e di sostegno per tutti quei pazienti che
necessitano di una chiave di Volta per aprire, scoprire e magari correggere quello che è
riuscito a renderli tale. La risonanza magnetica funzionale rappresenta una delle più
innovative scienze di imaging funzionale.
Negli ultimi anni ha permesso lo sviluppo di uno studio dettagliato delle varie aree
cerebrali, delle loro interconnessioni, permettendo di sviluppare protocolli clinici per
comprenderne al meglio le funzioni.
La risonanza magnetica funzionale (fMRI in inglese) prevede molteplici aree di utilizzo:
4
Neuroscienze cognitive: si concentra sulla acquisizione e comprensione di tutti gli
aspetti mentali coinvolti nei processi di consapevolezza, ragionamento, ed
apprendimento di conoscenze e di schemi di comportamento.
Diagnostica/clinica: è utilizzata per evidenziare molteplici aree del cervello che
sono sede di svariate applicazioni cliniche.
Ricerca: usata sia nella sperimentazioni animale, umana e farmacologica, al fine di
costruire modelli d’intervento clinico-diagnostico mirati, evoluti e non invasivi.
La fMRI (functional magnetic resonance) permette di avere una elevatissima risoluzione
spaziale e temporale nella valutazione delle attività cerebrali, capacità che nessuna altra
tecnica attualmente possiede.
Questo ha permesso nella stessa seduta di lavoro di programmare uno studio morfologico
associato ad un elevata risoluzione spaziale, integrandolo a protocolli
di attivazione
funzionale.
A livello clinico uno degli aspetti più importanti di questa metodica è la possibilità di
valutare l’attivazione di un’area cerebrale in relazione ad una lesione (masse neoplastiche,
patologie vascolari, malformazioni), per poter effettuare una valutazione prechirurgica non
invasiva, costruendo modelli d’intervento personalizzati sul paziente ed elaborando la
strategia vincente per rimuovere il maggior volume di massa neoplastica riducendo al
minimo i deficit neurologici che verranno causati dall’intervento.
Attualmente l’obbiettivo principe della fMRI risiede nell’integrazione con ulteriori tecniche
diagnostiche quali trattografia, spettroscopia, stimolazione corticale intraoperatoria, WADA
Test, stimolazione magnetica transcranica ed altre, al fine di riuscire ad offrire al
neurochirurgo un imaging sempre più accurato e sicuro.
L’fMRI non è esente comunque da limiti che risiedono attualmente in:
necessità di interpretazione attraverso modelli matematici e statistici del segnale
usato per l’imaging, il quale è un “marker” indiretto dell’attività dei neuroni,
influenzato da molteplici variabili: flusso e volume sanguigno, livelli di emoglobina
e de ossiemoglobina, campo magnetico applicato, sostanze che perturbano il campo
magnetico, tipologia di sequenza, grado di collaborazione del paziente, difficoltà
della”task”, tipologia ed età del paziente, anatomia cerebrale, ansia e stress...
Mancanza di processi standardizzati nell’esecuzione dei protocolli tecnicodiagnostici, per cui diviene più difficile una comparazione statistica ai fini di rendere
questa tecnica per ogni suo aspetto clinicamente accettabile.
5
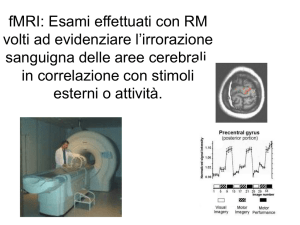
STORIA DELLA RISONANZA MAGNETICA
FUNZIONALE
All’inizio si è cominciato a studiare l’utilizzo di sostanze paramagnetiche introdotte nel
circolo sanguigno al fine di poterle utilizzare come marker vascolari per lo studio morfofunzionale.
Il mezzo di contrasto (un composto non tossico del Gadolinio) veniva introdotto
attraverso una vena della gamba, questo agente aveva la capacità di indurre una riduzione di
circa il 40% del segnale nei tessuti che circondano il bolo durante il suo passaggio.
All’inizio gli studi furono eseguiti sugli animali utilizzando tecniche di risonanza magnetica
ultraveloci, note con il nome di Echo Plannar Imaging (EPI), che permettono di ottenere
“istantanee” della distribuzione del mezzo di contrasto durante il suo passaggio nel circolo
cerebrale.
Il passaggio successivo si verificò quando la RM fu applicata ad indagini funzionali.
Si studiò un soggetto prima in una condizione di riposo prendendo delle immagini lungo il
piano del solco calcarino, in un intervallo temporale noto ed eseguendo poi una stima del
volume relativo del flusso sanguigno. Queste immagini sono poi state comparate tramite
tecniche di sottrazione d’immagine, eseguendo lo stesso tipo d’esame ed introducendo
come variabile la somministrazione di impulsi visivi al soggetto durante l’esecuzione
dell’indagine stessa.
Grazie a questa metodica si è potuto constatare un aumento relativo del flusso sanguigno
del 30% nella corteccia visiva primaria.
Ogawa (1990) e Tumer (1991) successivamente dimostrarono eseguendo esperimenti su
animali da laboratorio, che si poteva ottenere un cambiamento di contrasto inerente ad aree
adiacenti ai vasi sanguigni anche grazie ad una modificazione dei livelli d’ossigenazione del
sangue.
Questa osservazione derivava dal fatto notato da Faraday e misurato sperimentalmente da
Pauling e Corey (1936) che la desossiemoglobina è più paramagnetica dell’ossiemoglobina,
la quale ha una suscettività magnetica quasi uguale a quella del tessuto, perciò la
desossiemoglobina può essere considerata come un agente di contrasto naturale.
Continue variazioni nell’attività cerebrale di un soggetto che creano uno sbilanciamento tra
la richiesta di ossigeno ed il flusso sanguigno producono un cambiamento nel segnale
prodotto dai vasi che irrorano la corteccia, questo fenomeno può essere osservato nel caso
6
in cui vengano usate sequenze di immagini di risonanza sensibili alle disomogeneità del
campo magnetico.
Lo sviluppo di questa tecnica si è ultimato nei lavori di Kwong (1992) e di Ogawa (1990), i
quali documentarono che in un soggetto sottoposto a una luce brillante i cambiamenti dei
livelli della desossiemoglobina nella corteccia visiva umana erano sufficienti a determinare
cambiamenti di segnale misurabili nelle immagini di RM. Questa metodica prende il nome
di «Blood Oxygenation Level Dependent contrast» (BOLD) e consente di creare una
mappa dell’attività cerebrale funzionale senza mezzi di contrasto, senza uso di farmaci
radioattivi e con un elevata risoluzione spaziale integrandola a studi morfologici.
Figura 1: da sinistra a destra, Seiji Ogawa, Robert Corey e Linus Pauling
7
ASPETTI FISICI DEL SEGNALE: BOLD vs ASL
Segnale BOLD
Il fenomeno BOLD è alla base delle variazioni di segnale di RM provenienti dalle
attivazioni neuronali degli studi sull’encefalo.
Durante uno stimolo (motorio, cognitivo, sensoriale) si verifica un aumento del flusso
ematico nelle zone coinvolte alla produzione od elaborazione di questo fenomeno. La
variazione di flusso è la causa di una variazione del segnale misurato.
Nel sangue l’emoglobina si può difatti trovare in 2 forme: deossigenata con proprietà
paramagnetiche, ed ossigenata con caratteristiche isomagnetiche ai tessuti circostanti.
Essendo paramagnetica la desossiemoglobina, come altri materiali paramagnetici introdotti
in un campo magnetico esterno si allineano alla direzione ed al verso del campo andando a
sommarsi al campo ed aumentandone leggermente l’intensità.
La desossiemoglobina va a creare nei suoi intorni di concentrazione delle micro
perturbazioni magnetiche che aumentano lo sfasamento degli spin degli atomi. Il tutto si
riconduce in una perdità più rapida della coerenza di fase e quindi in un minor segnale.
L’emoglobina carica di ossigeno essendo invece isomagnetica ai tessuti circostanti non va a
perturbare l’omogenità di campo e non fa sfasare i protoni.
Possiamo di conseguenza schematizzare l’andamento del segnale BOLD in relazione ad
uno stimolo di attivazione neuronale: all’inizio si verifica una caduta di segnale dovuta ad
un immediato aumento di concentrazione di Hb de-ossigenata, dovuto all'estrazione di
ossigeno dai capillari arteriosi.
Successivamente avviene un incremento del segnale causato dall'aumento del flusso
sanguigno ossigenato nella sede attivata, che diluisce la concentrazione dell'emoglobina deossigenata. Nei secondi successivi il metabolismo cellulare determina un ulteriore
estrazione di ossigeno dai capillari, causando un aumento crescente della concentrazione di
desossiemoglobina, con derivante caduta del segnale, che successivamente dopo essere
giunto al minimo tende ad aumentare sino ai livelli precedenti l’attivazione neuronale.
8
Figura 2: Andamento temporale di alcuni paramentri fisiologici e diagnostici in relazione
alla stimolazione di un area cerebrale
CBF = Flusso sanguigno cerebrale
CBV = Volume sanguigno cerebrale
CMRO2 = Concentrazione metabolica cerebrale di ossigeno
BOLD = Blood Oxygenation Level Dependent contrast
rdHb = Concentrazione dell’emoglobina legata all’ossigeno
Un ulteriore effetto che determina la formazione del segnale nelle aree cerebrali interessate
è dato dall’utilizzo di sequenze molto veloci (es. GE EPI). A causa di ciò i protoni del
parenchima che stiamo studiando si trovano in una condizione di saturazione in quanto i
TR usati sono più corti della loro capacità di recupero del rilassamento longitudinale, ed il
segnale emesso è minimo.
All’interno dei vasi invece grazie all’aumentato flusso sanguigno dovuto all’attivazione vi
sono spin non saturi che emettono segnale massimo.
Il segnale che tramite l’fMRI andiamo a misurare sta nella differenza di segnale di ritorno
fra l’emoglobina ossigenata ed emoglobina deossigenata, che è nell’ordine del 1-4%.
Attraverso pesature T2*si è in grado di valutare questo cambiamento.
Il T2* è il parametro che caratterizza il grado di coerenza degli spin: se questi vengono
defasati da delle disomogeneità di campo prodotte dalla dHb il T2* si accorcerà
progressivamente ed il segnale decrescerà ulteriormente. Tale defasamento si manifesta
come ipointensità nelle immagini pesate in T2*.
Confrontando il parametro T2* in due momenti distinti (riposo e pausa) durante una
sequenza funzionale di RM si può identificare le zone ove è avvenuta una variazione di
segnale come in quelle coinvolte nell’attivazione.
9
Le tecniche di risonanza basate sul sistema BOLD come altre tecniche basate sul CBF
(cerebral blood flow), hanno alcuni limiti:
CBF è un marker indiretto di attività neuronale e non esprime la diretta attività del
neurone, ma il segnale proveniente dal comparto vascolare.
Ha una risoluzione spaziale nell’ordine di mm di diametro.
Il tempo di incremento del CBF ha una latenza di 2-6 secondi rispetto all’effettiva
attivazione
Le sequenze T2* sono molto sensibili alle disomogeneità di campo e possono
venire perturbate dalla presenza di metalli, emosiderina o altri prodotti metabolici, e
dal flusso rapido nelle grandi vene.
Siccome il segnale rilevato è molto piccolo anche piccoli movimenti del capo del
paziente possono falsare la localizzazione e l’intensità del segnale ricevuto.
Nella tesi seguente verranno analizzate tecniche diagnostiche, procedure cliniche e verrà
sviluppato il ruolo del TSRM negli approcci ai sistemi di attivazione funzionale tramite
l’utilizzo di fMRI legata al segnale BOLD. Per completezza vengono anche proposti cenni
sull’ ASL (Arterial Spin Labeling).
Segnale ASL (Arterial Spin Labeling)
E’ una tecnica non invasa che marca i protoni d’acqua del sangue utilizzandoli come
traccianti endogeni di flusso[23,24].
Essendo l’acqua contenuta nel sangue in continuo scambio con l’acqua presente nei tessuti
limitrofi attraverso i capillari, un magnetizzazione di un arteria o di un vaso (tramite impulsi
di inversione o saturazione) vicino alla zona di interesse va a modificare anche la
magnetizzazione tissutale.
Si va poi a fare un confronto fra 2 immagini una con “labeling” o modulazione della
magnetizzazione ed una senza, e si ottiene un segnale che è relativo al flusso endogeno in
quella zona. Questo segnale viene catturato durante le “task” di attivazione ed è
strettamente correlato all’attività dei neuroni in quanto i capillari sono estremamente
prossimi ai siti di attivazione.
Questo segnale a differenza del segnale BOLD è influenzato mono parametricamente
soltanto dai cambiamenti di flusso, mentre invece il segnale BOLD è multi parametrico e
10
non è stato ancora definito un modello fisiologico accettabile. Tuttavia entrambe le
tecniche correlano molto bene con la reale attivazione del neuroni.
Figura 3: Arterial Spin Labeling. Il sangue viene marcato in una zona tramite impulsi di RF,
viene poi valutato il segnale derivante dagli spin marcati e quello derivante dagli spin non
marcati in una zona di controllo(può differire dalla zona ove avviene la marcatura. La
differenza di segnale viene rappresentata come imaging di perfusione correlabile ad una
attività funzionale.
Le tecniche di ASL si possono suddividere in base a come viene effettuato il marcamento
degli spin dell’acqua del sangue permettendo di ricavare informazioni relative al flusso e
quindi alla funzionalità dei neuroni in:
CASL (Continuous Arterial Spin Labeling), gli spin vengono marcati in maniera
costante durante il loro passaggio tramite l’invio continuo di radiofrequenze
PASL (Pulsed Arterial Spin Labeling), si sfrutta una breve impulso per invertire la
magnetizzazione
in un determinato volume, poi si aspetta un TI (tempo di
inversione) per permettere agli spin di entrare nel tessuto e si acquisiscono le
immagini. Il volume dove avviene l’inversione può coincidere o meno rispetto a
quello dove viene acquisita l’immagine.
11
Le CASL sono caratterizzate da un elevato rapporto segnale/rumore ma depositano sui
tessuti un enorme quantità di RF, mentre invece le PASL hanno un rapporto segnale
rumore minore ma depositano anche molto meno radiofrequenza sui tessuti. Sono
utilizzate per l’imaging funzionale.
Attualmente sia l’fMRI con BOLD che con ASL vengono utilizzate ed integrate a vicenda
per confermare un quesito clinico e per correggersi ed integrarsi laddove vi siano dei dubbi
di falsi negativi o positivi.
12
AREE ELOQUENTI STUDIATE DALL’FMRI
L’fMRI (functional Magnetic Risonance Immaging), può studiare praticamente tutte le aree
di attivazioni cerebrale a secondo dell’impiego clinico. Si possono annoverare molteplici
aree di indagine suddividibili in:
Aree Motorie
Area 4, area motoria primaria M1 (area di Brodmann), occupa la circonvoluzione frontale
ascendente ed il lobo paracentrale, è identificata da un cospicuo numero di neuroni tra cui
i neuroni piramidali giganti da cui origina la via piramidale. In questa area esiste una
rappresentazione somatotopica capovolta della metà contro laterale del corpo, il cosiddetto
omuncolo motorio. La rappresentazione dell’omuncolo è bilaterale, mani, bocca e lingua, faccia
possiedono un area di rappresentazione corticale molto più estesa rispetto agli arti ed al
tronco, dovuta ai complessi e coordinati movimenti che possono svolgere.
Gli arti inferiori sono situati nella parte mediale e superiore dell’emisfero mentre faccia,
lingua e bocca si trovano infero lateralmente.
Figura 4: organizzazione somatotopica della corteccia motoria primaria. Task fMRI di
attivazione delle aree relative a flesso estensione del piede, opposizione delle dita al pollice, e
movimento delle labbra.
13
Area 6, area premotoria, è posta anteriormente l’area motoria primaria ed è connessa a
questa e a regioni del tronco encefalico. E’ è deputata alla ricerca di tutti i gesti e le
condizioni posturali necessarie prima di iniziare un movimento.
Area motoria supplementare, situata nella parte supero mediale del lobo frontale, riceve
afferenze dai nuclei della base e dalle aree motorie corticali, anche dalla contro laterale.
Manda efferenze alle aree motorie e alle vie piramidali (cortico-spinale). E’ deputata a
regolare i movimenti complessi fini, la memoria del movimento e del movimento legato ai
comportamenti.
Il tecnico di radiologia ed i neurofisiologi collaborano per la mappatura funzionale di
queste aree attraverso determinati compiti che vengono richiesti al paziente quali:
Movimenti delle dita della mano o percezioni sensoriali delle stesse, per determinare
o la localizzazione delle aree motorie relative o la localizzazione delle aree
associative fra corteccia sensoriale e motoria.
Movimenti delle labbra, movimenti della lingua
Movimenti di flesso estensione delle dita dei piedi
Bisogna tenere conto che durante queste indagini non è possibile far compiere al paziente
movimenti ampi o che ne modificano la centratura, perché potrebbero verificarsi delle
distorsioni geometriche ed aumenterebbero gli artefatti da movimento.
Utilizzo dell’ fMRI nella predizione dei pazienti verso un trattamento chirurgico
L’fMRI ha trovato una sua applicazione nella valutazione e selezione dei pazienti per un
eventuale intervento chirurgico[4].
Nella figura 3 nelle scansioni in alto, assiali T2 pesate, si osserva un glioblastoma
multiforme. Nell’emisfero di sinistra è possibile identificare (freccia) il solco centrale, cosa
che non è possibile fare per l’emisfero di destra in quanto la massa tumorale ha ricoperto
ed invaso i normali reperi anatomici che vengono utilizzati come strumenti di
pianificazione di interventi chirurgici in funzione della loro identificazione di aree
funzionali.
L’intervento chirurgico non era quindi possibile.
Vengono poi eseguite delle scansioni morfologiche T1 pesate con gli stessi parametri
geometrici delle T2. Su queste T1 vengono poi integrate le immagini di attivazione
14
funzionale derivanti da protocolli di “Finger Tapping”. Si può osservare come nell’emisfero
di sinistra l’attivazione delle aree corticali relative alla mano segua il normale
posizionamento anatomico a livello del giro pre e post centrale, mentre invece nell’emisfero
di destra la massa tumorale ha spostato l’area di attivazione della mano molto più
anteriormente.
Grazie all’fMRI ed a protocolli di “Finger Tapping”, si è riusciti a selezionare un paziente
per un intervento chirurgico, che invece era destinato a percorsi terapeutici molto differenti
(radioterapia, chemioterapia, cyberknyfe, gamma-knyfe) in quanto si riteneva di causare un
deficit motorio inaccettabile.
Figura5: in alto scansioni T2 assiali mettono in evidenza un glioblastoma multiforme, in
basso scansioni di fMRI mettono in evidenza le aree di attivazione della mano in relazione
alla lesione.
15
Mappature corticali sensitivo-motorie effettuate in condizioni di riposo
Vi sono molteplici problemi che si riscontrano nell’adottare l’fMRI nella pratica clinica
anche da parte del tecnico durante indagini di attivazione:
Non tutti i pazienti sono in grado di svolgere determinate funzioni che vengono
richieste da parte dell’operatore: opporre le dita al pollice, muovere piedi, seguire
oggetti con occhi, leggere, identificare oggetti. A causa della lesione neoplastica o ad
alterazioni delle corrette capacità cerebrali sovente si possono trovare pazienti
incapaci di svolgere quanto richiesto.
Bambini che non comprendono le domande che vengono formulate
Pazienti anestetizzati
E’ stato studiato e sperimentato un metodo che può risolvere l’approccio prechirurgico alle
lesioni in quei pazienti che si ritrovano impossibilitati allo svolgere un determinato gesto
relativo ad una task di attivazione, evitando dove possibile l’utilizzo di tecniche
preoperatorie
più
invasive
come
la
mappatura
tramite
stimolazione
corticale
intraoperatoria.
Questa metodica [4a] si basa sulla mappatura delle aree corticali senso motorie studiate sui
soggetti a riposo, mettendo in evidenza come anche senza task di attivazione alcune aree
del cervello comunicano sempre tra di loro.
16
Figura 6: A, modello di rete neurale senso-motoria sviluppato su 17 giovani adulti sani in
condizioni di riposo. Mette in evidenza un elevata correlazione fra le aree corticali sensomotorie di destra e di sinistra.
B, sono stati selezionati 2 soggetti dal gruppo dei 17, sono state eseguite 4 scansioni ciascuna
della durata di 7 minuti. In tutti i casi si sono mostrate delle alte correlazioni di attività nella
corteccia senso-motoria contro laterale.
Permette inoltre con un'unica scansione di avere un visione d’insieme di mappe neurali a
riposo, e di confrontare i pazienti standardizzando i protocolli, senza variazioni derivanti da
atteggiamenti individuali durante le richieste dell’operatore.
E’ possibile inoltre filtrare meglio le fluttuazioni derivanti dal rumore di fondo in quanto le
condizioni sono uniformate.
Questa metodica è stata correlata e comparata sia alla normale fMRI “task-based”, che alla
stimolazione corticale intraoperatoria con ottimi risultati.
Rispetto alla fMRI “task-based” ha mostrato anche una variazione individuale ridotta ed
una maggiore riproducibilità.
Attualmente l’applicazione delle mappe di riposo funzionali come tecnica d’indagine
preoperatoria è correlata scientificamente alle aree corticali senso-motorie con risultati
scientificamente accettati rispetto alle tecniche classiche. L’investimento per il futuro
riguarda l’area del linguaggio dove l’attivazione corticale intraoperatoria ha dei limiti fisici di
accesso, che tramite la mappatura a riposo possono essere superati. [4]
17
Figura 7: A, scansione RM morfologica che mette in evidenza la dislocazione della massa
tumorale inducendo a pensare una distruzione della corteccia somato-sensoriale e motoria.
Il cerchio verde rappresenta la posizione della mano ottenuta tramite stimolazione corticale
intraoperatoria.
B, mappa di correlazione eseguita a riposo che mostra la reale distribuzione delle reti sensomotorie in questo paziente. Il cerchio azzurro mostra la ROI presa nell’emisfero contro
laterale alla lesione. Dalle mappe a riposo si riesce a verificare che le funzioni senso-motorie
sono state dislocate in una regione antero-laterale da parte della massa tumorale.
18
Aree sensitive
Area sensitiva primaria S1 (aree 1,2,3 di Brodmann) situata nella circonvoluzione
parietale ascendente. E’ l’area destinata alla ricezione di tutte le afferenze sensitive della
metà controlaterale del corpo.
Anche in queste aree vi è una rappresentazione invertita dell’omuncolo sensitivo. L’area
sensitiva primaria ha numerose interconnessioni con l’area motoria in modo che le
afferenze sensoriali possano dare origine ad una risposta motoria immediata in caso di
necessità.
Le aree 5 e 7 costituiscono l’area sensitiva secondaria o stereognosica deputata al
riconoscimento di forma e caratteristiche fisiche oggetti senza l’ausilio della vista.
Le aree 9-10-11-12 sono aree associative, formano l’area prefrontale responsabile del
controllo e sviluppo di funzioni intellettive, di gestione del tono dell’umore, del tono
dell’affetto (bontà, cattiveria, pessimismo, ottimismo).
Sono situate nella parte più anteriore del lobo frontale.
Numerose sono le interconnessioni che si instaurano col sistema limbico.
Sono inoltre queste le aree che vanno ad individuare il centro della previsione deputato alla
regolazione dei sistemi mentali che progettano il movimento.
Le aree sensitive tramite lo studio in fMRI vengono attivate sfregando le mani o dita con
spazzole o oggetti di plastica ruvidi. Questi stimoli possono essere applicati anche in
diverse regioni corporee, l’importante è che il meccanismo di azione non interferisca col
campo magnetico e che non porti il paziente a muoversi.
Studi di fMRI rivolti all’attivazione della corteccia visiva attraverso stimoli sensitivi
in soggetti divenuti ciechi in età adulta
Sono stati fatti studi fMRI sulla attivazione della corteccia visiva in risposta a stimoli tattili
fra 2 gruppi di studio: soggetti non vendenti o con grossi deficit di visione dovuti a retinite
pigmentosa, ed un gruppo di soggetti vedenti bendati.
Sono prima state prese delle immagini anatomiche di riferimento tramite sequenze 3D
MPRAGE T1 [B] pesate su scanner Siemens da 3 Tesla. Le immagini di fMRI sono state
acquisite tramite sequenze EPI, TR 2000 ms, TE 25 ms, Flip angle 60°, 36 fette con voxel
isotropici 3x3x3 mm3.
19
La task di attivazione prevedeva il riconoscimento singolare di un
dischetto di carta vetrata nel cui centro vi era una striscietta di
carta vetrata con ruvidità differente.
Le istruzioni erano impartite tramite cuffie, le acquisizioni
venivano prese mentre il soggetto esplorava il dischetto per 4
secondi, dopodichè vi era un periodo di riposo per il ritorno alle
condizioni basali e per non saturare la polarizzazione.
I soggetti erano bendati e sono stati educati a mantenere sempre
gli occhi aperti anche nella completa cecità. Questo protocollo garantisce di minimizzare gli
effetti di attivazione della corteccia visiva dovuta all’immaginazione quando si tengono gli
occhi chiusi. Il software usato per l’analisi dei dati dell’immagine è il QX Brain Voyager, i
dati anatomici sono stati corretti sulle dismogenità ed ai dati funzionali sono state applicate
funzioni di: correzzione del movimento 3D, regolazione dell’intensità media, correzione del
tempo di acquisizione per sezione, filtri temporali.
E’ stata identificata automaticamente per ogni soggetto la corteccia visiva primaria,
delimitata nel polo occipitale e dalle 2 sponde della fissura calcarina. E’ stata eseguita una
ROI manuale su V1 e si è calcolato la precentuale di voxel attivi all’interno. Il valore medio
ottenuto è stato utilizzato per verificare l’ampiezza degli altri valori e stabilirne falsi positivi
o negativi. Ai 2 gruppi è stata fatta eseguire prima dell’indagine una simulazione per
addestrarli e ridurre errori ed incertezze.
20
Figura 8: risposte agli
stimoli tattili in soggetti
affetti
da
retinite
pigmentosa
A
sinistra
la
rappresentazione del segnale
BOLD derivante dagli stimoli
tattili (dischetti di carta
vetrata) in buona parte del
cervello.
RP1,
RP2
mostrano
un’attivazione massiva, sono i
2 soggetti con la perdita di
visione più accentuata, RP1 è
cieco.
RP3 e RP4 hanno un
attivazione
più
modesta,
presentano una visione a
tunnel.
RP6 è un soggetto con retinite
pigmentosa ai primi stadi e
presenta un attivazione simile
a quella dei soggetti di
controllo.
A destra viene visualizzata
l’attivazione della corteccia
visiva in relazione agli stimoli
tattili. La linea bianca
identifica il decorso della
scissura calcarina.
21
Figura 9: percentuale di voxel attivati in relazione al campo visivo
In questo grafico viene riportato l’andamento di attivazione (numero di voxel) della
corteccia visiva in relazioni al campo visivo dei soggetti. All’aumentare della perdita della
capacità visiva si nota un aumento dell’attivazione dei voxel relativi alla corteccia visiva
stessa. Ricordiamo che questa attivazione la si ha grazie alla somministrazione di stimoli
tattili.
Figura10: intensità del segnale BOLD in relazione al campo visivo
Attraverso questa indagine di fMRI si è potuto apprendere come nei soggetti affetti da
perdita della visione sia periferica che centrale, le aree corticali deputate all’elaborazioni dei
dati provenienti dai campi visivi (non più funzionanti), sono state successivamente
assegnate a ricevere ed elaborare informazioni derivanti da un contesto sensoriale (stimoli
tattili).
22
Questa attività di “incrocio delle funzioni”, si sta valutando anche per altri sensi, quali
udito, gusto, olfatto per osservare le aree corticali superiori come vengono utilizzate
qualora si verifichi un danno periferico alle strutture comandate da queste.
Un altro vantaggio dell’fMRI prevede la sua applicazione come indagine diagnostica e di
valutazione del progresso o regresso della patologia a seguito di procedure terapeutiche e
farmaceutiche (es. verifica della terapia farmacologica per la retinite pigmentosa).
Sempre grazie allo studio di attivazione funzionale si è sviluppato un altro “trial” dove i
soggetti esaminati erano sani, ed erano stati precedentemente bendati per 5 settimane. Si
sono osservate le attivazioni prima e dopo il bendaggio in relazione all’attivazione della
corteccia visiva tramite stimoli tattili. La situazione di temporanea cecità ha sviluppato
anche in questi soggetti un attivazione elevata del comparto corticale visivo rispetto agli
stimoli tattili (stessi paradigmi usati nel “trial” sopra descritto). Si è concluso che se il danno
non è permanente, l’area corticale investita dalla temporanea percezione sensitiva sarà
successivamente readibita alle sue originarie funzioni, in quanto con un ulteriore indagine di
controllo 2 settimane dopo che i bendaggi sono stati tolti si presentava una situazione
identica a quella prima del bendaggio.
Mappaggio corticale preoperatorio: batteria integrata di funzioni visive, motorie,
sensitive e linguistiche
Molte indagini eseguite con protocolli fMRI sono risultate valide ed efficienti ma
presentavano l’inconveniente di una scarsa riproducibilità, differenti protocolli applicativi,
scarsa fedeltà fra popolazioni di “testing” e popolazioni cliniche.
Si è cercato allora di sviluppare dei protocolli standard, riproducibili, adattabili alle
popolazioni cliniche ed integrativi di molteplici funzioni per poter al meglio discriminare le
aree eloquenti in relazione fra loro e nei riguardi della formazione neoplastica da valutare in
sede prechirurgica[12].
Si è cercato di verificare una corrispondente sensibilità sia nelle popolazioni cliniche (125
pazienti) che in giovani volontari sani (63 soggetti) in relazione alle informazioni riscontrate
con la “batteria multitasking”.
La veridicità di questa batteria si è ottenuta comparandola ad altre tecniche:
-
mappaggio
corticale
intraoperatorio
tra
cui
l’evocazione
di
somatosensoriali, stimolazione corticale diretta, mappaggio del linguaggio.
23
potenziali
-
Test di WADA [C]
-
Esame del campo visivo
Le indagini sono state eseguite tramite una risonanza a 1,5 Tesla (GE), acquisite sia
immagine T1 morfologiche su tutti e 3 i piani, che immagini T2* GE (TR 4000, TE 40, flip
angle 60) sensibili al cambiamento del segnale in risonanza relativo alle variazioni di de
ossiemoglobina nel comparto vascolare.
I paradigmi presi in esame prevedono 4 blocchi principali [6] e per ogni blocco sono state
eseguite 2 fasi della stessa durata (2 minuti e 24 secondi), suddivise in 3 sottoblocchi,
periodo di riposo, periodo di attività, periodo di recupero, e per ognuno di questi sono
state prese 10 immagini. Questa doppia suddivisione aveva il compito di evitare
affaticamenti al paziente ed una maggiore casistica per le statistiche e correzioni.
I blocchi usati sono:
I.
Stimolazione passiva tattile della mano e delle dita (Fig. 9) paziente attraverso un
oggetto di plastica ruvida. La mano stimolata è quella in relazione con l’emisfero
affetto dalla lesione. Nel frattempo il paziente vede proiettato su uno specchietto
situato sopra la sua testa una scacchiera che cambia i colori, che serve sia come
input visivo, ma anche ad aiutare il paziente a stabilizzare la testa durante
l’esecuzione dell’indagine.
II.
“Finger-Tapping”, ossia toccare il pollice con le varie dita, utilizzando la stessa
mano usata per la stimolazione passiva. Anche in questo caso viene mantenuto il
riferimento visivo.
III.
Il paziente deve “nominare silenziosamente”, ossia pensare e parlare senza muovere
ne bocca ne lingua, in relazione agli oggetti disegnati in bianco e nero che gli sono
proiettati (1 ogni 4 secondi), fissando lo stabilizzatore visivo (scacchiera invertita).
IV.
Il paziente ascolta sequenze di parole tramite delle particolari cuffie che lo isolano
dal rumore del magnete e trasmettono le registrazioni.
Gli obbiettivi di questa batteria sono: la localizzazione delle aree sensitive e motorie, la
localizzazione dell’area visiva primaria e secondaria, e la localizzazione delle aree uditive
primarie e secondarie.
24
Figura 11: cambiamenti del segnale RM in relazione alla stimolazione tattile passiva
Per questo paradigma sono stati eseguiti 2 blocchi. E’ stato esaminato la variazione del
segnale RM in un unico voxel durante i 2 blocchi. Per tutti i voxel del cervello che
presentavano durante l’attivazione dei valori differenti da quelli di base, sono stati
determinati dei colori (giallo, arancione e rosso)di attivazione riferibili al segnale delle
pesature in T2*, in ordine decrescente riferito ai livelli di fiducia statistica rispetto al segnale
del voxel di riferimento.
Tabella 1: blocchi di fMRI per mappaggio corticale di aree motorie, sensitive, linguistiche e
visive.
SENSITIVO (strofinamento mano
con ogetto di plastica)
+
VISIVO (proiezione scacchiera
invertita)
MOTORIO (toccare con dita il
pollice)
+
VISIVO (proiezione scacchiera
invertita)
+
VISIVO (proiezione figure in bianco
e nero)
+
UDITIVO (ascolto parole)
LINGUAGGIO
ATTIVO(nominare oggetti senza
parlare)
LINGUAGGIO PASSIVO (ascolto
parole)
25
Figura 12: attivazione aree corticali in relazione alla batteria di compiti assegnata.
L’attivazione derivante dagli stimoli tattili passivi si è sviluppata a ridosso della parte
posteriore della circonvoluzione centrale (GPoC).
L’attivazione derivante dagli stimoli motori di “finger thumb tapping” si è mostrata a
ridosso della parte anteriore della circonvoluzione centrale (GPrC).
L’attivazione derivante dagli stimoli relativi alla visione della scacchiera invertita sono posti
a ridosso della scissura calcarina (CaS)
La circonvoluzione occipitale (Goi) inferiore è attiva tramite il riconoscimento e la
verbalizzazione silente delle figure che vengono mostrate.
La verbalizzazione silente delle figure che compaiono e la task di ascolto delle parole
attivano sia l’aerea del Broca (GFi) che quella secondaria del Wernicke (GTs) a livello
dell’emisfero dominante.
La corteccia uditiva primaria (GTT) è attivata in entrambi gli emisferi durante l’ascolto delle
parole.
Nei soggetti sani, l’efficacia della batteria nell’individuazione delle aree corticali legate al
linguaggio è del 100% per tutte le aree ad eccezione dell’area del Broca dove la sensibilità si
abbassa al 93%.
Nei pazienti invece le statistiche del test si sono effettuate suddividendo i candidati in base
alla localizzazione della lesione, ed osservando la sensibilità del test per l’attivazione della
regione affetta dalla patologia. Tutti i pazienti sono riusciti ad eseguire la batteria.
26
Per motivi legati al movimento della testa a causa di deficit neurologici, la non perfetta
esecuzione del paradigma o a causa di alcuni soggetti con disturbi cognitivi si è ottenuto:
100% attivazione corteccia visiva, 91% area del Wernicke, 77% area del Broca, e 97% aree
sensitivo-motorie.
La comparazione della fMRI è stata eseguita anche con le mappature corticali, ed entrambe
le attivazione sono state verificate e comparate con un successo del 100%.
Grazie a questa “task” di attivazione multifattoriale, integrata con ulteriori metodi
diagnostici per il mappaggio cerebrale, si è riusciti nettamente a migliorare la localizzazione
delle aree eloquenti in popolazioni cliniche che necessitano di una pianificazione
prechirurgica d’intervento.
27
Aree del linguaggio
Aree corticali del linguaggio: hanno sede di solito nell’emisfero di sinistra che per questo viene
definito dominante. I centri del linguaggio si suddividono in centri motori e centri sensoriali.
Tra i centri motori vi sono il centro del Broca (area44) e il centro della grafia (area45), situati
rispettivamente nella parte posteriore della circonvoluzione frontale inferiore e in quella
media. L’area del Broca è deputata al controllo corticale dei muscoli della fonazione,
mentre il centro della grafia ci permette di comunicare attraverso la scrittura.
I centri sensoriali fanno parte dell’area del Wernicke, che comprende il centro verbo acustico
(area22) che ci permette di comprendere le parole udite ed è situato nella circonvoluzione
temporale superiore, ed il centro verbo visivo (area39) situato nel giro angolare, che controlla
la comprensione delle parole scritte.
Utilizzo fMRI nell’individuazione di differenti aree corticali in soggetti bilingui
precoci e tardivi
Già nel decennio scorso si è cercato di utilizzare l’fMRI per meglio comprendere
l’attivazione delle aree corticali linguistiche. Un articolo che fece molto scalpore fu quello
pubblicato da Karl H.S. “et al.”[8]dove vennero esaminati 12 soggetti suddivisi in 6 bi
lingua precoci che avevano appreso 2 lingue da piccoli e 6 bi lingua tardivi, ossia che
avevano appreso la seconda lingua in un età adulta, e che avevano raggiunto un livello
eccellente nel parlarla, ascoltarla e scriverla.
E’ stato usato un macchinario da 1,5 Tesla, sono state acquisite delle scansioni sia del giro
frontale anteriore (regione linguistica anteriore, area del Broca 44 e 46) e sia della parte
posteriore del giro temporale superiore (regione linguistica posteriore, 'Wernicke' area).
28
Figura 13: rappresentazione assiale
dell’area di attivazione della regione
linguistica anteriore in un soggetto bi
lingua tardivo.
Si possono notare 2 centri di attivazione
separati da un gap di 7,9 mm, indipendenti
l’uno dall’altro
Figura 14: rappresentazione assiale dell’area
di attivazione della regione linguistica
posteriore in un soggetto bi lingua tardivo. Si
può notare come il gap fra i 2 centri di
attivazione sia ridotto a 1,1 mm, meno della
dimensione di un voxel che per l’esame in
questione era di 1,6 mm per lato.
Figura 15: comparazione delle
aree linguistiche anteriori e
posteriori in soggetti bilingua
tardivi.
Si può facilmente osservare come
in tutti i casi, a livello di
distribuzione
spaziale
delle
attivazioni corticali vi è una netta
differenza fra l’area linguistica
anteriore dove i centri sono
nettamente separati, rispetto
all’area linguistica posteriore dove
le aree di associazioni sono
predominanti.
29
Figura 16: rappresentazione assiale dell’area di
attivazione della regione linguistica anteriore in un
soggetto bi lingua precoce.
Rispetto alla figura 5 si può notare come nel
soggetto bi lingua precoce non vi sia una
distinzione marcata dei centri di attivazione, e un
area comune estremamente vasta è utilizzata
indipendentemente dal tipo di linguaggio che viene
parlato o pensato.
Sono state prese 30 immagini, 1 ogni 3 secondi, suddivisi in diversi blocchi funzionali,
le prime 10 in un periodi di riposo, poi altre 10 durante le “task”, e le ultime 10 durante un
altro periodo basale. L’acquisizione è stata eseguita mentre il soggetto fissava un croce
luminosa per mantenere l’esatta centratura della testa e ridurre i movimenti.
La task prevedeva che i soggetti “parlassero in silenzio” mentre venivano proposti in modo
casuale 3 blocchi cognitivi: mattina, pomeriggio, notte. La lingua in cui parlare era decisa
casualmente ed i soggetti avevano 10 secondi per formulare un discorso con degli spunti
visivi annessi che li aiutavano. Le lingue durante le acquisizioni si alternavano casualmente
per evitare saturazioni della polarizzazione dei neuroni. Vi era anche per questo un periodo
di riposo.
Le task erano precedentemente state simulate per ridurre la marginalità di errore da parte
dei soggetti.
Le conclusioni sono state rivolte da queste indagini alla conoscenza di 2 differenti
formazioni citoarchitettoniche dell’area del Broca durante l’apprendimento del linguaggio.
Si è dedotto che la formazione corticale in neonati sottoposti a stimoli bi linguistici prevede
che non vi sia una separazione spaziale dei neuroni deputati ad una lingua rispetto all’altra,
ma che siano in un certo senso “totipotenti” per l’una o l’altra lingua.
Invece per i soggetti bi lingua tardivi, si è sviluppata prima un area linguistica a livello
dell’area del Broca rappresentativa della lingua madre, e successivamente, presubilmente in
quanto non modificale si è aggiunta accanto la formazione di una seconda area deputata
all’esercizio linguistico della seconda lingua.
Questa scoperta può avere anche un approccio clinico rilevante in quei soggetti bi lingua
tardivi affetti da una lesione a livello dell’area del Broca. Tramite l’fMRI si può prevedere in
30
questi soggetti un eventuale resezione dell’area compromessa e predire quali saranno i loro
deficit in termini di perdita della capacità di linguaggio, riuscendo magari a salvaguardare
almeno uno dei 2 o più pattern linguistici.
Adattamenti e neoformazione di reti linguistiche cerebrali in pazienti con gliomi a
basso grado
Si è cercato a lungo di comprendere come determinati tipi di lesione andassero a modificare
la plasticità della corteccia cerebrale modificando i “pattern” strutturali deputati allo
sviluppo di una determinata funzione. Sveljo O, “et al.”[9], hanno studiato questo
fenomeno in un paziente di 29 anni con un glioma di 2 grado nel lobo frontale di sinistra,
grazie all’ausilio di tecniche di fMRI.
I gliomi di basso grado hanno una progressione piuttosto lenta (anni) e per questo si
presuppone che la plasticità cerebrale riesca in qualche modo a plasmare le funzioni che
vengono perdute a causa dell’espansione della lesione, associandole e trasferendole in altre
aree cerebrali. Neoplasie invece rapide ed invasive, o lesioni acute (ictus), non permettono
un simile rimodellamento e redistribuzione della funzionalità, con conseguenze in termini
di deficit neurologico e riduzione della aspettativa e qualità di vita.
Il soggetto è stato studiato in varie tappe del “follow up” clinico, pre e post operazioni e
pre e post cicli di radioterapia.
A 29 anni il soggetto ha subito la prima operazione di resezione, successivamente ha
presentato casualmente dei blocchi della capacità di linguaggio per circa 10-20 secondi non
associati a perdita di coscienza, e successivamente un ripristino completo di queste capacità.
Si è quindi decisoo di sottoporlo a fMRI, utilizzando 2 blocchi di paradigmi: la valutazione
della fluenza verbale, e la valutazione linguistica di componenti semantiche, il tutto per
l’individuazione delle aree cerebrali legate al linguaggio.
Parametri di acquisizione: 3T RM, TR 3000 ms, TE 30 ms, spessore strato 3mm, FOV 240
mm, 10 acquisizioni. Elaborazione dati avvenuta con FMRIB’s Software Li-brary,
generazione mappe attivazione con FMRI Expert Analysis Tool.
Follow up fMRI
I.
A 36 anni, esattamente 7 anni dopo la resezione del primo tumore un MRI di
controllo ha trovato una recidiva formazione maligna. E’ stata eseguita una fMRI
31
per valutare le aree del linguaggio con il protocollo usato precedentemente e si è
scoperto una lateralizzazione sinistra per entrambe le task presentate (Fig. A e B).
II.
11 mesi dopo si è eseguita una seconda indagine di fMRI in previsione di un
intervento chirurgico dopo che una normale MRI aveva notato un aumento
notevole della lesione.
Si è osservato che le decisioni semantiche presentavano una dominanza
nell’emisfero di destro e le aree di attivazione della fluenza verbale mostravano un
attivazione mista sia destra che sinistra (Fig. C e D).
III.
Successivamente è stata effettuata un'altra operazione con rimozione tramite
controllo MRI del 90% del volume tumorale. Indagini condotte con fMRI hanno
permesso di constatare la conservazione della funzione linguistica ed un ritorno alla
dominanza sinistra per entrambe le task di attivazione (Fig. E e F)
Fig 17: sono riportate in varie tappe cronologiche le differenti allocazioni spaziali delle aree
di attivazione relative alle task di fluenza verbale e decisione semantica.
32
IV.
Successivamente il paziente è stato sottoposto ad un ciclo di radioterapia di 55 Gy,
e dopo 1 anno dall’operazione e 7 mesi dal ciclo radioterapico presentava una
dominanza sinistra per la fluenza verbale ed una codominanza destra e sinistra per
le decisioni semantiche.
V.
Dopo un ulteriore anno un ulteriore ciclo di MRI e fMRI mostrava una non
progressione tumorale e un ripristino totale della dominanza sinistra sia per le task
di fluenza verbale che di decisioni semantiche.
Grazie a questi studi di fMRI si sono potute formulare varie tesi scientifiche sulla plasticità
delle reti neurali legate al linguaggio in seguito ad un evento lesivo:
-
si verifica un aumento dell’ attività delle aree corticali contro laterali che svolgono la
stessa funzione.
-
Alcune aree si attivano al fine di reintegrare la perdita di funzione, questo viene
spiegato attraverso la presenza nel cervello di aree individuabili tramite l’fMRI che
vengono denominate “nodi insegnanti”, ed hanno il compito in caso di lesioni che
non si verificano in modo acuto, di “salvare” le funzioni che si stanno andando a
perdere in un area aggredita da una patologia, all’interno della propria zona di
dominio. Successivamente riescono a trasferire, insegnare queste funzioni ad
un'altra area, normalmente la contro laterale.
-
Tramite l’fMRI ed altre tecniche di mappatura cerebrale si sono sviluppate tesi di
reti neurali dinamiche che si sviluppano attorno a dei centri nodali comuni deputati
all’evoluzione citoarchitettonica delle reti stessi durante processi degenerativi o
lesivi .
33
Aree visive
Le aree corticali deputate alla visione sono suddivisibili in 3 sottogruppi:
Area 17, detta anche area visiva primaria situata nei pressi della scissura clacarina, è deputata
alla presa di coscienza delle sensazioni visive. A questa area è associata una
rappresentazione somatotopica delle diverse parti del campo visivo, posteriormente vi è la
sede della visione distinta, le zone anteriori presiedono alla visione periferica.
Le aree 18 e 19 situate vicino all’area 17 sulla faccia mediale del lobo occipitale costituisco
l’area visiva secondaria, addetta alla memoria visiva, presenta numerose interconnessioni con i
nuclei dei nervi oculomotori, deputati alla convergenza degli occhi mentre seguono un
oggetto in movimento.
L’area 39 detta centro verbo-visivo situata nella circonvoluzione parietale inferiore permette la
comprensione delle parole scritte. Presenta numerose connessioni coi centri visivi.
Studio della plasticità visiva tramite fMRI in soggetti affetti da neuriti ottiche
unilaterali
La fMRI viene utilizzata come abbiamo già visto per studiare la plasticità del nostro
cervello in relazione ad un danno.
E’ stato condotto uno studio sulle risposte della corteccia visiva a stimoli visivi monoculari
attraverso la fMRI e la DTI (diffusion tensor imaging) in soggetti che presentavano neuriti
ottiche unilaterali[26]. Lo scopo è stato quello di scoprire ed analizzare le connessione fra le
varie aree del cervello a seguito della perdita progressiva di visione a causa di un nervo
ottico danneggiato (l’area visiva però era preservata).
I soggetti analizzati sono stati 8, studiati in uno scanner da 1,5 Tesla della GE (General
Electric), le acquisizioni morfologiche: spin-echo T1-pesata, assiale FLAIR e Fast Spinecho T2-pesata, coronale T2-pesata. Il nevo ottico è stato studiato tramite una STIR.
Per l’imaging funzionale è stato preso come riferimento per la coregistrazione dei dati un
acquisizione 3D (IR Prep Fast SPGR 3D) e un set di acquisizioni assiali ad alta risoluzione
T1 FLAIR 2D a cui sono state sovrapposte le immagini funzionali ottenute tramite singleshot T2*-pesate GE EPI.
I paradigmi usati sono stati prodotti tramite un software progettato all’Università
Politecnica delle Marche, che proiettava stimoli visivi in un apposito casco munito di
34
monitor, inserito nella testa del paziente. Il soggetto durante l’invio degli stimoli doveva
fissare un puntatore luminoso situato all’interno di una scacchiera bianca e nera posta a 75
cm circa dal campo visivo del soggetto. I paradigmi erano sviluppati in blocchi da 5 minuti
con 15 secondi di attività e riposo alternati, ed erano proposti singolarmente ad ogni
occhio.
I movimenti degli occhi sono stati monitorati con una telecamera interna.
Il software utilizzato per l’analisi statistica è il Brain Voyager QX, sono state scartate le
prime 2 immagini di ogni serie a causa di un segnale non ancora saturato. I dati acquisiti
sono stati pre-processati per eliminare il rumore e gli artefatti da movimento. Le immagini
funzionali sono state sovrapposte alle immagini anatomiche 2D T1 FLAIR e coregistrate
nel planning 3D tramite un interpolazione trilineare.
L’analisi statistica applicata a ciascun dato segue il modello GLM (general linear model),
che prevede in questo caso la variazione del segnale BOLD in seguito ad una funzione che
valuta il grado di risposta del ritardo emodinamico. Quando il segnale è correlato
temporalmente con il “pattern” di stimolazione ed è significativamente differente dallo
stato di riposo (si applicano delle soglie di intensità) si ritiene che il segnale derivi dalla
stimolazione periferica. I volumi sono considerati attivi quando almeno 8 voxel da 1mm3
presentano questo “pattern” di attivazione.
Figura 18: paziente con neurite ottica unilaterale acuta di sinistra. A sinistra le aree sono
attivate bilateralmente e sono dovute a stimolazione dell’occhio sano. A destra (nervo ottico
affetto da neurite acuta) l’attivazione è minore sia come dimensione dei voxel attivi che come
intensità del segnale BOLD.
35
Attraverso l’fMRI e il nostro studio abbiamo constatato come in tutti i soggetti si verificava
una diminuzione dell’attivazione delle aree V1 soprattutto, ma anche di quelle extrastriate
(V2-V3-V4).
Figura 19: rappresentazione della distribuzione delle aree visive e delle loro connessioni.
Le aree V5 come descritto sotto in figura presentavano comunque invece sempre un livello
di attivazione costante sia nelle stimolazioni dell’occhio con la neurite acuta e non.
Figura 20: numero di voxel attivati in V1 e V5 a seguito di stimolazioni in pazienti con
neurite acuta (grigio) e non (bianco).
36
Figura 21: visualizzazione dell’attivazione dell’area V5 con controllo tramite le coordinate
di Talairach (x,y,z). Soggetto con neurite ottica acuta di sinistra. Le attivazioni sono dovute
nello stesso soggetto a stimoli nell’occhio interessato e non dalla neurite. L’attivazione in V5
è sempre presente.
L’analisi attraverso l’fMRI è stata integrata tramite uno studio trattografico che ha
permesso di meglio delineare la regione del nervo ottico affetta dall’infiammazione in
quanto non presentava un anisotropia tale da permettere la ricostruzione trattografica
tramite DTI (marker indiretto di danno).
37
Attraverso questo studio di fMRI sono state identificate le aree di plasticità neuronale che si
attivano in quei soggetti che presentano un danno al nervo ottico ma non alla corteccia
visiva primaria. V5 è stato visualizzato come un punto focale per lo scambio delle
informazioni visive con le altre aree anche durante le neuriti e permette di continuare a
ricevere, scambiare ed elaborare informazioni anche quando le aree primarie non riescono
ad essere attivate.
38
Aree uditive
Si trovano principalmente nel lobo temporale e si possono classificare in: area 41 e 42
situate rispettivamente nell’estremità della circonvoluzione temporale superiore e nel fondo
della scissura del Silvio. Vanno a formare la cosiddetta area acustica primaria, capace di
rendere coscienti gli stimoli uditivi e discenderne una localizzazione a seconda delle
frequenze.
Area 22, situata anteriormente ed inferiormente alle precedenti è legata alla comprensione
delle parole ascoltate.
La localizzazione delle aree corticali uditive può essere definita attraverso lo studio con
fMRI. Il TSRM deve provvedere ad alcuni accorgimenti e presetting di procedure.
Studi nel settore [5] hanno evidenziato che il rumore del magnete e dei gradienti altera
significativamente l’attivazione corticale uditiva e la formazione del segnale BOLD.
Assumendo un ritardo di 2 secondi circa fra l’inizio dello stimolo e la formazione del
segnale BOLD, ed un tempo di dispersione del segnale BOLD di circa 13-15 secondi, vi è
quindi la necessità di effettuare scansioni con un tempo di scansione al di sotto dei 2
secondi ed un TR superiore a 15 secondi, in questo modo diamo la possibilità al nostro
sistema uditivo di recuperare dai disturbi della scansione e dall’attivazione precedente.
Non tutti i protocolli necessitano di queste sequenze.
Infatti grazie all’innovazione tecnologica sono state fabbricate cuffie acustiche particolari,
esternamente insonorizzate, con involucro in plastica, ed internamente possiedono una
protuberanza conica in plastica semi dura che va infilata nell’orecchio, ed è collegata ad un
registratore esterno alla sala
Questo permette un duplice vantaggio:
diminuisce relativamente il rumore esterno derivante dal magnete rispetto ai
normali mezzi tradizionali
permette di diminuire i dB a cui vengono trasmessi gli impulsi sonori, proteggendo
cosi i timpani dei pazienti e riducendo le attivazioni corticali parassite derivanti da
sogli d’impulso troppo elevate.
Un altro “setting” per evitare i disturbi derivanti dal rumore dell’apparecchiatura è sfruttare
il rumore stesso come impulso sonoro, lo “switch” veloce dei gradienti permette la
39
formazioni di frequenze di toni utili al fine dell’indagine pre-clinica, senza l’ausilio di
nessuna altra strumentazione hardware.
Risposte mono e bi acustiche in giovani sani e pazienti sordi
Attraverso studi di si è dimostrato che l’attivazione corticale per la definizione delle aree
uditive deve essere effettuata attraverso un invio sonoro ad entrambe le orecchie.
Impulsi acustici rivolti ad un solo orecchio innescano un forte attività della corteccia
acustica contro laterale.
Inoltre l’area attivata dalla sommazione mono acustica sx più dx risulta comunque inferiore
del 30% rispetto all’attivazione delle aree corticali derivanti da un attivazione bi acustica.
Questo ad indicare sia meccanismi interneurali inibitori che una miglior performance
derivante dalla simultanea associazione delle 2 aree corticali uditive.
Un eccezione viene fatta per i pazienti sordi da molto tempo, che presentano una risposta
mono acustica similare a quella di pazienti sani stimolati da entrambe le orecchie.
Questo a dimostrare la plasticità del sistema nervoso e delle interconnessioni sviluppate
durante gli anni, e la riorganizzazione strutturale delle stesse.
Questo va tenuto conto quando si va a valutare un area corticale acustica in un soggetto
sordo con una lesione, ossia che la stimolazione acustica da un solo orecchio può dare esiti
inferiori dei reali, in quanto l’area stimolata può risultare più piccola di quello che è
realmente, infatti in questo soggetto non vi è una riorganizzazione strutturale delle funzioni
grazie alla plasticità temporale del sistema.
Organizzazione tonotopica della corteccia uditiva
Tramite paradigmi specifici è possibile sviluppare l’organizzazione tono topica del soggetto
d’indagine. Modulando l’invio delle frequenze e l’intensità in dB di queste si riescono a
determinare i voxel (Fig 5)che si attivano in relazione a questi 2 parametri e quindi a
sviluppare una mappa relativa.
Vanno però analizzati differentemente i semplici rumori indistinti, rispetto ai rumori relativi
ad oggetti conosciuti nel quotidiano o legati alla pronuncia delle parole, dove oltre
40
all’attivazione dell’area uditiva primaria vi è un attivazione dell’area acustica secondaria e
dell’area stereognosica.
Figura 22: B, attivazione dei voxel in relazione alle frequenze in kHz ad intensità basse e alte
di dB. C, visualizzazione del grado di attivazione.
Dagli studi emerge che a livelli crescenti di pressione sonora 70 dB (rosso), 82 dB
(verde,giallo), 90 dB (blu) vi è un attivazione corticale che si sposta latero medialmente e
ventro dorsalmente (Fig 23).
Figura 23, attivazione corteccia uditiva
determinata dal livello dell’impulso sonoro
ricevuto dal paziente, in termini di dB.
41
Sino ad ora abbiamo valutato l’attivazione delle aree corticali uditive in relazione a
frequenza ed intensità dell’impulso sonoro.
Sono state effettuate ricerche tramite l’fMRI per la valutazione tonotopica determinata dalla
scomposizione dell’ impulso sonoro in 2 componenti:
rumore di fondo
componente transitoria
Si è potuto concludere che tra i 2 emisferi non vi sono distribuzioni differenti relative alla
scomposizione sonora, inoltre nella zona centrale a livello del giro di Heschl il contributo
del rumore di fondo è molto importante e diviene più sfumato quando ci si sposta sulle
aree più laterali dove invece aumenta l’attivazione dovuta alla componente transitoria.
Questo suggerisce che a livello clinico durante la mappatura di aree uditive sarebbe
opportuna valutare l’attivazione con un pattern di stimoli differenti per avere un quadro
completo dell’area attivata.
Figura 24: differenti attivazione aree uditive causate da fonti sonore scomponibili in un
rumore di fondo ed una componente transitoria.
42
Attivazioni funzionali delle cortecce uditive primarie e secondarie correlato al tasso
di parole per minuto
Un altro importante parametro per la corretta identificazione delle aree corticali uditive
primarie e secondarie è stato studiato [5] nella risposta del segnale BOLD di suddette aree
durante una task di attivazione dove veniva cambiato il numero di parole inviate al soggetto
durante 1 minuto.
Lo studio è stato fatto per comparare i risultati PET (Lauter et al 1985;. Mazziotta et al
1982;. Petersen et al 1988;. Wise et al. 1991) riguardanti l’attivazione di aree corticali uditive
primarie e secondarie e dell’area del Wernicke con la rispettiva attivazione fMRI e per
convalidarne così riproducibilità ed affidabilità.
Gli impulsi sonori erano sillabe, nomi e verbi inviati al soggetto in blocchi differenti e a
velocità diverse: 0, 10, 50, 90, 130 parole al minuto. Sono state eseguite 16 immagini per
blocco e i blocchi sono stati ripetuti 3 volte ciascuno.
Sono state scartate le acquisizioni che presentavano una variazione dei parametri geometrici
di riferimento dell’ordine massimo del 30% relativo alle coordinate cartesiane di ciascun
voxel.
Sono stati inoltre scartati i voxel che si attivavano sporadicamente nelle aree corticali
limitrofe ma che non presentavano una linearità di risposta del segnale.
Si sono osservate attivazione ripetute in tutti i soggetti della corteccia uditiva primaria a
livello del giro trasversale temporale e della corteccia uditiva secondaria (area 22 e 42) a
livello della parte posteriore del giro temporale superiore.
I risultati hanno evidenziato un aumento dell’attivazione corticale bilaterale all’aumentare
del numero di parole proposto in un minuto, con un picco sulle 90 parole per poi tornare a
scendere verso le 130.
43
Nell’emisfero sinistro vi è un attivazione importante a 90 parole al minuto dell‘area del
Wernicke sede del centro verbo acustico.
Questo studio è risultato importante per stabilire un livello di accettazione del paradigma
per gli studi di aree uditive, ed un livello di 90 parole per minuto è ritenuto come il più
performante per la massiva attivazione delle suddette aree.
44
ASPETTI TECNICI DELL FMRI
Limiti e sfide della risonanza magnetica funzionale
Le indagini di risonanza magnetica funzionale hanno 3 punti principali dove la ricerca e lo
sviluppo stanno indirizzando i loro sforzi:
ridurre i tempi di acquisizione
aumentare la risoluzione spaziale
aumentare la risoluzione temporale
e rappresentano anche i 3 fattori dove si riscontrano i principali limiti della RM stessa.
fMRI e risoluzione spaziale
La risoluzione spaziale è influenzata principalmente dal rapporto segnale rumore e
dall’intensità del segnale che va a formare l’immagine.
In RM l’intensità del segnale dipende sostanzialmente dalla quantità di magnetizzazione che
si ha quando si va a registrare il segnale di eco.
A sua volta la quantità di magnetizzazione dipende da:
la grandezza del campo magnetico
il tempo di rilassamento ( T1, T2, T2*)
densità protonica
parametri di imaging
Mantenendo costanti tutti gli altri parametri l’intensità del segnale varia in maniera
proporzionale alla variazione del volume del voxel. Dal volume del voxel ovviamente
dipende la risoluzione spaziale, la quale normalmente cambia andando a modificare la
grandezza dels gradiente di codifica di fase (cambiando quindi anche il FOV) e/o
aumentando o diminuendo le dimensioni della matrice.
Il volume del voxel è determinato dallo spessore della fetta di acquisizione, e dalle
dimensioni X ed Y del campo di vista in relazione alla grandezza della matrice.
Es: FOV 200 mm x 200 mm, matrice 64 x 64, spessore fetta 5 mm, volume voxel =
(200/64) x (200/64) x 5 = 48.8 mm3.
45
Il rumore non è influenzato direttamente dal cambiamento del volume del voxel ma è
legato ai cambiamenti dell’intensità di segnale, ed essendo questa direttamente
proporzionale al volume, si può dire che il rumore a sua volta è influenzato dal volume del
voxel.Quindi cambiamenti nelle dimensioni del voxel portano a cambiamenti nel rapporto
segnale/rumore (SNR, “signal noise ratio”).
Nella fMRI i vincoli finali della risoluzione spaziale risiedono in:
nelle sequenze di fMRI vengo quasi sempre utilizzate sequenze multi-eco, esse
siano SE pesate in T2 o GE pesate in T2*. Durante la rifocalizzazione ed il
successivo ascolto degli echi il segnale ovviamente decade, normalmente questo
non influisce sulla risoluzione spaziale in quanto comunque la soglia minima di
segnale non perturbato dal rumore di fondo è garantita. Ma se si aumenta
notevolmente la risoluzione spaziale, tramite un aumento di campo, matrice o
ripidità di salita dei gradienti, ecco che questo decadimento del segnale T2 durante
gli echi successivi può divenire rilevante e causare delle sfumature nel segnale,
riducendo la risoluzione spaziale stessa. Questo fenomeno sarà più evidente in
tessuti con T2 lungo rispetto a quelli con un T2 breve, a causa dei molti echi
rilevabili ed al contributo via via maggiore da parte del rumore nella perturbazione
del segnale.
il segnale RM viene catturato dai protoni liberi dell’acqua, se questi protoni
diffondono velocemente e in modo significativo durante l’acquisizione dei dati, il
segnale risulterà sfumato e la localizzazione spaziale di questo risulterà ridotta.
Attualmente questo ultimo punto è stato in parte superato, rimangono inoltre altri fattori
che giocano un ruolo importante sulla capacità di risoluzione spaziale: spessore fetta,
risoluzione temporale, distorsione dell’immagine e l’area di cervello considerata nell’esame.
In generale e finora studi di fMRI su tutto il cervello vengono fatti con risoluzioni modeste,
mentre invece lo studio di singole aree può essere ottenuto ad alte risoluzioni spaziali.
Il rumore nella fMRI
Nella fMRI cosi come in RM il rumore è una qualsiasi variazione indesiderata del segnale
che va a perturbare la formazione dell’immagine.
In risonanza il rumore può essere causato da molteplici fattori fra cui:
46
rumore termico, che genera fluttuazioni casuali degli spin andando a creare
disomogeneità di campo e differenze nella registrazione del segnale
rumore presente all’interno dei circuiti elettronici degli “scanner” RM
rumore derivante dagli altri dispositivi presenti nella sala del magnete che vengono
usati per le indagini fMRI (occhiali elettronici, binocoli elettronici, schermi visivi,
cuffie).
rumore dovuto a disomogenità di campo
rumore generato dalle oscillazioni cardiache e respiratorie
rumore causato da movimenti del soggetto
rumore causato da fattori psicologici, ansia e tensione.
Il rumore visivamente può presentarsi sotto 2 forme:
I.
se il rumore è codificato ad una frequenza particolare e rappresentativa si
visualizzerà come una striatura luminosa ben visibile
II.
se invece ha una banda di rappresentazione ampia, sarà sufficiente diminuire il
rapporto segnale/rumore delle immagini in visualizzazione, rischiando però di
perdere informazioni riguardanti le attivazioni.
In generale per quanto riguarda la fMRI ed il segnale BOLD, un aumento dell’intensità di
campo magnetico determina un aumento notevole del segnale, addirittura maggiore che
rispetto alla RM tradizionale. Questo aumento di segnale si traduce anche in un aumento
del rapporto segnale/rumore, offrendo la possibilità di poter avere un “imaging” con una
risoluzione temporale e spaziale nettamente migliorata.
Disomogeneità di campo statico
Le problematiche derivanti dalle disomogeneità del campo statico sono assolutamente
evidenti anche nella fMRI, anche aumentando l’intensità di campo persistono problemi
relativi a perdita di segnale e distorsione delle immagini.
Queste disomogeneità di campo sono particolarmente evidenti nei lobi frontali e temporali
e nelle zone adiacenti ai seni venosi cerebrali, e sono definite come disomogeneità di
campo macroscopiche andando ad alterare aree relativamente molto grandi.
Il problema di fondo riguardante l’fMRI sta nel fatto che il segnale BOLD si basa proprio
sulle differenze di disomogeneità di campo fra il sangue ossigenato paramagnetico e quello
47
diamagnetico deossigenato. Pertanto delle correzioni che tendono a rimuovere le
disomogeneità di campo portano inevitabilmente anche alla perdita del segnale BOLD
stesso.
La miglior soluzione è stata trovata usando delle sequenze EPI, dove i treni di echi non
rifocalizzano a livello microscopico gli SPIN protonici mantenendo quindi le
disomogeneità tipiche del segnale BOLD, mentre invece a livello macroscopico vi è una
rifocalizzazione andando cosi ad eliminare le grosse disomogeneità di campo [14].
Alterazione fisiologica del segnale BOLD
Esistono alcuni fattori fisiologici che alterano il normale contrasto del segnale BOLD.
Il ritmo cardiaco si ripercuote attraverso un microflusso pulsato a livello del
cervello, che va a creare delle variazioni di flusso all’interno dei piccoli vasi, ed
altera la formazione del segnale.
La respirazione induce un cambiamento radicale e repentino fra deossiemoglobina
ed emoglobina ossigenata a livello del torace ad ogni atto respiratorio e questo
fenomeno anche se distante fisicamente dal cervello va a disturbare
significativamente il segnale che andiamo a registrare.
La soluzione è la necessità di acquisire molte immagini in un piccolo lasso
temporale e calcolare questi risultati “alterati” al di fuori delle medie statistiche.
La diffusione delle molecole d’acqua supera la normale barriera dei capillari e la
registrazione del segnale può avvenire spazialmente in un punto un po’ più distante
rispetto a dove è stato evocata la perturbazione del campo magnetico.
La densità di capillari in una regione determina a parità di cambiamento dello stato
di ossigenazione una risposta di incremento del segnale BOLD molto maggiore
rispetto ad una zona con minore concentrazione di capillari.
Non si è ancora riusciti a costruire un modello di attivazione che leghi il numero di
neuroni attivati con l’estensione spaziale del segnale.
Identificazione del segnale a livello capillare: un cambiamento di ossigenazione a
livello capillare può determinare un errore di registrazione spaziale del segnale in
quanto sovente accade che il sangue che viene drenato dai capillari si riversa a valle
in vene più grandi e il contributo al segnale di questo sangue talvolta è maggiore
rispetto a quello dei capillari limitrofi alla zona di attivazione da dove proveniva.
48
Decadimento del segnale nelle sequenze GE
Le sequenze single “shot GE EPI” hanno una elevata risoluzione temporale e sono molto
sensibili al segnale BOLD. Lo svantaggio di queste sequenze risiede nel fatto che soffrono
molto della formazione di artefatti da suscettività magnetica e di distorsione geometrica.
Questi artefatti si verificano tra 2 tessuti che presentano alte differenze di suscettività
magnetica, andando a creare delle disomogeneità di campo (che tra l’altro è la base del
segnale BOLD). Determinano un erronea mappatura del voxel lungo l’asse della codifica di
frequenza[19].
A determinare artefatti da suscettività magnetica possono essere:
protesi o schegge metalliche nei tessuti
interfaccia fra tessuti ad alte differenza di suscettività magnetica (acqua/osso,
aria/tessuto)
sequenze con soppressione del grasso
A livello clinico negli studi fMRI questi artefatti si possono sviluppare soprattutto a livello
della base cranica, delle cavità aeree orbitali, a livello del temporale, in alcune lesioni come
nelle malformazioni arterovenose, angiomi, tumori necrotici, ovvero in tutte quelle
situazioni ove la differenza di suscettività magnetica fra 2 tessuti sia elevata.
In oltre queste sequenze portano ad un ulteriore impoverimento della localizzazione
spaziale dell’attività neurale. Distorsioni geometriche possono svilupparsi a livello di
imaging, a ridosso delle lesioni e delle interfacce tissutali aria/tessuto portando ad una
dislocazione dell’area attivata sino ad un range di variabilità di 20mm.
Per ridurre gli artefatti da suscettività magnetica si può optare per una riduzione dello
spessore di fetta, in modo da ridurre le differenze di suscettività magnetica fra due tessuti
contigui andandone a campionare una porzione più piccola.
Si stanno valutando attualmente le sequenze EPI multishot, spin eco EPI e flash, in quanto
hanno una minor sensibilità per le differenze di suscettività magnetica.
In fase di post processing il tecnico può anche lavorare sulle sequenze EPI ma deve trovare
un buon compromesso fra caratterizzazione del segnale BOLD, risoluzione temporale,
spaziale e rapporto segnale/rumore.
Bisogna sempre tenere conto di queste distorsioni ed artefatti durante la coregistrazioni
delle aree morfologiche con quelle funzionali al fine di ritrovarsi con attivazioni
spazialmente non veritiere.
49
IL RUOLO DELLA fMRI NELLA PIANIFICAZIONE DEI
TRATTAMENTI CHIRURGICI
Il ruolo della fMRI nella pianificazione dei trattamenti chirurgici [15] prevede
essenzialmente 3 punti fondamentali:
I.
Valutazione del rischio di deficit neurologico e determinazione della operabilità di
una lesione.
II.
III.
Selezione dei pazienti per la mappatura corticale intraoperatoria.
Guida alla procedura chirurgica stessa come metodica integrativa ai sistemi di neuro
navigazione.
Lo scopo principe del trattamento chirurgico di una lesione cerebrale è la resezione
completa del tumore al fine di migliorare la sopravvivenza, le condizioni di vita del
paziente, l’efficacia delle terapie adiuvanti, il tutto cercando di non indurre deficit
neurologici.
La resezione chirurgica non deve quindi andare ad addossarsi su aree corticali eloquenti.
Normalmente la mappatura delle aree cerebrali avviene tramite metodi invasivi come la
stimolazione corticale intraoperatoria o l’impianto di una griglia subdurale con stimolazioni
sensoriali intra ed extraoperatorie. Tutte queste metodiche molto accurate, sono difficili da
eseguire, aumentano il rischio operatorio, provocano grande stress sul paziente, richiedono
una sua collaborazione da sveglio durante l’intervento operatorio stesso e molto spesso
necessitano di una craniotomia più estesa di quella necessaria alla resezione della massa
neoplastica.
Un altro limite di queste tecniche risiede nel fatto che nessuna informazione funzionale
riesce ad essere reperita prima dell’intervento stesso, e le decisioni di merito della gestione
clinica del paziente vengono prese senza conoscere l’esatta corrispondenza fra le aree
funzionali eloquenti ed i margini della lesione.
La fMRI invece è completamente non invasiva, viene eseguita prima dell’eventuale
mappatura corticale intraoperatoria o dell’intervento, ed ha un elevata sensibilità.
Riusciamo quindi a stabile una corrispondenza fra funzioni delle aree corticali e margini di
resezione chirurgica potendo prevedere eventuali deficit neurologici (motori, sensitivi,
uditivi, visivi, linguistici) dovuti al trattamento chirurgico stesso o all’espansione della massa
50
tumorale. Questo permette allo staff medico di sviluppare una strategia di costi-benefici e
decidere se attuare o meno l’intervento chirurgico.
Con l’fMRI tramite studi iniziati da “Yetkin et al.” si è dimostrato che resezioni chirurgiche
distanti 2 cm dai bordi delle aree funzionali non comportano deficit neurologici annessi
all’operazione chirurgica. La probabilità di deficit aumenta all’aumentare della vicinanza tra
resezione e bordo area funzionale. A 1cm il tasso di deficit neurologico è del 50%, e questa
è la golden rule per la selezione del paziente al trattamento invasivo di mappatura corticale
intraoperatoria.
Infine l’integrazione delle mappe funzionali ottenute con la fMRI coi sistemi di
neuronavigazione aiuta il neurochirurgo a pianificare la via d’accesso più sicura per
rimuovere la lesione: neuro navigazione funzionale.
Primo obbiettivo: valutazione del rischio di deficit neurologico e di
operabilità di una lesione
Il punto cardine nella decisione sull’operabilità o meno di una lesione cerebrale è la distanza
fra le aree eloquenti e i margini di resezione sul tumore.
Molti autori tra cui “Yetkin et al.”hanno riportato in numerosi articoli la distanza di 10-15
mm tra aree eloquenti e margine del tumore come “golden rule” per la resezione chirurgica
della lesione. A livello statistico si è visto come a 10mm circa il 50% dei pazienti mostrava
deficit neurologici dopo l’intervento, a 15 mm questa percentuale era ridotta al 33% ed a
una distanza di 20 mm non sono comparsi deficit neurologici post intervento.
Esistono comunque dei limiti e delle critiche che si rifanno a questa “golden rule”:
a livello corticale vi sono aree eloquenti che svolgono funzioni tali che un loro
danneggiamento o deficit comporta una riduzione inaccettabile del livello di qualità
della vita del paziente. Altre invece sono meno nobili o una volta danneggiate grazie
alla plasticità delle reti neurali possono risolversi nel giro di qualche mese dopo
l’intervento[9]. In sede di pianificazione vanno quindi valutate queste differenze in
relazione alla distanza fra l’area eloquente e la lesione da rimuovere.
L’esatta distanza fra la lesione e le aree eloquenti dipende da numerosi fattori tra
cui: la soglia di attivazione statistica utilizzata, la precisione della localizzazione
fMRI (che dipende da numerosi fattori), il fenomeno del “brain shift” conseguente
alla rimozione della lesione [D].
51
La fMRI offre un elevata risoluzione per quanto riguarda la corteccia cerebrale ma
non riesce a dare molte informazioni sulla materia bianca sottostante. Va
annoverato che anche lesioni alle fibre della sostanza bianca possono indurre a
gravissimi deficit neurologici.
fMRI e individuazione aree eloquenti
Di fronte ad un paziente con una anatomia normale, la localizzazione delle aree corticali
eloquenti avviene tramite reperi anatomici (circonvoluzioni e solchi) su scansioni di RM
tradizionale. La fMRI è stata molto d’aiuto in questo senso in quanto ha permesso la
migliore individuazione delle aree eloquenti dandone una visione durante l’attività e quindi
potendo meglio definirne i contorni.
fMRI e individuazione aree eloquenti in pazienti con lesioni anatomicamente
destruenti
In molte lesioni, la normale anatomia del cervello viene modificata, solchi e scissure
diventano non identificabili, e le aree funzionali possono essere traslate. I normali reperi
anatomici non riescono più ad adempiere alla loro funzione. In questi casi attraverso esami
di fMRI si può ricercare nell’emisfero affetto dalla patologia dove effettivamente si
collocano le aree eloquenti, se sono state spostate o se sono state infiltrate dalla lesione.
I paradigmi che si propongono devono essere inerenti all’area da localizzare e si deve tener
conto durante la loro attuazione di attivare l’area in tutta la sua estensione.
Specie per le aree motorie e sensitive è bene far svolgere al paziente laddove possibile un
attivazione somatotopica di tutto l’omuncolo motorio e sensitivo: flesso estensione piedi,
movimento del labbro, movimento delle dita.
fMRI come marker per la plasticità neurale
Durante lo sviluppo delle lesioni cerebrali si assiste a livello delle reti neuronali ad un
trasferimento parziale o massivo delle funzionai dall’area lesa ad un'altra area.
52
La velocità del trasferimento e la localizzazione della nuova area dipende soprattutto dalla
velocità di comparsa della lesione. Questo fenomeno prende il nome di plasticità neuronale,
ossia la capacità di riorganizzazione delle funzioni cerebrali a causa di un danno cerebrale.
Carpentier “et al.” hanno proposto tramite studi di fMRI dei modelli di riorganizzazione
cerebrale che si sviluppano in 6 tappe:
1. Normale grado di attivazione
2. Disturbi sull’attivazione derivanti dalla lesione
3. Maggiori disturbi della lesione sull’attivazione, non ancora evidente plasticità
4. Plasticità a livello locale
5. Plasticità omolaterale ben definita
6. Plasticità contro laterale
Grazie agli studi di fMRI si può osservare la plasticità neuronale durante il trattamento di
una lesione (operazione, radioterapia e chemioterapia), monitorare e programmare i
trattamenti clinici futuri, riuscendo ad avere sempre un controllo ed un feed-back positivo
su quello che sta mutando all’interno del cervello del paziente.
In linea generale la plasticità dipende dalla velocità di esordio della lesione, quelle acute
mostrano una riorganizzazione soprattutto a capo del territorio locale ed omolaterale,
mentre invece patologie meno aggressive permettono anche una riorganizzazione contro
laterale.
Secondo obbiettivo: selezione dei pazienti per stimolazione corticale
intraoperatoria
Alcune attivazioni possono presentarsi anche all’interno di una massa neoplastica o
direttamente adiacenti ai margini di questa. In questi casi l’fMRI individua quei pazienti in
cui è meglio adoperare delle procedure terapeutiche più conservative: radioterapia,
chemioterapia, gamma-knyfe. Esistono dei pazienti dove l’incertezza rimane però elevata in
quanto l’attivazione è al di sotto della soglia minima di distanza fra margine di resezione ed
attivazione area eloquente. In questo caso con la fMRI si ha la possibilità di selezionare
quei pazienti che debbono sottoporsi a una stimolazione corticale intraoperatoria.
Il limite fisico della fMRI che non gli permette di divenire una tecnica di programmazione
prechirurgica elitaria sino ad oggi, sta nel fatto della mancanza di una precisa
corrispondenza fra attivazione dei neuroni e localizzazione spaziale dell’evento.
53
Vi è una sorta di “scatter” fra questi 2 eventi dovuto alla natura stessa del segnale BOLD.
Il contrasto di questo segnale nasce soprattutto a ridosso del compartimento venoso,
perché è questa la zona più influenza dal diamagnetismo indotto dalla deossiemoglobina.
La localizzazione del segnale BOLD dipende in grande parte dall’intensità del campo
magnetico e dal tipo di sequenza che viene utilizzata.
Gao JH “et al.”[16] hanno dimostrato che si possono ottenere anche a 1,5 T immagini di
fMRI ponderata sul versante micro circolatorio con sequenze EPI single shoot multislice.
Le sequenze GE sono ancora più sensibili delle EPI al segnale BOLD, il problema di base
che questa loro sensibilità è soprattutto a carico del comparto venoso e quindi può dare
uno sfalsamento spaziale talvolta clinicamente difficile da accettare.
Recentemente e con campi di almeno 3 Tesla si stanno utilizzando sequenze GE EPI,
molto veloci e con qualche perdita in termini di risoluzione spaziale. Hanno il grosso
vantaggio di sfruttare un parametro “IVIM” (intravoxel incoherent motion), che permette
di selezionare ed attenuare il segnale inaspettato proveniente da flussi maggiori, mentre
persiste immutato il segnale tipico proveniente dai capillari situati in prossimità dei neuroni
attivati.
Questo ha permesso di far guadagnare alla fMRI un margine di riproducibilità spaziale al di
sotto dei 5 mm e garantire il suo utilizzo come tecnica diagnostica e di programmazione
prechirurgica.
Per le lesioni come sopra suddetto vicino ai margini di resezione, è sempre opportuno e
richiesto la stimolazione corticale intraoperatoria.
Terzo obbiettivo: integrazione della fMRI ai sistemi di
neuronavgazione
Negli ultimi anni i sistemi di neuro navigazione hanno vissuto una notevole evoluzione,
potendo coregistrare i dati morfologici derivanti da acquisizioni TC/RM assieme ai dati
funzionali derivanti da mappature intraoperatorie corticali e dalla fMRI, permettendo lo
sviluppo dei sistemi di neuro navigazione funzionale.
Il vantaggio di questa metodica risiede in fase chirurgica di poter programmare un accesso
alla rimozione della lesione tenendo meglio conto delle aree eloquenti e ponendo l’accento
sulla salvaguardia di queste e quindi sulla riduzione di deficit neurologici conseguenti.
54
Inoltre la neuro navigazione viene gestita a livello di software tramite una centratura ed una
calibrazione che fa riferimento ad i “fiducials marker” presi in TC/RM sulla cute del
paziente. In questo modo il neurochirurgo tramite un puntatore una volta calibrato il neuro
navigatore può in qualunque momento rendersi conto in che punto si trova, programmare
un accesso alla lesione, analizzarne gli aspetti tridimensionali e osservare le aree eloquenti
limitrofi per non danneggiarle.
L’integrazione della fMRI nei protocolli di neuro navigazione produce un duplice
vantaggio:
la possibilità di guidare il chirurgo durante l’operazione, consentendogli di effettuare
rimozioni più sicure evitando la resezione di parti delle aree eloquenti e garantendo
una possibilità di rimozione massimale del tumore laddove con le tecniche
“standard” si hanno incertezze sulla funzionalità o meno dell’area (Fig. 8).
Il limite di questa metodica sta nello spostamento durante la craniotomia della
massa cerebrale e con esso i riferimenti TC/RM a causa del "brain
shift”.Attualmente tramite tecniche integrate di ecografia tridimensionale
intraoperatoria si sta cercando di ridurre i margini di incertezza andando a fondere
e a correggere le immagini eco nel neuronavigatore tramite un rilevamento in real
time ed una correzione dei dati.
l’impianto di elettrodi epidurali guidati da fMRI per sindromi dolorose o acufene
(rumori, ronzii, fischi che si originano all’interno dell’apparato uditivo) (Fig.9).
Tramite precisi paradigmi vengono attivate le aree deputate alla formazione del dolore o del
rumore “phantom area”, vengono individuate e successivamente viene impiantato
l’elettrodo. L’fMRI in questo è d’aiuto in quanto la localizzazione di queste aree del
dolore/ronzii non sempre corrisponde alla classica localizzazione delle aree della
percezione nociocettiva ed acustica.
55
Figura 25: visualizzazione delle immagini in un sistema di neuro navigazione. Si ha la
possibilità di osservare la lesione in tutti e 3 i piani ed in una visione tridimensionale. Il
colore verde rappresenta la massa tumorale, ed il colore rosso l’area eloquente attivata. In
questo modo il chirurgo può scegliere l’ingresso opportuno e la strategia vincente per la
rimozione della lesione e nel contempo risparmiare l’area nobile.[18]
56
Figura 26: impianto di elettrodi
in
paziente
con
acufene
unilaterale sinistro.
Nelle immagini in alto si può
osservare come nella corteccia
uditiva primaria di destra vi sia
un livello di attivazione minore,
causato da un aumento basale
spontaneo dell’attività elettrica
dei neuroni di questa corteccia,
che riduce il contrasto BOLD
intrinseco (tinnito non pulsativo).
Questo scompenso causa una
percezione di rumori, ronzii e
fischi a livello del sistema uditivo
contro laterale di sinistra.
Sopra si può osservare una ricostruzione tridimensionale fMRI ed un indagine radiologica
tradizionale che mostra l’impianto dell’elettrodo epidurale (a sinistra), e il posizionamento
del pacemaker (a destra).
57
Successo tecnico della fMRI
Per una corretta programmazione prechirurgica la fMRI ha bisogno che vengano rispettati
alcuni principi:
collaborazione e cooperazione da parte del paziente,
apprendimento ed integrazione dei test simulativi,
corrispondenza fra task proposte al paziente e capacità cognitive e motorie dello
stesso,
di solito è meglio non eseguire esami in pazienti fortemente ansiosi in quanto anche
se sedati, si può influenzare i livelli reali di attivazione e quindi la visualizzazione
esatta delle aree a causa dei movimenti generati dall’ansia,
non devono esserci movimenti del capo, che causano artefatti di movimento, è
bene somministrare “task” che richiedano il movimento di muscoli distali rispetto a
quelli prossimali laddove è possibile, in modo che le influenze sulla postura del
capo siano minime,
utilizzare scansioni “EPI multislice” che permettono una maggiore copertura del
solco centrale, questo consente di non perdere la visualizzazione delle aree attivate
che a causa di una lesione possono aumentare, diminuire o essere dislocate. Con
tecniche “single slice” , si possono perdere le attivazioni in aree limitrofi, dislocate o
le attivazioni di aree supplementari dovute alla integrazione e plasticità del nostro
cervello.
L’influenza dei tessuti tumorali nella formazione del segnale BOLD
La risposta del segnale BOLD molto spesso è modificata nei tessuti neoplastici rispetto ad
un tessuto sano di riferimento. L’effettiva intensità e localizzazione dell’ attività neuronale
nei tessuti neoplastici non viene rappresentata sempre fedelmente dal contrasto BOLD.
Questo fenomeno si manifesta preferenzialmente nelle aree tumorali e a livello dei vasi
limitrofi che vengono influenzati dai cambiamenti metabolici indotti dalla neoplasia [17].
Le cause di questo fenomeno sono da ricondursi a:
perdita della capacità di autoregolazione da parte del sistema vasale tumorale. Se la zona
funzionale è situata nell’area neoplastica ma non ne viene visualizzata una sua
58
attivazione si tende a pensare che in questa area non vi sia attività. In realtà questo
può succedere perché magari in questa area anche se attiva non vi è un aumento del
flusso sanguigno a seguito di un attivazione e non si riesce quindi a discriminare e
visualizzare il segnale BOLD. In ambito tecnico non si può nemmeno abbassare la
soglia di visualizzazione delle aree attivate ad un livello troppo basso in quanto si
perderebbe la veridicità statistica dei paradigmi stessi.
Azione di macrofagi ed astrociti. Nelle zone di congiunzione fra tumore e tessuto sano
vi sono profonde modificazioni metaboliche e di pH, l’azione combinata di
macrofagi ed astrociti determina un rilascio continuo di ossido nitrico che porta ad
un locale aumento del flusso ematico cerebrale, che si traduce in una più ridotta
estrazione di ossigeno a livello basale. Questo induce ad una minore differenza di
intensità del segnale BOLD durante l’attivazione dei neuroni di questo territorio, in
quanto il flusso vasale è già aumentato, e le differenze fra condizioni basali e di
attivazione risultano ridotte cosi come l’intensità del segnale BOLD stesso.
Cambiamenti di pH, glucosio, lattato, adenosina trifosfato si verificano nei tessuti adiacenti
alla neoplasia, e possono indurre cambiamenti nel segnale BOLD
Edema ed aumento delle pressioni intracraniche. A causa dell’espansione tumorale o “mass
effect”, le strutture vasali, venule e grandi vene, vengono compresse e passano da
uno stato pressorio basale basso, ad uno medio alto. Questa alta pressione favorisce
la rapida fuoriuscita di desossiemoglobina andando così a ridurre il contrasto del
segnale BOLD.
Tumori gliali e neoangiogenesi. Alcuni tumori possono determinare neoproliferazione
vasale che può condurre ad aumento del flusso cerebrale, disaccoppiamento
spaziale fra attività neuronale e registrazione del segnale BOLD legata al flusso
venoso (principalmente).
E’ quindi molto importante comprendere che all’interno di un area neoplastica o nelle
sue vicinanze, un eventuale mancanza di attivazione non sempre è significativa di una
mancanza di attività neuronale ma questa manifestazione potrebbe essere dovuta ad
una perturbazione del segnale a causa dei fattori sopra citati.
59
Discriminazioni delle aree eloquenti da quelle sacrificabili: utilizzo
integrato di fMRI e stimolazione magnetica transcranica (TMS)
Uno dei limiti della fMRI è l’incapacità di discriminare all’interno di un area eloquente la
parte di questa area sacrificabile rispetto a quella prioritaria.
Per area sacrificabile si intende un area che mostra un’ attività durante l’esecuzione di una
“task” ma che non è direttamente correlata all’adempimento della funzione richiesta.
TMS è una tecnica non invasiva di stimolazione elettromagnetica del tessuto cerebrale, che
è in grado di produrre transitorie, reversibili e focali interruzioni a livello corticale di alcuni
neuroni coinvolti in “task di attivazione”. Utilizza un elettromagnete per interrompere le
scariche di potenziale fra i neuroni al punto di stimolazione.
Negli ultimi anni le tecniche di imaging integrato e la coregistrazione delle immagini ha
permesso di integrare immagini morfologiche di RM con alto dettaglio spaziale assieme ai
dati funzionali provenienti dalla fMRI, il tutto inserito all’interno di un neuronavigatore che
comanda l’elettromagnete del TMS. In questo modo ci si può spostare guidati dalle
immagini morfologiche RM andando ad
esplorare ed interrompere l’area corticale
nel punto esatto e con riferimenti precisi
ed affidabili. Il principio della TMS risiede
nel fatto che se interrompendo le
“comunicazioni” fra i neuroni adiacenti
viene interrotta e bloccata anche la
capacità di svolgere una determinata
azione prefissata, allora si parla di area
eloquente.
Il
vantaggio
di
questa
integrazione sta nel fatto di potere
escludere ulteriormente potenziali aree
eloquenti da una resezione chirurgica, e di
poter invece eliminare un area sacrificabile
che tramite una sola indagine di fMRI
poteva sembrare invece coinvolta nel diretto espletamento della funzione. Il limite
dell’integrazione risiede nel limite d’indagine e di esplorazione della TMS, in quanto zone
vicine all’osso temporale o al di sotto della fascia del collo sono fisicamente irraggiungibili,
60
inoltre la capacità d’esame della TMS è rivolta solo agli strati più superficiali delle aree
corticali, in quanto l’interpretazione dell’intensità del segnale nelle zone sottostanti diventa
clinicamente inaccettabile.
fMRI, DWI, DTI, FT e HDFT: un approccio multimodale per lo studio
delle lesioni cerebrali
Uno dei limiti della fMRI come già sopra accennato risiede nel fatto che offre dettagliate
informazioni sulle regioni corticali ma non è sensibile
a valutare
i rapporti che
intercorrono fra una lesione e la materia bianca cerebrale con tutte le fibre annesse.
Vi è quindi la necessità al fine di un miglioramento della valutazione diagnostica della
lesione e per una più efficiente programmazione prechirurgica di integrare la fMRI con
altre tecniche d’indagine che offrano più informazioni e dettagli in relazione ai tratti di
materia bianca cerebrale.
DWI (diffusion weighted imaging)
Le immagini pesate in DWI evidenziano le variazione di movimento dei protoni relativi alle
molecole di acqua all’interno di un tessuto.
Il principio che sorregge le pesature in DWI è dato da uno sfasamento e un successivo
rapido rifasamento degli spin protonici attraverso l’uso di potenti “switch” di gradiente. Le
molecole di acqua che si muovono rapidamente subiranno una perdita di segnale in quanto
essendo il loro moto casuale l’entità del rifasmento sarà minore rispetto a quelle situazioni
di flusso lento (edema, ipercellularità), dove il rifasamento sarà quasi a carico di tutti
protoni. Le sequenze DWI sono alla base delle sequenze DTI.
DTI (Diffusion Tensor Imaging)
E’ una tecnica che usa il calcolo infinitesimale e lo studio dei rapporti geometrici al fine di
descrivere angoli, volumi, lunghezze e curve di strutture dove una delle dimensioni è molto
maggiore rispetta a quella delle altre 2. Questa tecnica permette di visualizzare l’andamento
e l’orientamento delle fibre della sostanza bianca. Utilizza la diffusione dell’acqua come
61
contrasto di imaging per la formazione del segnale. L’acqua a livello delle fibre nervose
della materia bianca non diffonde in maniera isotropa (uniforme e casuale), ma bensì
anisotropa, ossia preferenzialmente lungo una direzione a causa di alcuni fattori biologici:
guaina mielinica, membrana assonale, e particolare disposizione dei microtubuli.
Figura 27: schema esemplificativo delle differenti modalità di movimento dell’acqua
all’interno dei 2 tipi di tessuto nervoso.
Per lo studio DTI serve un acquisizione di almeno un immagine morfologica di riferimento
pesata in T1. Successivamente devono venire acquisite almeno 6 immagini pesate in
diffusione e non collineari (non giacenti sullo stesso piano). Aumentando il numero di
pesature aumenta anche la risoluzione spaziale del tensore e la precisione nella formazione
delle strutture tridimensionali. Grazie a queste pesature non collineari si riesce ad ottenere il
tensore, che analiticamente è una matrice simmetrica 3 x 3 o più, che descrive la forma
tridimensionale della diffusione delle molecole d’acqua[20,21].
L’andamento delle fibre è individuato dall’autovettore che è stato generato, il quale sviluppa
oltre la direzione anche altri due elementi di analisi grafica:
un colore associato, in modo che si possa distinguere anche visivamente
l’andamento geometrico delle fibre, ad ogni colore è collegata una direzione,
brillantezza ed intensità della fibra, è data dall’anisotropia frazionale che è un valore
scalare che individua la diffusività in quel determinato voxel.
Lo sviluppo del DTI sta alla base dell’applicazione clinica e diagnostica della trattografia.
62
FT (fiber tractography)
Attraverso la DTI si sviluppa la trattografia, ossia una ricostruzione tridimensionale
dell’andamento delle fibre nervose, generata su un modello di distribuzione anisotropa delle
molecole d’acqua.
Questo permette di seguire l’orientamento dei fasci nervosi in relazione: alle masse
tumorali, alle strutture corticali ed alle molteplici variabili anatomiche.
La trattografia è ovviamente non invasiva ed è una tecnica prechirurgica che può indirizzare
il chirurgo alla programmazione dell’intervento.
Uno dei limiti della trattografia risiede nel fatto di non comprendere quali siano le fibre
effettivamente coinvolte nell’espletamento di una funzione in relazione alle fibre riprodotte.
Unendo la fMRI e la trattografia e grazie a software dedicati ed integrati anche nei sistemi
di neuro navigazione si è riusciti a superare questo scoglio.
Tramite l’fMRI si identificano le aree eloquenti e le stesse immagini vengono utilizzate
come punto d’innesco per gli algoritmi della trattografia. Vengono generati i fasci che
dipartono dalle aree eloquenti, e si possono scandagliare le loro estensioni in relazione ad
altre aree eloquenti o alle masse tumorali.
I tumori in relazione alla sostanza bianca possono provocare: dislocamenti, infiltrazioni,
distruzione e compressione che vanno ad alterare la normale morfologia tissutale rendendo
difficile selezionare delle ROI manuali (region of interesting) al fine di indentificare i fasci
di fibre vicini od inseriti all’interno del tumore e che possono essere rappresentativi di
collegamenti ad aree eloquenti.
Sono stati creati dei software che permettono di visualizzare selettivamente tratti di materia
bianca ad una determinata distanza dal tumore, con la possibilità di cambiare la distanza
stessa al fine di visualizzare progressivamente le vie limitrofi al tumore.
Hanno inoltre la possibilità di studiare una zona dalle dimensioni variabili ed identificare in
questa zona direttamente le fibre nervose che vi passano.
Permettono anche un integrazione con le aree eloquenti attivate con l’fMRI e quindi la
possibilità di osservare il decorso delle fibre che originano o arrivano alle aree che debbono
essere chirurgicamente preservate[22].
63
Figura 28: Immagini trattografiche. Utilizzo di un software dedicato per il posizionamento
di ROI manuali che investigano sulla visualizzazione e decorso dei tratti di fibre. Figura A e
B, visualizzazione della massa tumorale (verde) ed identificazione del tratto cortico-spinale
situato in prossimità del tumore (cerchio rosso). Il tratto è stato trovato e visualizzato
tramite un esplorazione manuale nelle vicinanze del tumore. Nella figura C viene mostrato
un tratto di fibre parietali situate nelle vicinanze del tumore. Figura D, integrazione della
trattografia con l’fMRI e visualizzazione di un area di attivazione (magenta) durante una
“task” motoria di “finger tapping” per la mano destra. Si può osservare come l’area sia
accostata al tumore ed alcune fibre siano associate ad esso.
64
HDFT (High-Definition Fiber Tractography)
E’ una nuova metodica che utilizza una combinazione di: software, processi di elaborazione
e ricostruzioni nell’ambito degli sviluppi di tecniche trattografiche. Permette di studiare con
un dettaglio spaziale mai visto prima le fibre della materia bianca, le loro interconnessioni e
le afferenze ed efferenze alle e dalle aree corticali e subcorticali.
Si sta validando con ampi margini l’effettiva sua applicazione in ambito clinico e
prechirurgico.
E’ una tecnica che permette una forte collaborazione con l’fMRI e riesce a studiare tutte
quelle zone che attraverso l’attivazione funzionale non riescono ad essere esplorate in
maniera valida: transito delle fibre nei peducoli cerebrali, il decorso della vie ottiche nelle
sue diramazioni, l’arborizzazione terminale del tratto arcuato e il decorso delle fibre dorsali
dell’area del Broca.
Inoltre tramite HDFT si possono osservare come le fibre vengono distrutte ed infiltrate dai
gliomi “high grade”, dislocate ed interrotte nei gliomi “low grade” e cavernomi, e si spera
quindi che assieme ad fMRI possa divenire d’uso quotidiano nella pianificazione
prechirurgica per interventi al cervello[25].
Nello studio dei gliomi “low grade”, il problema principale è determinare se vi sono fibre
intrappolate nel tumore o attorno al tumore stesso, HDFT può darci notevoli informazioni
a riguardo. Esistono 2 fattispecie di gliomi “low grade”: focali quando sono confinati
all’interno di una circonvoluzione, o diffusi quando occupano più di una circonvoluzione o
solco. Secondo la casistica fino ad ora sviluppata con HDFT si è potuto constatare che i
gliomi “low grade” durante la loro espansione tendono ad aumentare seguendo il decorso
delle fibre invece di infiltrare a livello macroscopico.
Il limite della HDFT nei gliomi a basso grado risiede nel non poter visualizzare ancora le
microinfiltrazioni della sostanza bianca stessa, che tramite studi hanno dimostrato
verificarsi sino a 2 cm dopo l’imaging ottenuto tramite delle acquisizioni FLAIR.
65
Figura 29: Glioma “low grade” a carico dell’area motoria supplementare. Nella figura (A)
vengono visualizzati in una acquisizione pre-operatoria tramite HDFT i punti di arrivo del
tratto cortico-spinale dislocati dalla massa tumorale. A fianco (B), viene mostrata un
immagine 3 mesi dopo l’operazione dove i punti di arrivo del tratto cortico-spinale sono stati
spostati nella loro normale sede anatomica sul giro precentrale. Nella figura (C) viene
mostrato come i fasci del cingolo sono spostati verso il basso dalla massa tumorale
(acquisizione pre-operatoria), a destra acquisizioni coronali T2. Nella figura (D), in una
acquisizione post-operatoria si può notare come l’effetto della massa sul dislocamento del
fascio sia svanito, a destra la FLAIR coronale mostra come una recidiva si sia formata a
livello del giro prefrontale superiore.
66
LOW GRADE GLIOMA
I gliomi Low Grade (a basso grado) sono tumori a lenta crescita che si sviluppano
all’interno dell’encefalo. Derivano da cellule gliali, cioè dalle cellule che fungono da rete di
sostegno e regolazione dei neuroni. A secondo delle cellule da cui derivano, i gliomi di
basso grado si distinguono in astrocitomi, oligodendrogliomi o tumori misti
oligoastrocitari.
I gliomi vengono classificati a secondo del loro grado di malignità, ossia in relazione a
caratteristiche istologiche in: gliomi di primo, secondo, terzo e quarto grado.
I gliomi di basso grado aumentano lentamente di dimensione e tendono ad invadere ed
infiltrare l’encefalo, potendo determinare nel tempo deficit neurologici permanenti. Inoltre,
hanno la tendenza a diventare più aggressivi nel corso degli anni (aumentando di grado di
malignitá dal II al III o IV; quest´ultimo viene definito "glioblastoma secondario"-).
Il trattamento primario dei LGG (low grade glioma) è la rimozione chirurgica, si è visto che
maggiore e più precoce è la rimozione e minore sarà la sua azione maligna evolutiva. Inoltre
una tempestiva ed efficace azione chirurgica (anche più interventi) determina un
miglioramento sia della qualità di vita che della prospettiva della durata di vita del paziente.
Il neurochirurgo può scegliere come strategia d’approccio diagnostico un esame integrato
di fMRI e trattografia per valutare la strategia migliore d’attacco alla lesione, identificare i
rapporti delle aree eloquenti con la massa, i rapporti delle aree eloquenti fra loro e
visualizzarne le connessioni, il tutto al fine di rimuovere la maggior parte della lesione con il
minimo deficit neurologico applicabile.
Pianificazione prechirurgica attraverso l’fMRI
La nostra azienda ospedaliera tramite una collaborazione con MR Lab (Mattarello Trento)
ha cercato attraverso il neuroimaging funzionale di sviluppare una pianificazione
prechirurgica ai LGG. L’obbiettivo è quello di fare rientrare e di convalidare l’efficacia
dell’fMRI assieme ad altre tecniche di imaging avanzato nel iter clinico/diagnostico
d’approccio ai LGG. Si è cercato di convalidare il ruolo della fMRI come tecnica
67
diagnostica non invasiva capace di aiutare il neurochirurgo nella determinazione della via
chirurgica d’accesso ai LGG.
Soggetti e apparecchiature
Sono stati studiati
7 pazienti con LGG. 3 Casi sono illustrati successivamente
rispettivamente:
Caso 1,soggetto con lesione gliale temporo-parietale di secondo grado;
Caso 2 ,soggetto con lesione gliale temporo-parietale di secondo grado;
Caso 3, soggetto con lesione gliale frontale destra e sinistra di secondo grado;
Caso 4, soggetto con cavernoma nei pressi dell’are del Wernicke.
Le indagini sono state eseguite tramite un 4T Bruker MedSpec MRI: attivamente
schermato, con magnete da 4.0 Tesla per la scansione di tutto il corpo, gradienti da
40mT/m (gradienti Siemens Sonata) con uno slew rate (tempo di risposta) di 200 T/m/s. Il
sistema è dotato di un ricevitore a otto canali e un risuonatore birdcage.
Apparecchiatura periferica:
Videoproiettore per gli stimoli visivi (EPSON EMP-7900) utilizzato con schermo
acrilico removibile
Diversi pacchetti software per la manipolazione degli stimoli audiovisivi (Eprime,
toolbox di psicofisica di Matlab, Visage)- Cuffie stereo e microfono (SereneSound,
Resonance Technology, Inc.)
Tastiera di controllo con quattro pulsanti (Lumina)
Due microfoni a fibra ottica per effettuare registrazioni vocali durante l’acquisizione
di immagini (Fibersound, FOM-DR1z)
montature in vetro compatibili con l’MR (COMO FRAME) e lenti (Ottica Soppa,
Rovereto) per la correzione della miopia. Per ciascun occhio le correzioni vanno da
-6 a +6 diottrie in diverse fasi (0.50-2.0 in fasi da 0.25, 2.5-5.0 in fasi da 0.5, 5-6 in
fasi da 1 diottria)
Stimolatore tattile piezoelettrico (QuaeroSys)
Stimolazione Magnetica Transcranica (MagVenture, Coil MRI-B88)
68
Paradigmi
I paradigmi che sono stati utilizzati durante questi esami di fMRI prevedono:
Conta vs Riposo: il soggetto doveva contare da 0 a 10, attivando quindi i muscoli
motori della bocca e della lingua. L’impulso visivo viene somministrato attraverso
un proiettore Prevede 5 blocchi alternati di attivazione e riposo di 30 secondi
ciascuno. Il software successivamente utilizzato per l’analisi statistica possiede
algoritmi specifici creati direttamente al MR Lab, che sottraggono le attivazioni
indesiderate, per esempio quelle visive e quelle durante il riposo.
Denominazione vs Conta: si tratta di una task di blocchi 5 x 2 di 30 secondi
ciascuno . La denominazione prevede un integrazione di richieste semantiche,
sintattiche e fonemiche proiettate visivamente al soggetto nello scanner attraverso
un proiettore o degli occhiali specifici . Si utilizza il “Test di denominazione di
Boston” come fonte da cui reperire i modelli proposti per la task. Le aree che si
attivano possono raggrupparsi come quelle deputate all’elaborazioni semantiche,
fonemiche e sintattiche. A queste viene sottratto tutta l’attivazione riguardante
l’area motoria della “conta” (bocca e lingua), ed abbiamo un quadro di attivazione
puro del solo processo di denominazione in relazioni a più stimoli.
Al neurochirurgo non serve la distinzione fra i tre paradigmi lessicali, ma la visione
dell’area attivata in toto per poter accedere alla lesione senza causare deficit
neurologici.
Controllo Verbale: si tratta di una task che prevede una batteria 5 x 5 di funzioni
verbali non vocalizzate (30 secondi) intervallate a periodi di riposo (30 secondi).
Si integrano assieme batterie di lettura parola, fluenza semantica, denominazione
oggetti, produzione verbale. Le task non sono vocalizzate per non coinvolgere
anche l’attivazione delle aree motorie del linguaggio. Gli input dove necessari sono
di carattere visivo tramite proiettore o occhiali specifici.
69
Discussione
Caso 1
Il soggetto presentava una lesione gliale frontale destra di basso grado. Il soggetto tramite
l’Edimburg Test è stato valutato mancino. Precedentemente a quanto riportato in figura 30
il soggetto era stato operato con un asportazione parziale del glioma.
Figura 30: Immagini RM morfologiche T1 pesate in assiale, coronale e sagittale.
Nei due anni successivi la lesione è cresciuta notevolmente e si è deciso di sottoporre il
soggetto ad un indagine di fMRI al fine di un ulteriore programmazione prechirurgica.
Sotto nella figura 31, vi sono le immagini funzionali relative al paradigma Conta vs Riposo.
Si è potuto osservare come nel giro di poco meno di due anni la lesione aumentando di
volume ha dato la possibilità al nostro sistema cerebrale di riorganizzarsi, dando adito alla
70
cosiddetta plasticità neuronale. La plasticità riorganizzativa del nostro cervello si sviluppa
più facilmente quando la lesione è a lenta crescita. Si può osservare che l’area motoria della
bocca è distante dal margine della lesione e ciò dà la possibilità di un reintervento
chirurgico.
Figura 31: task di attivazione Conta vs Riposo, si possono osservare l’attivazione dell’area
relativa alla bocca e alla lingua e nell’immagine coronale anche l’attivazione dell’area
motoria supplementare.
71
Figura 32: Denominazione vs Conta, si nota molto
bene in sagittale l’attivazione massiva dell’area del
Wernicke. In questo modo il chirurgo ha la possibilità
di osservare esattamente dove sia situata questa
attivazione per decidere il corretto approccio
d’intervento anche in visione di una futura
stimolazione corticale intraoperatoria.
Successivamente le immagini funzionali sono state inserite nel neuro navigatore ed hanno
coadiuvato lo staff di neurochirurgia durante le operazioni di mappaggio corticale
intraoperatorio e successiva asportazione del glioma.
Figura
33:
in
alto
ricostruzione
tramite
segmentazione
FSL
della
corteccia cerebrale.
FSL è un libreria software free
per la risonanza magnetica
funzionale, ed è fornito di
numerosissime funzioni.
In basso immagini in “awake”
di
mappaggio
corticale
intraoperatorio, le letterine
applicate indicano i limiti
della
regione
ove
il
neurochirurgo deve asportare
la massa.
72
Successivamente è stato fatto un controllo post operatorio che mostra come la massa sia
stata completamente eradicata. Quello che prende contrasto è esclusivamente sangue.
Figura 34: immagine post operatorie pesate in T1 dove viene mostrata la completa
rimozione del LGG.
73
Caso 2
Si tratta di un paziente con LGG temporo-parietale che occupa una zona molto grande.
A confronto sono messe immagini RM preoperatorie e post-operatorie dopo resezione
parziale. Non è stato possibile effettuare una resezione maggiore in quanto durante la
stimolazione corticale intraoperatoria a livello dell’insula il paziente ha presentato un
altissimo stato d’ansia e vomito
so 2
Il tumore successivamente è ricresciuto nuovamente ed è stata effettuata un indagine di
fMRI per osservare i rapporti dell’area motoria con il LGG.
74
Per questo paziente sono state eseguite 3 differenti task per valutare esattamente i rapporti
fra la lesione, le aree motorie del linguaggio e quelle relative alle elaborazioni sintattiche,
semantiche e fonemiche. (Conta vs riposo – Denominazione vs conta – Controllo verbale)
Attraverso l’indagine fMRI si è potuto osservare come l’area motoria relativa alla bocca si
trovi molto vicina alla lesione.
Figura 35: mappe di attivazioni ottenute tramite la task Conta vs Riposo.
In evidenza l’attivazione dell’area motoria della bocca ai margini col LGG. Le altre 2
attivazioni nella immagine in sagittale sono probabilmente degli artefatti in quanto si
trovano nella valle silviana.
75
Successivamente è stata proposta una task di Denominazione vs Conta per vedere se vi
erano aree di attivazione significativa a ridosso alla lesione al fine di valutare un accesso
sicuro ed efficace per l’intervento.
E’ stato possibilie constatare un attivazione significativa di denominazione a livello della
pars triangularis e pars opercularis dorsale (due sottoaree del Broca), che ha permesso di
meglio definire il punto di accesso per il prossimo intervento.
Figura 36: mappe statistiche riferibili all‘attivazione delle aree deputate alla
denominazione. Il software ha sottratto automaticamente le aree attivate riferibili al
movimento della bocca/lingua.
76
Figura 37: task di Controllo Verbale, serve per valutare la localizzazione del controllo
verbale. Si nota l’esclusiva attivazione dell’area del Wernicke, nessuna significativa
attivazione nelle zone limitrofi alla lesione.
Figura 38 : sequenze
morfologiche T1 pesate
che
mostrano
la
rimozione della massa
neoplastica.
Grazie a l’fMRI si è riusciti a decidere l’esatta strategia per accedere alla massa neoplastica
senza causare deficit motori, e si è potuto rimuovere il 75% del LGG, che viene
considerato un risultato buono visto le dimensioni che aveva raggiunto il tumore.
77
Caso 3
Questo soggetto presentava una precedente asportazione del lobo frontale di destra per la
rimozione di un grosso LGG. Successivamente una massa è comparsa a livello del lobo
frontale si sinistra. Il dubbio clinico risiede nella possibilità di rimozione della massa senza
indurre deficit neurologici. Il soggetto non aveva più il lobo frontale di destra, se vengono
asportate le connessioni di questo lobo con l’emisfero contro laterale (a livello di aree
eloquenti) non si da modo alla plasticità neuronale di permettere una riorganizzazione
cellulare delle aree non eloquenti.
A tal scopo si è ricorsi ad un accurata indagine di fMRI, che prevedeva 2 task principali:
Denominazione vs Conta
Conta vs Riposo
78
Le aree eloquenti di attivazione sono molto più laterali rispetto alla lesione. E’ stata valutata
anche una mappa statistica di attivazione con sommazione di più blocchi.
Denominazione vs Conta e Conta vs Riposo, si è andato così a valutare sia le componenti
di elaborazione e di processazione linguistica, che la componente motoria legata al
linguaggio.
Figura 39: mappa di attivazione statistica relativa alle duplici task sovra descritte.
Il paziente è stato operato e la lesione asportata con successo grazie anche all’utilità
diagnostica della fMRI.
79
Caso 4
Questo soggetto presenta una lesione sottocorticale (cavernoma) nei pressi dell’area del
Wernicke. Il paziente soffre di crisi parziali complesse, vertigini e turbe linguaggio. Il dubbio
clinico è riguardante l’effettiva localizzazione delle aree deputate a compiti semantici, sintattici
e fonemici e quindi sulla via d’accesso idonea per la rimozione della lesione.
Sono state sviluppate due task: Conta vs Riposo e Denominazione vs Conta.
Figura 40: attivazione delle aree motorie relative alla bocca e alla lingua nella task Conta Vs
Riposo
Figura 41: attivazione delle aree eloquenti del linguaggio con sottrazione nella task
Denominazione vs Conta.
L’fMRI ha messo in evidenza la dislocazione da parte del cavernoma dell’area del Wernicke
da parte più posteriormente e più inferiormente rispetto alla norma, sino alla regione
occipitale. Significative attivazioni sono presenti anche nelle zone superiori alla lesione.
80
Normalmente la prassi chirurgica prevede un approccio alla lesione attraverso il solco
temporale inferiore, ma questo avrebbe causato sicuramente una condizione di afasia ed
altri deficit neurologici annessi. Grazie all’fMRI si è deciso di operare il soggetto da sveglio
(awake surgery), la stimolazione corticale intraoperatoria conferma le attivazioni superiori
alla lesione. Si è quindi optato di approcciare la lesione dall’unico punto in cui normalmente
non sarebbe stato possibile farlo, ossia direttamente dall’area del Wernicke attraverso il
terzo posteriore del solco temporale superiore.
Department of Neurosciences and Rehabilitation
Division of Neurosurgery
University-Hospital S. Anna Ferrara - Italy
81
IL RUOLO DEL TSRM NELLE PROCEDURE DI fMRI
Il Tecnico Sanitario di Radiologia Medica rientra in questo processo clinico diagnostico
lavorando in equipe con altri professionisti e fornendo al medico, delle immagini
diagnostiche della miglior qualità possibile in relazione al tipo d’esame che viene condotto.
Preparazione del paziente: la simulazione
La prima cosa che un TSRM deve eseguire è la simulazione e l’addestramento del paziente
alla tipologia d’esame a cui dovrà essere sottoposto. La preparazione del paziente ad uno
studio di attivazione ha un ruolo chiave per la riuscita dell’indagine stessa. E’ opportuno
che il paziente sia a conoscenza del perché si fa un’indagine di fMRI, comprenda ed
affronti i paradigmi che gli verranno proposti. Una ottima esecuzione di quanto richiesto
induce un’attivazione delle mappe cerebrali molto più fedele ed ampia rispetto ad
un’esecuzione meno attenta.
Per questo il paziente è invitato a recarsi presso il sito di RM almeno 30-45’ prima rispetto
all’orario di inizio del suo esame, in modo che possa essere istruito ed allenato su quello che
dovrà successivamente svolgere sotto lo scanner.
L’allenamento del paziente è di circa 10-15 minuti per paradigma per un massimo di 3-4
paradigmi per paziente.
I paradigmi relativi soprattutto al centro verbo-acustico e verbo-visivo devono essere
differenti da quelli che si effettueranno
successivamente durante l’esame per evitare
adattamenti o interferenze sulla fedeltà e veridicità clinico-diagnostica dell’indagine.
Le domande ed i quesiti devono essere semplici e facilmente interpretabili dal paziente in
modo da non generare confusione, va ricordato che i paradigmi che non vengono compresi
tendono ad aumentare il livello di movimento del paziente durante l’esame andando a
creare degli artefatti da movimento.
I paradigmi vanno eseguiti nella madrelingua del paziente in modo da non generare
confusione. [A]
La simulazione offre notevoli vantaggi, permette talvolta di evitare la sedazione del
paziente, andando a ridurre lo stato di ansia. Inoltre un paziente sedato ha sicuramente un
attivazione cognitiva differente rispetto a che se non lo fosse, andando cosi a falsare l’entità
del segnale durante l’esame.
82
Permette inoltre di tranquillizzare i pazienti pediatrici cercando di renderli consci che quello
che si andrà a fare non è dannoso e spaventevole per loro.
Paziente, TSRM e fMRI
Il tecnico di radiologia durante questi esami si troverà innanzi a pazienti che riversano in
uno stato emotivo drammatico. Sono persone che hanno un tumore nel cervello, che
provengono da un infinito “iter” di esami clinico/diagnostici, e si ritrovano ad affrontare
un ultimo “giudizio”, da cui dipenderà l’esito della loro aspettativa di vita, qualità di vita e
capacità di integrare altre tipologie terapeutiche.
Attraverso l’fMRI si deciderà se il soggetto possa essere operato o non. E’ facilmente
intuibile quale sia lo stato d’animo di queste persone: rabbia, odio, paura ed avvilimento, il
tutto contornato da un continuo stato d’ansia e tensione. Sono soggetti altamente irritabili e
scontrosi. Il tecnico deve sapersi porre con la massima professionalità e gentilezza nel
trattare queste persone ed i loro familiari. Non deve dare mai segno di incertezze nell’agire
e nell’operare, cercando di confortare intelligentemente il paziente, portandogli positività ed
energia durante tutta la durata dell’esame.
Posizionamento e sequenze
Il TSRM come in un normale esame di RM farà spogliare il paziente, gli fornirà gli abiti
conformi allo scanner, e lo inviterà ad entrare nella sala magnete, lo posizionerà sul lettino
comodamente andando a verificare la conformità ed il funzionamento di tutti i dispositivi
aggiuntivi associati ad un indagine di fMRI[27,28]:
proiettore,
monitor,
specchietti montasti sopra il casco o bobina del paziente che permettono di vedere
o il monitor o gli operatori in sala,
binocoli visivi,
cuffie,
telecamere per il “track motion”, e per le correzioni via software,
PC associato per lo sviluppo delle “task”,
83
Syncbox, un dispositivo collegato sia al personal computer che allo scanner di
risonanza e permette al PC di inviare stimoli visivi tramite il proiettore, sincroni
all’acquisizione.
Accessori per l’acquisizione con il gating cardiaco e respiratorio (elettrodi per ECG,
fasce con rilevatori di movimento per il gating respiratorio).[E
Il paziente verrà centrato e si inizierà l’esame.
Si eseguirà uno scout triplanare. Successivamente andranno acquisite immagini morfologiche:
SE (Spin Echo) T1, FSE T2 (Fast Spin Echo), ed un immagine GE T1 3D che servirà per
lo studio trattografico e funzionale.
Se l’fMRI viene integrata con la trattografia si devono anche acquisire immagini pesate in
DWI e DTI.
Le sequenze funzionali vengono acquisite tramite single-shot T2*-pesate GE EPI.
Il TSRM tramite un PC dedicato alla gestione delle “task” d’attivazione guiderà in maniera
sincrona e coordinata l’acquisizione dell’imaging ed i movimenti del soggetto, controllando
su un real time l’andamento dell’esame.
Il real time [29] è un applicativo software che visualizza su un monitor posto in sala
comandi istante per istante con un ritardo sull’ordine dei secondi l’attivazione delle aree
funzionali senza le correzioni per il movimento ed i filtraggi. Serve per avere un idea della
reale attivazione di un area, e per controllare laddove il sistema di telecamere sia cieco la
corretta esecuzione o meno del gesto tecnico da parte del paziente.
Nella fMRI sperimentale il real time viene usato anche a scopo di “macchina della verità”,
per monitorare l’attivazione delle aree cerebrali a seconda dei quesiti proposti.
Al termine della fase di acquisizione il tecnico farà scendere il paziente dal lettino e
provvederà ad inviare i dati ottenuti ad una workstation dedicata per l’elaborazione.
Il TSRM deve essere attento e vigile sull’idonea ed efficace esecuzione dell’esame in quanto
l’indagine di fMRI non può essere refertata immediatamente dato che i tempi di
elaborazione delle mappe statistiche e di correzione dell’immagine sono ancora molto
lunghi (ore). Per questo il paziente viene mandato a casa prima che si sappia se l’esame sia
effettivamente risultato efficace ai fini preposti per il quale è stato eseguito.
Successivamente il TSRM invierà alla workstation i dati acquisiti per una successiva
elaborazione.
84
Elaborazione dei dati
Il TSRM è addetto anche all’elaborazione dei dati che si sviluppa attraverso 3 principali fasi:
Preprocessing [31,32,33], è rivolto ad aumentare il rapporto segnale/rumore, ad
eliminare gli artefatti e ad assicurare la validità delle mappe statistiche che si vanno a
generare.
Analisi statistica, permette la creazione delle mappe statistiche legate
all’attivazione.
Coregistrazione, avviene la fusione delle immagini funzionali con quelle
anatomiche
L’elaborazione dei dati si sviluppa attraverso l’utilizzo di software (es. Brain Voyager QX,
SPM8) che hanno varie funzioni applicabili
su tutto il data set. In questo caso è
presentato SPM 8. La schermata iniziale è
suddivisibile in 3 parti principali: il primo
gruppo (in alto) è deputato allo sviluppo del
“preprocessing”, il secondo gruppo (in
mezzo) è coinvolto alla gestione e sviluppo
dell’analisi statistica, ed infine (in basso) il
gruppo relativo alla gestione dell’immagine
ed atre funzioni. Non tutti i software
gestiscono
il
preprocessing
e
la
coregistrazione come eventi dissociati come
didatticamente
vengono
descritti,
e
nemmeno tutti i software prevedono le stesse funzioni, ma dipende dalla collaborazione ed
integrazione fra azienda produttrice degli scanner e quelle produttrici degli applicativi
software.
85
Preprocessing
Il TSRM deve gestire queste funzione al fine di migliorare il rapporto segnale/rumore e
rimuovere disomogeneità ed artefatti dall’immagine[39].
Slice scan time correction
Correzione del movimento
Filtraggio spaziale
Filtraggio temporale
Normalizzazione intensità del segnale
Segmentazione
Normalizzazione
Figura 42: finestra di dialogo del software Brain Voyager QX relativa al preprocessing. La
segmentazione a differenza dell’SPM8 viene sviluppata in un ambiente separato dal
preprocessing.
86
Slice scan time correction
Durante le acquisizioni normalmente, le slice sono acquisite in maniera crescente o
decrescente, o in maniera alternata in modo da eliminare qualsiasi correlazione e disturbo
fra fette adiacenti. Le slice quindi sono acquisite in tempi differenti, quello che noi
cerchiamo di ottenere attraverso questa correzione è l’interpolazione temporale di tutte le
slice ad un medesimo istante di tempo. Questo ci permette di visualizzare il fenomeno
funzionale in un'unica immagine temporale di riferimento.
Vi sono anche critiche a questa correzione:
necessità di interpolazioni,
può generare artefatti,
l’interazione con le correzioni di movimento sono imprevedibili,
avviene uno “smoothing”(smussamento dei bordi per interpolazione) nelle slice
vicine,
utilizza derivate temporali di HRF (hemodynamic response function), che possono
generare mappe di attivazioni alterate.
Figura 43: a sinistra finestra di
comando Brain Voyager QX per lo Slice
scan time correction. L’interpolazione
cubic spline è la più onerosa come pro
cessazione ma la migliore come
risultato ed attendibilità
Figura 44: a sinistra 2 modelli
di slice scan time correction, in
alto quello con acquisizioni
sequenziali, in basso alternate.
87
Correzione del movimento
Vengono corretti i volumi acquisiti andando ad eliminare i movimenti indesiderati durante
l’acquisizione, spostamenti della testa, movimenti da pulsazione cardiaca o respiratoria. I
vari volumi cerebrali registrati in diversi intervalli temporali vengono sovrapposti e corretti
rispetto ad un volume target di riferimento dello stesso soggetto. Queste correzioni
avvengono tramite rotazione e traslazione lungo i tre assi corporei (x,y,z) con riferimento
ad una slice guida.
Figura 45: correzione del movimento attraverso una slide di riferimento. A destra vengono
visualizzati i parametri di trasformazione del corpo rigido utilizzati da questo applicativo.
88
Il movimento dei soggetti all’interno dello scanner durante l’esecuzione di un esame causa
numerosi artefatti ed alterazioni spaziali della registrazione del segnale.
I 2 principali punti ove il TSRM può adoperarsi per limitare questo movimento sono:
utilizzo di software che supportino algoritmi di “track motion” e di correzioni delle
distorsioni geometriche.
Utilizzo di macchine a 3Tesla o superiori, che grazie agli alti campi magnetici
permettono una riduzione dei tempi di acquisizione delle sequenze e la possibilità di
introdurre ulteriori presidi di immobilizzazione sul paziente. Presidi inaccettabili se
posti per un lungo tempo: nastri, imbottiture, “bite” per immobilizzare i denti.
Il TSRM in quanto tale, è tenuto come previsto al punto 7.3 del codice deontologico a
“fornire il suo parere professionale sull'acquisto di apparecchiature o materiali, nonché sulla loro efficacia ed
efficienza, ispirando le proprie scelte in funzione della reale utilità delle tecnologie senza condizionamenti
politico-amministrativi ed economici.”
Figura 46: presidi di immobilizzazione utilizzati in indagini fMRI: dall’alto e da sinistra: bite
per denti, maschere termoplastiche , collari con nastri immobilizzanti, sagome con nastri
bloccanti. Il TSRM è responsabile del corretto posizionamento di questi presidi al fine
dell’immobilizzazione del paziente.
89
Filtraggio spaziale
Si usano filtri di smoothing per migliorare il rapporto segnale/rumore. Viene sostituito il
valore di ogni voxel con un valore di media ponderata ottenuto fra i voxel vicini a quello
bersaglio.
Permette inoltre una migliore comparazione fra diversi soggetti e permette lo studio
attraverso “Gaussian Field Theory”
Gli svantaggi risiedono nel fatto che essendo un filtro che tende ad omogeneizzare delle
micro aree crea una perdita di risoluzione spaziale e di dettaglio.
Figura 47: sopra sono evidenziate le aree attive al netto del filtro di smoothing, sotto si può
osservare come questa filtrazione influisca notevolmente sulla visualizzazione e sulla
omogeneizzazione del segnale.
90
Filtraggio temporale
Vengono applicati due principali differenti filtri a secondo dei bisogni: filtro passa alto e
filtro passa basso. Il filtro passa alto è quello comunemente più utilizzato per tagliare le
componenti a basse frequenze derivanti da: “scanner drift”, rumore termico, rumore da
pulsazione cardiaca o da respirazione toracica, rumore derivante da ansia e stress.
Lo “scanner drift” è una componente del rumore associata all’usura e degrado dei magneti
che creano dei campi differenti e quindi anche frequenze di Larmor differenti. Per questo i
protoni coinvolti risuonano a frequenze diverse andando a generare dei segnali
interpretabili come rumore.
Figura 48: con Brain Voyager QX si può selezionare il filtraggio passa alto, e si possono
utilizzare 3 metodi di filtraggio (Fourier analysis, GLM, GLM con DTC che sono dei predittori)
danno risultati molto simili e si possono variare a secondo di alcune situazioni o delle
preferenze.
91
Normalizzazione intensità del segnale
A causa dei dispositivi fisici usati, del numero dei canali riceventi della bobina, dell’usura
del magnete, della morfologia della testa del paziente, e di come il paziente appoggia la
testa stessa nello scanner, vi possono essere delle notevoli differenze di intensità del segnale
registrato. Normalmente la correzione più importante che viene fatta via software è quella
relativa all’intensità del segnale sul piano coronale. Di solito si ha un maggiore segnale a
livello dell’occipite rispetto al frontale in quanto le bobine risultano più vicine alla nuca del
paziente, e questo tradotto in termini di imaging può determinare una più difficile visione
della morfologia delle aree e dei contorni perché bisogna o aumentare o abbassare molto la
finestra di contrasto e si perdono dei dettagli.
Figura 49: in questa immagine è visualizzata nel menù a tendina la possibilità di correzione
del movimento e unwarp simultaneo (SPM8).
92
Segmentazione
La segmentazione viene utilizzata per separare principalmente i 3 differenti tessuti che
ritroviamo all’interno della nostra testa. Attraverso la segmentazione si riesce ad eliminare
tutti i voxel che costituiscono la calotta cranica e si può scegliere di ricostruire le immagini
2D o 3D in base a 3 differenti tipi tissutali:
materia grigia, materia bianca, liquido
cerebrospinale.
Il software per la segmentazione utilizza un
analisi dell’intensità del segnale combinata
con mappe (template) probabilistiche, che
definiscono anatomicamente la probabilità
di un voxel di appartenere o meno alla
materia grigia o bianca. Attraverso la regola
di Bayes, queste mappe
probabilistiche a priori, combinate con
l’intensità di ogni voxel, restituiscono la
probabilità a posteriori di appartenenza ad
un genere tissutale.[37]. Sulla segmentazione
vengono poi integrate in immagini 3D le aree di attivazione, il neurochirurgo così può
liberamente osservare solchi, circonvoluzioni ed aree di attivazione in rapporto alla lesione
senza avere l’onere visivo della presenza della calotta cranica ed altri tessuti[38].
Figura 50: Segmentazione attraverso l’open source DATAVIEW 3D. (A) Immagine
morfologica MRI con sovrascrizione delle mappe di attivazione. (B) Segmentazione 3D
della corteccia partendo dai dati della figura A. (C) Sovrascrizione delle mappe di
attivazione nella ricostruzione 3D.
93
Normalizzazione
In natura la variabilità morfologica umana del cervello è molto elevata. Sia il volume che la
forma possono presentarsi con notevoli variazioni. Per poter fare un confronto fra più
soggetti vi è la necessità di riportare a un modello uniforme di riferimento le varie tipologie
di cervelli acquisiti. La normalizzazione è una procedura utilizzata per compensare le
differenze di forma tra i vari cervelli, normalizzandoli in uno spazio comune. Questo spazio
comune è detto spazio stereotassico e quello più usato è l’atlante di Talairach (ma ne
esistono anche altri).
Figura 51: visualizzazione delle mappe di Talairach per studio stereotassico del cervello
umano, definiscono la posizione delle strutture cerebrali indipendentemente dalle differenze
nella forma e nella dimensione tra i cervelli presi in analisi.
I due punti di riferimento da cui si inizia a costruire questo sistema sono le commessure
anteriore e posteriore che giacciono in quasi tutti i cervelli esattamente nel piano sagittale
mediano.
94
Il TSRM attraverso Brain Voyager QX può effettuare 2 tipi di normalizzazioni:ricerca
automatica e manuale attraverso il “tool” di controllo 3D VOLUME TOOLS del piano
ACPC (anterior commisure, posterior commisure).APCP
Figura 52: ricerca automatica APCP
Figura 53: ricerca manuale APCP. Il TSRM dovrà poi eseguire 3 step: (1) ricerca AC, (2)
ricerca del piano tramite una calibrazione triplanare, (3) trasformare il nostro data set in un
nuovo spazio ACPC di Talairach per terminare la normalizzazione.
95
Analisi statistica
La valutazione dell’attivazione cerebrale sulla base del contrasto BOLD richiede un’analisi
statistica dei dati. Per la fMRI si utilizza normalmente il GLM (Modello Generale Lineare),
che è un modello statistico inferenziale.
E’ un modello che confronta per ogni voxel i valori attesi (su base di fattori predittivi e
varianza del segnale dovuto alla risposta emodinamica)rispetto ai valori rilevati.
Nel nostro cervello durante un attivazione vi sarà un andamento del segnale similare a
quello nella figura sotto riportata con un picco di segnale durante l’attività (banda verde) ed
un decadimento del segnale successivo (banda grigia).
Il GLM va a confrontare il valore atteso con il segnale acquisito in ogni voxel tramite un’analisi di
varianza (ANOVA). Si va a calcolare il coefficiente di correlazione fra il segnale rilevato ed
il segnale atteso. Successivamente avviene un campionamento del coefficiente di
correlazione. Laddove questo coefficiente superi una determinata soglia il voxel verrà
colorato di una tonalità dal rosso al giallo a secondo del grado di correlazione, e i voxel al di
sotto della soglia non saranno visualizzati. Le mappe di attivazione rappresentano la
correlazione tra l'andamento del segnale nel voxel e quello atteso.
Figura 54: visualizzazione di
una mappa statistica relativa
ad una task di finger tapping
del dito mano dx.
96
Coregistrazione
Si tratta di coregistrare normalmente delle immagine funzionali EPI GE T2* con le
immagini anatomiche ad alta risoluzione spaziale, di solito pesature T1 3D[35,36].
Per potere effettuare la coregistrazione bisogna che il tecnico utilizzi un software in grado
di farlo, attualmente si usa di solito l’SPM8 (Statistical Parametric Mapping, versione 8) per
la ricerca o il Brain Voyager per studi clinici..
Prima di potere effettuare i confronti statistici e le coregistrazioni le immagini devo essere
pre processate come abbiamo visto.
Per coregistrare le immagini viene utilizzata un immagine di riferimento acquisita tramite
una sequenza anatomica (source image) e le altre immagini vengono riallineate su questa.
Le immagini subiscono delle rotazioni e delle traslazioni 3 x 3 sugli assi. Alcuni programmi
gestiscono anche 3 x 3 x 3 movimenti di correzione su 3 assi di rotazione di corpo rigido
differente. Molto spesso coregistrazione e correzione del movimento sono abbinate
sequenzialmente o integrate.
Le immagini anatomiche di riferimento sono quasi sempre immagini 3D, in quanto questi
studi servono poi ai neurochirurghi per operare la lesione, ed ovviamente lavorando con un
neuronavigatore, necessitano di avere un immagine tridimensionale ove vengono fuse le
mappe d’attivazione.
Sotto viene elencata una procedura di coregistrazione di dati anatomici 3D (VMR-volume
magnetic resonance) e funzionali (FMR-functional magnetic resonance)(39,40).
Per prima cosa bisogna caricare i 2 data set VMR e FMR e eseguire poi l’allineamento
iniziale e la correzione automatica allineamento (Fine Tunnig).
97
L’allineamento iniziale (Initial alignment) può essere eseguito in 2 modi differenti a seconda
delle circostanzeHeader Based Coregistration, da risultati eccellenti, i presupposti richiedono che i dati
VMR e FMR siano stati acquisiti nella stessa sessione e che siano stati inseriti all’interno di
Brain Voyager.
In questo modo l’operatore può visualizzare il risultato, si possono anche settare i livelli di
trasparenza delle FMR sovrascritte su VMR e regolarne il livello.
98
Allineamento con settaggio punti di coregistrazione, viene utilizzato quando i 2 data
set sono stati acquisiti in 2 sessioni differenti. Si devono definire almeno 3 punti su VMR
ed altri tre su FMR grazie ai quali sarà possibile effettuare il riallineamento. Per prima cosa
bisogna creare un nuovo volume per i dati funzionali per poterli riallineare e coregistrare
quindi sugli anatomici 3D. Flipe slice order è un opzione per inserire la convenzione
radiologica di visualizzazione delle slice da sinistra a destra. Poi si seleziona crea volume.
99
Successivamente vengono visualizzate in alto le acquisizioni VMR nei tre piani ed in basso
quelle FMR. Di solito (sopra) le acquisizioni funzionali non vengono prese in sagittale
quindi bisogna ricostruirle per poterle meglio sovrapporre.
Attraverso questo comando si possono effettuare rotazioni di 90° sino ad ottenere
l’orientamento desiderato della acquisizione funzionale in modo che sia successivamente
allineabile al dataset VMR (anatomiche T1 o T2).
100
A questo punto i tre piani di acquisizione dei 2 dataset sono sovrapponibili e si può iniziare
a definire i punti di allineamento.
101
Vanno individuate 3 coppie di punti attraverso la funzione Set point, che siano facilmente e
fedelmente rintracciabili sia nelle acquisizioni FMR che VMR
Una volta definite le coppie si può iniziare l’allineamento e verificarne l’esattezza e la
corrispondenza.
.
Per concludere la coregistrazione delle immagini attraverso Brain Voyager QX avvengono
tramite 2 funzioni di base: allineamento iniziale e correzione automatica d’allineamento ove
questa ultima serve soprattutto per annullare le eventuali deviazioni dovute al movimento
del soggetto.
102
CONCLUSIONI
Alla luce degli studi condotti, delle ricerche in letteratura, attraverso le esperienze personali
sul campo presso l’Ospedale Bellaria di Bologna e l’Ospedale S.Anna di Ferrara, sono
arrivato alla conclusione che le indagini di fMRI siano indispensabili come integrazione
nella pianificazione degli interventi chirurgici al SNC.
Permettono un mappaggio delle aree eloquenti dando la possibilità al neurochirurgo di
scegliere la via d’accesso più opportuna per aggredire la lesione senza indurre deficit
neurologici. A questo riguardo va aggiunto che l’fMRI non è in alcun modo sostitutiva alla
stimolazione corticale intraoperatoria, in quanto è una metodica si sensibile ma non
specifica, ed inoltre è estremamente operatore dipendente. Il risultato delle mappe
statistiche è legato ai macchinari, ai software, alla gestione del processing e dei parametri
statistici e non per ultimo all’esperienza ed abilità di chi conduce ed elabora tutto il
processo di formazione dell’immagine.
L’fMRI permette, necessita e si avvantaggia dell’integrazione con altre tecniche (DTI, FT,
spettroscopia), al fine di fornire al neurochirurgo una visione d’insieme sulla funzionalità
del nostro cervello e le relazioni con la lesione, prima di decidere se operare o meno..
L’fMRI per il TSRM è una conquista prestigiosa, che lo proietta in una fase sempre più
avanzata nell’elaborazione e processazione dell’immagine. Si ritrova a dovere collaborare
con nuove figure professionali (psicologi della riabilitazione, neurofisiologi, neurochirurghi,
ingegneri e tecnici informatici, matematici) al fine di sviluppare nuove strategie di
attivazione cerebrale, e quindi di dover reperire conoscenze e capacità che esulano dalla
normale formazione. E’ un modo innovativo per progredire e valorizzare la sua formazione
e la sua professione portandola in rotta con le tendenze di informatizzazione massiva che
stanno affermandosi in ogni ambito di vita. Proprio quest’anno è stato aperto infatti il
primo corso in tecniche avanzate di RM per TSRM in Italia(FT, fMI, spettroscopia,
perfusione).
Per concludere il TSRM che lavora attraverso la fMRI deve possedere anche un alta
capacità professionale in ambito di accoglienza, cura e gestione del paziente, che spesso
vive una situazione drammatica, ove l’esito dell’esame lo indirizzerà su un percorso
chirurgico o meno da cui dipenderà la sua prospettiva e speranza di vita.
103
BIBLIOGRAFIA
[1]
Vincenzo Mezzogiorno "et al."(1999), “TESTO E ATLANTE DI ANATOMIA
UMANA”, Napoli, Piccin.
[2]
Gabrieli et al. (1998), "The role of left prefrontal cortex in language and memory",
PNAS n°95.
[3]
Kapsalakis IZ “et al.” (2012), “Preoperative evaluation with FMRI of patients with
intracranial gliomas”, Department of Neurology, School of Medicine, University
Hospital of Larisa, University of Thessaly, Larisa, Greece.
[4]
Stefan Sunaert (2006), “Presurgical Planning for Tumor Resectioning”, Department
of Radiology, University Hospital of the Catholic University of Leuven Belgium.
[4a]
Zhang D “et al.”(2009 Dec), “Preoperative sensorimotor mapping in brain tumor
patients using spontaneous fluctuations in neuronal activity imaged with functional
magnetic resonance imaging: initial experience.”, Department of Radiology,
Washington University in St. Louis.
[5]
AJAY DHANKHAR (1997) “et al”, “Functional Magnetic Resonance Imaging
Assessment of the Human Brain Auditory Cortex Response to Increasing Word
Presentation Rates”, Departments of Psychiatry, Radiology, Neurosurgery, and
Molecular Biophysics and Biochemistry, Yale University School of Medicine, New
Haven, Connecticut.
[6]
Joy Hirsch (2000) “et al.”, “An integrated functional magnetic resonance imaging
procedure for preoperative mapping of cortical areas associated with tactile, motor,
language, and visual functions”, Department of Neurosurgery, New York.
[7]
Dave R.M. Langers (2012),“Mapping the Tonotopic Organization in Human
Auditory Cortex with Minimally Salient Acoustic Stimulation”, Faculty of Medical
Sciences, School of Behavioral and Cognitive Neurosciences, University of
Groningen, Olanda.
[8]
Karl H. S. Kim (1997)”et al.”, “Distinct cortical areas associated with native and
second languages”, Department of Neurology and Neuroscience, New York.
104
[9]
Olivera Sveljo, Katarina Koprivsek, Milos Lucic (2011),“Adaptability of languagerelated brain network in a low-grade glioma patient”, Diagnostic Imaging Centre,
Oncology Institute of Vojvodina, Sremska Kamenica, Serbia.
[10]
Samantha I. Cunningham “et al”(2011), “Visual Cortex Activation Induced by
Tactile Stimulation in LateBlind Individuals with Retinitis Pigmentosa”,
Department of Biomedical Engineering, Neuroscience Graduate Program,
Department of Psychology, University of Southern California, Los Angeles, CA.
[11]
Van der Kouwe AJ “et al.”(2008), “Brain morphometry with multiecho
MPRAGE”, Department of Radiology, Massachusetts General Hospital.
[12]
Joy Hirsch “et al.”(2000)“An Integrated Functional Magnetic Resonance Imaging
Procedure for Preoperative Mapping of Cortical Areas Associated with Tactile,
Motor, Language, and Visual Functions”, Departments of Neurology and
Radiology New York.[12]
[14]
Scott W. Atlas “Magnetic Resonance Imaging of the Brain and Spine”, Lippincott
Williams & Wilkins, fourth edition.
[15]
Stefan Suanert (2006), “Presurgical Planning for Tumor Resectioning”, Department
of Radiology, University Hospital of the Catholic University of Leuven, Belgium.
[16]
Gao JH, “Quantitative assessment of blood inflow effects in functional MRI
signals”, Magn Reson Med 1996;36:314–319.
[17]
Andrei I. Holodny “et al.”(200), “The Effect of Brain Tumors on BOLD
Functional MR Imaging Activation in the Adjacent Motor Cortex: Implications for
Image-guided Neurosurgery”, Departments of Radiology and Neurosurgery,
UMDNJ-New Jersey Medical School, Newark, NJ.
[18]
Guenther C. Feigl “et al.” (2000), “Evaluation of Usefulness of Coregistering MRI
and BOLD fMRI for Intraoperative 3D Neuronavigation in Patients with Tumors
in Eloquent Areas”, Department of Neurosurgery, University of Ulm, Germany.
[20]
Michela Tosetti, “TECNICHE AVANZATE DI RISONANZA MAGNETICA:
SPETTROSCOPIA, DIFFUSIONE, PERFUSIONE e fMRI” Laboratorio RM IRCCS Stella Maris - Pisa.
[22]
Alexandra J. Golby, M.D. “et al”(2011),” Interactive Diffusion Tensor
Tractography Visualization for Neurosurgical Planning”, Brigham and Women’s
Hospital Department of Neurosurgery, Harvard Medical School Boston,
105
MA, United States.[22]
[23]
Ronald L. Wolf, John A. Detre (2007), “Clinical Neuroimaging Using Arterial SpinLabeled Perfusion Magnetic Resonance Imaging”, Departments of Radiology and
Neurology, University of Pennsylvania Medical Center, Philadelphia, Pennsylvania.
106
[25]
Juan C. Fernandez-Miranda “et al.”(2012), “High-Definition Fiber Tractography of
the Human Brain: Neuroanatomical Validation and Neurosurgical Applications”,
Department of Neurological Surgery and Magnetic Resonance Research Center,
Department of Radiology, University of Pittsburgh Medical Center, Pittsburgh,
Pennsylvania.
[26]
Giulia Mascioli “et al” (2012),” Functional MRI Examination of Visual Pathways in
Patients with Unilateral Optic Neuritis”, Sezione Scienze Radiologiche,
Dipartimento di Scienze Cliniche Specialistiche ed Odontostomatologiche,
Università Politecnica delle Marche, Ancona, Italia.
[27]
Riccardo Lazzarini, Mirco Cosottini (2008), “Ruolo del TSRM nella risonanza
magnetica funzionale prechirurgica”, Università di Pisa.
[28]
AA.VV.(2005)“Siemesn Medical Bold Immagin”,Germany.
[29]
deCharm RC. (2008),”Application of real-time fMRI” Omneuron 3T MRI Research
Center, Menlo Park, California.
[30]
Wei-Ting Zhang “et al” (2006), “Strategies for improving the detection of fMRI
activation in trigeminal pathways with cardiac gating”, Athinoula A. Martinos
Center for Biomedical Imaging, Massachusetts General Hospital, Charlestown.
107
SITOGRAFIA
http://131.114.94.135/lezioni/bioingegneria/Esploraz_funz_cervello/3%20Tecnic
he%20di%20analisi%20dei%20dati%20fMRI.pdf [36]
http://beta.fisica.uniba.it/LinkClick.aspx?fileticket=KzaD8JLcrI%3D&tabid=80&mid=1519[37]
http://cdn.leganerd.com/wp-content/uploads/LEGANERD_041874.jpg
http://en.wikipedia.org/w/index.php?title=File:Ventraldorsal_streams.svg&page=1
http://it.wikipedia.org/wiki/Imaging_con_tensore_di_diffusione [21]
http://it.wikipedia.org/wiki/Telencefalo
http://it.wikipedia.org/wiki/Test_di_Wada [13]
http://pacs.unica.it/biblio/lezione16.pdf
http://pages.unibas.ch/dmr/mr_physik/research/fMRI/auditory/main.htm [6]
http://posters.neurosurgeon.org/browse.php?function=public_view&id=36048
http://spazioinwind.libero.it/biomod/thesis/TesiMangia/CAPITO~2.PDF [24]
http://tesi.cab.unipd.it/25986/1/PRENDIN_ALBERTO.pdf [34]
http://tesi.cab.unipd.it/28282/1/tesi.pdf [35]
http://www.bolognatsrm.it/atti%20congressi/BN_Lez%2006%20ARTEFATTI.p
df [19]
http://www.brainmapping.org/NITP/images/Summer2011Slides/NITP2011_M
M_01_Preprocessing_print.pdf[31]
http://www.brainvoyager.com/bvqx/doc/UsersGuide/WebHelp/BrainVoyagerQ
XUsersGuide.htm [39]
http://www.cs.wright.edu/~agoshtas/OMI.html [D]
http://www.frontiersin.org/neuroinformatics/10.3389/neuro.11.009.2009/full[38]
http://www.neuropsicomotricista.it/il-movimento/1205-aree-corticalimotorie.html
http://www.tsrmumbria.it/doc_rubriche/19-013-Ligi_DiffusioneRM.pdf
http://www.usc.edu/programs/neuroscience/private/docs/journal_clubs/Lei_Pre
processing_08_11_2011.pdf[32]
https://www.biac.duke.edu/education/courses/fall03/fmri/handouts/W9_Prepro
cessing_Design_2003.htm[33]
108
http://www.ernohermans.com/wpcontent/uploads/2011/11/spm8_startersguide.pdf [40]
http://www.medicitalia.it/minforma/Neurochirurgia/759/Gliomi-cerebrali-dibasso-grado-Grado-II-sec-WHO [41]
109
NOTE INTEGRATIVE
[A] Contrariamente a quanto riportato nel testo, vi sono alcuni rari casi di pazienti bi
linguistici o più, dove i paradigmi possono essere posti in più lingue. Questo si verifica
quando una lesione si trova in prossimità delle aree acustiche. Tonotopicamente la
mappatura di queste aree prevede delle sub-aree dove si osservano delle nette separazioni
fra le attivazioni corticali di un linguaggio rispetto ad un altro. Con una duplice proposta di
task si può valutare a seguito di una resezione chirurgica quale area verrà persa e la
possibilità del soggetto di continuare ad ascoltare e parlare almeno con un linguaggio.
Questo come è valido per i pazienti bilinguistici tardivi.
[B ] Le 3D MPRAGE ( Three Dimensional Magnetization Prepared Rapid Acquisition
GRE) sono sequenze T1 pesate, tridimensionali. Vi è un preimpulso di magnetizzazione a
180°, seguito da una rapida successione di immagini GRE steady state, ed una seconda
inversione di fase nella direzione della slice. Sono ottime da usare per lo studio morfologico
delle aree corticali in quanto hanno elevatissimo contrasto per i segmenti delle aree corticali
stesse. Vi sono anche delle versioni multieco (MEMPR), dove viene ridotto il rapporto
segnale rumore, e le segmentazioni corticali sono meglio distinguibili rispetto alla
duramadre. Quest’ultima sequenza è indicata per studi morfometrici. [11]
[C] Test di Wada, è un test medico dove al paziente sveglio viene iniettato del sedativo
blando (amobarbitale) in una delle 2 carotidi, tramite catetere o cannula. Lo scopo è quello
di anestetizzare uno dei due emisferi cerebrali, “spegnendo” le funzioni linguistiche e di
memoria. Successivamente viene eseguita una indagine neuropsicologica per valutare l’altro
emisfero. In questo modo è possibile valutare pazienti che presentano disturbi epilettici o
formazioni neoplastiche, per visionare queste aree in formazione predittiva ad un
intervento chirurgico [13].
[D] Il fenomeno del “brain shift” si verifica durante l’intervento chirurgico a causa della
instabilità del nostro cervello durante la craniotomia e l’asportazione di tessuto, determina
uno spostamento e riposizionamento talvolta marcato delle strutture contigue. Questo
causa una perdita della relazione spaziale fra i sistemi di neuro navigazione, le mappe fMRI
ed i riferimenti TC/RM.
[E] Alcuni esami fMRI è preferibile eseguirli attraverso delle sequenze che prevedano
l’utilizzo del gating cardiaco o respiratorio. I motivi principali per queste procedure
risiedono nell’eliminazione delle interferenze del battito cardiaco sullo spostamento e sulla
110
variazione di volume dei vasi cerebrali. Queste variazioni possono influire notevolmente
sulla produzione del segnale e sulla fedeltà di attivazione o meno, e quindi sulla produzione
delle mappe statistiche. I distretti che meglio beneficiano di queste tecniche sono il tronco
encefalico e le aree temporali ed occipitali, che ospitano i tratti arteriosi i quali subiscono
maggiori variazioni a causa del ritmo cardiaco. Anche il gating respiratorio viene utilizzato
per ridurre le variazioni di movimenti e le disomogeneità di campo causate dalla
respirazione toracica. Col gating si acquisisce l’immagine sempre allo stesso livello del ciclo
cardiaco in quanto si presuppone che le variazioni di movimento e di volume siano sempre
euguali tra 2 battiti cardiaci e quindi non vi è uno “shift” assoluto delle strutture ma
vengono acquisite sempre nello stesso punto.
Le sequenze utilizzate sono GE EPI (TR ogni 3-6-9 battiti), Dual ECO EPI (due echi a 21
e 55 ms dal TR dato ogni 2 battiti cardiaci).[30]
Le controindicazioni per gli studi col gating risiedono in un allungamento della durata
dell’esame ed in un’impossibilità o difficoltà di eseguire gli studi legati all’attivazione delle
aree nociocettive, in quanto bisognerebbe sottoporre il soggetto ad uno stimolo molto più
lungo.
111
112