NEUROSCIENZE AFFETIVE E
COGNITIVE
Brain Imaging:
tecniche funzionali
Lezione 2: Tecniche di brain imaging
tecniche funzionali
Alessio Avenanti – 13 Ottobre 2014 – Dip. di Psicologia, Università di Bologna
Tecniche funzionali
Le varie metodiche differiscono soprattutto per:
1. Risoluzione spaziale
2. Risoluzione temporale
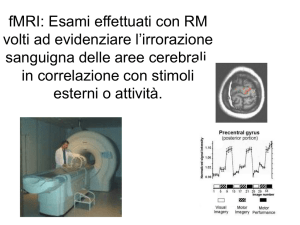
• Risonanza magnetica funzionale (fMRI)
• Tomografia ad emissione di positroni (PET)
3. Tipo di informazione (correlazionale, causativa)
Risonanza Magnetica Funzionale
La fMRI (come PET) non misura direttamente l’attività cerebrale (come
EEG e MEG), ma le risposte emodinamiche (volume sanguigno, flusso
cerebrale, ossigenazione dei tessuti) che accompagnano l’aumento di
attività neuronale.
fMRI
In particolare, la fMRI è basata sul contrasto BOLD (Blood Oxygenation
Level Dependent), cioè sul rapporto desossiemoglobina (Hbr) /
ossiemoglobina (HbO2) nei tessuti nervosi.
Il ferro dell’Hbr è una sostanza
paramagnetica, cioè si polarizza
intensamente se immerso in un campo
magnetico. Riduce il segnale fMRI.
Al contrario il ferro della HbO2 non è
suscettibile al campo magnetico
(sostanza diamagnetica) come il resto
del tessuto cerebrale.
1
Risonanza Magnetica Funzionale
BOLD (Blood Oxygenation Level Dependent)
1. Aumento attività
neurale locale
2. Aumento metabolismo locale: consumo di ossigeno
(con relativo aumento di desossiemoglobina)
3. Aumento flusso ematico nella regione attiva.
Poiché l’aumento di flusso ematico eccede la
capacità del tessuto nervoso di utilizzare
l’ossigeno ematico fornito all’area (arriva più
sangue di quello richiesto) nell’area attiva si crea:
4. Aumento locale
del segnale BOLD
in prossimità dei
capillari che
irrorano le aree
attive
a) aumento relativo di ossiemoglobina
b) riduzione di desossiemoglobina
Registrazioni elettrofisiologiche e fMRI simultanee
Studi di Nikos K. Logothetis
Relazione tra segnale BOLD e
extracellular fields potentials
(EFPs):
LFPs: Local Field Potentials
potenziali graduati di ampie popolazioni
di neuroni; riflettono attività integrative
dendridiche (registrate entro una
distanza di 0.5-3mm). Alta correlazione
con segnale BOLD!
MUA: Multiunit spiking Activity
Il segnale BOLD inizia ad
aumentare dopo circa 2-3
sec. dall’inizio dell’attività
neuronale, raggiungendo il
suo picco dopo 5-10 sec.
Stimolo visivo
MUA e SDF mostrano forte
adattamento
stimulus
onset
Initial negative BOLD signal
LFP rimane elevato per tutta la
durata dello stimolo (area grigia)
somma pesata di potenziali d’azione
extracellulari di centinaia di neuroni
(entro una sfera di raggio di 150-300μm)
SDF: Spike Density Function
potenziali d’azione extracellulari di una o
più singole unità. Elettrodo vicinissimo al
neurone (entro 50μm)
Registrazioni elettrofisiologiche e fMRI simultanee
Studi di Nikos K. Logothetis
Local Field Potentials (LFPs):
1) È un segnale registrato usando un
microelettrodo a bassa impedenza per
registrazione extracellulari posto a
distanza sufficientemente lontana da
singoli neuroni per evitare il dominio
dell’attività di una particolare cellula
nel segnale.
2) Si applica un filtro passa-basso a
~300 Hz, per ottenere il LFPs.
Logothetis et al., 2001 Nature
3) La bassa impedenza e il
posizionamento dell’elettrodo
permettono che nel segnale
contribuisca l’attività di un numero
ampio di neuroni
Si possono comunque
trarre delle
informazioni temporali
sull’attivazione
sequenziale di diverse
aree impegnate in un
compito
I LFPs rappresentano (soprattutto) le afferenze sincronizzate all’area target,
al contrario di MUA e SDF (spike) che rappresentano l’output dall’area.
I LFPs sono composto principalmente da potenziali graduati post-sinaptici.
2
Acquisizione
Acquisizione ed analisi dati di fMRI
VOXEL
( Pixel Volumetrico)
SPESSORE
Sezione
6 mm
3 mm
6 mm
SEZIONE SAGITTALE
SEZIONE TRASVERSALE
3 mm
A. Fase di acquisizione di immagine strutturale
B. Fase di acquisizione di immagini funzionali
C. Appaiamento delle due immagini (coregistrazione)
D. Normalizzazione
E. Analisi statistica
Matrix
64 x 64
A,B
B
In un tipico esperimento fMRI, il soggetto è sdraiato con la
testa nel magnete e svolge un compito.
Esperimento fMRI: 2. Fase Funzionale
Vengono prese una serie di immagini funzionali (T2*) a bassa
risoluzione (ad esempio 1 volume di immagini ogni 2 secondi
X 150 volumi = 300 sec = 5 minuti).
A
Esperimento fMRI: 1. Fase Anatomica
Viene acquisita un’immagine anatomica (T1) del cervello ad
elevata risoluzione, che in seguito sarà usata per sovrapporre
le regioni di attivazione cerebrale.
C
Immagini fMRI: coregistrazione
voxel
voxel
primo volume
(2 sec per acquisire))
3
C
Coregistrazione immagine
strutturale (pesata in T1) e
immagine funzionale (pesata
in T2*)
Spatial
normalization
C
Normalizzazione
• Le scansioni MRI di diversi individui
variano molto a causa di differenze di
orientamento delle scansioni e di
strutture anatomiche (forma, grandezza)
• In generale è utile normalizzare le
scansioni in base ad un cervello di
riferimento (standard template, ad
es. il cervello di Talairach o MNI)
• Normalizzare un cervello consiste nel
traslare, ruotare, scalare e deformare il
cervello in modo da farlo corrispondere
al template (in base a volume o solchi)
Metodi stereotassici
D
Coregistrazione immagine
strutturale (pesata in T1) e
immagine funzionale (pesata
in T2*)
• Dopo la normalizzazione può essere utile riportare localizzazioni
per mezzo di coordinate stereotassiche (Talairach, MNI). Si tratta
di 3 numeri (x, y, z) che descrivono la distanza dalla
commessura anteriore (l’origine dello spazio di Talairach).
D
Metodo Sottrattivo
Il metodo della sottrazione cognitiva si deve agli
studi con tempi di reazione (TR).
(F. C. Donders, un fisiologo olandese).
Misura il tempo di un processo psicologico
confrontando due tempi di reazione, uno dei
quali ha le stesse componenti dell’ altro + il
processo che si vuole misurare.
Statistical
analysis
Esempio:
TR1: Premi un pulsante quando vedi una luce;
TR2: Premi quando la luce è verde ma non quando è rossa;
TR2 – TR1 = tempo per discriminare due stimoli diversi
D
D
Analisi Statistica
Immagini funzionali
~2s
Risposta dell’area STS
Segnale
BOLD
Osservazione del
movimento biologico
(aumento segnale fMRI)
Tempo
Condizione
Mappa statistica
Osservazione del
movimento random
(diminuzione segnale fMRI)
Sovrapposta su
immagine anatomica
Tempo
Regione di interesse
(Region of Interest: ROI)
~ 5 min
Grossman & Blake, 2001, Vision Res
4
D
Attivazioni: regioni cerebrali in cui si verifica una
differenza (statisticamente) significativa del segnale
BOLD tra due condizioni.
Sez. coronale
Un esempio (“antico” e criticato) di metodologia sottrattiva:
Peterse e coll 1988, 1989 studio PET su attività nervosa durante lettura
di singole parole.
Modello cognitivo di elaborazione lessicale di tipo sequenziale
T1: Baseline (nessuno stimolo)
T2: Presentazione passiva. Presentazione di parola (e.g. torta) senza
alcun compito
T3: Ripetizione. Presentazione di parola (e.g. torta) e richiesta di lettura
ad alta voce
T4: Generazione verbo. Presentazione di parola (e.g. torta) e richiesta di
produzione di un verbo ad essa collegato (e.g. mangiare)
T2 – T1: attivazioni legate a analisi sensoriale
T3 – T2: attivazioni legate a codifica e programmazione articolatoria
T4 – T3: attivazioni legate a elaborazione semantica
Sez. sagittale
-
Ok per i primi 2 contrasti.
Il contrasto T4 - T3 è più problematico sotto diversi punti di vista.
Ad es. esso presuppone che la lettura di una parola non implichi di
per se’ già un’elaborazione semantica della parola stessa.
(Il modello cognitivo di riferimento è toppato!)
Sez. orizzontale
Vantaggi e Svantaggi della fMRI
Vantaggi:
- Poco invasiva (specialmente se confrontata con PET)
- Buona/ottima risoluzione spaziale (1-3 mm)
Le varie metodiche differiscono soprattutto per:
1. Risoluzione spaziale
2. Risoluzione temporale
3. Tipo di informazione (correlazionale, causativa)
Svantaggi:
- Segnale relativamente debole (il BOLD presenta variazioni
dell’ 1-4% rispetto alla condizione di riposo)
- Non misura direttamente l’attività neuronale (ma il flusso
ematico nella zona attiva)
- Povera risoluzione temporale
- Sensibile a numerosi artefatti (movimenti della testa)
- Non differenzia tra inibizione ed eccitazione
- Alto costo (sia per acquistare che per mantenere)
PET
PET
Positrone Emission Tomography
Positrone Emission Tomography
Permette di “fotografare”
il metabolismo delle aree
cerebrali, monitorando le
più attive durante lo
svolgimento di un
determinato compito.
Utilizza un tracciante
radioattivo emittente
positroni (ad es.
glucosio marcato),
iniettato per via
endovenosa (o inalato)
a volontari impegnati in
compiti di cognitivi,
percettivi, motori
5
La testa è circondata da sensori
che rilevano le emissioni
radioattive (gamma camera o
tomografo-PET); un elaboratore
fornisce l’imaging delle aree che
hanno un incremento metabolico.
Le immagini della scansione
vengono visualizzate su
computer come sezioni sottili
del cervello.
La PET è una metodica di visualizzazione indiretta dell’attività cerebrale
(come la fMRI), in grado di fornire informazioni sul metabolismo del
cervello a riposo o durante vari tipi di compiti. Si basa sull’uso di traccianti
emittenti positroni.
Una volta introdotto nel sistema vascolare, il tracciante contenente
l’isotopo si diffonde nel cervello e si concentra nelle zone con
maggiore attività neurale. L’isotopo (elemento instabile) decade,
emettendo un positrone che collide con un elettrone (dopo un aver
percorso un tragitto a volte dell’ordine di alcuni millimetri).
Come si crea un tracciante:
Attraverso un ciclotrone (strumento
che accelera a velocità elevatissima
protoni) si bombardano nuclei stabili
di azoto, carbonio, ossigeno o fluoro.
Questa
procedura
comporta
l’introduzione nel nucleo di un
ulteriore protone, cioè la creazione di
un isotopo instabile.
La collisione produce la loro reciproca annichilazione, con il rilascio di
energia: 2 fotoni (raggi g) che viaggiano a 180 gradi l’uno dall’altro.
L’isotopo instabile viene connesso ad un composto utilizzato dai neuroni
(ad es., glucosio, o l’ossigeno), viene iniettato nel soggetto e raggiunge il
cervello. L’isotopo funge da tracciante del metabolismo del composto
introdotto
TOMOGRAFO A POSITRONI (gamma camera)
I due raggi gamma (fotoni) emessi a seguito dell’annichilazione
raggiungono una coppia di rivelatori del tomografo (posti ai due lati della
testa del soggetto) che registrano eventi solo quando sono simultanei.
15O
Il metodo di detezione simultanea dei fotoni permette la
localizzazione delle sedi in cui avvengono le emissioni g,
con una risoluzione di alcuni millimetri (1-8 mm).
6
Il tracciante (isotopo) radioattivo iniettato nel sistema
vascolare si diffonde nel cervello e si concentra nelle zone in
cui il flusso ematico è maggiore, cioè quelle attive durante il
compito.
Per esperimenti di attivazione cerebrale sono utili quegli
isotopi la cui emi-vita (tempo impiegato dal 50% dell’isotopo
per decadere emettendo positroni) sia dell’ordine di minuti o
ore.
Esempi di traccianti PET: ad es.: carbonio-11, azoto-13, ossigeno-15
Ossigeno 15O: EV = 1.5 min
Inalazione di ossigeno molecolare marcato con 15O (Metabolismo dell’ossigeno); anche
inalazione di anidride carbonica marcata con 15O.
Fluoro (18F-FDG: 18-fluorodesossiglucosio): EV 109 min
Il desossiglucosio, somministrato per endovenosa, viene trasportato nel cervello e fosforilato
in modo simile al glucosio ma non viene metabolizzato ulteriormente, e rimane nel tessuto
(Metabolismo del glucosio).
Vantaggi e Svantaggi della PET
Vantaggi:
- Buona risoluzione spaziale (< fMRI, >ERP/MEG)
- È possibile studiare diversi processi biochimici cerebrali,
usandi differenti composti radioattivi (ad esempio studiare il
metabolismo del glucosio, dell’ossigeno etc.).
Svantaggi:
- Invasiva
- Non misura direttamente l’attività neuronale (ma il flusso
ematico nella zona attiva).
- Povera risoluzione temporale.
- A causa del lento decadimento di alcuni isotopi, è difficile
sottoporre il soggetto a molte condizioni sperimentali.
- Alto costo (sia per acquistare che per mantenere).
7