ORGANIZZAZIONE
SINDROME
DI ANGELMAN
Via Bressa n° 8
Tel. 0422411132 Fax.0422319571
http://www.sindromediangelman.org
31100 TREVISO
C.F.94047800266
E mail: [email protected]
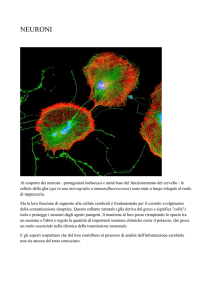
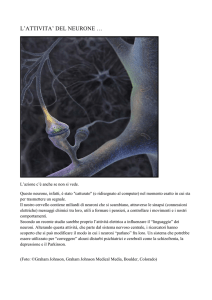
Gli inibitori di topoisomerasi riattivano l’allele dormiente dell’Ube3a nei neuroni
Autori: Huang HS, J Allen ….and Philpot BD. Nature 2012
La premessa
La Sindrome di Angelman è una malattia del neurosviluppo causata dalla perdita
o da un difetto (mutazione) dell’allele materno della proteina ubiquitina ligasi E3A
(UBE3A), per cui non esistono terapie efficaci per la Sindrome di Angelman.
Nella maggior parte dei tessuti dell’organismo il gene Ube3a è espresso in modo
biallelico (funziona sia la copia materna sia quella materna); tuttavia, nei roditori e negli
umani, la maggior parte dei neuroni (cellule del sistema nervoso) esprimono Ube3a
unicamente dagli alleli di eredità materna. Gli alleli paterni sono resi silenti dalla
metilazione, un meccanismo di regolazione comune nel genoma, i geni metilati sono
generalmente spenti. Questo tipo di processo, che per il gene UBE3A è molto più
complicato perché coinvolge anche un antisenso di UBE espresso solo dall’allele
paterno, viene definito epigenetico. Questo schema di regolazione così unico ha
suggerito la possibilità che riattivando nei neuroni gli alleli paterni dormienti di Ube3a e
rendendoli capaci di produrre una proteina funzionante, si possa almeno a livello di
modello cellulare correggere il difetto.
Esperimenti su colture cellulari di neuroni del modello murino
Per testare questa possibilità, è stato indagato l’effetto di 2306 piccole molecole che
avrebbero potuto riattivare l’allele paterno in neuroni corticali del topo modelloAngelman Ube3A-YFP (la molecola YFP è un fluorocromo che consente di seguire il
percorso di Ube3A: la presenza di Ube3A-YFP non è rivelabile se di eredità paterna,
mentre lo è se la proteina è di eredità materna).
Sebbene si ritiene che la metilazione ed altri marcatori epigenetici possano controllare
l’imprinting di Ube3a, sorprendentemente, nessuno dei composti di uso comune che
agiscono l’epigenoma, compresi i farmaci di rimodellamento della cromatina e gli
inibitori di DNA metiltransferasi, ha riattivato gli alleli paterni dell’Ube3a-YFP, mentre
dodici inibitori di topoisomerasi I e quattro inibitori di topoisomerasi II (le
topoisomerasi sono enzimi molto importanti nel metabolismo del DNA: determinano un
aumento o una diminuzione del grado di superavvolgimento della doppia elica e quindi
svolgono un ruolo fondamentale nell’impacchettamento e nella replicazione del DNA)
si sono rilevati capaci di promuovere l’attivazione dell’allele paterno dell’Ube3a in
misura dose dipendente. Questi farmaci comprendono topotecan, irinotecan, etoposide e
dexrazoxano (ICRF-187).
§§ Iscr.Reg.Vol. TV 0209 - O.N.L.U.S. §§ C.C.Postale N.390310 §§ IBAN - IT 13 Y 02008 12011 000005467786 §§
Abbiamo concentrato i nostri studi rimanenti sull’inibitore di topoisomerasi I
“topotecan” in quanto è un farmaco approvato per l’utilizzo nell’uomo e poiché il
topotecan inibisce la topoisomerasi I (TOP1), espressa ad alti livelli nel cervello in
sviluppo e in quello adulto. In questo studio esperimenti sui neuroni in coltura
provenienti da topi Ube3a m-/p+, hanno dimostrato che il topotecan è capace a
basse concentrazioni, di far produrre all’allele paterno, la stessa quantità di Ube3a
prodotta dall’allele materno di topi sani. Gli esperimenti dimostrano che ciò avviene
grazie alla capacità del topotecan, senza agire sulla metilazione, ma riducendo
l’espressione sull’allele paterno del trascritto antisenso di Ube3a: un risultato molto
importante perché è proprio l’espressione dell’antisenso ad impedire il funzionamento
dell’allele paterno di Ube3a. Specifici esperimenti in grado di discriminare tra proteina
espressa dall’allele paterno fosse attiva e svolgesse la sua funzione enzimatica hanno
dato esito positivo. Quindi la proteina di origine paternaè presente e funzionale nelle
colture cellulari.
Esperimenti in vivo
E’ stata scelta una dose di farmaco ben tollerata, dimostrata dall’assenza di diminuzioni
significative di peso corporeo tra l’inizio e la fine del trattamento e somministrato il
topotecan unilateralmente nel ventricolo laterale di topi Ube3a m+/pYFP o Ube3a m/p+ mediante infusione intracerebroventricolare (i.c.v.) per due settimane. I topi sono
stati sacrificati a) immediatamente b) 5h dopo la cessazione del trattamento.
Sorprendemente, il topotecan ha riattivato Ube3a nell’ippocampo, nello striato e nella
corteccia cerebrale dell’emisfero infuso, ma ha avuto soltanto un effetto modesto
sull’emisfero contrapposto (non infuso) senza alcun effetto sul cervelletto relativo (Fig.
3 a-e e Suppl. Figg. 14-15). Le analisi farmacocinetiche hanno dimostrato che una
quantità significativa di topotecan era rilevabile nell’emisfero infuso immediatamente
dopo il trattamento, mentre bassi livelli erano presenti nell’emisfero contrapposto (non
infuso) e nel cervelletto relativo (Fig. 3 a e Suppl. Figg. 14). Tuttavia, una dose più
elevata di topotecan (21,6 microg h-1 per 5 giorni) ha riattivato gli alleli paterni di
Ube3a in neuroni Purkinje del cervelletto, ma non è stata rilevata nessuna differenza
significativa nei livelli di topotecan nel sangue tra i topi trattati col farmaco e quelli
trattati col veicolo (placebo) (dati non mostrati). Le concentrazioni di topotecan sono
diminuiti significativamente cinque ore dopo l’interruzione del trattamento i.c.v. (Fig.
3a) e ciò indica che il topotecan non persiste ed è rapidamente rimosso/metabolizzato
nel cervello.
I dati farmacocinetici e farmacodinamici indicherebbero che il grado di riattivazione
degli alleli paterni di Ube3a da parte del topotecan sia direttamente correlato con le
concentrazioni del farmaco nel cervello e possa essere esteso a tutto il sistema nervoso.
Si ritiene che l’imprinting genomico avvenga soltanto durante il periodo di maturazione
delle cellule germinali e dello sviluppo embrionale e che i geni che hanno subito
l’imprinting poi tipicamente rimangono inalterati per tutta la vita. A questo proposito si
è verificato se l’effetto del topotecan sull’espressione dell’allele paterno di Ube3a
fosse transitorio o di lunga durata. Per investigare questa possibilità, abbiamo
utilizzato un protocollo di somministrazione intratecale (i.t., iniezione nel midollo
spinale) del farmaco perché: a) in questo modo il topotecan e l’irinotecan riattivano
Ube3a paterno in una popolazione sparsa di neuroni spinali lombari e permettono di
quantificare tutti i neuroni Ube3a-YFP-positivi, b) la via intratecale è già stata utilizzata
per somministrare il topotecan nel cervello dell’uomo.
§§ Iscr.Reg.Vol. TV 0209 - O.N.L.U.S. §§ C.C.Postale N.390310 §§ IBAN - IT 13 Y 02008 12011 000005467786 §§
Abbiamo rilevato che il topotecan (50 nmol in 5 micro l; i.t. una volta al giorno, per 10
giorni in un periodo di 14 giorni) è stato ben tollerato (Suppl. Fig. 13) e ha incrementato
significativamente il numero di cellule Ube3a-YFP-positive paterne nel midollo spinale
lombare di topo. La maggior parte (>93%) di queste cellule UBE3A-YFP-positive erano
neuroni NeuN+ e ciò indica che il topotecan in vivo riattiva principalmente Ube3a
nei neuroni. Inoltre, la proteina UBE3A-YFP paterna riattivata raggiungeva livelli
paragonabili a quelli dei controlli materni UBE3A-YFP (Suppl. Fig. 17c).
Sorprendentemente, il numero di neuroni di midollo spinale UBE3A-YFP-positivi
è rimasto elevato ben 12 settimane dopo l’interruzione del trattamento, quindi
molto oltre il tempo di eliminazione del topotecan dai tessuti (Fig. 3 a). Questi
risultati indicano che il topotecan è in grado di riattivare durevolmente l’Ube3a paterna
in un sottoinsieme di neuroni spinali e che un unico ciclo di trattamento è in grado di
modificare per lungo tempo l’espressione di Ube3a.
In conclusione, abbiamo rilevato che gli inibitori di topoisomerasi sono in grado di
riattivare l’allele paterno dell’Ube3a e che la proteina di derivazione paterna è
funzionale. Questi risultati suggeriscono che gli inibitori di topoisomerasi sono
potenzialmente adatti al recupero dei deficit molecolari, cellulari associati alla perdita di
UBE3A.
Problemi aperti
L’espressione di Ube3A viene modestamente sovra-regolata (upregulated) nel cervello
di topi Top2b knockout e ciò dà supporto genetico alla regolazione dell’espressione di
Ube3a da parte delle topoisomerasi
L’inibizione del trascritto antisenso di Ube3a potrebbe alterare l’espressione di altri geni
che sono sottoposti allo stesso tipo di regolazione genica col rischio di generare la
condizione speculare alla sindrome di Angelman ossia la sindrome di Prader-Willi.
L’ideale sarebbe trovare un giusto equilibrio tra l’espressione dei diversi geni impronte
in modo da migliorare la sintomatologia Angelman senza generare quella della PraderWilli. Questo studio rivela che il topotecan ridurrebbe l’espressione di Snrpn paterna e
di Ipw, la regione genomica la cui cancellazione/eliminazione è associata alla Sindrome
Prader-Willi.
Non si conosce il grado di regolazione da parte del topotecan dell’espressione di altri
geni nel cervello, compresi i cluster di geni di imprinting Igf2r, Kcnq1 e Gnas, e se o
meno i trattamenti a lungo termine con gli inibitori di topoisomerasi producono una
condizione di tipo Prader-Willi.
Tuttavia, il topotecan e l’irinotecan sono approvati per l’impiego in pazienti affetti da
cancro; essi penetrano nel sistema nervoso centrale e sono ben tollerati quando vengono
somministrati in modo cronico sia in pazienti adulti che in quelli pediatrici. Inoltre, i
pazienti trattati con inibitori di topoisomerasi non mostrano sintomi associati alla
Sindrome Prader-Willi.
§§ Iscr.Reg.Vol. TV 0209 - O.N.L.U.S. §§ C.C.Postale N.390310 §§ IBAN - IT 13 Y 02008 12011 000005467786 §§
Commento di Silvia Russo Ph D
Responsabile Sezione Genetica Malattie Rare
Istituto Auxologico Italiano
L’idea di riaccendere “l’allele che dorme” non è nuova ed un obiettivo che ci si pone
anche per altri difetti dell’imprinting, ma è la prima volta che viene riportato con
evidenze sperimentali così ben articolate un risultato positivo.
Ben Philpot dimostra che iniettando un farmaco peraltro già usato in commercio a
livello della zona bersaglio l’allele silente può produrre una proteina apparentemente
attiva, con effetti durevoli, almeno nel modello animale.
Prima di arrivare a pensare un trial sui pazienti resta tuttavia ancora un po’ di lavoro:
monitare per lunghi periodi gli effetti collaterali che possono derivare dalla
modulazione dell’attività di altri geni imprinted, valutare sempre sui topi una possibile
tossicità in tempi lunghi e soprattutto gli effetti sui sintomi della malattia. Una volta
riacceso l’allele paterno cosa migliora? Quanto?
Nonostante il lavoro da fare sia ancora molto e ancora molti siano i quesiti da risolvere,
sicuramente gli esperimenti di Ben Philpot e dei suoi collaboratori c’incoraggiano a
lavorare in questa direzione, a proseguire una ricerca che forse domani potrà migliorare
la qualità della vita di bambini con la sindrome di Angelman
§§ Iscr.Reg.Vol. TV 0209 - O.N.L.U.S. §§ C.C.Postale N.390310 §§ IBAN - IT 13 Y 02008 12011 000005467786 §§