UNIVERSITÀ DEGLI STUDI DI VERONA
LAUREA IN SCIENZE MOTORIE
++
TESI DI LAUREA
RUOLO DELL’ESERCIZIO FISICO NELLA PREVENZIONE
PRIMARIA DEL DIABETE TIPO 2: ASPETTI MOLECOLARI
RELATORE
CH.MO PROF. FEDERICO SCHENA
LAUREANDO
GINETTO BOVO
ANNO ACCADEMICO 2001-2002
Questo documento può essere liberamente distribuito a patto di non modificarlo in nessuna sua
parte. Indirizzo internet: http://digilander.libero.it/bovoginetto
INDICE
Introduzione
Aspetti generali
a) Insulina ed esercizio
b) Insulino resistenza
Fattori prerecettoriali, recettoriali (genetici) e postrecettoriali
nello sviluppo dell’insulino resistenza
a) fattori prerecettoriali: TNF alfa, Adiponectina, Obesità,
Leptina, Amilina, Bilancio Energetico, sFFA;
b) fattori recettoriali (genetici);
c) fattori postrecettoriali:
1) Recettori e trasduzione del segnale: brevi caratteristiche
generali;
2) GLUT4;
3) Trasporto e metabolismo del glucosio nel muscolo
scheletrico;
4) Trasduzione intracellulare del segnale insulinico;
5) Effetti
dell’esercizio
fisico
nella
trasduzione
intracellulare dei segnali insulinici;
6) Sistemi non insulino dipendenti in grado di potenziare il
trasporto e il metabolismo del glucosio nel muscolo
scheletrico (AMP Kinasi e MAP Kinasi) ed effetti
dell’esercizio fisico.
Conclusioni
A Primo Riccardo Bovo
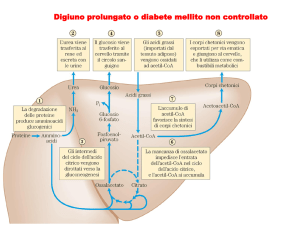
INTRODUZIONE
(Zimmet 2001, Booth 2002)
Nel libro “Oxford Textbook of Public Health” – Ed. 2002 – è scritto testualmente che
l’inattività fisica (sedentarietà) è uno dei maggiori fattori di diffusione della malattia
diabetica tipo 2 e dell’obesità. Attualmente il diabete tipo 2 colpisce dal 3 al 5% della
popolazione sia nei paesi sviluppati che di quelli in via di sviluppo. E’ noto che, in
genere, tra il manifestarsi della malattia e la sua diagnosi passano almeno 5 ÷ 10 anni.
Per questo motivo si pensa che allo stato attuale una stessa percentuale di persone
sarebbe affetta da malattia senza esserne a conoscenza. Inoltre, l’OMS informa che
nei prossimi 10 anni l’incidenza del diabete tipo 2 è destinata a raddoppiare a causa
dell’aumento percentuale dei soggetti in sovrappeso anche nei paesi in via di
sviluppo. Secondo recenti risultati ottenuti dal Finnish Diabetes Prevention Study è
stato dimostrato che il rischio di patologia diabetica può essere ridotto di ben il 58%
mediante programmi mirati che includano anche l’esercizio fisico. La malattia è
conseguente a fattori genetici con più o meno spiccate componenti ambientali ed è
spesso caratterizzata da una concentrazione plasmatica media di insulina
essenzialmente normale o anche elevata. La malattia si manifesta nella popolazione
dopo i 30 anni. Due sono, fino ad oggi, i principali fattori chiave responsabili
conosciuti: l’insulino resistenza e l’obesità. Su queste due principali cause di diabete
tipo 2 l’esercizio fisico produce degli effetti positivi importanti (riduzione della
massa adiposa, aumentata sensibilità all’insulina, ecc.). Nonostante il contributo in
senso patologico del fattore genetico, il diabete tipo 2 può essere ampiamente
prevenuto. Il genoma umano è stato evolutivamente programmato per l’esercizio
fisico. L’inattività fisica, caratteristica dello stile di vita moderno, è ampiamente
responsabile della diffusione di questo tipo di malattia. Il mancato movimento
fisiologico interagisce direttamente con il genoma determinando l’attivazione di
fattori patologici iniziali che conducono progressivamente verso la malattia
conclamata. E’ stimato che entro l’anno 2020 ci saranno nel mondo
approssimativamente circa 250 milioni di persone affette da diabete tipo 2. L’insulina
è un ormone fondamentale per regolare la quantità di zuccheri nel sangue dopo i pasti
e a digiuno. Le cellule dei pazienti diabetici sono incapaci di assorbire il glucosio,
che rimane nel sangue raggiungendo livelli pericolosi per la salute in quanto può
contribuire a glicolisare irreversibilmente alcune importanti proteine. Il diabete
determina l’incapacità dell’organismo di ossidare il glucosio. Conseguentemente sia
l’insulina che il glucosio si accumulano nel sangue. I valori glicemici normali o
patologici a digiuno sono i seguenti:
70÷115 mg/dl nei soggetti normali;
115÷140 mg/dl nei soggetti con ridotta tolleranza agli idrati di carbonio;
140 mg/dl nei pazienti diabetici.
Secondo un articolo apparso nella rivista “Nature” del 13 dicembre 2001 i dati
relativi alla diffusione nel mondo della malattia diabetica e le relative previsioni sono
i seguenti:
- anno 2000: 151 milioni (n. di persone con diabete)
- anno 2010: 221 milioni (n. di persone con diabete)
incremento 46%.
ASPETTI GENERALI
Insulina ed esercizio fisico (Marliss 2002, Zierath 2000 Shulman 2002)
L’insulina determina il metabolismo generale e l’omeostasi energetica mediante
l’interazione centrale e periferica con i recettori insulinici la cui attivazione risulta
coinvolta nella regolazione della sensibilità. Generalmente la concentrazione
dell’insulina plasmatica diminuisce in corso di esercizio fisico sia per effetto di una
aumenta eliminazione epatica sia a causa di una ridotta secrezione mediata dalla
stimolazione dei recettori alfa adrenergici cui si lega l’andrenalina a livello delle
cellule beta dell’insula pancreatica. In vitro è stato dimostrato che la captazione del
glucosio durante la contrazione avviene mediante un meccanismo insulino
indipendente e che l’insulina e la contrazione muscolare hanno effetti additivi sul
trasporto del glucosio. Bassi livelli di glicogeno limitano la prestazione sportiva per
cui diventa straordinariamente importante la resintesi di questo carboidrato dopo
l’esercizio fisico. Se nel periodo immediatamente seguente la seduta di attività fisica
non vengono introdotti i carboidrati la ricostituzione delle scorte di glicogeno è non
solo rallentata ma anche incompleta. I possibili meccanismi coinvolti nella migliorata
sensibilità dei recettori insulinici dopo esercizio fisico potrebbero essere i seguenti. In
corso di attità fisica si determina, per effetto degli ormoni catabolici (glucagone,
catecolamine, cortisolo, GH), un aumento dell’attività glicogenolitica ed una
concomitante riduzione dell’attività glicogenosintetica. Conseguentemente dopo
esercizio fisico, il basso livello di glicogeno favorisce in ultima analisi il
miglioramento della sensibilità dei recettori insulinici in quanto si determina un
aumento della captazione del glucosio, necessario per la sintesi del glicogeno, e un
aumento dell’attività dell’enzima glicogenosintetasi (GS) nella sua forma attiva
defosforilata. A riposo, gli elevati livelli di glicogeno esercitano un’azione inibitoria
sulla traslocazione delle proteine trasportatrici del glucosio (GLUT4) e sulla
glicogenosintetasi sia direttamente che indirettamente dalle molecole trasduttrici del
segnale insulinico. Dopo esercizio si verifica esattamente la situazione opposta in cui
bassi livelli di glicogeno stimolano la traslocazione delle GLUT4, la captazione del
glucosio, la trasformazione dell’UDP-glucosio in glicogeno. Quest’ultima situazione
si accompagna transitoriamente ad una inevitabile aumentata sensibilità dei recettori
insulinici. L’enzima glicogenosintetasi (GS) catalizza la reazione dell’UDP-glucosio
in glicogeno nel muscolo scheletrico. In relazione alla tappa riguardante il trasporto
di glucosio, l’attività dell’enzima GS costituisce il fattore limitante nella conversione
del glucosio in glicogeno. La GS è regolata sia da fattori allosterici (principalmente
glucosio 6-fosfato) sia da modificazioni covalenti mediante fosforilazione e
defosforilazione reversibili che determinano rispettivamente l’inattivazione o
l’attivazione
della
GS.
L’attivazione
dell’enzima
GS
avviene
attraverso
l’inattivazione della kinasi che agisce sulla GS stessa, ma anche mediante
l’attivazione delle GS fosfatasi che risulta principalmente coinvolte nelle proteine
fosfatasi I (PPI).
L’insulina e l’esercizio fisico sono due importanti regolatori fisiologici di attività
della GS, nonostante i sottostanti meccanismi non siano stati completamente
compresi. La stimolazione insulinica dell’enzima GS molto probabilmente coinvolge
la deattivazione della GSK3 e l’attivazione del PPI. Si è pensato per qualche tempo
che il glicogeno muscolare fosse un potente inibitore della GS, ma è stato evidenziato
anche che alti livelli di glicogeno possono ridurre la potenziale attività dell’insulina
di attivazione della GS. Molto recentemente, lo sviluppo di anticorpi specifici in
grado di riconoscere la fosforilazione dei siti specifici della GS hanno aggiunto
importanti informazioni riguardanti l’attività di questo enzima sia nel diabete tipo 2
che negli effetti attivati dall’esercizio fisico. L’insulina non stimola la captazione del
glucosio nel fegato, ma inibisce la glicogenolisi e la gluconeogenesi, e stimola la
glicogenosintesi regolando in questo modo il livello di glicemia a digiuno. I tessuti
cosiddetti “insulino indipendenti” quali il cervello e le cellule beta pancreatiche,
possono essere importanti nell’omeostasi del glucosio.
Insulino resistenza (Shulman 2000, Chakravarthy 2002, Kahn 2000)
L’insulino resistenza consiste in una ridotta risposta dei tessuti periferici (adiposo,
epatico, muscolare) all’azione dell’insulina che si lega con una minore affinità al suo
specifico recettore. Il muscolo scheletrico è stato indicato come il sito più importante
di resistenza all’insulina nel diabete tipo 2. I livelli di GLUT4 aumentano in seguito
all’allenamento atletico sia nei soggetti normali che nei pazienti NIDDM che vanno
incontro ad un aumento delle sensibilità del muscolo all’insulina. L’insulino
resistenza è uno dei fattori chiave responsabile dell’iperglicemia ed è la conseguenza
di numerose anormalità metaboliche associate alle malattie cardiovascolari (sindrome
da insulino resistenza anche in assenza di diabete conclamato). I meccanismi
coinvolti nell’insulino resistenza sono multifattoriali e solo parzialmente compresi.
Fra questi risulta particolarmente importante l’aumentata disponibilità degli acidi
grassi (sFFA) per i danni da questi provocati a livello del sistema muscolare. Il ruolo
degli sFFA nel diabete tipo 2 è particolarmente evidente nei soggetti obesi che hanno
diverse anormalità del metabolismo lipidico. L’esercizio fisico tramite l’aumentata
captazione del glucosio ematico può contribuire nei soggetti con insulino resistenza a
migliorare l’omeostasi glicemica. L’insulino resistenza è un aspetto fondamentale
nell’eziologia del diabete tipo 2 ed è anche legata, tramite meccanismi diversi
all’ipertensione, all’iperlipemia, all’aterosclerosi, alla policisti dell’ovaio. L’insulino
resistenza nell’obesità è manifestata da un diminuito trasporto e metabolismo del
glucosio negli adipociti o nel muscolo e da una peggiorata soppressione della
produzione epatica di glucosio. Anche se le cause primarie del diabete tipo 2 sono
tuttora sconosciute, l’insulino resistenza è comunque uno dei principali fattori nello
sviluppo di questa malattia. L’insulino resistenza non è più la causa ma è l’effetto (es.
di un deficit della sintesi del glicogeno a livello muscolare) e consiste essenzialmente
in un difetto nella trasduzione del segnale in un punto della catena che va dal
recettore fino alla parte terminale della sequenza di reazioni che determina i vari
effetti metabolici. La combinazione di parecchi effetti associati risultano in un debole
segnale di trasduzione, insufficiente a generare una risposta totale di assunzione di
glucosio. Il sistema muscolare è il principale tessuto responsabile dell’insulino
resistenza . Il muscolo scheletrico è stato indicato come il sito più importante di
resistenza all’insulina, (fibre rosse o aerobiche in particolare) nel diabete tipo 2. Fra i
fattori che contribuiscono all’insulino resistenza vi è anche il cambiamento
energetico inteso come rapporto fra ATP ed il prodotto ADP libero e fosfato
inorganico: APT/ADP libero + Pi libero. Recenti dati ottenuti da vari gruppi di
pazienti hanno evidenziato un nuovo meccanismo di insulino resistenza: un diminuito
effetto dell’insulina nello stimolo del flusso ematico. Sono state evidenziate alcune
ricerche in cui il meccanismo opposto può elevare l’insulino sensibilità negli
individui allenati aerobicamente. Alcuni ricercatori hanno dimostrato l’esistenza di
recettori insulinici nell’endotelio vascolare dei muscoli scheletrici. Questo può
significare che la maggior densità dei capillari nei muscoli allenati può migliorare
l’azione insulinica nei soggetti attivi che, ovviamente, hanno una frazione
significativa di fibre lente (ossidative) nei muscoli sottoposti ad esercizio. Alcuni
studi hanno dimostrato che questo profilo si accompagna a uno stato di migliore
insulino sensibilità.
FATTORI PRERECETTORIALI, RECETTORIALI (GENETICI) E
POSTRECETTORIALI (INTRACELLULARI) NELLO SVILUPPO
DELL’ INSULINO RESISTENZA
(Zierath 2000)
Lo stato di insulina resistenza si determina da una profonda disregolazione delle
azioni metaboliche intracellulari dell’insulina nei tessuti insulino dipendenti
(stimolazione della glicogenosintesi, lipogenesi e proteino sintesi, inibizione della
lipolisi, glicogenolisi, proteolisi, ecc). L’insulino resistenza è una condizione tipica
nello sviluppo del diabete tipo 2, così come nell’obesità e in altre condizioni
patologiche. In essa possiamo distinguere fattori prerecettoriali, recettoriali (difetti
genetici) e postrecettoriali (intracellulari) in grado di determinare lo sviluppo di
insulino sensibilità. L’insulino resistenza nell’obesità e nel diabete tipo 2 è
caratterizzata da difetti a molti livelli in cui è possibile constatare una diminuita
concentrazione dei recettori insulinici e della loro rispettiva attività chinasica, una
diminuita concentrazione e fosforilazione degli IRSs, una diminuzione dell’attività
della PI 3-Kinasi, una diminuita traslocazione delle proteine GLUT4 coinvolte nel
trasporto del glucosio, una diminuita attività degli enzimi intracellulari, ecc. Nei
soggetti allenati si osserva una riduzione della secrezione di insulina che è
espressione di una maggiore sensibilità dei tessuti all’ormone e quindi, in termini
pratici significa minor probabilità di sviluppare uno stato di insulino resistenza.
Fattori prerecettoriali
TNF alfa (Steensberg 2001, Saltiel 2001)
Serve a limitare l’espansione della massa adiposa. E’ prodotto dagli adipociti e dalle
cellule infiammatorie e svolge un ruolo importante nell’insorgenza dell’insulino
resistenza e dell’aterogenesi. La sua produzione è inibita dall’interleukina 6 (IL-6),
che è una citochina prodotta in corso di esercizio dai muscoli coinvolti nella
contrazione in quantità correlata all’intensità e alla durata dello sforzo e dal livello
endomuscolare di glicogeno. Bassi livelli di glicogeno favoriscono la produzione di
IL-6 che ha diversi effetti: a livello del tessuto adiposo favorisce la lipolisi dei
trigliceridi e inibisce la produzione di TNF alfa che ha un ruolo patogenetico
nell’insorgenza dello stato di insulino resistenza e a livello epatico favorisce la
glicogenolisi. La sintesi di TNF alfa è aumentata negli adipociti dei soggetti obesi ed
è il responsabile della fosforilazione della serina degli IRS-1, determinando in questo
modo una riduzione dell’attività dei recettori tirosina-chinasici e quindi dello stato di
insulino resistenza. Nei roditori, reagenti anti TNF alfa migliorano significativamente
l’insulino resistenza; nell’uomo alcuni limitati studi hanno invece documentato che
questo meccanismo non produce nessun o scarsi effetti sull’insulino resistenza. Il
TNF alfa aumenta inoltre la degradazione delle sfingomieline la cui concentrazione
risulta correlata positivamente con l’obesità.
Adiponectina (Acrp30) (Berg 2001, Saltiel 2001)
Sono stati identificati un cospicuo numero di fattori coinvolti nel metabolismo
energetico che sono espressi esclusivamente o in forma predominante e rilasciati dal
tessuto adiposo. L’Acrp30 è uno di questi fattori che risulta coinvolto nel controllo
sistemico dell’insulino sensibilità ed è costituito da una proteina di 247 aminoacidi.
Recentemente è stato osservato che elevando farmacologicamente i livelli di Acrp30
si determina un transitorio abbassamento dei livelli glicemici, mentre nei soggetti
obesi e diabetici di tipo 2 sono stati evidenziati bassi livelli plasmatici di adiponectina
indicando in questo modo una correlazione con l’insulino resistenza. Questo effetto
viene principalmente ottenuto attraverso una riduzione del rilascio del glucosio da
parte del fegato in conseguenza di una migliorata insulino sensibilità. In laboratorio
sono stati prodotti modelli che si basano su roditori che esprimono elevati livelli di
Acrp30 tre o quattro volte superiori ai livelli normali che risultano caratterizzati da
una notevole sensibilità dei recettori insulinici, da un diminuito livello plasmatico
degli FFAs, da una ridotta quantità di trigliceridi nei muscoli e nel fegato e da una
aumentata espressione dei geni coinvolti nell’ossidazione degli acidi grassi e nella
spesa energetica. Questi tipo di studi dimostrano il coinvolgimento diretto e indiretto
dell’Acrp30 nel metabolismo dei carboidrati e dei lipidi e quindi sulla sensibilità
insulinica. Per quanta riguarda gli effetti dell’esercizio fisico non accompagnato a
riduzione di peso non sono state osservate modificazioni significative dei livelli
plasmatici di adiponectina in contraddizione con un paio di abstracts presentati a San
Francisco (USA) nella Diabetes Conference 2002 in cui invece si mette in evidenza
che l’attività fisica determina un incremento di questa proteina.
Obesità (Khan 2000, Booth 2002)
Un soggetto viene considerato obeso quanto il suo peso corporeo supera del 20%
rispetto a quello raccomandato per una data altezza. L’obesità consiste in una
espansione della massa adiposa oltre i limiti fisiologici causando, molto spesso (80%
dei casi), uno stato di insulino resistenza i cui meccanismi non sono ancora ben
chiari. La prevalenza di diabete è circa tre volte maggiore nelle persone obese.
L’insulino resistenza è la conseguente iperinsulinemia, oltre ad essere causate
dall’obesità, possono contribuire esse stesse allo sviluppo eccessivo della massa
adiposa. La funzione degli adipociti può essere considerata anche come ghiandola
endocrina, con ampi effetti in altri organi incluso il cervello. Il rilascio di una
notevole quantità di molecole che includono ormoni quali la leptina, le citochine
come il TNF alfa, e i substrati quali gli FFA permettono al tessuto adiposo di avere
un ruolo fondamentale nel bilancio energetico dell’organismo e nell’omeostasi
glucidica. Le sfingomieline (ceramide) risultano positivamente correlate all’obesità.
L’adiponectina (acrp30) è un fattore rilasciato dal tessuto adiposo che ha
un’importante funzione nel metabolismo energetico ed è coinvolta nel controllo della
sensibilità sistemica dell’insulina. Un aumento farmacologico di questo fattore ha
dimostrato un ridotto livello glicemico da diminuito rilascio epatico di glucosio in
conseguenza della migliorata sensibilità all’insulina. L’ossidazione degli FFA non
solo provvede a fornire energia ai tessuti, ma implica anche una ridotta utilizzazione
del glucosio. Questo effetto regolatore degli FFA è conosciuto come ciclo glucosioacidi grassi. L’obesità può essere parzialmente spiegata come iperfagia e ridotta
attività fisica che determinano un bilancio energetico positivo con deposito di energia
chimica sotto forma di trigliceridi nell’organismo. Il tessuto adiposo è l’organo più
importante per il deposito dei lipidi. Miglioramenti metabolici associati ad una
riduzione della massa adiposa includono dei cambiamenti riguardanti il metabolismo
dei carboidrati e dei lipidi che possono ridurre il rischio di sviluppare malattie quali il
diabete e le patologie cardiovascolari generalmente associate ad una obesità
distrettuale localizza a livello dell’addome (obesità viscerale). L’obesità viscerale in
particolare interagisce con l’inattività fisica incrementando in questo modo il rischio
di malattia coronarica e di diabete tipo 2, che è un altro fattore di rischio indipendente
di malattia delle coronarie. Secondo alcuni recenti studi, l’obesità si associa ad un
peggioramento del sistema di trasferimento interno del segnale insulinico
determinando nell’adipocita una diminuita attività del trasduttore IRS-1, che
contribuisce ovviamente allo sviluppo di insulino resistenza. Da sottolineare un
paradosso molto importante. Sia l’eccesso che l’assenza di tessuto adiposo causano
insulino resistenza mettendo in evidenza la complessità di questa correlazione. Il
tessuto adiposo, considerato oggi come un organo endocrino, svolge funzioni
complesse (vedi es. secrezione della leptina ed effetti multipli da essa prodotti, ecc.).
Conoscenze scientifiche prodotte nell’ultimo decennio hanno evidenziato importanti
aspetti biologici degli adipociti che come ghiandola endocrina finiscono per produrre
i loro effetti in altri organi, in particolare a livello del sistema nervoso centrale. Il
rilascio di una varietà di sostanze quali la leptina, il TNF alfa e substrati quali gli
FFAs permettono al tessuto adiposo di svolgere un ruolo importante nell’omeostasi
del glucosio e nel bilancio energetico del soggetto. Nella opulenta società moderna,
l’obesità ha raggiunto proporzioni epidemiche per cui si rende necessario, ai fini della
prevenzione delle patologie ad essa associate, spostare l’equazione relativa
all’assunzione ed utilizzazione energetica verso una ridotta scorta lipidica offrendo in
questo una grande opportunità di modificare positivamente il decorso della patologia
umana. In corso di esercizio fisico, specialmente di bassa o moderata intensità il
tessuto adiposo provvede a fornire una parte considerevole di substrati al muscolo
scheletrico (30÷90%). Durante l’attività fisica di moderata intensità la lipolisi nel
tessuto adiposo aumenta di due o tre volte rispetto al valore basale. Inoltre, la
percentuale di acidi grassi riesterificati nel tessuto adiposo diminuisce e
conseguentemente un’aumentata quantità di acidi grassi vengono forniti ai muscoli in
attività. I principali stimolatori della lipolisi in corso di esercizio fisico sono costituiti
da un aumento dell’attività del sistema nervoso simpatico adrenergico e da una
diminuzione della concentrazione di insulina. Alcuni studi inoltre dimostrano che la
sensibilità del tessuto adiposo alla risposta adrenergica aumenta nel corso di una
singola seduta di esercizio fisico. I soggetti allenati, in corso di esercizio, ossidano
una maggiore quantità di acidi grassi rispetti ai soggetti sedentari. Gli effetti
dell’allenamento sull’attività dell’enzima lipasi ormono sensibile (HSL), che
costituisce il fattore limitante nella lipolisi, ha effetti contrastanti in quanto sono stati
evidenziati aspetti che determinano un aumento e una diminuzione di attività. Studi
scientifici documentano che la lipolisi nel tessuto adiposo da soppressione insulinica
è più sensibile nei soggetti allenati rispetto ai sedentari. Gli FFAs sono prodotti
durante la lipolisi dei trigliceridi in molti tessuti e fino a tempi recenti non è stato
possibile valutare direttamente in corso di esercizio fisico il ruolo relativo dei vari
depositi. La quantità delle scorte del tessuto adiposo intraddominale si correla
direttamente con l’insulino resistenza ed è considerata un fattore importante nello
sviluppo del diabete tipo 2, dell’iperlipemia e dell’ipertensione arteriosa.
L’ossidazione generale degli acidi grassi aumenta in risposta all’esercizio e raggiunge
il suo picco massimo a circa il 60% della VO2 max. Inoltre, l’ossidazione lipidica
aumenta con la durata dell’esercizio caratterizzato da moderata intensità. L’esercizio
incrementa lipolisi sia nel tessuto adiposo sia nei muscoli coinvolti nella contrazione,
mentre gli FFA plasmatici derivanti dai trigliceridi contribuiscono nel periodo
postprandiale solo molto parzialmente al metabolismo dell’esercizio.
Leptina (Zaccaria 2002; Gabriely 2002, Nindl 2002, Saltiel 2001)
La concentrazione serica di leptina è ridotta in presenza di un bilancio energetico
negativo. La leptina è una proteina scoperta nel 1994 che è espressa e prodotta dal
tessuto adiposo ed ha la funzione di controllare l’assunzione degli alimenti mediante
l’attivazione di segnali di sazietà a livello ipotalamico (neuropeptide Y), che è il
centro di controllo dell’appetito nel cervello. In condizione di equilibrio energetico la
leptina è considerata un buon indice della quantità di grasso depositata
nell’organismo, mentre in condizioni di sbilancio la leptina non può più essere
considerata un marker fedele della quantità di energia chimica di tipo lipidico
presente in un determinato soggetto. Infatti, nel digiuno prolungato caratterizzato da
un bilancio energetico negativo la concentrazione di leptina è diminuita, mentre nella
sovralimentazione in cui si determina un bilancio energetico positivo il livello di
leptina è aumentato. Solo l’esercizio fisico estremo che determina un elevato
dispendio energetico è in grado di ridurre la concentrazione di leptina. I risultati
contradditori sulle risposte della leptina ai vari tipi di esercizi potrebbero essere
spiegati sulla base delle differenti procedure sperimentali (es. protocolli di esercizi,
dieta prima e durante esercizio fisico, ritmi circadiani). Il digiuno prolungato provoca
una caduta della leptina a partire dalla 12a ora. La somministrazione cronica di leptina
fa diminuire l’assunzione di cibo determinando conseguentemente una riduzione
della massa adiposa in particolare a livello viscerale, con un parallelo significativo
miglioramento dell’azione dell’insulina a livello epatico e periferico. La leptina dal
p.v. molecolare è un peptide di 16-K prodotto dagli adipociti che può modulare molte
alterazioni
metaboliche
associate
ai
processi
di
invecchiamento
(obesità,
cambiamento della distribuzione adiposa, insulino resistenza). La somministrazione
cronica di leptina fa diluire l’assunzione cibo e induce una riduzione della massa
adiposa a livello viscerale con un parallelo significativo incremento dell’azione
epatica e periferica dell’insulina. Le azioni principali della leptina riguardano il
controllo dell’assunzione alimentare, la massa adiposa e la sua espressione genica a
livello degli adipociti. La leptina comunica lo stato delle scorte energetiche
dell’organismo al SNC. L’invecchiamento e l’obesità determinano uno stato di
leptino resistenza con conseguente aumento del livello plasmatico della leptina stessa.
I soggetti obesi presentano alte concentrazioni di leptina nel tentativo di ridurre
l’introduzione calorica alimentare e di aumentare la termogenesi, entrambi
meccanismi fisiologici di rimozione dell’energia chimica. La leptina funziona non
solo come segnale di sazietà e di soppressione dell’appetito, ma anche tramite i suoi
recettori presenti nelle cellule e nei vasi di recente formazione interviene nel
modulare l’attività immunologia ed emodinamica. Con l’invecchiamento aumentano i
livelli plasmatici di leptina che determinano uno stato di resistenza all’azione della
stessa leptina e possono spiegare perché le persone anziane presentano un’obesità di
tipo addominale accompagnata spesso da insulino resistenza.
Amilina (Kraemer 2002)
L’amilina è un ormone polipeptidico di 37 aminoacidi cosecreto con l’insulina dalle
cellule beta pancreatiche delle Isole del Langherhans in risposta agli stimoli
alimentari. Esercita la sua azione sul controllo glicemico post prandiale
essenzialmente traimite i seguenti meccanismi:
a) soppressione della secrezione di glucagone che è uno dei più potenti stimoli della
glicogenesi a livello epatico;
b) modulazione della disponibilità dei nutrienti nel transito stomaco-duodeno;
c) riduzione di assunzione di cibo mediante stimolazione dei rispettivi recettori ad
alta densità localizzati nel SNC la cui stimolazione è in grado di anticipare il senso
di sazietà e quindi di limitare l’assunzione di cibo e la relativa introduzione
calorica. Nei pazienti diabetici tipo 2 il deficit parziale di amilina, che tende ad
accumularsi al di fuori della cellula beta assumendo le caratteristiche tintoriali
dell’amilodie, contribuisce a determinare uno sbilanciamento glicemico dovuto ad
un alterato rapporto fra entrata ed uscita di glucosio. Protocolli di esercizio fisico
intermittente di moderata e media intensità hanno dimostrato degli importanti
aumenti plasmatici di amilina.
Bilancio energetico (Khan 2000)
Ci sono evidenze scientifiche che incriminano il bilancio energetico positivo
derivante da un eccesso di assunzione calorica alimentare oppure da un ridotto
dispendio energetico da inattività quale fattore centrale nello sviluppo dell’insulino
resistenza e nella patogenesi di molte altre malattie metaboliche. Con
l’invecchiamento si verifica una graduale riduzione del metabolismo basale, non
accompagnato molto spesso da una proporzionale riduzione dell’assunzione dei
nutrienti alimentari. Il tessuto adiposo, considerato oggi come un organo endocrino,
riveste un ruolo fondamentale in grado di dire che cosa fare ad altri organi che si
occupano di accumulare energia. L’effetto dell’allenamento nel mantenimento di un
equilibrato bilancio energetico è un importante aspetto nella prevenzione del diabete
tipo 2, così come di altri tipi di patologie.
SFFA (Shulman 2000, Saltiel 2001, Sihna 2002)
Gli FFA sono mobilizzati dal tessuto adiposo e vengono ossidati dal muscolo e dagli
altri tessuti dell’organismo.Viaggiano nel plasma trasportati dall’albumina la cui
concentrazione esercita un ruolo parziale nel controllo dell’ossidazione lipidica nel
muscolo. Non solo, l’ossidazione degli FFA esercita entro determinate condizioni
anche un controllo sul tasso di utilizzazione ed ossidazione del glucosio. Il ciclo
glucosio-acidi grassi ha quindi un ruolo nell’insulino resistenza e nel disturbo
metabolico ad esso associato. L’ossidazione degli FFA può inibire l’utilizzazione del
glucosio e del glicogeno. L’allenamento determina la capacità di indurre una
aumentata rimozione dei TG dal circolo. Una notevole percentuale dei grassi ossidati
durante l’esercizio è di provenienza intramuscolare. Molti dei rimanenti grassi
ossidati provengono dagli FFA originati dal tessuto adiposo. Ci sono molte evidenze
scientifiche nelle quali si dimostra che gli FFA vengono captati dal muscolo tramite
la mediazione di uno specifico sistema di trasporto. A causa della scarsa solubilità, il
99% degli FFA si trova nel plasma legato all’albumina che manifesta un’alta affinità
per questo tipo di lipide. In condizioni di iperlipemia un’alta percentuale del flusso
totale di FFA avviene tramite la via della diffusione passiva. La sostituzione
alimentare degli acidi grassi saturi con gli insaturi determina un minore accumulo di
tessuto adiposo a livello addominale e conseguentemente migliora l’insulina
sensibilità. Quando gli acidi grassi nei muscoli e nel fegato non sono sufficientemente
utilizzati, il loro accumulo non solo impedisce all’organismo di consumare calorie ma
può portare all’insulino resistenza, che aumenta il rischio di sviluppare diabete.
Elevati livelli di FFA sono caratteristiche di obesità, insulino resistenza e diabete tipo
2. L’insulino resistenza è uno dei maggiori fattori nella patogenesi del diabete tipo 2 e
recenti studi hanno dimostrato una forte correlazione fra l’aumento della
concentrazione plasmatica degli acidi grassi e molti stati di insulino resistenza, fra cui
il diabete tipo 2 e l’obesità. E’ stata osservato, anche a digiuno, una correlazione
inversa fra concentrazione degli acidi grassi e insulino sensibilità, supportanto
l’ipotesi che un alterato metabolismo lipidico può contribuire a determinare un
ulteriore stato di insulino resistenza nei pazienti diabetici. Inoltre, alcuni recenti studi
effettuati tramite biopsia muscolare o tramite NMR hanno dimostrato una forte
correlazione fra accumulo intracitoplasmatico di trigliceridi nella cellula muscolare e
insulino resistenza. Sembra che il meccanismo tramite il quale gli FFA inducono
insulino resistenza sia costituito da una maggiore proporzione di acidi grassi saturi
dei fosfolipidi di membrana e dalla quantità e saturazione degli acidi grassi
intramiocellulari.
Infatti,
gli
acidi
grassi
saturi,
quali
l’acido
palmitico,
specificatamente inibiscono l’attivazione della PKB e conseguentemente anche la
captazione cellulare del glucosio mediata dall’insulina e la capacità di sintesi del
glicogeno. L’attività fisica determina l’attivazione del catabolismo generale
inducendo quindi un incremento della lipolisi nono solo nel tessuto adiposo ma anche
a livello muscolare. Per un certo periodo di tempo si è pensato che il principale
meccanismo coinvolto nella lipolisi intramuscoalre fosse determinato dalla
lipoproteina lipasi intracellulare. Comunque, questo enzima è sintetizzato come una
proteina secretoria e non ha un appropriato ottimo pH. Queste caratteristiche non
sono applicabili alla lipasi ormono sensibile del tessuto adiposo, che recentemente è
stata trovata anche nel muscolo. La lipasi ormono sensibile nel muscolo può essere
simultaneamente fosforilata e attivata dalla proteina kinasi cAMP dipendente. La
degradazione dei trigliceridi e del glicogeno nel muscolo può essere regolata da
enzimi, rispettivamente lipasi ormono sensibile e glicogeno fosforilasi, che sono
attivati in parallelo e sotto il duplice controllo del calcio e degli ormoni. Ci sono
infatti evidenze scientifiche che dimostrano l’attivazione simultanea, nel muscolo,
della lipoproteina lipasi (LPL) e della lipasi ormono sensibile. La cellula adiposa è
importante nella regolazione metabolica generale quanto rilasciando gli FFAs riduce
la captazione del glucosio da parte del muscolo, la secrezione insulinica delle cellule
beta e aumenta il rilascio ematico del glucosio da parte del fegato. La cellula adiposa
secerne anche le “adipokine” quali ad esempio la leptina, l’adiponectina e il TNF,
che regolano l’assunzione di cibo, la spesa energetica e l’insulino sensibilità.
Fattori recettoriali
Recettore per l’insulina (Gomperts 2002)
Il recettore per l’insulina è una glicoproteina costituita da due subunità alfa
completamente extracellulari che legano l’insulina e da due subunità beta che
possiedono attività tirosina chinasica. Dopo il legame con l’insulina, a seguito
probabilmente di un cambiamento conformazionale fra unità alfa e unità beta che si
propaga attraverso la membrana cellulare, si determina un processo di
autofosforilazione dei due specifici residui Tyr localizzati sul lato citoplasmatico
delle due subunità beta (regione protein chinasica). La reazione catalizzata
dall’enzima proteina tiroxina chinasi (PTK) è la seguente:
residuo Tyr + ATP → TyrP + ADP
A seguito di questa attivazione molte proteine chiave intracellulari vengono
fosforilate da una serie di reazioni a catena la cui sequenza è la seguente: IRS-1
(substrato recettore insulico-1), PI3-Kinasi (fosfatidilinositolo - 3 Kinasi, classe IA),
PIP2 (fosfatidilinositolo difosfato), PIP3 (fosfatidilinositolo trifosfato), PKB
(proteina kinasi B), PKC (proteina Kinasi C).
La fosforilazione di queste proteine è essenziale per la determinazione cellulare
dell’insulina sui seguenti eventi biologici:
a) stimolazione della trascrizione o repressione dei geni del DNA a livello del
nucleo;
b) stimolazione della sintesi proteica;
c) stimolazione intracellulare dei processi anabolici e inibizione di quelli catabolici
(carboidrati, lipidi, proteine);
d) traslocazione delle unità di trasporto del glucosio dal citoplasma alla membrana
cellulare e tubuli a T.
Questo recettori possono essere geneticamente difettosi e determinare quindi insulino
resistenza. Fattori genetici e acquisiti possono profondamente influenzare la
sensibilità dei recettori insulinici. Difetti genetici dei recettori insulinici sono
piuttosto rari, ma rappresentano la forma più severa di insulino resistenza.
Fattori postrecettoriali (intracellulari)
(Lodish 2000, Gomperts 2002)
Recettori e trasduzione del segnale: brevi caratteristiche generali
L’informazione nei sistemi biologici viene trasferita mediante segnali e recettori
aventi affinità chimico o fisica. I segnali sono solitamente di tipo molecolare (es.
insulina, ecc), ma possono anche essere di tipo non molecolare (es. luce, suoni, onde
elettromagnetiche, variazione di potenziale elettrico di membrana). I recettori sono
complessi proteici o glicoproteici la cui funzione primaria consiste nel raccogliere e
trasmettere l’informazione biologica proveniente da altre molecole chimiche. Essi
possono essere localizzati sulle membrane delle cellule bersaglio che si legano con
molecole di natura proteica non in grado di attraversare la membrana cellulare (es.
insulina), e recettori intracellulari che si legano invece a molecole di natura lipidica in
grado di attraversare la membrana plasmatica grazie alle loro caratteristiche di
idrofobicità (es. ormoni steroidei, ecc..). I recettori di membrana per funzionare
necessitano di un trasduttore, detto anche secondo messaggero, che trasferisce il
segnale dalle membrana ai sistemi che devono essere attivati dentro la cellula
(effettori biologici). Essi sono molto importanti in quanto possono intervenire nella
modulazione dell’informazione sia in senso qualitativo che quantitativo. I trasduttori
del segnale consentono di amplificare enormemente l’azione di ogni singolo recettore
attivato, ma sono possibili anche effetti di retroazione inibitoria, che nel caso
specifico dei recettori insulinici può portare allo sviluppo di insulino resistenza. In
condizioni fisiologiche normali, a seguito del legame insulina recettore si attiva una
proteina chinasi che, tramite la fosforilazione di proteine, innesca l’attivazione di una
serie di funzioni biologiche ma nello stesso tempo, però, il recettore stesso viene
fosforilato in una preciso sito aminoacidico con conseguente disattivazione della sua
funzione (meccanismo di feed-back negativo). Questo significa perdita di affinità di
legame fra recettore e l’insulina, cioè sviluppo di insulino resistenza che è la causa
principale preliminare essenziale che precede diverse importanti patologie
metaboliche fra cui il diabete tipo 2.
GLUT4 (Booth 2002, Zierath 2002)
L’insulina è un’importante molecola segnale che aumenta il trasporto di glucosio nel
tessuto adiposo e nel muscolo mediante la stimolazione della traslocazione delle
proteine GLUT4 dai siti intracellulari alla membrana plasmatica. Le GLUT4 si
trovano in vescicole che continuamente si trasferiscono dai depositi intracellulari alla
membrana plasmatica. L’insulina aumenta il trasporto transmembrana del glucosio
aumentando l’esocitosi delle vescicole contenenti GLUT4. Recenti evidenze
scientifiche dimostrano che queste vescicole si muovono fino ad agganciarsi e a
fondersi con la membrana plasmatica. Anche questi processi si effettuano comunque
sempre sotto il controllo insulinico. La quantità di GLUT4 proteine è il fattore
primario che determina il massimo tasso di glucosio che può essere trasportato
all’interno della cellula muscolare. Perciò è importante capire come l’esercizio fisico
regola l’espressione del GLUT4. La capacità di trasporto del glucosio attraverso la
membrana cellulare dipende, nel muscolo scheletrico, principalmente dall’insulina e
dalla contrazione muscolare in cui il contenuto di glicogeno ha un importante ruolo
regolativo. La cascata tradizionale di reazioni riguardano la PI-3 kinasi e la PKB
quali enzimi chiave, ma altri trasduttori alternativi comprendono la proteina kinasi C.
Le GLUT4 costituiscono nel tessuto adiposo un elemento chiave nel trasporto dello
zucchero. Normalmente, l’insulina stimola i muscoli e le cellule adipose a traslocare
le GLUT4 verso la membrana cellulare, per far iniziare il trasporto di glucosio
attraverso il doppio strato di fosfolipidi ad esso impermeabile verso l’interno della
cellula dove viene trasformato in carboidrati complessi e grasso oppure ossidato. La
riduzione delle GLUT4 nelle cellule adipose va considerata come un importante
fattore di rischio nello sviluppo della resistenza insulinica che costituisce il primo
passo verso la patologia diabetica. Le GLUT4 nel muscolo scheletrico sono il
maggior trasportatore di glucosio. In contrasto con gli altri trasportatori di glucosio
che costitutivamente risiedono nella membrana cellulare, le GLUT4 fanno da shuttle
fra la il citoplasma e la membrana cellulare. In condizioni basali la distribuzione delle
vescicole delle GLUT4 è prevalentemente intracellulare. A seguito della stimolazione
mediata dall’insulina, oppure dalla contrazione muscolare, si verifica una
ridistribuzione delle GLUT4 per cui nel giro di qualche minuto una larga frazione di
esse si trova sulla superficie della membrana cellulare o sui tuboli a T. Le GLUT4
sono costituite da un polipeptide composto da 509 aminoacidi che è codificato da un
gene localizzato nel cromosoma 17. Queste proteine trasportatrici sono presenti ad
elevati livelli nei tessuti insulino dipendenti quali il muscolo scheletrico e il tessuto
adiposo. L’esercizio fisico determina un incremento di captazione di glucosio da
parte del muscolo scheletrico. La contrazione muscolare induce un aumento della
sensibilità e dell’azione insulinica. Il meccanismo dell’aumentata captazione di
glucosio durante e dopo esercizio non è attualmente ben conosciuto. I fattori che
potrebbero essere coinvolti comprendono il MAF (muscolar activity factors), un
aumento del flusso sanguigno nei muscoli sottoposti ad esercizio, un aumento del
legame dell’insulina e cambiamenti nella concentrazione citoplasmatica del calcio.
Poiché nel muscolo il trasporto del glucosio è il fattore che più limita l’ossidazione
del glucosio stesso, la regolazione di questo sistema gioca un ruolo fondamentale nel
corso dell’esercizio. Recentemente, molti studi hanno dimostrato che una singola
seduta di esercizio fisico può aumentare il numero e l’attività intrinseca delle proteine
trasportatrici di glucosio presenti nella membrana plasmatica delle cellule muscolari
(effetti acuti dell’esercizio). L’allenamento determina come effetto un aumento
dell’abilità dell’insulina di stimolare la captazione di glucosio nei tessuti insulino
dipendenti (muscolo, tessuto adiposo). Nel muscolo scheletrico, le proteine GLUT4
costituiscono il sistema di trasporto del glucosio più rilevante. Le proteina GLUT4
sono traslocate da una localizzazione intracellulare, quale ad esempio i microsomi a
bassa intensità, alla membrana plasmatica con la quale si fonde per rilasciare le
proteine coinvolte nel trasporto del glucosio dall’esterno verso il citoplasma. Le
GLUT4 sono distribuite nel muscolo scheletrico, nel tessuto adiposo bruno e bianco e
nel muscolo cardiaco. Nel muscolo le GLUT 4 potenziano il trasporto transmenbrana
del glucosio sia per effetto mediato dall’insulina (legame recettore insulina, IRS-1, PI
3-Kinasi, stimolazione traslocazione GLUT4) sia per effetto derivante dalla
contrazione muscolare. IRS-1 e PI 3-Kinasi sono componenti essenziali per la
stimolazione dell’insulina delle GLUT4 nel muscolo scheletrico e non costituiscono
parte del meccanismo tramite il quale l’esercizio fisico, cioè la contrazione
muscolare, stimola la traslocazione delle GLUT4. La traslocazione è comunque solo
la prima tappa del movimento delle GLUT4 dal pool vescicolare del citoplasma. Le
altre tappe comprendono l’aggangio (docking) e la fusione delle GLUT4 con la
membrana plasmatica, cui segue l’internalizzazione e l’endocitosi da parte del pool
vescicolare. Difetti del movimento delle GLUT4 possono contribuire a peggiorare lo
stato di insulino resistenza nel muscolo a causa di una parziale insufficienza delle
GLUT4 di traslocare, di agganciarsi e di fondersi con la membrana plasmatica.
Trasporto e metabolismo del glucosio nel muscolo scheletrico (Zierath 2002)
Il trasporto del glucosio, nel muscolo scheletrico, può essere attivato da 2 vie
indipendenti: la via mediata dal legame insulina recettore e la via mediata dalla
contrazione muscolare (quest’ultima è costituita da due sistemi di attivazione
AMPKinasi e MAP kinasi). Il muscolo scheletrico è quantitativamente il più
importante tessuto coinvolto nel mantenimento dell’omeostasi glucidica; capta circa
l’80% del glucosio disponibile in seguito all’ingestione dello stesso. Sono state
fornite prove dirette che dimostrano che deficit nel trasporto del glucosio e nella
traslocazione delle proteine GLUT4 sono responsabili diretti dell’insulino resistenza.
Le GLUT4 sono essenziali non solo per lo stimolo dell’insulina, ma anche per
l’ipossia/esercizio (contrazione). Il livello di attività fisica è legato al miglioramento
dell’omeostasi glicemica. L’allenamento ha effetti multipli sul metabolismo del
glucosio e sull’espressione genica a livello muscolare. L’espressione di tutte le
proteine di trasporto è maggiore nelle fibre ossidative rispetto a quelle glicolitiche .
Questo potrebbe significare che i muscoli con prevalente metabolismo aerobico sono
più colpiti dalle malattie metaboliche quali ad esempio il diabete.
Trasduzione intracellulare del segnale insulinico (Pessin 2000, Lodish 2000, Zierath
2002)
L’insulino resistenza si può determinare a causa di difetti nei meccanismi
intracellulari di trasduzione del segnale dalla membrana cellulare verso l’interno della
cellula. Al riguardo è essenziale illustrare i meccanismi che operano internamente
alla cellula tenuto conto che il muscolo, in caso di insulino insensibilità, è il tessuto
che più di ogni altro contribuisce allo sviluppo dell’insulino resistenza di carattere
generale.
Sistema insulino dipendente
A livello muscolare, così come negli altri tessuti insulino dipendenti, il glucosio per
attraversare la rispettiva membrana cellulare bisogna che l’insulina si leghi al suo
rispettivo recettore. Questo è costituito da una glicoproteina in cui sono presenti due
subunità alfa rivolte verso la parte esterna della cellula e due subunità beta rivolte
invece verso il citosol, cioè la parte interna, tenute insieme da due ponti disulfurici.
L’insulina, legandosi alla parte esterna del recettore, cioè alle componenti alfa,
determina una variazione conformazionale del recettore a livello delle due subunità
beta con conseguente attivazione del recettore tirosina-chinasi localizzato nelle due
subunità beta (auotofosforilazione). In questi ultimi anni sono stati fatti studi
importanti per identificare gli eventi postrecettoriali in grado di attivare le azioni
biologiche finali che caratterizzano il metabolismo intracellulare dell’insulina. Tali
reazioni riguardano l’attivazione dei substrati insulinici 1 e 2 (IRS 1 e 2 ), della
fosfatidilinositolo 3 Kinasi (PI 3-Kinasi), della proteina kinasi B (PKB) e C (PKC),
del fosfatidilinositolo difosfato (PI2) e fosfatidilinositolo trifosfato (PI3).
Substrati recettore insulina (IRS1 e 2)
La trasduzione intracellulare del segnale insulinico consiste in una serie di eventi
complessi che coinvolgono effettori di natura proteica che regolano le diverse
risposte cellulari. La via della trasduzione del segnale insulinico non è
necessariamente lineare in quanto c’è un alto grado di reciproca influenza fra i
trasduttori di segnali. L’IRS1 e 2 che si attivano immediatamente dopo il legame
insulina recettore si fanno da tramite fra lo stesso recettore e gli eventi molecolari a
cascata finalizzati ad attivare le varie risposte metaboliche (azioni intracellulari
dell’insulina). Le molecole costitutive degli IRS contengono numerosi siti tirosinici
che diventano fosforilati dopo stimolazione insulinica giocando un ruolo selettivo
nella regolazione della risposta metabolica nei tessuti insulino dipendenti (fegato,
muscolo, tessuto adiposo).
Fosfatidilinositolo 3 kinasi (PI 3-kinasi) ed effettori
Il fosfatidilinositolo 3 kinasi (PI3-Kinasi) è uno degli intermedi molecolari più
caratterizzati che si lega da una parte agli IRS1 e 2 e dall’altra ad altre molecole
coinvolte nella trasduzione intracellulare del segnale insulinico. La PI 3-kinasi
associata alla fosforilazione tirosinica degli IRSs dopo stimolazione insulinica
catalizza la formazione del fosfatilinositolo trifosfato (PIP3 trifosfato), che serve
quale regolatore allosterico del fosfatidilinositolo kinasi dipendente (PI 3-kinasi).
Questo enzima ha un ruolo importante nel trasporto del glucosio mediato dalle
GLUT4, cioè dal complesso proteico che potenzia il trasporto del glucosio attraverso
la membrana cellulare (traslocazione delle GLUT4). I meccanismi di questo processo
non sono ancora ben chiari. Sembra che la PI 3-kinasi attivi un’altra proteina kinasi B
o C che determinerebbe successivamente la traslocazione delle GLUT4 e
conseguentemente una aumentata captazione del glucosio a livello della membrana.
L’attività della PI 3-kinasi conseguente al legame recettore insulina nel muscolo
scheletrico è peggiorata nei pazienti affetti da diabete tipo 2 e nei soggetti obesi
mettendo in evidenza il ruolo determinante dello stato di insulino resistenza nelle due
patologie sopra citate. Una persistente sensibilità all’insulina è osservabile nel
muscolo anche dopo parecchie ore dalla fine di una singola seduta di allenamento.
L’aumentata attività della PI 3-Kinasi da elevata fosforilazione tirosinica nelle ore
immediatamente dopo esercizio fisico può parzialmente contribuire al persistente
incremento di captazione del glucosio. L’esercizio fisico regolare aumenta l’attività
della PI 3-kinasi nel muscolo scheletrico. Poiché la PI 3-kinasi è un importante
sistema che interviene nel regolare l’assunzione del glucosio, questo meccanismo può
notevolmente contribuire a migliorare le azioni intracellulari dell’insulina nel
muscolo scheletrico. L’allenamento determina un aumento generalizzato della
captazione del glucosio ematico. Questo effetto è correlato con l’aumentata
espressione proteica delle GLUT4 come risposta adattiva nell’espressione e funzione
delle molecole chiave attivate in conseguenza del legame recettore insulina. Anche se
le conoscenze attuali sulla trasduzione dei segnali che regolano la captazione del
glucosio sono limitate, stanno tuttavia per essere messe in evidenza importanti
meccanismi che mediano il trasferimento intracellulare di questa molecola.
IRS1 e 2 ed esercizio
L’IRS1 e 2 sono importanti mediatori chimici dei segnali nel muscolo scheletrico.
Sono stati messi in evidenza gli effetti dell’allenamento che inducono un aumento di
attività degli IRS 1 e 2 osservabili fino a 16 ore dalla fine della seduta di esercizio.
Effetti dell’esercizio fisico nella trasduzione intracellulare dei segnali insulinici
(Chakravarth 2002, Zierath 2000)
L’esercizio fisico acuto determina fra l’altro un aumento del trasporto del glucosio a
livello della membrana del muscolo scheletrico tramite l’attivazione di un processo di
traslocazione delle GLUT4 non insulino dipendente. Così effetti immediati
dell’esercizio fisico acuto sulla omeostasi glucidica avvengono primitivamente a
livello del traffico GLUT4 piuttosto che tramite un’elevata trasduzione mediata dal
meccanismo insulinico (IRS1 e 2, PI 3-Kinasi). Parecchie ore dopo la fine di una
seduta di allenamento, nel muscolo scheletrico persiste un aumento del trasporto di
glucosio da aumentata sensibilità insulinica. Gli effetti dell’esercizio fisico sono
osservabili anche fino a 16 ore dopo. Misurazioni effettuate in questo periodo
riflettono dei cambiamenti a livello di espressione genica (aumentata o soppressa),
che avvengono in risposta anche ad una singola seduta di attività motoria.
L’allenamento sembra contribuire ad aumentare la sensibilità dei recettori insulinici
mediante un incremento di attività dei mediatori coinvolti nella trasduzione del
segnale post recettoriale. L’aumento del trasporto di glucosio insulino mediato
sembra essere correlato ad un incremento dei mediatori a livello degli IRS1 e 2 e PI
3-Kinasi. Questo è particolarmente importante poiché l’attività degli IRS 1 e 2 e della
PI 3-Kinasi è peggiorata nei pazienti affetti da diabete tipo 2 e nei soggetti obesi.
L’esercizio fisico induce anche l’attivazione della GSK3 le cui conseguenze
fisiologiche riguardano l’aumentata sintesi di glicogeno, anche se questo sembra
essere solo una parte del meccanismo riguardante la regolazione glicogenosintetica.
E’ molto probabile che la GSK3 abbia un ruolo nella regolazione dei processi
addizionali metabolici e trascrittivi. Capire i meccanismi tramiti i quali si traducono i
segnali biochimici e meccanici in risposte metaboliche e trascrittive è essenziale per
una migliore comprensione degli adattamenti benefici del muscolo scheletrico in
risposta all’esercizio.
Sistemi non insulino dipendenti in grado di potenziare il trasporto e il metabolismo
del glucosio nel muscolo scheletrico (AMP Kinasi e MAP Kinasi) (Zierath 2002,
Aronson 1997)
I due sistemi, AMPK e MAPK, vengono attivati nel muscolo scheletrico direttamente
dalla contrazione dove sono in grado di determinare mediante meccanismi diversi
significativi effetti per quanto riguarda il trasporto del glucosio attraverso la
membrana ed intervenire direttamente sulla espressione genica di proteine in grado di
migliorare il metabolismo dello zucchero. Esistono fra i due sistemi, la cui attività è
completamente indipendente dal legame recettore insulina, delle interazioni
reciproche, ad esempio l’AMPK è in grado di interferire con l’MAPK sui rispettivi
substrati che andranno a regolare l’attività genica.
Attivazione dell’AMP proteina Kinasi
L’AMP Kinasi è una proteina eterotrimerica composta da una subunità alfa catalica e
da due subunità beta e gamma non cataliche. E’ attivata dallo stress cellulare
associato ad una deplezione di ATP . L’AMPK è una proteina che ha il compito di
monitorare lo stato energetico della cellula e di attivare eventualmente i necessari
processi metabolici finalizzati a riportare ad un livello normale le concentrazioni dei
fosfati altamente energetici. Pertanto un incremento di attività dell’AMP Kinasi è
correlato con i seguenti parametri:
aumentata attività di traslocazione delle GLUT4 e quindi del trasporto del
glucosio nel muscolo scheletrico;
aumentata ossidazione degli acidi grassi liberi nel muscolo scheletrico;
diminuita lipogenesi e lipolisi negli adipociti;
diminuita sintesi di acidi grassi liberi e colesterolo negli epatociti.
Recenti risultati scientifici hanno evidenziato il ruolo centrale dell’AMP Kinasi nella
regolazione dell’omeostasi glucidica in risposta all’esercizio. L’attivazione dell’AMP
kinasi (AMPK) è coinvolta quale importante mediatore che potenzia il trasporto del
glucosio a seguito della contrazione muscolare scheletrica. Anche se l’attività
dell’AMPK non sembra essere incrementata in risposta all’insulina, costituisce
tuttavia nel muscolo scheletrico uno dei regolatori critici degli eventi metabolici in
risposta all’esercizio. Recenti evidenze scientifiche documentano il ruolo centrale
dell’AMPK nella regolazione dell’omeostasi glucidica in risposta all’esercizio fisico.
Infatti, l’esercizio fisico di varia intensità , preferibilmente di tipo aerobico, induce un
incremento di attività dell’AMPK intervenendo in questo modo nella regolazione
dell’assunzione di glucosio in risposta all’esercizio. Poiché l’AMPK sembra
incrementare il metabolismo del glucosio da meccanismi insulino indipendenti,
questa via costituisce una strategia alternativa per incrementare la rimozione del
glucosio dal circolo ematico negli stati di insulino resistenza, muscolare o generale.
MAPK (Mitogenic Activated Protein Kinasi) e trasduzione dei segnali (Widegren
2001)
E’ questo il secondo sistema che, a livello muscolare, è attivato dallo stress cellulare
indotto dalla contrazione, dalle citochine, dai fattori di crescita. E’ costituito da tre
sistemi separati posti in parallelo, cioè ERK 1/2, p38 MAPK e JNK la cui attività può
dipendere sia da fattori locali che sistemici o da entrambi. In futuro si cercherà di
identificare i vari componenti che intervengono nell’attivazione di questo sistema il
cui fine ultimo è quello di regolare l’attività trascrittiva tramite i rispettivi fattori e
quindi l’espressione genica associata al miglioramento intracellulare del metabolismo
del glucosio. Il MAPK riveste un ruolo importante negli adattamenti a lungo termine
che avvengono nel muscolo scheletrico a seguito dell’esercizio fisico ripetuto con
importanti effetti anche per quanto riguarda la differenziazione e proliferazione
cellulare.
CONCLUSIONI
Le conclusioni sono le seguenti. E’ possibile contrastare l’incidenza della patologia
diabetica facendo svolgere alla popolazione un’adeguata attività fisica abituale in
grado di modificare positivamente proprio quei fattori molecolari che risultano
coinvolti nella genesi dell’insulino resistenza. Lo stile di vita attuale porta sempre più
verso l’inattività fisica, cioè verso l’assenza di forme fisiologiche di stress cellulare in
grado di mantenere l’equilibrio biodinamico, e quindi verso l’acquisizione, molto
spesso inconscia, di uno dei principali fattori di rischio di malattia non solo del
diabete tipo 2.
Un doveroso ringraziamento a mia moglie Laura e a mio figlio Alberto per la
loro insostituibile collaborazione tecnica.
BIBLIOGRAFIA
Aroson D, Violan AM, Dufresne DS, Zangen D, Fielding AR, Goodyear LJ.
Exercise stimulates the mitogen-activated protein kinase patway in human
skeletal muscle.
J. Clin. Invest. 1997 6: 1251-1257.
Berg AH, Combs TP, Xueliang DU, Brownlee M, Scherer PE.
The adipocyte-secreted protein Acrp30 enhances hepatic insulin action.
Nature Medicine August 2001; 8: 947-95.
Booth FW, Chakravarthy MV, Gordon SE, Spangerbur EE.
Waging war on physical inactivity: using modern molecular ammunition against
an ancient enemy.
J Appl Physiol 2002 93: 3-30.
Booth FW, Thomanson DB.
Molecular and cellular adaptations of muscle in response to exercise:
perspectives of various models.
Physiol Rev 1991 71: 541-585.
Booth FW
RID Newsletter
July 31st, 2002
Chakravarthy MV, Joyner MJ, FW Booth.
An obbligation for primary care physicians to prescribe physical activity to
sedentary patients to reduce the risk of chronic health conditions.
Mayo Clin Proc. 2002 77: 165-173.
Gabriely I, Xiao HM, Rosetti L, Barzila N.
Leptin resistence during aging is indipendent of fat mass.
Diabetes 2002 51:1016-1021.
Gomperts DB, Tatham PE, Kramer IM.
Signal transduction – Chapter 13 – Phosphoinositide 3-kinases, protein kinase B
and signalling through the insulin receptor.
2002 – Academic Press.
Goodyear LJ, Kahm BB.
Exercise, glucose transport, and insulin sensitivity.
Ann Rev Med 1998 49: 235-261.
Holloszy JO, Schultz J, Kusnierkiewicz J, Hagberg JM, Ehsani AA.
Effects of exercise on glucose tolerance and insulin resistence.
Acta Medica Scand 1986 (Supp) 711: 55-65.
Hulver MW, Zheng CJ,Hounard JA, Kraus WE, Slentz CA, Sina MK, Pories WJ,
MacDonald KG, Dohm GL.
Adiponectin is not altered with exercise training despite enhanced insulin action.
Am J Physiol Endocrinol Metabo 2002 283(4): E861-5 (Abstract)
Kahn BB, Flier JS.
Obesity and insulin resistance.
The Journal of Clinical Investigation 2002 106: 473-481.
Kraemer RR, Acevedo EO, Synovitz LB, Durand RJ, Johnson LG, Petrella E,
Fineman MS, Gimpel T, Castracarne VD.
Glucoregolatory endocrine responses to intermittent exercise of different
intensities: plasma changes in a pancreatic beta-cell petptide, amylin.
Metabolism 2002 May; 51(5): 657- 663
Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J.
Molecular Cell Biology – Fourth Edition 2000.
Chapter 20 – Cell Interactions - Cell-to-Cell Signaling: Hormones and Receptors.
Marliss EB, Mladen V.
Intense exercise has unique effects on both insulin release and its roles in
glucoregulation.
Diabetes 2002 51 (supplement 1) : S271—S283.
Nindl CB, Scoville CR, Sheehan KM, Leone CD, Mello RP.
Gender differences in regional body composition and somatotrophic influences
of IGF-I and leptin.
J Appl Phyiol 2002 92: 1611-1618.
Pessin JE, Saltiel AR.
Signaling pathways in insulin action: molecular targets of insulin resistance.
The Journal of Clinical Investigation 2000 106: 165-169.
Saltiel RA, Khan R.
Insulin signalling and the regulation of glucose and lipid metabolism.
Nature 2002, 414: 799-806
Steensberg A, Febbraio M, Osaka T, Schjerling P., van Hall G, Saltin B, Pedersen
BK.
Interleukin-6 productuion in contracting human skeletal muscle is influenced by
pre-exercise muscle glycogen content.
Journal of Physiology 2001 537.2: 633-639
Shulman GI.
Cellular mechanisms of insulin resistence
The Journal of Clinical Investigation 2000 106: 171-176
Siha R, Dufour S, Petersen KF, Le Bon V, Enoksson S, Ma YZ, savoye M, Rothman
D, Shulman G, Caprio S.
Assessment of skeletal Muscle Triglyceride Content by 1H Nuclear Magnetic
Resonance Spectoscopy in Lean and Obese Adolescents
Diabetes 2002, 51: 1022-1027
Wallberg-Henriksson H.
Glucose transport into skeletal muscle.
Act Physiol Scand 1987 Suppl 564.
Widegren U, Ryder JW, Zierath R.9
Mitogen-activated protein Kinase signal transduction in skeletal muscle: effects
of exercise and muscle contraction.
Acta Physiol Scand 2002, 172:227-238.
Zaccaria M, Ermolao A, Roi SG, Englaro P, Tegon G, Varnier M.
Leptin reduction after endurance races differing in duration and energy
expenditure.
Eur J Appl Physiol 2002 87: 108-111
Zierath JR.
Exercise Effects on Muscle Insulin Signaling and Action. Invited review:
exercise training-induced changes in insulin signaling in skeletal muscle.
J Appl Physiol 2002 93: 773-781.
Zierath JR, Krook A, Henriksson HW.
Insulin action and insulin resistence in human skeletal muscle.
Diabetologia 2000 43: 821-835.
Yamauchi et al.
The fat-derived hormone adiponectin reverses insulin resistence associated with
both lipoatrophy and obesity
Nature Medicine August 2001 8: 941-946
Zimmet P, Alberti M, Shaw J.
Global and societal implications of the diabetes epidemic
Nature 2001, December 13, Vol 414, n. 6865
Figura 1: Trasduzione del segnale insulinico e della contrazione nel
muscolo scheletrico
Insulina
Recettori Insulina
Glucosio
Glucosio
IRS's
GLUT4
ione
z
a
r
t
n
o
C
re
muscola
AMPK
PI 3-kinasi
GLUT4
MAPK
MAPK
substrati
DNA
Figura 2: Cinetica delle GLUT4 nel muscolo scheletrico
Dissociazione
Recettore
7
Traslocazione
Insulina
8
Glucosio
6
Trasporto
Glucosio
Intracellular
pool
Sistemi di
trasporto
del glucosio
5
Fusione
3
Traslocazione
?
4
Binding
Segnale
2
Recettore
Membrana del plasma
Insulina
1
Associazione