Tecniche di Immunoistochimica e
Biologia Molecolare
applicate alla diagnostica
istopatologica
Immunoistochimica
• Metodiche utilizzate per identificare
costituenti cellulari e tissutali come
antigeni in situ, utilizzando anticorpi
• Le tecniche di IIC possono essere
applicate su cellule isolate su preparati
istologici e citologici
Immunoistochimica
Alcuni tumori possono essere
diagnosticati con un semplice esame
istologico, mentre altri per una
corretta definizione richiedono l’ausilio
di ulteriori indagini:
• Istochimiche
• Immunoistochimiche
• Biologia molecolare
L’immunoistochimica
al microscopio
Immunoistochimica
Il principio dell’IIC prevede
il riconoscimento di un
antigene mediante l’utilizzo
di un anticorpo specifico.
Antigene
L’antigene è una molecola proteica,
glicoproteica o lipoproteica capace di di
evocare una risposta immune da parte
del sistema immunitario.
Ogni antigene è costituito da uno o più
siti antigenici. Disponendo dell’
anticorpo specifico qualunque antigene
può essere evidenziato mediante
reazioni di IIC.
DEFINIZIONE
EPITOPO 1
DI ANTIGENE
Ogni singolo Ag è
costituito da una o
più porzioni
chiamate epitopi o
determinanti
antigenici differenti
tra loro
Ag
EPITOPO 2
EPITOPO 3
ANTICORPO
DEFINIZIONE DI ANTIGENE
L’antigenicità di una molecola
dipende dalla sua composizione
e conformazione strutturale ed
è modificata da tutti i
trattamenti fisici e chimici
attuati durante la
processazione dei campioni
Anticorpi
Gli ac sono molecole proteiche (Ig) prodotte
dalle plasmacellule in grado di legarsi ad un
determinante antigenico. Possono essere:
Monoclonali:costituiti da ac identici fra loro e diretti
contro lo stesso determinante antigenico
Policlonali: costituiti da anticorpi diversi fra loro e
diretti contro differenti determinanti antigenici
Ibridi: immunoglobuline modificate in modo tale che
ciascun frammento abbia specificità per un
differente determinante antigenico
Struttura dell’anticorpo
Frammento Fc
porzione costante specie-specifica
Frammento Fab
porzione dell’ Ig in grado di legare l’Ag, è
costituito da domini ipervariabili che
consentono grande versatilità nel
riconoscimento e nel legame con l’Ag
(specificità e affinità)
STRUTTURA DI UN ANTICORPO
REAZIONE
ANTIGENE-ANTICORPO
Il complesso tra l’antigene e
l’anticorpo che si forma nella
reazione immune non è di per sé
visibile. E’ necessario quindi
servirsi di marcatori che
direttamente o indirettamente
possano evidenziarne la
formazione
Markers della reazione
immunoistochimica
Attualmente sono impiegati due
differenti tipi di tracciante:
•
Fluorescente
•
Enzimatico
Tecniche Immunoistochimiche
Tecniche di Immunofluorescenza
utilizzano fluorocromi come
marcatori della reazione antigeneanticorpo
Tecniche Immunoenzimatiche
utilizzano enzimi per evidenziare la
reazione antigene-anticorpo
Tecniche di immunofluorescenza
• Le sostanze fluorescenti
maggiormente utilizzate sono:
• Isotiocianato di fluoresceina
• Tetrametil rodamina
• Ficoeritrina
• Cianina
• Rosso Texas
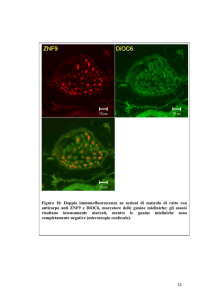
Immunofluorescenza
CK Rodamina
Carcinoma lobulare della mammella
CK Fitc
Immunofluorescenza
Metodi di indagine
Metodi diretti
Metodi indiretti
Immunofluorescenza
Metodo indiretto
Immunofluorescenza
Metodo diretto
Immunofluorescenza
Metodo diretto
– Tessuto
nervoso
Doppia colorazione
Immunofluorescenza
Limiti dell’immunofluorescenza
-Scarsa possibilità di diluizione degli Ac
-Mancanza di informazioni topografiche
-Naturale estinzione della fluorescenza
-Necessità di osservazione in microscopia
particolare
Non conservabilità dei preparati
Campi di applicazione
dell’immunofluorescenza
• Diagnostica nefropatologica
• Diagnostica dermatologica
• Indagini citoflussimetriche
Immunofluorescenza
Nella diagnosi delle patologie renali l’IF
diretta permette di identificare Ag e altri
fattori presenti nelle strutture glomerulari.
La evidenziazione di depositi di
immunocomplessi, di frazioni del
complemento, di fibrinogeno e la loro
distribuzione a livello glomerulare è un
fondamentale supporto nella diagnosi
differenziale tra le varie glomerulonefriti.
Immunofluorescenza
Patologia renale
Glomerulonefrite granulare
Pattern granulare
IgG
Immunofluorescenza
Patologia cutanea
Depositi lineari antianti-C3
Depositi lineari antianti-IgG
Immunofluorescenza
Analisi Citofluorimetria
Sospensione
cellulare
Immunofluorescenza
Tessuto fresco
Campionamento
Congelamento rapido in azoto liquido
Sezioni di 44-5 µ al
microtomo congelatore
Asciugare le sezioni
all’aria
Conservazione a
-80
Sezioni non
utilizzate
Fissare in acetone
per 10’
Lavare con PBS
Colorazione
Congelamento
Il congelamento permette di conferire al
campione di tessuto una rigidità tale da
consentire l’allestimento di sezioni sottili (25 µ) permette inoltre di:
• Stabilizzare le strutture cellulari
• Mantenere inalterate le
caratteristiche di antigenicità del
tessuto
• Non interferire nella reazione Ag-Ac.
Congelamento
La biopsia chirurgica viene inglobata in
una particolare resina chiamata OCT
che ha la proprietà:
- Solidificare a basse temperature
- Preservare il tessuto
- Formare un supporto rigido
necessario per il taglio delle sezioni.
Congelamento
Il metodo maggiormente utilizzato è
quello di immergere il tessuto per alcuni
secondi in azoto liquido che essendo alla
temperatura di –196°C consente un
rapido congelamento senza provocare
danni alla struttura antigenica e
all’architettura morfologica
Tecnica per If diretta
Tessuto fresco
Campionare
Congelare
Tagliare al criostato
Sezioni di 4 µ su vetrini con adesivo o polarizzati
Asciugare le sezioni all’aria
Fissare con acetone a 4°C
Lavare con tampone
Incubare con Ac primario fluorescinato 1 ora
Lavare con tampone
Montare con un sistema acquoso e conservare al buio
Osservare al microscopio a fluorescenza
Immunoistochimica
tecniche e metodi
La tecnica Immunoenzimatica prevede
l’uso di enzimi legati direttamente o
indirettamente all’Ac I° per evidenziare
la formazione del complesso immune.
L’enzima catalizza la formazione di un
precipitato colorato e insolubile visibile
al microscopio, nel sito in cui è
avvenuta la reazione Ag-Ac
EVIDENZIAZIONE DEL COMPLESSO IMMUNE
A seconda del tracciante
enzimatico:
• IMMUNOPEROSSIDASI
• IMMUNOFOSFATASI
• IMMUNOGLUCOSIDASI
• IMMUNOβ
β−GALATTOSIDASI
Perossidasi
• E’ ottenuta dal rafano ma è
presente anche nei tessuti umani
• Può formare legami covalenti con
le immunoglobuline
• Suo substrato è il perossido di
idrogeno
2 H2O2
2H2O+O2
elemento ossidante per il cromogeno
Immunoperossidasi
Il cromogeno più utilizzato è la DAB che
da un prodotto di ossidazione insolubile e
colorato in bruno.
L’insolubilità e la stabilita del prodotto di
ossidazione della DAB consentono il
montaggio e l’archiviazione dei preparati
dei preparati secondo le tecniche di
routine.
Immunoperossidasi
Altri substrati come ad es. l’ AEC
fornisce un prodotto di
osssidazione rosso, è liposolubile e
fotosensibile rendendo necessaria
la conservazione al buio nonché la
documentazione fotografica
Metodi immunoenzimatici
I metodi immunoenzimatici possono
essere:
Diretti
Indiretti
Il metodo diretto scarsamente sensibile
non viene utilizzato nei laboratori di
Anatomia Patologica
Metodi Immunoenzimatici
Il metodo indiretto:
•E’ estremamente sensibile e ha il
vantaggio che un solo anticorpo II°
marcato può essere utilizzato per
riconoscere diversi anticorpi I°
appartenenti alla stessa specie.
Perossidasi
La scelta del cromogeno si pone tra
DAB - Cancerogena
- Origina un precipitato marrone
insolubile nei solventi organici
AEC - Non cancerogeno
- Origina un precipitato rossiccio
solubile nei solventi organici
Fosfatasi alcalina
• Si ottiene dall’intestino di bue
• Substrati sono gli esteri fosforici
alfa-naftilfosfato e naftolo AS-TR
fosfato
• Cromogeno è un sale di tetrazolio
• Conferisce una colorazione rossa
Immunoistochimica
Tecniche e metodi
Enzima + substrato
cromogeno
Prodotto colorato
Metodi Immunoenzimatici
Diretto
Ac I° marcato
Semplice e rapido
Indiretto
Ac I° non marcato
Ac II°
Storia dell’immunoistochimica
dell’immunoistochimica
• 1941 Coons
Coons::
– Anticorpi marcati con fluoresceina per localizzare
antigeni in sezioni di tessuto
• 1966 Nakane
Nakane::
– Anticorpi marcati con enzimi
• 1970 Sternberger
Sternberger::
– Perossidasi
erossidasi--Anti Perossidasi (PAP)
• 1981 Hsu
Hsu::
– Avidin Biotin Complex (ABC)
• 1984 Cordell
Cordell::
– Alkaline Phosphatase Anti Alkaline Phosphatase
(APAAP)
• 1989 Bobrow
Bobrow::
CSA-TSA)
– Catalysed Reporter Deposition (CARD CSA• 1993 Bisgaard
– Polimeri del destrano
Perossidasi AntiAnti-Perossidasi
Antigene
Anticorpo primario
Anticorpo secondario
Enzima
Complesso PAP
Metodi Immunoenzimatici
Il sistema Avidina Biotina (ABC) si
basa sulla straordinaria affinità fra
l’avidina, una glicoproteina con p.m.
68.000 D presente nell’albume d’uovo e
la biotina piccola molecola vitaminica.
In particolare la biotina si lega ai
gruppi aminici -NH2 degli Ac e della
Pr di modo che più molecole di biotina
corrispondono a ciascuna molecola di
Ig
Metodo ABC
LSAB
Labelled Streptavidin
Biotin
(Peroxidase)
Press left mousebutton
Metodo ABC
• Antigene
• Anticorpo primario
• Anticorpo secondario
biotinilato
• Complesso ABCABC-Pr
Sistemi avidina
avidina--biotina
biotina::
vantaggi
• Alta affinità dell’avidina
dell’avidina per la biotina
• E’ possibile ottenere un elevato rapporto
fluorocromo/enzima
fluorocromo
/enzima--proteina
• Elevata amplificazione
• L’
L’avidina
avidina coniugata è molto stabile
• Un singolo coniugato marcato può essere
utilizzato in molteplici metodiche
• Basso costo
Sistemi avidina
avidina--biotina
biotina::
svantaggi
• Biotina endogena
• Reazione con multipli passaggi
Polimeri del destrano
Polymer
Detection
Polymer
Detection
Pre ss left mousebutton
Press left mouse button
Metodi Immunoenzimatici
Polimeri del destrano
Antigene
Anticorpo primario
Anticorpo secondario
secondariopolimeropolimero
-enzima
Polimeri del destrano:
destrano:
vantaggi
• Ottima sensibilità
• Nessuna interferenza legata alla biotina
• Tempi di reazione ridotti
Catalyzed Signal Amplification
Catalyzed Signal Amplification
•Tiramide biotinilata
•acqua ossigenata
Catalyzed Signal Amplification
Catalyzed Signal Amplification
CARD: vantaggi
•
•
•
•
Altissima sensibilità
Aumenta la diluizione di anticorpi primari 05
Utilizzo di anticorpi non usualmente reattivi
Possibilità di utilizzo in svariate metodiche
(ibridazione in situ, FISH, etc)
• Numerosi apteni utilizzabili
Metodi Immunoenzimatici
Doppie colorazioni
Permettono di evidenziare
contemporaneamente nella stessa
cellula due o più antigeni diversi
utilizzando differenti substrati
cromogeni e differenti enzimi
Colorazioni doppie
TCRBCL: CD20/CD54R0
Doppia colorazione
Inibizione di enzimi endogeni
Applicando metodiche di
immunoistochimica enzimatica è
necessario ricordare che alcuni enzimi
utilizzati come traccianti possono
essere presenti nel tessuto da
analizzare, è necessario perciò inibire
l’enzima endogeno senza danneggiare le
proprietà antigeniche.
Trattamento del materiale istologico e
citologico da sottoporre ad indagini di IIC
Dall’effettuazione del prelievo bioptico
o citologico al momento dell’esame
microscopico dei preparati colorati con
reazioni immunoistochimiche
intervengono diversi fattori che
possono influenzare i risultati e
portare a false interpretazioni dei
quadri patologici
Trattamento del materiale
I campioni bioptici da sottoporre ad indagini
di IIC vengono trattati secondo le normali
procedure per l’allestimento delle sezioni
per la diagnostica istomorfologica e cioè
• Fissazione
• Disidratazione e chiarificazione
• Inclusione in paraffina
• Taglio al microtomo
Fissazione
Gli scopi principali della fissazione sono:
• Preservare la morfologia cellulare e
l’architettura tissutale
• Permettere al campione di tollerare gli
stress della processazione
• Mantenere un buon grado di reattività per
le colorazioni tradizionali
• Preservare l’integrità antigenica
• Mantenere le molecole antigeniche nella
loro posizione originale
Fissazione
Tra i fissativi quello maggiormente
impiegato è la formalina neutra
tamponata (10%),
(10%), che permette il
miglior compromesso tra stabilità,
costo, preservazione di molti antigeni,
buona morfologia.
Azione della formalina
La fissazione con formalina
determina legami crociati tra
il liquido fissativo e gruppi
attivi delle proteine, con
mascheramento di molti siti
antigenici.
Trattamento del materiale
istologico
•Azione della formalina sulle proteine del tessuto
Proteina naturale
Proteina denaturata
Reticolazione
Trattamento del materiale istologico
Azione della formalina sulle proteine
del tessuto
Prima della fissazione
Dopo fissazione
Tempi e modalità di fissazione
variabili preanalitiche
• Primo obiettivo di standardizzazione
• Fissare immediatamente il campione
• Un ritardo determina degradazione
proteolitica con diffusione dell’antigene
e ridotta o assente immunocolorazione
• Evitare una fissazione prolungata
•
Tempi non superiori alle 24 ore
• Condizionano l’immunoreattività tissutale
Tempi e modalità di fissazione
variabili preanalitiche
Ritardo della fissazione
Er
Procedure di ripristino dell’antigenicità
I processi a cui sono sottoposti i tessuti o le
cellule dal momento del prelievo
all’effettuazione della reazione di IIC possono
danneggiare l’antigenicità rendendo:
• Inaccessibile l’Ag all’Ac
• Modificando parzialmente l’antigenicità
• Modificandola in modo irreversibile
Ripristino dell’antigenicità
La reattività immunologica può
essere ripristinata rompendo
questi legami crociati o con un
trattamento
Enzimatico
Alte temperature
Trattamento enzimatico
Gli enzimi proteolitici rompono i legami
aldeidici rendendo i siti antigenici disponibili
per il relativo Ac. Quelli maggiormente
utilizzati sono:
• Pepsina
• Proteasi XXIV
• Tripsina
• Proteinasi K
Trattamento enzimatico
L’incubazione con uno di questi enzimi può
avvenire a temperatura ambiente o a 37°C
per un periodo di tempo variabile (5-30’) e
dipende:
• concentrazione
• durata della fissazione
• spessore della sezione
• tipo di enzima
Ripristino dell’antigenicità
A partire dagli anni 90 l’uso del
calore ha largamente sostituito i
metodi enzimatici. Le alte
temperature sono in grado di
ristabilire l’originale struttura
proteica dopo che questa è stata
modificata dalla fissazione in
formalina
Metodi di recupero
dell’antigenicità
• Come effettuare lo smascheramento
Recupero a caldo
•
•
•
•
Forno a microonde
Pentola a pressione
Bagno termostatato
Autoclave
Efficienza dei metodi di
recupero dell’ antigenicità
Fattori che condizionano lo smascheramento
antigenico in mezzo liquido
Tempo di riscaldamento
T (°C) x t (min.)
pH
-Ag indifferenti al pH della soluzione
-Ag buoni risultati a pH acido
-Ag buoni risultati a pH basico
Smascheramento
Intensità di colorazione aumenta aumentando i tempi
Recettore per estrogeni
10’
Smascheramento
Recettore estrogeni
20’
’
Smascheramento
Recettore per estrogeni
30’
Efficienza dei metodi di recupero
dell’antigenicità
• Tempo/Temperatura
• A parità di trattamento il tempo e la temperatura
alla quale le sezioni vengono sottoposte giocano un
ruolo fondamentale per il raggiungimento di un
risultato ottimale
• Casi con reattività debole o incerta possono
diventare chiaramente positivi se esposti al calore
per un periodo più lungo
• Viceversa casi sicuramente negativi restano tali
anche dopo esposizione prolungata al calore
Metodi di recupero
dell’antigenicità
•
•
•
•
•
Soluzioni utilizzate
Tampone citrato 0.01 M pH6
Tampone EDTA pH 8-9
Tampone glicina
Acqua distillata
FASI DELLA COLORAZIONE IIC
SPARAFFINARE
REIDRATARE
PRETRATTAMENTO
INIBIZIONE
Ac I°
Ac II°
ABC-ENZIMA
CROMOGENO
CONTRASTO
MONTAGGIO
OSSERVAZIONE
Interpretazione dei
risultati
Una delle maggiori difficoltà
dell’immunoistochimica sta nell’interpretazione
dei risultati. La presenza di deposizione di
substrato cromogeno in corrispondenza di una
cellula o di un tessuto, spesso, dovrebbe
significare che in quella sede è avvenuta una
reazione tra l’anticorpo e l’antigene tissutale.
Questo è vero nella maggior parte dei casi,
tuttavia altri eventi definiti artefatti, possono
essere responsabili della colorazione
Interpretazione dei
risultati
Le cause più comuni di colorazioni dovute
ad artefatti sono:
•Presenza di perossidasi o fosfatasi (già presenti nel
tessuto ) non adeguatamente inibite.
•Cross
Cross--reattività dell’anticorpo I°
I° con un antigene
diverso da quello in studio.
•Legame aspecifico dell’anticorpo alla cellula o tessuto
(attraverso il frammento Fc o per carica elettrica)
•Inadeguata fissazione del tessuto. Scarsa fissazione
provoca un eccesso di “fondo “; eccesso di fissazione
provoca una ridotta sensibilità
Pattern di colorazione
Esistono alcune strategie che possono aiutare a
distinguere una colorazione immunoistochimica
specifica da una non specicifica o legata ad
artefatti L’interpretazione dei risultati in IIC deve
tenere conto del tipo di positività attesa per un
determinato Ab che può essere di quattro tipi:
• Nucleare
• Citoplasmatica
• Di membrana
• Extracellulare
Pattern di colorazione
• NUCLEARE
• CITOPLASMATICO
• DI MEMBRANA
Campi di applicazione
L’approccio diagnostico
immunoistochimico deve essere
condotto con razionalità
scegliendo, sia il tipo di materiale
più idoneo, sia gli anticorpi da
utilizzare, secondo un algoritmo
appropriato
Campi di applicazione
Si definisce algoritmo
immunoistochimico la successione
logica nella selezione degli anticorpi da
utilizzare al fine di giungere alla
diagnosi.
Esiste un algoritmo primario che
consiste nell’utilizzo di un pannello di
anticorpi che consente di identificare
la neoplasia
Campi di applicazione
Le positività riscontrate con
l’algoritmo primario consentono
di applicare un algoritmo
secondario al fine di classificare
adeguatamente la neoplasia.
Raramente si rende necessario
l’utilizzo di un ulteriore
algoritmo
Campi di applicazione “IHC”
• Marcatori di differenziazione
• “Colorazione speciale”
• Marcatori di neoplasia
• Marcatori di agenti infettivi
• Fattori prognostici
Marcatori di
differenziazione
• Natura della popolazione cellulare
• Linfomi B/T
• Epiteliale vs. mesenchimale
• DD melanoma amelanotico
• Mesotelioma vs adenocarcinoma
Marcatori di
differenziazione
• Sottoclassificazione linfomi
• Sottoclassificazione neoplasie
mesenchimali
• Differenziazione endocrina
Colorazione speciale
• Individuazione tipi cellulari
specifici: cellule
sustentacolari, cellule
follicolari dendritiche ecc.
CD21 - cellule FD
Marcatori prognostici
• Ag regolatori del ciclo
cellulare (Mib
(Mib--1, cicline)
• Recettori ormonali (Er, Pr)
• Prodotti di oncogeni e geni
oncosoppressori (Erb
(Erb--B2, Myc)
• Ag legati all’invasività (E
(E--caderina)
Marcatori immunoistochimici
di riconosciuta validità clinica
• ER, PR
• Proliferazione – Ki67
• HER
HER--2
• KIT
• EGFR
CARCINOMA DELLA MAMMELLA
Fattori prognostici/predittivi
Il carcinoma della mammella, viene
caratterizzato con lo studio di:
Parametri morfologici
Grandezza del tumore,istotipo,infiltrazione,
grado di differenziazione, presenza o meno
di linfonodi metastatici
Parametri biologici (non puramente morfologici)
• Attività proliferativa (MIB1)
• Assetto ormonale (ER,PR)
• Prodotti di oncogeni (HER2)
Carcinoma della mammella
Fattori pronostici
Per caratterizzare i parametri biologici
si impiegano metodiche:
Immunoistochimica che permettono
di evidenziare sostanze di natura
proteica presenti nei tessuti
Ibridazione in situ (FISH e
CISH) identificazione di una sequenza
di acido nucleico in tessuti o cellule
Marcatori prognostici/predittivi
• Validità clinica
Estrogeni-Progesterone
Mib1
Cerb-2
Queste indagini sono svolte su tutte
le neoplasie perché complementari non
solo all’interpretazione istopatologica
ma anche per le relative implicazioni
terapeutiche
Scelta degli anticorpi
Estrogeni
Scelta degli anticorpi
Progesterone
Scelta degli anticorpi
KI67 (Mib1)
Valutazione dell’attività proliferativa
delle cellule neoplastiche e normali.
Si utilizza un Ac monoclonale ki67 (clone
MIB1) che riconosce un antigene
nucleare presente in tutte le fasi
attive del ciclo cellulare
Scelta degli anticorpi
Mib1
Scelta degli anticorpi
C-erb-B2
L’anticorpo reagisce con l’oncoproteina
C-erb-B2 su tessuti fissati in formalina
e inclusi in paraffina.
La colorazione è localizzata nelle
membrane cellulari delle cellule
neoplastiche
Her-2
Kit standardizzati
Devono essere
eseguiti accuratamente
Valutazione dello stato di
HER2/neu
Attualmente sono disponibili numerosi sistemi per
valutare lo stato di HER2/neu (Southern Blot, Dot
Blot, PCR quantitativa).
I più frequentemente utilizzati sono la
dimostrazione dell’iperespressione di HER2
mediante indagine immunoistochimica (IHC) e
dell’amplificazione mediante ibridazione in situ
fluorescente (FISH).
Carcinoma della mammella:
valutazione dello stato di HER-2/Neu
Her 2/neu/c-erbB-2 appartiene alla famiglia
dei recettori per i fattori di crescita.
E’ un componente della via di trasduzione del
segnale coinvolto nella crescita cellulare.
La sua localizzazione extra-cellulare lo rende
un possibile bersaglio farmacologico.
Valutazione dello stato di
HER2/neu
I campioni con intensa positività per Her-2
(IHC 3+) sono elegibili per la terapia con
Herceptin.
I campioni IHC 2+ devono essere ritestati
con altro metodo, preferibilmente con
indagine FISH.
I campioni sono inizialmente testati
mediante IHC.
HER2/NEU EXPRESSION
IHC - HercepTest
2+
3+
Vysis (PathVysion) - Dakocytomation
HER-2/DNA probes
Permettono di valutare l’ amplificazione del gene
HER-2 mediante FISH.
Entrambe le metodiche prevedono l’utilizzo di due
sonde a DNA marcate con sostanze fluorescenti:
HER-2 che identifica l’ intero gene HER-2 marcato
con Spectrum Orange®
CEP 17 è marcato con Spectrum Green® e si
ibridizza con il DNA alfa-satellite localizzato in
corrispondenza del centromero del cromosoma 17
(17p11.1-q11.1)
HER-2/NEU - FISH
HER2/NEU AMPLIFICATION
Low Level
High Level
Problemi metodologici
• Tecniche di smascheramento
antigenico
• Cloni utilizzati
• Sensibilità dei sistemi di
rivelazione
• Scoring methods
• Controlli di qualità
Marcatori di neoplasia
• bcl
bcl--2 - linfomi follicolari vs
iperplasia follicolare
• Ciclina D1 - linfoma mantellare
• p53
• p80 - ALCL
Marcatori di neoplasia
Bcl2
Marcatori di differenziazione
• Determinazione della sede primitiva
di una neoplasia metastatica
– Profilo cheratine
– Marcatori melanocitari
– TTF1 ecc...
Applicazioni microbiologiche
• Identificazione di virus
• Identificazione di batteri
HPV
Helicobacter Pylori
HPV e carcinoma della cervice
.
Tra gli agenti virali
un
posto di rilievo è assegnato
allo Human Papilloma Virus
(HPV)
Numerosi studi
epidemiologici hanno
dimostrato un innegabile
legame tra infezione da
HPV e sviluppo del
carcinoma della cervice
uterina
HPV e oncogenesi cervicale
•Sono stati identificati 100 genotipi di cui
40 presentano tropismo per il tratto anogenitale
•Vengono suddivisi in tre categorie che ne
identificano il diverso potenziale oncogeno
Alto rischio (16, 18 )
Rischio intermedio (31,33,35,51,58)
Basso rischio (6, 11, 34,42,61,68)
Colorazione IIC per HPV
Ibridazione in situ
• Ibridazione in situ
ISH
HPV 16-18
PCR
1) Estrazione del DNA
• Le sezioni raccolte in un tubo sterile sono state
sparaffinate, reidratate e incubate per tutta la
notte con proteinasi K a 37°C
• Inattivazione della proteinasi K a 95°C per 30’
2) Reazione di PCR
Preparare una miscela di amplificazione
contenente: H2O, dNTP, MgCl2, Taq-polimerase
templato
PCR
La PCR avviene
attraverso una serie di
cicli composti da tre
fasi:
Denaturazione
Annealing
Allungamento
Termociclatore computerizzato
opportunamente programmato
PCR
P.M.
Contr- Contr+
-
+
+
Elettroforesi su gel di agarosio
+
Ibridazione inversa
Tipizzazione genotipica di HPV
Campi di applicazione
Possibilità di individuare i ceppi coinvolti
Possibilità di individuare lesioni latenti o
preneoplastiche
Utilità nello screening preventivo
Principali Ac utilizzati nella diagnostica
delle patologie neoplastiche
CITOCHERATINE
• Famiglia di proteine che costituiscono
la maggior parte dei filamenti intermedi
del citoscheletro delle cellule epiteliali.
• In base al peso molecolare che varia
da 40 a 67 kD sono numerate da 1 a 20
• La loro evidenziazione in una cellula
normale o neoplastica depone quindi per
una origine epiteliale
Principali Ac utilizzati nella diagnostica
delle patologie neoplastiche
CITOCHERATINE
• Sono espresse in modo caratteristico nei
diversi tipi di epiteli normali e/o neoplastici
Es:
CK7
+ ADK polmone
-ADK colon
CK20
- ADK polmone
+ ADK colon
• In IIC vengono utilizzati Ac diretti contro le
singole CK o cocktail di Ac variamente allestiti
per identificare CK a basso/medio/alto peso
molecolare
Principali Ac utilizzati nella diagnostica
delle patologie neoplastiche
CITOCHERATINE
Principali Ac utilizzati nella
diagnostica delle patologie
S-100
• L’anticorpo reagisce con una
proteina presente in numerose linee
cellulari (cellule muscolari striate e
cardiache, melanociti, elementi gliali)
• E’ positiva nei mioepiteli ma non è
un marcatore specifico
Principali Ac utilizzati nella
diagnostica delle patologie
S-100
Principali Ac utilizzati nella
diagnostica delle patologie mammarie
Actina del muscolo liscio
• E’ un componente del sistema contrattile
cellulare; è espressa dalle cellule mioepiteliali
ma anche dai miofibroblasti stromali
• L’Ac diretto contro l’actina identifica quindi
tutti gli elementi normali o neoplastici che
presentano una struttura contrattile di tipo
muscolare
Principali Ac utilizzati nella
diagnostica delle patologie mammarie
•Actina del muscolo liscio
Sono stati identificati sei tipi di actina a
seconda del tessuto muscolare di origine
riconosciuti da Ac differenti
-alfa actina muscolo liscio
-alfa actina muscolo scheletrico e cardiaco
-alfa actina muscolo liscio, mioepiteli,
miofibroblasti
Principali Ac utilizzati nella
diagnostica delle patologie
•Actina del muscolo liscio
Principali Ac utilizzati nella
diagnostica delle patologie mammarie
Calponina
• E’ una proteina che regola la contrazione
delle cellule muscolari lisce
• E’ un marcatore molto sensibile delle cellule
mioepiteliali. Mostra moderata crossreattività con i miofibroblasti
• Positività citoplasmatica
Principali Ac utilizzati nella
diagnostica delle patologie mammarie
Calponina
Principali Ac utilizzati nella
diagnostica delle patologie mammarie
• E-Caderina
• Le caderine sono una famiglia di proteine di
adesione cellulare. Formano complessi con le
proteine citoplasmatiche chiamate
catenine.Questi complessi insieme con altri
componenti del citoscheletro,tra cui l’actina,
sono parte essenziale del sistema di adesione
intercellulare e quindi coinvolti nella invasività
delle cellule tumorali
Principali Ac utilizzati nella
diagnostica delle patologie mammarie
• E-Caderina