Quinta unità didattica
Tavola periodica
Storia della Tavola periodica
Il primo tentativo di ordinare
gli elementi conosciuti si deve
a Wolfgang Dobereiner nella
prima metà dell’Ottocento: egli
rilevò che a gruppi di tre
(triadi) presentavano notevoli
somiglianze.
In particolare ipotizzò che la
massa atomica dell’elemento
centrale della triade potesse
essere la media aritmetica
delle masse atomiche degli
altri due elementi.
Storia della Tavola periodica
Dopo il 1860, John
Newlands enunciò la
legge delle ottave,
secondo la quale dopo
una serie di 7 elementi
l’ottavo presenta
proprietà simili al primo
elemento della serie
precedente.
John Newlands
Storia della Tavola periodica
Nel 1869 Dmitrij Mendeleev
ordinò i 63 elementi noti in
base alla massa atomica
crescente, e costruì la prima
tavola periodica degli
elementi.
Mendeleev determinò anche
la legge della periodicità
attraverso la quale poté
prevedere le proprietà di
elementi ancora sconosciuti e
scoperti anni dopo.
Storia della Tavola periodica
Nella tavola periodica che Mendeleev pubblicò nel 1871, gli
elementi erano ordinati in dodici file orizzontali e otto verticali
secondo la massa atomica crescente. Non comparivano i gas
nobili.
Prima tavola periodica
Prima tavola periodica
schema ordinato
Storia della Tavola periodica
• Mendeleev notò che gli elementi classificati presentavano
proprietà simili periodicamente ( proprietà periodiche) per
tale motivo li ordinò in colonne e righe (non tutte della
stessa lunghezza). Inoltre ebbe l’intuizione di lasciare
spazi vuoti per gli elementi ancora da scoprire
Storia della Tavola periodica
• Successivamente nel
1914, il fisico inglese
Moseley intuì che la
periodicità delle proprietà
chimiche degli elementi
non dipendeva dalla
massa atomica ma dal
numero atomico, ovvero il
numero di elettroni e
protoni presenti in
ciascun elemento( che
corrispondeva al numero d’ordine degli
elementi sulla tavola usato da
Mendeleev)
Con il tempo si capì,
grazie al chimico
svizzero A.Werner,
che le proprietà
periodiche degli
elementi erano legate
agli elettroni esterni
(configurazione
esterna) situati nel
livello di valenza
•
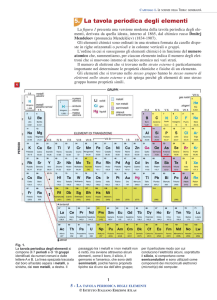
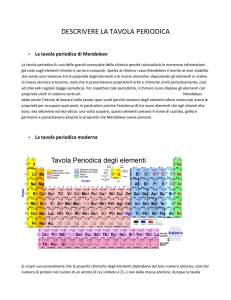
Tavola periodica attuale
La tavola periodica si può suddividere in blocchi che
corrispondono al riempimento degli orbitali da
parte degli elettroni di valenza. Nella tavola attuale sono
distinguibili 4 blocchi corrispondenti ai tipi di orbitali(s,p,d,f) . Ogni blocco ha
tante colonne(gruppi) quanti sono gli elettroni che possono essere ospitati nel
sottolivello (2 in s, 6 in p, 10 in d, 14 in f)
Tavola periodica attuale
Tavola periodica attuale
periodi
• E’ suddivisa in 7 righe dette periodi e 18 colonne
• sono sette righe di diversa lunghezza tanti
quanti sono i livelli energetici in condizione non
eccitate
• Nel primo periodo compaiono solo 2 elementi
• Nel secondo e terzo periodo 8 elementi
• Nel quarto e quinto periodo 18 elementi
• Nel sesto e settimo 32 elementi
Tavola periodica attuale
gruppi
• Corrispondono alle colonne e vanno da 1
a 18 ( nella classificazione più moderna) o
da 1 a 8 A e da 1 a 8 B (nella
classificazione tradizionale).
• Il gruppo 8B è costituito da tre colonne,
pertanto il numero dei gruppi è di 16
mentre le colonne sono 18.
Tavola periodica attuale
gruppi
•
•
•
•
•
•
•
•
•
•
Da sinistra a destra distinguiamo :
Gruppo 1(1A): detto dei metalli alcalini, hanno proprietà fortemente
metallica( a parte H) e tendono a cedere 1 e-.
Gruppo 2 (2A): detto dei metalli alcalini-terrosi, tendono a cedere 2 eI gruppi da 3 a 12 (gruppi di tipo B): contengono gli elementi di transizione
, elementi metallici. Il gruppo 11( 1B) è detto dei metalli nobili.
Il 13 (3A): contiene un solo non metallo (B) mentre gli altri sono metalli.
Tendono a cedere 3eIl gruppo 14(4A): contiene il C e Si (non metalli e semimetalli) e Sn e Pb
( metalli) , tendono a cedere o acquistare 2 o 4 eIl gruppo 15(5A): contiene N , P , As e Sb (non metalli e semimetalli) e solo
Bi come metallo. Tendono a cedere da 1 a 5 e- o acquistare 3 eIl gruppo 16 (6A): contiene O, S, ecc, tutti non metalli e due semimetalli .
Tendono a cedere da 2 fino a 6 e- ed acquistarne 2
Il gruppo 17 (7A): detto degli alogeni, tutti non metalli tranne At. Tendono a
cedere da 1 a 7 e- ed acquistarne 1.
Il 18 gruppo ( 8A): detto dei gas nobili, è costituito solo da non metalli
gassosi . Non hanno tendenza ne a cedere e ne ad acquistare elettroni.
Tavola periodica attuale
• Gli elementi presenti nella tavola sono
118(almeno ad oggi), di cui in gran parte naturali
e gli altri di sintesi
• Sono in massima parte, a temperatura ambiente
e pressione atmosferica, solidi. Quelli liquidi
sono: Hg e Br , mentre i gassosi sono: H, N, O,
Cl, F e tutti i gas nobili.
• In gran parte sono metalli , gli altri non metalli e
pochi semimetalli.
• I metalli si trovano, nella tavola, a sinistra e
sono divisi dai non metalli da una scaletta. I
semimetalli si trovano adiacenti alla scaletta
Metalli e sue proprietà
• Le proprietà tipiche dei metalli sono:
durezza, lucentezza, duttilità, malleabilità
e sono buoni conduttore di corrente
elettrica e di calore.
• Presentano un legame caratteristico
chiamato legame metallico che conferisce
loro tutte le proprietà sopra elencate
• Tendono a cedere elettroni e formare
composti basici(pH maggiore di 7)
Metalli e sue proprietà
Le proprietà chimiche dei metalli dipendono dalla
loro tendenza a perdere elettroni diventando ioni
positivi.
Le proprietà fisiche dei metalli dipendono dal tipo
di legame tra gli atomi.
Non Metalli e semimetalli
• I non metalli presentano proprietà opposte ai
non metalli, mentre i semimetalli hanno
proprietà intermedie tra metalli e non metalli
• Ad esempio il silicio, un semimetallo,
chimicamente si comporta come i metalli
cedendo spesso elettroni, però non conduce
bene il calore ed è un semiconduttore elettrico,
cioè conduce l’energia elettrica in maniera
intermedia rispetto ai metalli e ai non metalli
Proprietà periodiche degli elementi
•
•
•
•
Raggio atomico e volume atomico
Energia di ionizzazione
Affinità elettronica
Elettronegatività
Proprietà periodiche degli elementi
Il raggio
atomico (Å) è
la metà della
distanza
minima di
avvicinamento
tra due atomi
dello stesso
elemento.
Il raggio
atomico
aumenta lungo
un gruppo e
diminuisce
lungo un
periodo.
Proprietà periodiche degli elementi
L’energia di prima ionizzazione (kJ/mol) è
l’energia necessaria per rimuovere un elettrone da
un atomo isolato.
L’energia di prima ionizzazione aumenta lungo un
periodo e diminuisce lungo un gruppo.
energia di prima ionizzazione
andamento
Proprietà periodiche degli elementi
L’affinità elettronica è l’energia che si libera
quando un atomo in fase gassosa cattura un
elettrone.
L’affinità elettronica, come l’energia di prima
ionizzazione, aumenta lungo un periodo e diminuisce
lungo un gruppo.
Proprietà periodiche degli elementi
L’elettronegatività di un elemento misura la sua
tendenza ad attrarre gli elettroni di legame da un
altro elemento.
L’elettronegatività aumenta lungo un periodo, e
diminuisce lungo un gruppo.