Relazione del II anno dell'attività di ricerca del dott. Costantino Forleo
Dottorato di ricerca in Scienze Chimiche XVII ciclo
Anno Accademico 2002-2003
Durante il secondo anno di questo dottorato, il mio lavoro è stato incentrato
principalmente nell’approfondimento dello studio della fosfatasi AphA di
Escherichia coli (AphA-Ec). Si tratta di una fosfatasi batterica classificata come
“Non Specific Acid Phosphatase” (NSAP) di classe B ed appartenente anche alla
superfamiglia delle “DDDD”. L’AphA-Ec è una proteina oligomerica costituita da
quattro subunità identiche di 25 KDa ognuna e viene secreta nello spazio
periplasmico di E.coli. Attualmente il suo ruolo nella fisiologia batterica è
sconosciuto, quello che già da qualche tempo è noto è che mostra una attività ottimale
a valori di pH acido e che la presenza di un co-fattore metallico è essenziale per la
sua funzionalità. Da una preliminare caratterizzazione di tipo funzionale, si è visto
che l’enzima è in grado di defosforilare diversi fosfomonoesteri organici tra cui i 5’ e
i 3’ nucleotidi, i 2’-deossi-5’-nucleotidi, arilfosfati, a l’acido fitico. La sua attività
può essere inibita dall’EDTA e dal calcio, al contrario può essere stimolata dalla
presenza di ioni magnesio. Lo scopo che mi sono prefisso durante questo secondo
anno e stato quindi di ampliare ed approfondire la caratterizzazione biochimica di
questo enzima. Ho quindi condotto numerose prove di attività su un ampio spettro di
possibili substrati e inibitori, al fine di determinare le costanti cinetiche di reazione
per ognuno di essi. Tutte queste informazioni, assieme alla conoscenza della struttura
tridimensionale della proteina, sono indispensabili per l’interpretazione del possibile
ruolo svolto dall’enzima in vivo. Abbiamo inoltre depositato ben 7 strutture della
AphA-Ec nel Protein Data Bank.
Contemporaneamente ho portato avanti il progetto riguardante i trasportatori di
Zinco; ho infatti aggiornato e ampliato il database delle proteine che sono con
maggior probabilità evolutivamente correlate alla ZnuA di E.coli (vedi relazione I
anno) arrivando ad ottenere ben 194 sequenze aminoacidiche diverse. L’utilizzo del
database mi ha permesso di analizzare le omologie e le differenze principali tra le
diverse proteine in esso contenute. Questo tipo di analisi mi ha dato interessanti
indicazioni sulla esistenza di una correlazione evolutiva tra gli ipotetici trasportatori
di zinco. Disegnando poi un albero filogenetico con tutte queste proteine ho ricavato
anche indicazioni sul tipo di metallo che con maggiore probabilità viene trasportato
da ognuna di esse. Queste deduzioni sono scaturite, tra l’altro, valutando la presenza
di proteine parzialmente caratterizzate nello stesso ramo di quelle ancora non
caratterizzate. Bisogna comunque dire che non necessariamente un trasportatore è
specifico per un particolare metallo, accade non di rado infatti che questo possa
legare con diversa affinità metalli diversi. E’ comunque interessante notare che esiste
una correlazione evolutiva tra i diversi trasportatori di diversi metalli, questo risulta
con maggiore evidenza con i trasportatori di zinco, di ferro e di manganese. E’
evidente che questi risultati, ottenuti attraverso strumenti bioinformatici, debbano
essere confermati con un approccio di tipo più sperimentale per esempio attraverso la
risoluzione della struttura tridimensionale di questi trasportatori. Purtroppo ad oggi
sono pochissime le strutture risolte, a causa di tutta una serie di problematiche
inerenti sia la produzione che la purificazione di tali trasportatori.
ATTIVITA’ SVOLTA NELL’ANNO ACADEMICO 2002-2003
SEMINARI E ATTIVITA’ DIDATTICA
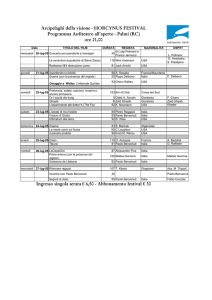
“ZnuA a zinc transporter protein”, 26 marzo 2003, presso il dipartimento di Biologia Molecolare
dell’ Università degli studi di Siena.
Attività didattica svolta nell’ambito dell’insegnamento di Biotecnologie dei Microrganismi del
corso di laurea in Biotecnologie presso Università degli studi di Siena.
PARTECIPAZIONE A CONVEGNI E SCUOLE
Corso ‘Biochimica per dottorandi’ tenuto dal prof. J.M. Frère Ordinario dell’Università di Liegi
(Belgio) , Università degli studi di Siena 12-16 giugno 2003
Corso ‘Fondamenti di Bioinformatica’ organizzato dall’ Istituto Superiore della Sanità, Roma 2226 settembre 2003
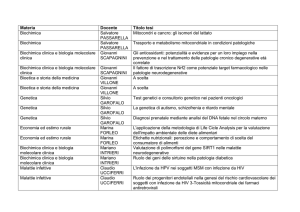
PUBBLICAZIONI
Expression, purification, crystallization and preliminary X-ray characterization of the class B
acid phosphatase (AphA) from E.coli
C. Forleo, M. Benvenuti, V. Calderone, S. Schippa, J.D. Docquier, M.C. Thaller, G.M. Rossolini,
and S. Mangani
Acta Crystallogr D Biol Crystallogr. 2003 Jun;59,(Pt 6):1058-60.
The first structure of bacterial class B acid phosphatase reveals further structural
heterogeneity among phosphatases of the haloacid dehydrogenase fold
V. Calderone, C. Forleo, M. Benvenuti, G.M. Rossolini, M.C. Thaller and S. Mangani
JMB 2004 Jan; 335,(3):761-773
Biochemical characterization of the class B acid phosphatase (AphA) from Escherichia coli
MG1655
In progress
Bioinformatic analysis of Escherichia coli ZnuA relatives in bacteria
In progress
STRUTTURE DEPOSITATE NEL PDB:
1N8N
Release Date: n/a Deposition Date: 21-Nov-2002
Title: Crystal structure of the Au3+ complex of AphA class B acid phosphatase/phosphotransferase
from E. coli at 1.69 A resolution
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1N8N
1N9K
Release Date: n/a Deposition Date: 25-Nov-2002
Title: Crystal structure of the bromide adduct of AphA class B acid phosphatase/phosphotransferase
from E. coli at 2.2 A resolution
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1N9K
1RM7
Release Date: n/a Deposition Date: 27-Nov-2003
Title: Crystal structure of AphA class B acid phosphatase/phosphotransferase ternary complex with
adenosine and phosphate at 2 A resolution
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1RM7
1RMT
Release Date: n/a Deposition Date: 28-Nov-2003
Title: Crystal structure of AphA class B acid phosphatase/phosphotransferase complexed with
adenosine.
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1RMT
1RMQ
Release Date: n/a Deposition Date: 28-Nov-2003
Title: Crystal structure of AphA class B acid phosphatase/phosphotransferase with osmiate
mimicking the catalytic intermediate
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1RMQ
1RMY
Release Date: n/a Deposition Date: 28-Nov-2003
Title: Crystal structure of AphA class B acid phosphatase/phosphotransferase ternary complex with
deoxycytosine and phosphate bound to the catalytic metal
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1RMY
1RMW
Release Date: n/a Deposition Date: 28-Nov-2003
Title: Crystal structure of AphA class B acid phosphatase/phosphotransferase ternary complex with
adenosine and phosphate bound to the catalytic metal at 1.2 A resolution
Authors: Calderone, V., Forleo, C., Benvenuti, M., Rossolini, G.M., Thaller, M.C., Mangani, S.
Status: HPUB RCSB ID: PDB1RMW
Costantino Forleo