A
Federico Allemand, Alessandro Allemand
Neurofisiologia
ed elettroencefalografia neonatale
Copyright © MMXII
ARACNE editrice S.r.l.
www.aracneeditrice.it
[email protected]
via Raffaele Garofalo, /A–B
Roma
()
----
I diritti di traduzione, di memorizzazione elettronica,
di riproduzione e di adattamento anche parziale,
con qualsiasi mezzo, sono riservati per tutti i Paesi.
Non sono assolutamente consentite le fotocopie
senza il permesso scritto dell’Editore.
I edizione: luglio
Indice
Premessa
Introduzione
Capitolo I
L’EEG neonatale
Capitolo II
L’EEG convenzionale (cEEG)
.. Tecnica di registrazione, – .. Artefatti, .
Capitolo III
Aspetti maturativi
.. Maturazione dell’EEG, – .. Organizzazione del sonno, –
.. Reattività, – .. Applicazioni pratiche , .
Capitolo IV
L’EEG neonatale patologico
.. L’eeg patologico del neonato a termine, .
Capitolo V
L’EEG patologico del neonato pretermine
Capitolo VI
Valore prognostico dell’EEG neonatale
Capitolo VII
L’EEG in patologia neurologica neonatale
.. Le convulsioni neonatali , – .. Encefalopatia ipossico–ischemica
, – .. Emorragie intracraniche , – .. L’EEG nelle infezioni del
Neurofisiologia ed elettroencefalografia neonatale
SNC, – .. Malformazioni cerebrali e anomalie cromosomiche, –
.. Disturbi metabolici , – ... Errori congeniti del metabolismo , –
... Alterazioni metaboliche transitorie, .
Capitolo VIII
L’ aEEG (CFM)
.. Errori e avvertenze, – .. aEEG e le convulsioni neonatali, .
Capitolo IX
Encefalopatia ipossico–ischemica emorragia intracranica e aEEG
.. Emorragia intracranica GMH–IVH e aEEG, – .. Conclusioni, .
Capitolo X
Nuove applicazioni dell’EEG neonatale
.. Assistenza al neonato con encefalopatia ipossico–ischemica (EII) tramite trattamento ipotermico, – ... Incidenza dell’EII, – ... Meccanismi patogenetici del danno cerebrale ipossico–ischemico, – ... Raffreddamento cerebrale, – ... Compiti del centro di riferimento di –
livello , .
Conclusioni
Appendice illustrativa
Bibliografia
Premessa
La decisione di scrivere un nuovo piccolo manuale pratico di EEG
neonatale è maturata a seguito dell’utilizzo tuttora frequente di questo
antico mezzo diagnostico. Se fino agli anni del XX secolo era
praticamente il solo strumento a disposizione del neurologo e del
neonatologo per lo studio del sistema nervoso centrale (S.N.C.) del
neonato, ancora oggi, nonostante l’esplosione delle neuroimmagini
e delle indagini di laboratorio, ha conservato intatto il suo valore
diagnostico e prognostico, sia nel neonato a termine e pretermine
che nel lattante, rimanendo così uno dei pilastri fondamentali della
neurologia dello sviluppo.
D’altra parte, sono tuttora molto pochi gli elettroencefalografisti
che si sono dedicati in particolare a questa età della vita e si vedono
ancora troppo spesso tracciati EEG neonatali interpretati come se
fossero di bambini più grandi o addirittura di adulti.
Tutti questi motivi ci hanno fatto ritenere ragionevole fare di nuovo
il punto su questo argomento.
La gran parte dei dati di normalità e di patologia sono stati studiati
mezzo secolo fa, ma la possibilità successiva di confrontare i dati
neurofisiologici con quelli neuroanatomici oltre che con la clinica ha
affinato ulteriormente le nostre conoscenze sull’EEG in particolare e
sulla neurologia neonatale in generale.
Speriamo che questo nostro lavoro risulti utile per neonatologi,
neuropsichiatri infantili, pediatri e tecnici di neurofisiologia e che
contribuisca a migliorare le loro conoscenze in un ambito tuttora di
nicchia e poco frequentato.
Introduzione
La conservazione dell’integrità del sistema nervoso centrale è un compito primario della terapia intensiva neonatale (TIN), soprattutto in
questo periodo storico caratterizzato dalla sopravvivenza anche di neonati estremamente gravi o estremamente prematuri. Gli sforzi spesso
eroici per far sopravvivere tali neonati devono mirare ovviamente
anche a ridurre al minimo la morbilità successiva, quella neurologica
in particolare. A tale scopo si stanno ora utilizzando nuove modalità
di approccio terapeutico quali il cooling che impongono un monitoraggio continuo anche della attività elettrica cerebrale, strumento
indispensabile per valutare la funzione del cervello e gli effetti delle
terapie. Rimane inoltre inalterato il grande valore prognostico soprattutto dell’attività di base dell’EEG convenzionale valore conosciuto
ormai da quattro decenni.
La neurofisiologia neonatale, che negli ultimi anni era stata oscurata dall’uso sempre più intensivo della diagnostica per immagini,
ecografia transfontanellare e RMN (risonanza magnetica nucleare)
cerebrale in primis, ha riacquistato così un ruolo decisivo, tale da imporre a tutti i neonatologi una conoscenza almeno sufficiente delle
diverse metodiche di monitoraggio bioelettrico, modalità non invasive
e atraumatiche, utili sia nei nati a termine che nei pretermine (Lamblin
–André ).
Scopo di questo libro è proprio quello di fornire, non solo ai neurologi e ai neuropsichiatri infantili, ma a tutti i neonatologi e a tutti i
tecnici neurofisiopatologi, gli strumenti basilari per un utilizzo corretto e fruttuoso soprattutto dell’EEG convenzionale (cEEG) e dell’aEEG
o CFM (cerebral function monitor), conoscendone le specificità tecniche, i limiti, le caratteristiche maturative di normalità e le principali
caratteristiche patologiche (Neubauer ).
Verranno inoltre trattate le principali patologie neurologiche neonatali e in dettaglio verrà considerato l’apporto che la neurofisiologia
può dare per la comprensione della loro fisiopatologia, per la diagnosi
Neurofisiologia ed elettroencefalografia neonatale
e per il controllo della terapia. La trattazione riguarderà soprattutto la
convulsività neonatale, l’encefalopatia ipossico–ischemica, le emorragie intracraniche, le infezioni del SNC e le patologie malformative e
metaboliche.
Come esempio delle nuove frontiere dell’EEG neonatale si parlerà rapidamente delle metodiche di prevenzione del danno cerebrale mediante ipotermia e del ruolo che in questo ambito gioca il
monitoraggio EEG.
La bibliografia è ancora in gran parte quella storica della seconda
metà del ‘ da cui non si può assolutamente prescindere perché
tuttora valida ed è stata integrata con le novità di questi ultimi decenni
sia quelle strettamente neurofisiologiche che quelle cliniche.
Capitolo I
L’EEG neonatale
La neurologia neonatale negli ultimi due decenni è stata dominata dalla
diagnostica per immagini, in particolare l’ecografia transfontanellare e la RMN cerebrale e, anche se di meno, dagli approfondimenti
laboratoristici e genetici. Tutto ciò ha apparentemente reso quasi residuali la semeiotica clinica e la neurofisiologia che invece avevano
dominato nei decenni precedenti. In questi ultimi anni, però, soprattutto in relazione a nuove modalità di intervento intensivo (sedazione,
terapia del dolore, cooling) l’EEG neonatale ha riacquistato un ruolo
importante, sia nella diagnosi della convulsività infraclinica che nella
prognosi (Boylan ). Ci è parso quindi opportuno riprendere questo argomento per aggiornarlo e chiarire se possibile le controversie
che ancora esistono.
L’elettroencefalografia neonatale è praticata ormai da più di anni.
Le prime registrazioni nel nato a termine, infatti, sono state eseguite
da Loomis nel e nel neonato pretermine da Hughes nel . Ma
è soprattutto a partire dagli anni sessanta–settanta che i progressi sono
stati molto significativi, in concomitanza con l’uso delle registrazioni
poligrafiche e di metodiche di monitoraggio; e l’EEG è andato via
via assumendo un ruolo sempre più importante nella valutazione del
neonato con problemi neurologici, ruolo solo parzialmente intaccato
dall’utilizzo sempre più massiccio delle neuro immagini. Si tratta infatti di un metodo relativamente semplice, assolutamente non invasivo,
in grado di studiare adeguatamente i rapidi processi maturativi che interessano il SNC del neonato, in particolar modo la corteccia cerebrale.
È generalmente considerato un mezzo tecnico ottimo per la determinazione dell’età gestazionale con una precisione di +/– una settimana:
esiste infatti una correlazione stretta tra gli aspetti morfologici dello
sviluppo cerebrale e le caratteristiche maturative elettroencefalografiche. È in grado inoltre di studiare adeguatamente l’entità e il tipo di
Neurofisiologia ed elettroencefalografia neonatale
numerose alterazioni della funzione del SNC in molteplici situazioni
patologiche. L’uso frequente della sedazione in TIN ha inoltre reso
insostituibile l’EEG come monitoraggio delle funzioni del SNC, monitoraggio obbligatorio anche in caso di trattamento ipotermico. In
quest’ultima circostanza l’EEG è inoltre uno strumento indispensabile
come criterio di inclusione dei soggetti asfittici nel trattamento.
L’EEG è venuto assumendo quindi di nuovo un significato importante sia dal punto di vista della diagnosi che della prognosi (Kato ,
Clancy ).
Nonostante tutto ciò è ancora opinione diffusa che l’interpretazione dell’EEG neonatale sia troppo difficile e che la sua utilità sia
limitata. In effetti, la rapida crescita dell’SNC nel corso del periodo
neonatale si accompagna ad imponenti trasformazioni dei quadri EEG
e le caratteristiche bioelettriche si modificano fortemente in relazione
ai differenti stati comportamentali. Ciò non facilita la interpretazione
dell’EEG neonatale e può scoraggiare molti neurologi e neurofisiopatologi a cimentarsi con le registrazioni dei neonati. Ma le difficoltà, in
realtà, sono superabili abbastanza facilmente: per un corretto uso di
tale mezzo strumentale occorre soprattutto avere adeguata esperienza
delle caratteristiche dell’EEG normale alle differenti età gestazionali pur tenendo presente che grande è la variabilità interindividuale.
In definitiva non esiste un solo EEG neonatale ma ne esistono tanti
quante sono le settimane di età gestazionale dalla ventiquattresima alla
quarantaquattresima.
Un altro elemento problematico dell’elettroencefalografia neonatale consiste nel fatto che il substrato fisiologico dell’attività EEG non è
ancora ben conosciuto. Sulla base di studi sperimentali sugli animali e
di studi soprattutto in pazienti adulti si ritiene generalmente che l’attività registrata dagli elettrodi posti sullo scalpo rappresenti la somma e
la media di un gran numero di potenziali postsinaptici generati dalla
attività dendritica dei neuroni corticali più superficiali. Tale attività
corticale viene modulata da input provenienti da strutture subcorticali, soprattutto talamiche. Ma la precisa localizzazione delle strutture
generatrici dei diversi pattern EEG neonatali è tuttora poco conosciuta.
Allo stato attuale delle conoscenze possiamo affermare che l’EEG sia
una media spaziotemporale dei potenziali postsinaptici sincroni delle
cellule piramidali corticali orientate in parallelo. L’attività neuronale
sincrona si attiva attraverso vari meccanismi: le cellule delle connessio-
. L’EEG neonatale
ni talamocorticali, le cellule del nucleo reticolare talamico e le cellule
piramidali corticali hanno ognuna proprietà endogene di attività ritmica. L’attività tra gruppi di neuroni talamocorticali è sincronizzata da
connessioni ricorrenti tra le cellule di relay talamocorticali e il nucleo
reticolare talamico che le circonda e tra il talamo e la corteccia.
Durante il risveglio le afferenze sia colinergiche che noradrenergiche provenienti dal tronco cerebrale determinano un effetto eccitatorio depolarizzante sulle cellule talamocorticali e corticali e inibiscono
le cellule reticolari talamiche. Risultato di questa rete del risveglio
è una riduzione dell’attività sincrona e un incremento della attività
asincrona ad alta frequenza.
Lo sviluppo della sincronia tra l’attività dei due emisferi è una delle
caratteristiche più tipiche della maturazione progressiva dell’EEG del
pretermine. Ma se ciò dipenda dallo sviluppo del corpo calloso o,
come più autorevolmente è stato sostenuto ( Joseph , Lombroso
, Hellstrom–Westas ), da strutture neuronali sub corticali, non
è ancora del tutto chiaro.
Come ultimo elemento problematico ai fini della comprensione dei
substrati fisiologici dell’attività EEG, va sottolineato che a ventiquattro
settimane di età gestazionale si registra già una attività ben individuabile (Dreyfus–Brisac ), tipica di tale età gestazionale, che contiene
i precursori dell’attività EEG delle settimane successive, mentre l’aspetto della corteccia a tale età gestazionale è ancora molto primitivo:
i dendriti basali dei neuroni della corteccia sono ancora molto scarsi,
lo sviluppo delle spine dendritiche e della sinaptogenesi è ancora agli
inizi e avverrà soprattutto all’ottavo mese di vita intrauterina (Purpura
) come pure lo sviluppo delle connessioni talamo corticali. Non
sembrerebbe esserci quindi all’inizio una perfetta corrispondenza tra
caratteristiche istologiche dello sviluppo della corteccia, molto primitive, ed attività EEG già sufficientemente caratterizzata (Tharp ,
Lamblin , Selton , Hayakawa ). Quanto esposto sino ad
ora, sia riguardo alle oggettive difficoltà di comprensione dell’EEG
neonatale dipendenti dalla rapida trasformazione di quest’ultimo
nel corso delle diverse settimane di gestazione, sia riguardo alle
difficoltà di comprensione del substrato fisiologico non devono far
dimenticare le grandi possibilità di utilizzo dell’EEG (Shany ) e
il suo apporto spesso insostituibile (basti pensare alla convulsività).
Apporto decisivo anche se negli ultimi anni si sono imposti sempre
Neurofisiologia ed elettroencefalografia neonatale
di più altri e sofisticati mezzi diagnostici quali l’ecografia cerebrale,
la tecnica Doppler per lo studio della velocità di flusso, la RMN, la
PET, la SPECT.
Non vi è dubbio che tali nuovi mezzi abbiano rivoluzionato la
neurologia neonatale ma non hanno affatto ridotto lo spazio di
pertinenza dell’elettroencefalografia. Anzi, spesso ne hanno migliorato l’utilizzo e meglio precisato il significato che è soprattutto
prognostico (Husain ). Qualsiasi eccessiva enfatizzazione di
un mezzo strumentale a discapito degli altri è concettualmente
scorretta e pericolosa nella pratica clinica. Solo attraverso l’uso
combinato di tutti i mezzi strumentali oltre, evidentemente, all’apporto insostituibile della semeiotica fisica, si attua un approccio
corretto ai complessi problemi della neurologia neonatale.
Lo scopo di questo testo è proprio quello di mettere in evidenza
in quali circostanze e in base a quali criteri l’EEG può essere di
reale aiuto per il neonatologo e il neurologo infantile, precisando
i limiti di tale metodica ma anche i vantaggi e tutte le possibili
applicazioni.
Nella nostra esposizione verranno dapprima considerate le caratteristiche dell’EEG normale e i suoi differenti aspetti a seconda
dell’età gestazionale e dello stato comportamentale: solo attraverso
una adeguata conoscenza dell’ontogenesi dell’attività bioelettrica
cerebrale e dell’organizzazione del sonno, infatti, si potranno valutare adeguatamente le alterazioni dell’EEG e, nello stesso tempo,
utilizzarlo come mezzo per uno studio del SNC.
In seguito la trattazione riguarderà le principali anomalie sia
nel neonato a termine che nel pretermine. Di ciascuna verranno
considerate l’eventuale valore diagnostico e le possibili correlazioni
con le alterazioni neuroanatomiche.
Un capitolo a parte verrà dedicato al valore prognostico dell’EEG neonatale. È questo infatti il campo di applicazione più fertile
per l’elettroencefalografia in neonatologia.
Infine verranno considerate le caratteristiche EEG in alcuni delle
principali situazioni patologiche.
Tali capitoli verranno preceduti da una premessa riguardante le
tecniche di registrazione che devono essere utilizzate in età precoce,
perché solo attraverso una adeguata standardizzazione e un uso
corretto della tecnica che si possono ottenere risultati apprezzabili.
. L’EEG neonatale
Tenuto conto dell’utilizzo sempre più frequente di metodiche
di monitoraggio elettroencefalografico semplificate nei reparti di
TIN, una seconda parte verrà dedicata al CFM o aEEG nei suoi
aspetti maturativi, diagnostici e prognostici.
In ultimo verrà trattato il capitolo sul cooling come esempio di
un uso molto importante e attuale delle registrazioni EEG.
Capitolo II
L’EEG convenzionale (cEEG)
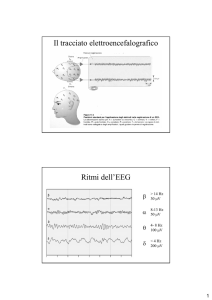
.. Tecnica di registrazione
È assolutamente indispensabile soffermarsi sulle modalità di esecuzione di una registrazione EEG nel neonato perché buona parte dei
fraintendimenti e delle difficoltà riguardanti il significato e l’importanza dell’EEG dipendono da un uso scorretto del mezzo tecnico (Husain
–Cherian ).
Anche se i principi di base di tecnica EEG restano validi anche in
epoca neonatale, alcune peculiarità vanno tenute presenti: le dimensioni del cranio sono piccole, a volte estremamente piccole; i neonati
sono per lo più degenti in centri di terapia intensiva e quindi giacciono in termoculla, non spostabili, spesso trattati con O, circondati
da apparecchiature e in condizioni generali sovente molto precarie;
non esiste un solo tipo di EEG neonatale ma tanti tipi quante sono le
settimane di età gestazionale dalla a alla a e tanti quanti sono gli
stati comportamentali (REM, NREM, Veglia).
Tali peculiarità impongono protocolli diversi rispetto alle età successive senza i quali la comprensione del tracciato risulta estremamente
difficile (Monod ) e l’EEG può trasformarsi da eccellente ausilio
ad elemento fuorviante sia per la diagnosi che per la prognosi.
Una buona registrazione si ottiene solo se il neonato è mantenuto
in condizioni di neutralità termica, se l’installazione degli elettrodi
viene effettuata prima di un eventuale pasto e la registrazione inizia
alla fine del pasto (tutto questo per favorire una registrazione e uno
studio del sonno).
Qualunque sia la tecnica utilizzata il fine ultimo deve essere quello di ridurre al minimo le manipolazioni, soprattutto allo scopo di
evitare brusche desaturazioni e di allontanare qualsiasi pericolo di
Neurofisiologia ed elettroencefalografia neonatale
infezioni, anche, naturalmente, attraverso una sterilizzazione accurata
del materiale utilizzato, che ora è per lo più monouso.
Nel neonato a termine, generalmente registrato in lettino, possono
essere utilizzati sia elettrodi a coppetta con pasta conduttrice adesiva
che elettrodi a bottone in casco preformato. Nel prematuro gli elettrodi a coppetta con pasta conduttrice adesiva sono l’unica modalità
utilizzabile. Gli elettrodi devono essere in argento clorurato o placcati
in oro e devono essere in numero ridotto (Dreyfus–Brisac ): otto
più uno di terra sono sufficienti nella gran parte dei casi (fig.).
Per la preparazione del neonato occorre quindi seguire le seguenti
tappe:
pulizia accurata del cuoio capelluto;
determinazione delle zone da evitare per il posizionamento degli
elettrodi (edemi, tumefazioni. fontanelle, suture);
rapida applicazione degli elettrodi, già predisposti con la pasta
conduttrice.
L’uso di numerosi montaggi nuoce alla qualità del tracciato perché
i cambiamenti fisiologici della morfologia dell’EEG sono mascherati
dai frequenti cambiamenti di montaggio. Occorre sempre ricordare
che la valutazione dell’EEG neonatale è soprattutto basata sulla sua
organizzazione generale temporo–spaziale e non sui singoli grafoelementi. Un montaggio longitudinale di media distanza tipo Jasper e
un montaggio trasversale sono generalmente sufficienti. Montaggi di
lunga distanza sono obbligatori in caso di tracciato inattivo.
Occorre inoltre sottolineare che, essendo l’EEG variabile a seconda
dei differenti stati comportamentali, è necessario che in ogni istante si
sia in grado di determinare in quale stato comportamentale il neonato
si trovi. È necessario quindi che chi effettua la registrazione annoti con
precisione il comportamento del neonato e che vengano registrati,
oltre all’EEG, anche altri parametri fisiologici indispensabili per la
identificazione dei diversi stati (ECG, respirogramma, miogramma
del mento, oculogramma). È necessario infine che la registrazione
duri per almeno un intero ciclo del sonno, sia per studiare adeguatamente l’organizzazione degli stati che per il fatto che i grafoelementi
patologici appaiono soprattutto nel corso del sonno calmo. L’osservazione accurata del neonato e la registrazione in poligrafia sono inoltre
. L’EEG convenzionale (cEEG)
indispensabili per differenziare numerosi artefatti che possono simulare perfettamente la morfologia di eventi reali quali le crisi, punte,
onde aguzze, bouffées di varia localizzazione.
Una contemporanea registrazione video può facilitare grandemente la comprensione dell’EEG e favorire lo studio delle correlazioni
elettrocliniche, anche se una ripresa video, per quanto efficace, non
può mai sostituire del tutto gli occhi di un tecnico e le sue capacità
decisionali durante una registrazione.
In definitiva i principali argomenti tecnici possono essere così
schematizzati:
ridotto numero di elettrodi;
registrazione almeno di un intero ciclo del sonno;
ridotto numero di differenti montaggi (–);
registrazione poligrafica;
tecnico EEG in grado di riconoscere e annotare le caratteristiche
comportamentali del neonato sia a termine che pretermine;
uso frequente del video–EEG;
uso di costanti di tempo che consentano la registrazione dell’attività di fondo a bassa frequenza;
eliminazione dei filtri al fine di registrare l’attività ad alta frequenza;
riduzione al minimo delle manipolazioni;
in caso di sospetto di crisi, monitoraggio prolungato con EEG
dinamico o aEEG.
Per una adeguata standardizzazione delle tecniche di registrazione
è consigliabile che ogni centro utilizzi una scheda tecnica di registrazione (fig. ).
Per quanto concerne l’interpretazione, anche se quella tradizionale
visiva è ancora nettamente maggioritaria, si utilizzano anche tecniche
di interpretazione automatiche (Lofhede –Temko ).
.. Artefatti
Ci è sembrato opportuno dedicare un intero paragrafo a questo argomento perché, per le peculiari condizioni di registrazione, nel neonato
Neurofisiologia ed elettroencefalografia neonatale
più che nelle altre età si raccolgono artefatti che possono confondersi
facilmente con eventi autentici e rendere così difficile l’interpretazione
del tracciato.
Gli artefatti possono essere distinti in:
—
—
—
—
artefatti legati agli elettrodi;
artefatti legati ai cavi;
artefatti secondari alle condizioni ambientali;
artefatti secondari alla attività del neonato.
Artefatti dovuti ad un cattivo contatto elettrodo–cute o a un cattivo
contatto morsetto–elettrodo, possono simulare una crisi (fig.). Per
eliminarlo è sufficiente modificare la posizione del morsetto o umidificare la pasta con soluzione fisiologica, oppure aggiungere altra pasta.
Una cattiva clorurazione degli elettrodi posti in posizione centrale
può determinare sia artefatti di polarità positiva che simulano punte
rolandiche positive (fig.), che artefatti di polarità negativa, simili a
punte rolandiche negative. In tali casi occorre cambiare l’elettrodo.
Un ondeggiamento dei cavi può determinare un artefatto che
simula un ritmo theta simile all’attività EEG tipica delle settimane
di età gestazionale (fig.). Oppure artefatti somiglianti a bouffées di
punte negative. In tal caso occorre verificare i cavi e, eventualmente,
cambiarli.
L’accendere un apparecchio nella stanza di registrazione può determinare un artefatto simile a una punta. Anche il semplice spostamento
di una persona nella stanza può causare artefatti. È necessario quindi
annotare sempre minuziosamente quello che avviene nell’ambiente
di registrazione.
Gli artefatti dovuti allo stesso neonato sono i più comuni. La pulsazione di una arteria può simulare una crisi (fig.). Bisogna verificare
allora che il casco non sia troppo stretto o eventualmente spostare
leggermente l’elettrodo allontanandolo dal vaso. Inoltre, occorre saper differenziare un ECG che si iscrive sul tracciato da una crisi vera.
Occorre quindi registrare sempre il ritmo cardiaco, soprattutto in
neonati con sospetto di crisi convulsive. Anche l’attività respiratoria
può determinare artefatti simulanti crisi attraverso un movimento
della testa sincrono con il respiro (fig.). A volte tale artefatto dipende
da una eccessiva estensione della testa, così che gli elettrodi occipitali
. L’EEG convenzionale (cEEG)
toccano il piano di appoggio; basta in tal caso sollevare leggermente
l’occipite. È comunque indispensabile registrare sempre anche l’attività respiratoria. I singhiozzi del neonato possono simulare punte
o complessi punta–onda (fig.) e l’ammiccamento encoches frontali
(fig.).
Ma, nonostante quanto detto, occorre riconoscere che a volte la
distinzione tra artefatti ed eventi reali è talmente difficile che solo la
successiva evoluzione del tracciato può sciogliere il dilemma.
In conclusione si può sottolineare quanto segue:
— a volte è molto difficile differenziare artefatti da segnali autentici.
Occorre quindi attendere alcuni istanti prima di cercare di eliminare un ipotetico artefatto perché il grafoelemento sospetto
può risultare autentico;
— è assolutamente indispensabile la registrazione contemporanea
di cuore e respiro;
— occorre sempre registrare il sonno calmo perché in questo stato
scompaiono la gran parte degli artefatti da movimento;
— le annotazioni riguardanti sia il comportamento del neonato
che le caratteristiche ambientali in cui avviene la registrazione
sono un aspetto insostituibile del lavoro del personale tecnico e
facilitano molto l’interpretazione del tracciato.
Capitolo III
Aspetti maturativi
La maturazione cerebrale evolve rapidamente nel corso delle ultime
settimane di età gestazionale e nel periodo post–natale. Lo sviluppo
strutturale e funzionale del SNC si riflette sulle rapide trasformazioni
dell’attività bioelettrica cerebrale e sulla progressiva organizzazione
del ciclo del sonno.
Questa correlazione tra maturazione cerebrale ed evoluzione dell’EEG e della organizzazione del sonno è stata da lungo tempo e
largamente documentata sia in studi sperimentali su varie specie di
mammiferi ( Jouvet , Caveness , Gransbergen ), sia sui
neonati pretermine e a termine (Dreyfus Brisac , , , ;
Ellingson ; Nolte , ). Oggetto di questo capitolo è appunto
l’ontogenesi della attività bioelettrica cerebrale e della organizzazione
del sonno nei pretermine e nei nati a termine, come espressione della
progressiva maturazione del SNC.
L’EEG è espressione di attività corticale che dipende però da impulsi che provengono da strutture sottocorticali che entrano in gioco in
maniera differenziata in rapporto ai diversi stati comportamentali. Alla
maturazione progressiva di questi stati corrispondono le progressive
variazioni maturative dell’EEG. È quindi indispensabile considerare
l’evoluzione elettroencefalografica nel corso dell’ontogenesi correlata all’evoluzione di veglia, sonno calmo, sonno attivo. Tuttavia, per
maggior chiarezza di esposizione tratteremo questo argomento in tre
punti:
— nel primo si tratterà dell’evoluzione dell’EEG in relazione alle
diverse età gestazionali;
— nel secondo dell’ontogenesi del ciclo del sonno;
— nel terzo di alcune applicazioni pratiche che tali conoscenze
neurofisiologiche possono avere in neonatologia.
Neurofisiologia ed elettroencefalografia neonatale
.. Maturazione dell’EEG
L’attività elettrica appare inizialmente nelle regioni subcorticali. Bergstrom () ha registrato una attività continua a livello del ponte in
embrioni di settimane di età gestazionale. L’ampiezza di tale attività
aumenta fino a giorni, poi resta stabile.
A partire dalle settimane di età gestazionale si registra una attività
discontinua a livello della parte rostrale del tronco dell’encefalo e a
livello dell’ippocampo. E discontinua è anche l’attività che si registra
sullo scalpo a partire dalle settimane (Dreyfus Brisac ). Essa
consiste in un pattern polimorfo molto ampio intervallato da lunghi
periodi di tracciato ipovoltato. Possono aversi rari periodi di attività
più continua con contemporanea presenza di motilità e pianto ma,
a questa età gestazionale nessuna differenziazione tra sonno e veglia
può essere fatta. L’attività motoria spontanea è pressoché continua, gli
occhi chiusi, i movimenti oculari rari, l’attività cardiaca e respiratoria
tendenzialmente regolari. E non vi è evidenza di attività cerebrale
ciclica nei soggetti di tale età gestazionale registrati dopo la nascita.
A settimane l’EEG è caratterizzato dalla comparsa di onde lente
e di bouffées theta (fig.) della durata di qualche secondo e di voltaggio
tra e microvolts, su un fondo di tracciato inattivo che può durare
anche un minuto. A – settimane cominciano ad apparire brevi
periodi di attività continua, primo abbozzo di sonno REM.
A settimane l’ attività continua, ampia e lenta, diffusa, della durata di qualche minuto, comincia ad arricchirsi di immagini occipitali
ampie e lente, sovraccaricate di ritmi rapidi: sono le cosiddette delta–
brushes (fig.). Tale attività continua è contemporanea ai movimenti
oculari e a irregolarità del respiro e indica che il REM si è ormai
strutturato bene. Persiste inoltre il tracciato discontinuo delle settimane precedenti anche se più ricco in onde lente più ritmi rapidi; tale
tracciato si accompagna sempre di più agli altri parametri del sonno
calmo. Persiste ancora l’attività theta tipica delle settimane.
A settimane il sonno attivo occupa gran parte della registrazione.
L’EEG più o meno continuo è costituito da onde occipitali monomorfe di ampiezza variabile tra e microvolts, con sovrapposti ritmi
rapidi (fig.). Le regioni anteriori sono poco attive. Possono ancora
registrarsi ritmi theta tipici delle settimane precedenti. I periodi di
sonno calmo sono sempre meglio caratterizzati con una diminuzione
. Aspetti maturativi
della motilità, scomparsa dei movimenti oculari e un EEG discontinuo
con attività costituita da immagini polimorfe intervallate da periodi di
inattività, progressivamente sempre meno lunghi (fig.).
A settimane appaiono le prime onde lente bifasiche frontali o
encoches (fig.). Si tratta di grafoelementi spesso sincroni bilateralmente, caratterizzati, nella loro forma tipica, da una fase iniziale breve,
di modica ampiezza, di polarità negativa, seguita da una seconda fase
positiva, più lunga e di maggiore ampiezza ( microvolts).
A – settimane gli stati comportamentali sono ben caratterizzati
ma il tracciato differisce ancora da quello tipico del neonato a termine
di settimane: il sonno attivo conserva ancora le onde lente occipitali
sovraccaricate di ritmi rapidi presenti sin dalla a settimana e il sonno
calmo è caratterizzato da onde occipitali, a volte di ampiezza considerevole (fino a microvolts), che hanno un aspetto monomorfo,
molto diverso da quello polimorfo delle onde occipitali del tracciato
alternante di un neonato di settimane. I ritmi rapidi sono acuti, assumendo a volte l’aspetto di pseudopunte occipitali (fig. ); è a questa
età che appaiono la disritmia lenta anteriore e l’attività rolandica che
poi assumerà le caratteristiche definitive a settimane.
A settimane di età gestazionale, se si registra in buone condizioni
termiche ed ambientali, il neonato dorme per circa il % della registrazione. Il tracciato di veglia è breve, a volte del tutto assente, spesso
difficile ad interpretarsi per la presenza di artefatti di movimento ed è
identico sia ad occhi chiusi che aperti: l’attività è continua, composta
di frequenze molto variabili (,– c/s) e di ampiezza variabile da
a microvolts; tale tipo di attività viene denominata dagli Autori
francesi “activité moyenne” (Samson–Dolfuss ) ed appare già verso
la a–a settimana.
L’EEG nel corso del sonno attivo che precede il sonno calmo è
sovrapponibile a quello della veglia, ma ricco di onde lente a – c/s
sulle derivazioni posteriori (fig.); I’EEG del sonno attivo che segue il
sonno calmo è caratterizzato da una attività continua di basso voltaggio
(– microvolts), ricca in frequenze della banda theta.
Il tracciato EEG del sonno calmo è di tipo lento; le onde lente, che
hanno una ampiezza che varia da a microvolts, possono essere
sia continue (fig.) che raggrupparsi in bouffées di durata variabile
da a secondi, sincrone sui due emisferi e separate da intervalli di
attività meno ampia (fig.); è questo il “tracé alternant”.
Neurofisiologia ed elettroencefalografia neonatale
Sulle derivazioni anteriori si registrano frequentemente delle onde
lente di ampiezza media dette ”disritmia lenta anteriore”, e le punte
difasiche o encoches frontali, a volte ampie e aguzze. Sulle derivazioni
rolandiche si registra inoltre una attività di frequenza variabile dalla
banda alfa alla banda theta e punte negative, isolate o ripetitive, spesso
aguzze, che possono essere erroneamente interpretate come patologiche. All’inizio del sonno calmo l’alternanza è data soprattutto dalle
bouffées occipitali, nella seconda parte del sonno calmo, soprattutto
dalla attività rolandica.
Quanto detto sino ad ora sulle differenti caratteristiche EEG in relazione alle diverse età gestazionali ha cercato di individuare gli aspetti
più tipici ma non bisogna dimenticare che la variabilità interindividuale è molto forte, soprattutto nel corso del sonno calmo.
Quella fatta è una descrizione per esteso delle caratteristiche EEG
nelle varie epoche della gestazione nei vari stati comportamentali; da
parte di Parmelee () è stato fatto un tentativo per schematizzare
meglio le variazioni elettroencefalografiche nel corso dell’ontogenesi.
Parmelee ha individuato un codice di interpretazione visiva basato
su tre numeri. il terzo dei quali identifica il pattern fondamentale
e i primi due le variazioni maturative di tale pattern. In tal modo,
una particolare attività elettroencefalografica può immediatamente
essere classificata usando il codice. A titolo esemplificativo, essendo
il il pattern fondamentale tipico del sonno calmo caratterizzato da
attività discontinua o alternante, il codice sarà il tracciato di sonno
calmo a settimane di età gestazionale con attività discontinua a
bouffées caratterizzate da onde lente occipitali sovraccaricate di ritmi
rapidi; il codice sarà il “tracé alternant” maturo con onde lente
raggruppate in bouffées sincrone alternate a periodi di attività più
depressa a frequenza mista.
Occorre comunque sottolineare che i principi informatori di tale
codice maturativo sono gli stessi della descrizione per esteso fatta
precedentemente e che è derivata soprattutto dai lavori di Monod
() e Dreyfus–Brisac ().
Accanto alla valutazione visiva dei vari patterns maturativi, è possibile seguire la maturazione delle strutture nervose utilizzando metodi
di analisi computerizzata delI’EEG (Faienza ); in tal modo si elimina la soggettività della lettura del tracciato, affidando ad un computer
il compito di “leggerlo”. Per l’analisi del materiale elettroencefalografi-
. Aspetti maturativi
co può utilizzarsi lo studio delle funzioni di auto e cross–correlazione,
degli spettri di potenza e della funzione di coerenza; i dati che si ottengono con questo sofisticato mezzo di “lettura” concordano con le basi
teoriche della maturazione bioelettrica del S.N.C. e possono costituire
una valida base per indagini neurofisiologiche. Ma chiaramente ciò è
possibile solo in pochissimi Centri specializzati; il metodo di lettura
visiva rimane quindi quello di gran lunga più utilizzato e consente
una valutazione maturativa dell’EEG.
.. Organizzazione del sonno
Alcuni dati riguardanti questo argomento sono stati già esposti; ora
verranno trattati in maniera più organica ed estesa.
In primo luogo, occorre sottolineare come, soprattutto nel pretermine, sia molto difficile differenziare la veglia dal sonno e, nell’ambito
del sonno, i diversi stati. Sono testimonianza di tale difficoltà le differenti classificazioni comportamentali e poligrafiche che sono state
fatte: si va, nel neonato a termine, dai stati di Prechtl (), due
di sonno e tre di veglia, ai stati di Emde e Koenig (), mentre
Sterman e Hoppenbrouwers () preferiscono differenziare gli stati
nel pretermine in comportamento quieto, comportamento attivo e
stato REM, senza nominare affatto il sonno.
La classificazione in uso nel servizio di EEG del Dipartimento di
Pediatria e NPI della Sapienza Università di Roma è quella forse più
comune in letteratura e distingue stati: veglia, sonno attivo, sonno
calmo e stato indifferenziato (Allemand ):
a) veglia: periodi con occhi aperti e che si muovono orizzontalmente, con o senza movimenti diffusi del corpo, con o senza
pianto; oppure periodi con occhi chiusi ma con diffusi movimenti corporei e/o pianto, della durata di almeno minuti;
EEG, quando leggibile, tipo “activité moyenne”;
b) sonno attivo: presenza di movimenti oculari, respiro irregolare,
motilità spontanea soprattutto delle estremità e dei muscoli
mimici; assenza della attività tonica mentoniera; EEG caratterizzato da attività continua di basso voltaggio, con o senza onde
lente sovrapposte;
Neurofisiologia ed elettroencefalografia neonatale
c) sonno calmo: assenza di movimenti oculari, respiro regolare,
motilità spontanea assente, presenza della attività tonica mentoniera, EEG lento continuo o alternante.
I parametri utilizzati per classificare gli stati sono quelli di Anders
(). In un determinato periodo di registrazione ne devono essere
presenti almeno (utilizzando il medium scoring) per poter classificare uno stato; altrimenti si ha il cosiddetto “stato indifferenziato”,
cioè periodi durante i quali non vi sono parametri sufficienti né per
classificarli nel sonno attivo né nel sonno calmo.
È difficile dire quale tra i parametri suddetti sia più utile per classificare uno stato. Monod e Garma () hanno sostenuto che I’EEG e i
movimenti oculari sono i più utili; Parmelee (), invece, sostiene
che ad essere più utile è il respiro; in base alla esperienza personale è
forse il miogramma del mento il meno utile, soprattutto nel pretermine. Già le diverse definizioni degli stati del sonno utilizzate dai vari
Autori sottintendono quale parametro si consideri più significativo.
Così, se si usa la definizione REM/NREM è ai movimenti oculari che
si dà maggiore importanza; se si usano i termini sonno attivo/sonno
calmo è alla attività motoria spontanea che si presta più attenzione; se
si usa la definizione regolare/irregolare (Wolff ) è al respiro che si
pensa maggiormente.
Oltre ai parametri consigliati da Anders e che sono quelli più
universalmente usati, ve ne sono molti altri che potrebbero essere
utilizzati per differenziare gli stati: i potenziali spontanei cutanei più
frequenti nel sonno attivo rispetto al sonno calmo; la temperatura,
più elevata nel sonno calmo; la frequenza cardiaca, più regolare nel
sonno calmo; la PaO con valori maggiori nel sonno calmo rispetto al
sonno attivo; ma, anche per ottenere una maggiore uniformità di dati,
conviene che in studi poligrafici siano utilizzati i parametri di Anders.
Occorre ora sottolineare che la differenziazione in stati esposta
precedentemente è facilmente riscontrabile nel neonato a termine
ma è molto più difficile e spesso impossibile nel pretermine; vedremo
adesso come tale differenziazione si produce progressivamente nel
corso dell’ontogenesi.
Dalla alla settimana di età gestazionale vi è un unico stato
indifferenziato caratterizzato da movimenti fasici distali, rari movimenti oculari, ritmo cardiaco e respiratorio variabili, attività tonica
. Aspetti maturativi
mentoniera variabile, EEG discontinuo. Per alcuni Autori ( Jouvet
) tale stato sarebbe da assimilare al sonno attivo ma, siccome molti
parametri di tale stato sono assenti, vale la pena classificarlo come stato
indifferenziato.
A settimane si possono avere periodi di registrazione caratterizzati contemporaneamente da EEG continuo, movimenti oculari,
respiro irregolare, a tratti caduta del tono antigravitario; è il primo
abbozzo di sonno attivo.
A settimane il sonno attivo è ben strutturato sia nelle componenti comportamentali sia elettroencefalografiche e si cominciano ad
individuare dei periodi di sonno calmo che si manifestano con riduzione della attività motoria spontanea, scomparsa dei movimenti oculari,
respiro regolare ed EEG discontinuo; ma è a partire dalla a settimana
che tale stato si caratterizza in maniera completa e definitiva.
A settimane si differenzia la veglia dal sonno e quindi possono
individuarsi correttamente tutti gli stati: veglia, sonno attivo, sonno
calmo e stato indifferenziato, con caratteristiche che permangono
fondamentalmente immutate fino al termine.
In realtà, nel neonato a termine sono stati distinti da parte di alcuni
Autori (Monod e Dreyfus–Brisac , Petre–Quadens , Cianchetti
) due tipi di sonno attivo: il sonno attivo che precede il sonno
calmo, con EEG ricco in onde lente posteriori, movimenti oculari più
rari e più lenti; e sonno attivo che segue il sonno calmo con EEG di
basso voltaggio più ritmico, movimenti oculari più numerosi e più
rapidi. Crediamo che, tuttavia, sia tuttora opportuno rimanere legati
alla classificazione tradizionale in stati senza ulteriori suddivisioni.
Molto schematicamente e semplificata l’evoluzione percentuale
dei vari stati nelle varie età gestazionali è la seguente: fino alla a
settimana vi è il % di stato indifferenziato; dalla a settimana
appare il sonno attivo che occupa inizialmente circa l’% del tracciato
e diminuisce poi progressivamente fino a rappresentare al termine
circa il % di tutto il sonno; a settimane appare il sonno calmo
che occupa dapprima il –% della intera registrazione di sonno ed
aumenta progressivamente fino al % circa a settimane.
Anche sulle percentuali presentate precedentemente i pareri non
sono del tutto concordi. Tali percentuali variano a seconda dei criteri
ai quali fanno riferimento i vari Autori; ciò è soprattutto vero per
quanto concerne lo stato indifferenziato che è percentualmente tanto
Neurofisiologia ed elettroencefalografia neonatale
maggiore quanti più parametri si richiedono per caratterizzare uno
stato. Comunque si può senz’altro affermare che il sonno attivo appare
prima del sonno calmo, è percentualmente il più importante e tende
a diminuire nel corso dell’ontogenesi. Il sonno calmo appare dopo e
tende invece ad aumentare progressivamente; esso infatti richiede per
la sua espressione lo sviluppo delle complesse interazioni tra centri
corticali e strutture del tronco che si maturano in periodi più avanzati
della gestazione e, in particolare, richiede la maturazione dell’area
inibitoria telencefalica. Per il sonno attivo, almeno per quanto riguarda
i parametri fondamentali, è sufficiente invece l’attività della parte
caudale del tronco che giunge più precocemente ad un sufficiente
livello di maturazione.
Un’ultima annotazione prima di chiudere questa parte: l’organizzazione ciclica del sonno con passaggio regolare dal sonno attivo al
sonno calmo e di nuovo al sonno attivo, si struttura anch’essa nel
corso dell’ontogenesi e diviene tanto più regolare man mano che ci si
avvicina al termine (Monod ).
.. Reattività
In appendice a quanto detto sinora sugli aspetti fisiologici della attività
elettroencefalografica in età neonatale, considereremo ora la reattività, valutando essenzialmente la risposta agli stimoli acustici, i più
frequentemente utilizzati nel corso di una registrazione di routine. La
reattività elettroencefalografica al rumore si traduce direttamente sul
tracciato e si possono avere diversi tipi di risposta:
a) bouffées al vertice costituite da una punta negativa seguita o
meno da un’onda lenta. Questo tipo di risposta appare già nel
pretermine di – settimane (Monod e Garma );
b) appiattimento globale della attività. Questo tipo di risposta
è raro prima delle settimane di età gestazionale e si vede
meglio sui tracciati ampi e lenti;
c) bouffées diffuse di ritmi delta o theta; tale risposta è difficile ad
ottenersi su un tracciato alternante;
d) talvolta lo stimolo determina un cambiamento di stato con
conseguente cambiamento del tipo di tracciato.
. Aspetti maturativi
Tali risposte EEG sono tipiche del sonno calmo; nel sonno attivo
la risposta è soprattutto comportamentale con soprassalti, ammiccamenti etc.
.. Applicazioni pratiche
Le applicazioni pratiche delle nozioni neurofisiologiche di cui abbiamo trattato sinora sono molteplici. Percorrendo le tappe dell’ontogenesi della attività elettroencefalografica, si è visto che vi è una
stretta corrispondenza tra età gestazionale e maturazione EEG.
L’EEG è quindi un ottimo mezzo per determinare l’età gestazionale, essendo l’età che potremmo definire “bioelettrica” dipendente da quest’ultima e non dal peso e consente di determinare
l’età gestazionale con una approssimazione di ± una settimana.
Ciò è stato affermato già da Nolte e Hass (), attraverso uno
studio estremamente accurato e convincente effettuato utilizzando una versione aggiornata del codice di interpretazione visiva di
Parmelee; e da Tharp nella sua revue del .
Indubbiamente tale validità non è assoluta: Schulte () ha
mostrato un ritardo della maturazione EEG in nati da madre tossiemica; la stessa Dreyfus–Brisac () ha sostenuto che i piccoli
per l’età gestazionale presentano nel sonno calmo un ritardo delle caratteristiche maturative; Lombroso () ha dimostrato che
in numerose situazioni patologiche i neonati possono presentare
una maturazione bioelettrica inferiore a quella che ci si sarebbe
attesi per la loro età gestazionale. Anche nella casistica personale
sono numerosi i casi di “ringiovanimento” del tracciato a seguito di numerose noxae patogene. Comunque nella grandissima
maggioranza dei casi I’EEG è un metodo validissimo per la determinazione dell’età gestazionale; e tale validità è stata dimostrata dal
nostro gruppo anche in soggetti pretermine con ritardo di crescita
intrauterino di peso estremamente basso, per i quali da parte di
alcuni Autori (Gould , Gluck ) era stata ipotizzata una accelerazione della maturazione cerebrale. Quindi, anche in questo
caso, (Allemand ) è stata dimostrata la sostanziale dipendenza
della maturazione bioelettrica cerebrale dalla età gestazionale.
Neurofisiologia ed elettroencefalografia neonatale
Ora, se è vero che normalmente la maturazione EEG è correlata
alla età gestazionale, se in soggetti in cui l’età gestazionale è stata
correttamente accertata con altri metodi si registra una discordanza
tra età gestazionale e maturazione EEG, questo è indice di una
qualche noxa che ha determinato un arresto maturativo o una regressione a livelli maturativi inferiori. Lo studio della maturazione
bioelettrica può essere quindi un elemento utile, unitamente ad altri accertamenti clinici e laboratoristici, nella valutazione di neonati
con diversi tipi di patologia. Un altro aspetto che va sottolineato è il
seguente: la maturazione elettroencefalografica procede in pratica
allo stesso modo sia in utero che fuori dell’utero, in incubatrice:
un soggetto nato a settimane di età gestazionale ha alla nascita
un EEG abbastanza sovrapponibile a quello di un soggetto nato, ad
esempio, a settimane e registrato a settimane di vita. In realtà i
“late preterm” sembrano fisiologicamente meno maturi nella loro
organizzazione del sonno di quanto ci si aspetterebbe (Scher ).
Lo studio della maturazione bioelettrica in soggetti pretermine nel
corso delle prime settimane di vita è comunque un ottimo metodo per accertarsi della normale evoluzione maturativa del SNC di
questi neonati. In definitiva, quindi, lo studio maturativo dell’EEG
consente:
— nella gran parte dei casi l’apprezzamento dell’età gestazionale;
— in caso di discrepanza tra età “elettroencefalografica” ed
età gestazionale fa sospettare l’esistenza di una noxa che ha
bloccato i processi maturativi del S.N.C.;
— studi EEG seriati nei pretermine nel corso del loro accrescimento permettono di apprezzare il normale evolversi dei
processi maturativi del S.N.C. o eventuali alterazioni di tale
evoluzione.
Esamineremo ora le applicazioni pratiche delle conoscenze
sull’organizzazione del sonno.
Essendo quest’ultima il risultato della maturazione di numerose strutture anatomiche e di complessi meccanismi biochimici, è
naturale che una sofferenza del S.N.C. possa alterarla. Una buona
organizzazione del sonno è quindi generalmente indice di integrità
. Aspetti maturativi
del S.N.C. del neonato. Tre tipi principali di alterazione del sonno
possono riscontrarsi:
a) assenza della organizzazione del sonno: tale fenomeno può
riscontrarsi con molti tipi di tracciato EEG ma più spesso
si ha con tracciati estremamente alterati quali l’inattivo e
il parossistico (ved cap. successivo), in soggetti per lo più
comatosi. In tali circostanze la prognosi è quasi obbligatoriamente catastrofica e sottintende alterazioni gravissime del
S.N.C.;
b) in alcune situazioni meno gravi può riscontrarsi assenza
della normale relazione tra i vari parametri fisiologici che
concorrono a determinare uno stato. Per esempio, la respirazione può essere irregolare durante il sonno calmo e i
movimenti oculari possono essere assenti nel corso del sonno attivo. Tali alterazioni fanno sì che lunghi periodi della
registrazione vengano classificati come stato indifferenziato.
Fenomeni di questo tipo sono stati riscontrati sia da noi (Allemand ) sia in precedenza da altri Autori (Dreyfus–Brisac
e Monod ) in numerose situazioni patologiche e sono
spesso tra le più precoci alterazioni che si riscontrano all’insorgere di un processo morboso interessante il S.N.C. La
prognosi è negativa se tale discrepanza persiste in numerose
registrazioni successive nelle prime settimane di vita;
c) possono inoltre esservi modificazioni della lunghezza dei
vari stati: può aumentare la veglia a detrimento del sonno;
può aumentare il sonno attivo o, viceversa, il sonno calmo;
può esservi un allungamento globale dell’intero ciclo, o, all’inverso, un accorciamento dovuto a rapidi cambiamenti di
stato. In questi casi, però, non può essere formulato un preciso giudizio prognostico, essendo molti i fattori che possono
influenzare la durata degli stati e non tutti legati a sofferenza
cerebrale. I risultati della casistica personale inducono a ritenere tali modificazioni come assolutamente non aggravanti
la prognosi (Allemand –). La presenza contemporanea di alterazione della organizzazione del sonno e di crisi
EEG è un elemento prognosticamente molto sfavorevole
(Nunes ).
Neurofisiologia ed elettroencefalografia neonatale
Concludiamo questa parte riguardante l’utilità pratica degli studi sulla
organizzazione del sonno accennando ad uno dei temi di ricerca su cui
maggiormente si è incentrata l’attenzione di pediatri, neurofisiologi e
fisiopatologi respiratori: l’apnea in età neonatale. È ormai opinione comune che si debbano distinguere tipi di apnea in età neonatale (Schulte
):
a) apnea quale espressione di una crisi convulsiva (fig.);
b) apnea cosiddetta neurogena o “blackout apnea’‘ caratterizzata da
contemporanea cessazione del flusso d’aria a livello del naso e
degli sforzi muscolari respiratori;
c) apnea ostruttiva caratterizzata da cessazione del flusso d’aria attraverso il naso ma da contemporanei sforzi muscolari respiratori;
d) apnea mista quando una fase iniziale neurogena è seguita da una
fase con ostruzione delle prime vie aeree (il contrario è molto più
raro, Guilleminault ).
Non vi sono dubbi sul fatto che vi sia una relazione stretta tra stati del
sonno e diversa incidenza di apnee. Se le apnee miste e quelle ostruttive
avvengono più frequentemente nel sonno calmo, l’incidenza di apnee
cosiddette neurogene è molto maggiore nel sonno attivo; ed è su queste
ultime che focalizzerò l’attenzione, essendo le più frequenti, soprattutto
nei pretermine. Normalmente si ritiene che in caso di apnea neurogena
si abbia una riduzione generalizzata dello stato di eccitazione dei neuroni
della sostanza reticolare. È attraverso l’attività di questi neuroni che si
ha l’eccitazione sia dei neuroni della corteccia che dei motoneuroni
spinali, dei neuroni dei centri respiratori, dei neuroni dei nuclei preposti
al controllo della frequenza cardiaca e della pressione arteriosa; una
diminuzione quindi dello stato di eccitazione della reticolare si ripercuote
negativamente sull’attività di tutti i complessi neuronali precedentemente
menzionati.
L’attività continua della sostanza reticolare è mantenuta attraverso
una grande quantità di connessioni sinaptiche. I neuroni immaturi
dei pretermine, nei quali l’apnea neurogena è più frequente, hanno
un minor numero di dendriti e poche connessioni sinaptiche. Per
questa ragione l’eccitabilità delle cellule nervose è bassa e basta un lieve disturbo del metabolismo cellulare per determinare una completa
caduta dell’attività della reticolare romboencefalica con conseguente
. Aspetti maturativi
diminuzione dì voltaggio dell’EEG (espressione della ridotta attività corticale), arresto respiratorio, ipotonia dei muscoli scheletrici e
diminuzione della pressione arteriosa.
Nei soggetti pretermine la gran parte delle crisi di apnea avviene
nel corso del sonno REM (Gabriel ; Monod ; Allemand );
ed inoltre in questo stato le crisi sono più frequentemente accompagnate da bradicardia e tendono a durare più a lungo. La spiegazione di tale
fenomeno risiede verosimilmente nella inibizione cui sono soggetti i
motoneuroni periferici nel corso del sonno attivo, inibizione che nelle
registrazioni poligrafiche di routine è testimoniata dalla perdita del
tono dei muscoli mentonieri. Hagon () e Henderson–Smart (),
studiando l’attività dei motoneuroni che innervano il diaframma e
la muscolatura intercostale nei vari stati del sonno hanno dimostrato
una inibizione di tale attività nel corso del sonno attivo, che riguarda
sia i motoneuroni alfa che le fibre afferenti la (Schulte ). Tale
inibizione interferisce con i meccanismi riflessi a partenza dei recettori meccanici situati nella muscolatura intercostale e probabilmente
con altre afferenze che contribuiscono a regolare la ventilazione, con
conseguenti pause respiratorie e maggior incidenza di apnee. Inoltre
Bryan e Bryan () hanno dimostrato che è soprattutto durante il sonno
attivo che la gabbia toracica perde la sua stabilità; sempre nel corso del
sonno REM si osservano in fase inspiratoria frequenti retrazioni toraciche
piuttosto che espansioni (Curzi–Dascalova –). Questo pattern
respiratorio paradosso si ha soprattutto nei pretermine nei quali l’attività
tonica dei muscoli intercostali è ridotta e risente fortemente degli impulsi
inibitori durante il sonno REM; quindi la contrazione diaframmatica in
fase inspiratoria causa la retrazione della gabbia toracica poiché non è
contrastata da un incremento del tono riflesso dei muscoli intercostali.
Quanto detto sinora non implica chiaramente che episodi di apnea
neurogena intervengano solo nel sonno attivo Shannon () e Guilleminault () hanno dimostrato che alcuni tra i più gravi episodi di
“blackout apnea’‘ si hanno nel sonno calmo. Tuttavia non pare ci siano
dubbi su una maggior incidenza di apnee neurogene nel corso del sonno
attivo (Gabriel –Hoppenbrouwers (). Anche in studi personali (Allemand ) tale maggior incidenza di apnee nel sonno attivo è apparsa
chiaramente sia in neonati a termine che pretermine.
Ecco quindi un aspetto particolarmente significativo dell’applicazione
nella pratica neonatologica delle conoscenze sulla organizzazione del
Neurofisiologia ed elettroencefalografia neonatale
sonno; è impossibile studiare correttamente l’apnea neurogena senza far
riferimento agli stati del sonno. A conclusione di questo capitolo si può
affermare quanto segue: vi è una stretta correlazione tra maturazione
cerebrale ed evoluzione della attività elettroencefalografica e della organizzazione del sonno, così che ad ogni età gestazionale corrisponde
una diversa “età bioelettrica” ed anche il sonno si struttura ontogeneticamente seguendo tappe fisse: da uno stato indifferenziato emerge alla
a settimana il sonno attivo, alla a settimana il sonno calmo e alla
a settimana la veglia; ma è solo nelle ultime settimane di gestazione
che tali stati si strutturano compiutamente.
L’esistenza della correlazione suddetta consente di determinare
attraverso I’EEG l’età gestazionale o, in caso di discrepanza tra età
gestazionale ed “età bioelettrica”, sospettare l’esistenza di una noxa
che abbia bloccato i processi maturativi. Anche lo studio dell’organizzazione del sonno trova applicazioni in età neonatale. Una buona
organizzazione del sonno è indice di integrità del S.N.C., soprattutto
del tronco dell’encefalo; una assenza dell’organizzazione è invece un
evento prognosticamente sfavorevole. Sono inoltre numerose le situazioni sia fisiologiche che patologiche correlate con gli stati del sonno;
particolarmente significativa è in età neonatale l’apnea neurogena,
strettamente correlata con il sonno attivo, correlazione questa che ha
aperto nuove prospettive alla ricerca neurofisiologica in età neonatale.
Capitolo IV
L’EEG neonatale patologico
Le noxae patogene che possono interessare il SNC del neonato sono molteplici e di conseguenza è frequente il riscontro di alterazioni
EEG in soggetti degenti in reparti di patologia neonatale o di terapia
intensiva. Il SNC può essere interessato sia da alterazioni transitorie di
natura metabolica (ipoglicemia. iponatremia. ipocalcemia etc.) o, più
generalmente, di tipo funzionale, sia da alterazioni primitivamente
organiche quali la necrosi neuronale, le emorragie, le meningiti, le
malformazioni etc. Naturalmente queste ultime sono considerate di
gran lunga più preoccupanti delle prime, anche se una distinzione netta tra i due differenti gruppi eziologici non è assolutamente possibile
(ad esempio una ipoglicemia persistente determina necrosi neuronale
e, d’altro canto, l’encefalopatia ipossico–ischemica può accompagnarsi
ad ipoglicemia, iponatremia, ipocalcemia etc.).
Purtroppo la gran parte delle alterazioni EEG neonatali è aspecifica
e sulla base di un singolo EEG non si può stabilire se ci si trovi di fronte
a transitorie alterazioni di natura funzionale o metabolica o a un danno
organico più permanente: basti pensare che un tracciato fortemente
depresso può registrarsi a causa di una massiva somministrazione di
benzodiazepine o a seguito di una crisi di apnea prolungata con rapida
caduta della PO (Roberton ). Allo stesso modo può esserci un disturbo marcato della attività di fondo elettroencefalografica dopo una
crisi convulsiva prolungata o negli istanti immediatamente seguenti
un parto difficoltoso. Chiaramente tali alterazioni EEG sono molto
spesso transitorie ma possono non essere distinte da alterazioni EEG
più permanenti legate ad alterazioni neuropatologiche imponenti, se
ci si basa sulle caratteristiche di un singolo tracciato.
D’altra parte, un tracciato molto alterato registrato precocemente
in caso di encefalopatie gravi spesso può apparentemente “normalizzarsi’‘ nei giorni e nelle settimane successive. Nella casistica riportata
Neurofisiologia ed elettroencefalografia neonatale
da Tharp () nel % dei soggetti con sequele gravi che avevano
presentato EEG patologici nei primi giorni di vita, l’ultimo tracciato
registrato in età neonatale era normale. Se quindi un unico tracciato
registrato subito dopo la nascita o comunque nella fase iniziale e acuta
del processo morboso può indurre in errore apparendo a volte più
grave di quanto presupponga l’evento patologico che lo sottintende,
a causa di disturbi funzionali transitori, un unico tracciato registrato
subito prima della dimissione, o comunque tardivamente, può essere
ancora più fuorviante perché può indurre ad ottimismi mal riposti.
L’unica soluzione a tale problema consiste nel registrare un tracciato precocemente, subito dopo che ha agito una noxa patogena,
sia per fini diagnostici (ad esempio in caso di crisi convulsive solo
EEG), sia per formulare un iniziale giudizio prognostico; giudizio
che sarà comunque meglio precisato sulla base delle registrazioni
successive. È infatti indispensabile ripetere frequentemente le registrazioni per seguire correttamente l’evoluzione del processo morboso
e per chiarire meglio il giudizio di gravità, o effettuare monitoraggi
molto prolungati. Il progressivo deteriorarsi dell’EEG o il persistere di
alterazioni gravi impongono un giudizio prognostico severo; d’altra
parte il normalizzarsi tardivo di tracciati inizialmente molto alterati
non è elemento sufficiente per rendere la prognosi più favorevole.
Quanto detto sino ad ora deve essere tenuto assolutamente presente
se si vuole dare un giudizio corretto sulla patologia dell’EEG sia nel
neonato a termine che pretermine; altrimenti si corre il rischio grave
di mal interpretare un tracciato e di trasformare I’EEG da ottimo
supporto per la clinica a strumento causa di errori e fraintendimenti.
In definitiva, occorre tenere ben presenti i seguenti punti:
a) un unico tracciato registrato nella fase post–acuta è non solo
inutile ma pericoloso perché può facilmente indurre a formulare giudizi assolutamente non corrispondenti alla reale gravità
dell’evento morboso;
b) un tracciato registrato immediatamente dopo un evento acuto,
se può essere molto utile dal punto di vista diagnostico, soprattutto in caso di convulsività, può apparire più gravemente
alterato di quanto in realtà presupponga la patologia soggiacente perché può risentire di disturbi metabolici o “funzionali”
transitori (Plouin );
. L’EEG neonatale patologico
c) solo attraverso registrazioni continue di lunga durata o registrazioni seriate iniziate precocemente e proseguite per l’intero
periodo neonatale, in fase acuta con cadenza ravvicinata (anche giornaliera), in fase post–acuta con cadenza più rallentata
(generalmente settimanale), si può giungere ad un uso corretto della elettroencefalografia neonatale sia dal punto di vista
diagnostico che, soprattutto, dal punto di vista prognostico.
.. L’eeg patologico del neonato a termine
Per miglior chiarezza espositiva verranno considerati separatamente le
alterazioni della attività di fondo, le modificazioni della organizzazione
spaziale e temporale e il sovraccarico di grafoelementi patologici.
Alterazioni della attività di fondo
— Tracciato inattivo, è un tracciato il cui voltaggio è permanentemente
inferiore a microvolts (fig.); per poter affermare ciò con precisione
occorre registrare con una potenza di , microvolts per mm., utilizzando voltaggi a lunga distanza e avendo cura di eliminare qualsiasi
artefatto che possa simulare una attività cerebrale; bisogna inoltre
registrare per almeno due ore e ripetere possibilmente la registrazione il giorno successivo. Nel corso delle prime ore di vita si
possono registrare tracciati inattivi reversibili e, eccezionalmente, con
evoluzione non del tutto sfavorevole; a partire dal ° giorno di vita la
prognosi è catastrofica (Monod ). Il tracciato inattivo che è anche
areattivo e senza organizzazione del sonno deve far ipotizzare lesioni
necrotiche gravissime (Larroche ; Monod ). La persistenza
di una organizzazione clinica del ciclo del sonno in un neonato con
tracciato inattivo deve invece indurre a pensare ad una malformazione
cerebrale grave. Tale tipo di tracciato generalmente scompare dopo la
seconda settimana di vita.
— Tracciato parossistico o permanente discontinuo è caratterizzato da
bouffées composte di figure variabili (punte, ritmi theta e delta) sopravvenenti con discreta periodicità sui due emisferi, intervallate da
periodi di tracciato inattivo (figg.–). Anche tale tracciato è areattivo, si accompagna a scomparsa del ciclo del sonno e comporta una
Neurofisiologia ed elettroencefalografia neonatale
prognosi catastrofica (Monod ). Per lo più il tracciato parossistico
si registra nella prima settimana di vita, più raramente nella seconda.
Come il tracciato inattivo ha il suo corrispettivo anatomo–patologico
nella necrosi neuronale massiva (Larroche ; Monod ).
— Tracciato di basso voltaggio, è caratterizzato da un voltaggio di –
microvolts (fig.); questo tipo di tracciato presenta spesso una labilità
e una reattività e si accompagna a volte ad una organizzazione del
ciclo del sonno. In tal caso nel sonno calmo può raggiungere anche
i microvolts. La sua prognosi è grave solo se persiste al di là della
seconda settimana di vita (Monod ); tale tracciato può evocare una
anossia di modico grado, a volte un ematoma subdurale bilaterale o
una malformazione cerebrale.
— Tracciato di basso voltaggio con sovraccarico di grafoelementi patologici, differisce dal precedente per la presenza di ritmi theta o bouffées
di elementi parossistici (fig.) o crisi elettriche o onde lente sovraccaricanti il tracciato di base; si accompagna ad una prognosi molto
grave (Monod ) e traduce una sofferenza cerebrale diffusa su base
anossico–ischemica con zone di necrosi localizzate ed edema cerebrale; la persistenza della organizzazione del sonno in questo tipo di
tracciato rappresenta un elemento prognostico favorevole.
— Tracciato ritmico, è un tracciato di voltaggio medio ma costituito
essenzialmente da frequenze theta ritmiche anche nel sonno calmo.
Tale tracciato conserva per lo più reattività, labilità ed organizzazione
del sonno. Si riscontra spesso come tracciato intercritico soprattutto
nelle crisi neonatali benigne e non comporta una prognosi sfavorevole.
— tracciato lento, è caratterizzato da una attività lenta, continua e diffusa
a ,/ c/s, d’ampiezza variabile e presente in tutti gli stati del sonno;
si riscontra in caso di encefalopatia ipossico–ischemica, di meningiti
batteriche e di alcune malattie metaboliche; la persistenza al di là della
seconda settimana di questo tipo di tracciato comporta una prognosi
sfavorevole.
Modificazioni della organizzazione spaziale e temporale
— Assenza di labilità, consiste in una assenza completa di variazione di
ampiezza e di morfologia dei pattern EEG durante l’intero tracciato.
Si riscontra soprattutto nei tracciati inattivi, parossistici, lenti, di basso
voltaggio con sovraccarico di grafoelementi patologici. Induce ad un
giudizio prognostico sfavorevole.
. L’EEG neonatale patologico
— Assenza di organizzazione spaziale, è caratterizzata da mancanza di
differenziazione antero–posteriore ed è prognosticamente sfavorevole
se persiste al di là della seconda settimana di vita.
— Assenza di attività occipitale, è un evento raro ed ha un significato
prognostico sfavorevole se si registra al di là della seconda settimana.
— Asinergia e asincronia nel nato a termine, asinergia e asincronia marcate nell’attività tra i due emisferi si osservano frequentemente nel
tracciato parossistico e nel tracciato di basso voltaggio con sovraccarico di grafoelementi patologici; rivestono un significato prognostico sfavorevole se registrate dopo la settimana di età gestazionale
(fig.).
— Asimmetrie, le asimmetrie di ampiezza sono frequenti (fig.–);
spesso sono un artefatto legato a banali situazioni extracerebrali (infusioni epicraniche, tumore da parto, edema del cuoio capelluto) e, se
incostanti, non rivestono alcun significato. Generalmente non sono
in relazione a lesioni localizzate — le emorragie subdurali, ad esempio, eccezionalmente si accompagnano a depressione omolaterale
dell’attività EEG (Allemand ). Rivestono un significato prognostico sfavorevole se sono persistenti e se la differenza è superiore al %
(Varner ).
Sovraccarico di grafoelementi patologici
— “Encoches” frontali o onde aguzze difasiche frontali, sono, come si è visto nel capitolo dedicato alla maturazione EEG, un grafoelemento che
appare fisiologicamente intorno alla a settimana di età gestazionale
si distinguono in encoches frontali tipiche (fig.) ed atipiche. Vengono
registrate in neonati perfettamente normali con una frequenza molto
variabile: nel sonno calmo da un massimo di ogni secondi ad un
minimo di ogni minuti; nel sonno attivo che segue la veglia molto
più frequentemente che nel sonno attivo che segue il sonno calmo (
ogni minuti rispetto a ogni minuti–Statz ). Una frequenza
abnormemente elevata di tali grafoelementi era stata riscontrata già
nel da Dreyfus–Brisac in neonati con disturbi metabolici transitori. Arfel () ha attribuito un significato prognostico sfavorevole ad
un eccesso di encoches frontali. Risultati di studi personali (Allemand
) hanno mostrato una correlazione tra eccesso di encoches frontali
e alterazioni minori dello sviluppo neuromotorio, correlazione già
ipotizzata da Tharp ().
Neurofisiologia ed elettroencefalografia neonatale
— crisi elettriche, possono avere aspetti molto diversi: le crisi generalizzate sono rare; per lo più interessano solo una regione o più regioni di
uno dei due emisferi; le aree rolandiche ed occipitali sono interessate
più spesso di quelle frontali e temporali. Le crisi sono costituite da
attività ritmica, ripetitiva, costituita da punte positive o negative, onde
lente monomorfe a – c/s (fig.), onde aguzze (fig.), ritmi theta o
pseudoalfa (fig.) con frequenza variabile da a c/s e con ampiezza
di – microvolts interessanti generalmente le aree rolandiche ed
occipitali. La loro durata è variabile (da pochi secondi, per lo più il
minimo è , ad alcune decine di minuti) ed anche la sequenza dei
vari patterns è molto variabile.
La differenziazione tra crisi elettriche ed artefatti (polso, ECG,
respiro, tremori) non sempre è facile, donde la necessità della registrazione simultanea dei parametri suddetti. Il rapporto tra crisi elettriche
e cliniche è variabile; le crisi cloniche si accompagnano più di frequente a punte; le crisi toniche a treni di onde delta; i ritmi alfa/like
si riscontrano spesso in corso di convulsioni apneizzanti (Passouant
; DreyfusBrisac ). Ma spesso le crisi sono solo elettriche o
a traduzione unicamente vegetativa. Le crisi elettrocliniche tipiche
hanno frequentemente una localizzazione rolandica. La presenza di
dissociazione elettroclinica (crisi elettriche senza traduzione clinica o
rare crisi cliniche senza traduzione elettrica ma con tracciato intercritico estremamente alterato) è di significato prognostico sfavorevole
(Monod ).
Le crisi elettriche isolate hanno una prognosi meno grave rispetto
allo stato di male (successione di crisi subentranti per almeno un’ora
con vigilanza alterata nella fase intercritica); la prognosi dipende comunque soprattutto dalla qualità del tracciato intercritico (Allemand
– Lawrence ).
— Disritmia lenta anteriore , differisce dalla attività fisiologica del sonno
calmo perché caratterizzata da immagini più lente, ampie e monomorfe, inabitualmente ripetitive. Può riscontrarsi in caso di malattie
metaboliche o di malformazioni e ha valore peggiorativo solo se persiste al di là della seconda settimana in neonati di età gestazionale
maggiore di settimane.
— attività beta ritmica, nella forma di “spindle delta bursts” appare molto raramente nell’EEG del neonato a termine (approssimativamente
due grafoelementi ogni 0 ). Nel lavoro personale del un eccesso
. L’EEG neonatale patologico
di tali “brushes” è stato riscontrato più frequentemente in neonati
che poi hanno presentato uno sviluppo neuromotorio modicamente
problematico.
— Attività alfa ritmica, Statz () afferma che si riscontra nel %
de neonati perfettamente normali, con localizzazione predominante
nelle regioni centrali e frontali; si tratta quindi di un reperto relativamente frequente in condizioni fisiologiche; tuttavia Monod ()
ha assegnato alla attività alfa ritmica non rolandica un significato prognostico sfavorevole. — Punte e onde aguzze, si tratta generalmente di
grafoelementi con ampiezza minore di microvolts. Nella popolazione studiata da Statz () composta di neonati perfettamente normali,
sono state riscontrate in tutti i soggetti nel corso del sonno calmo
con una incidenza variabile da ogni 00 a ogni 00 . Al contrario
nel sonno REM sono state riscontrate solo nel % dei neonati con
una frequenza variabile da ogni 0 a ogni 0 . Nella veglia nel %
dei neonati con una incidenza sempre inferiore a ogni 0 . Si tratta
quindi di un evento relativamente frequente in condizione di perfetta
normalità. Soprattutto, non va dimenticato che le punte rolandiche
negative sono perfettamente fisiologiche nel corso del sonno calmo.
Le punte frontali, temporali e occipitali sono apparse correlabili con
sviluppo neuromotorio problematico se presenti con frequenza maggiore di quella sopra indicata (Allemand ). Monod () distingue
le punte lente (di durata maggiore di msec.), senza alcun significato
prognostico sfavorevole, dalle punte rapide (di durata minore di
msec.), la cui prognosi varia con l’età; nell’ambito delle punte rapide
l’Autrice distingue:
— punte rapide localizzate ripetitive, persistenti per più di una
settimana, a prognosi sfavorevole e indice di una sofferenza cerebrale grave, spesso localizzata (malformazioni, poroencefalia,
eccezionalmente emorragia intracerebrale);
— punte rapide sporadiche, a prognosi favorevole se registrate nel
corso della prima settimana, a prognosi sfavorevole se registrate
dopo la seconda settimana in soggetti di settimane di età
gestazionale o più.
Da quanto esposto sinora risulta evidente che per esprimere un
giudizio sulla entità delle alterazioni EEG nel neonato a termine sia
Neurofisiologia ed elettroencefalografia neonatale
molto più importante lo studio globale della attività di fondo e della
organizzazione spaziale e temporale in relazione ai differenti stati
comportamentali, piuttosto che la ricerca dei singoli grafoelementi e
della loro localizzazione. È questa una delle peculiarità più significative
della elettroencefalografia neonatale e si riflette anche sulla tecnica di
registrazione che, finalizzata allo studio della organizzazione generale
della attività EEG, deve utilizzare come già affermato, pochi montaggi
e tempi di registrazione prolungati.
Capitolo V
L’EEG patologico del neonato pretermine
Per molto tempo le caratteristiche del tracciato patologico del pretermine sono state mal definite anche se alcune alterazioni considerate
come molto gravi erano già state descritte da Cukier () (le punte rolandiche positive frequenti secondo l’autrice nella emorragia
intraventricolare del pretermine, in realtà molto più frequenti nella
leucomalacia periventricolare); e da Lombroso () (regressione della maturazione bioelettrica in caso di sofferenza neurologica). Già
alla fine degli anni e all’inizio degli anni , però, sono apparsi
in letteratura lavori che hanno considerato in maniera più completa
l’EEG patologico del pretermine ed hanno attribuito ad esso valore
prognostico; sulla base di tali lavori (Tharp –) i tracciati del
pretermine possono essere distinti in quattro gruppi a seconda della
loro gravità; tale distinzione ha un sicuro valore prognostico (West
):
a) anomalie maggiori; tracciato parossistico caratterizzato da attività permanentemente discontinua, non modificata da stimolazioni, priva di qualsiasi ritmo fisiologico tipico di quell’età
gestazionale; tracciato inattivo; crisi elettriche con o senza traduzione clinica (fig.a); punte rolandiche positive (fig. );
asimmetria d’ampiezza superiore al % e persistente; asincronia permanente associata a punte multifocali e a bouffées di
ritmi rapidi rolandici;
b) anomalie moderate (fig.); tracciato di basso voltaggio nel
quale i ritmi fisiologici tipici dell’età gestazionale del soggetto
sono mal identificabili; asimmetria inferiore al % con ritmo
di fondo considerato come anormale per l’età gestazionale del
soggetto; asinergia considerata come eccessiva per l’età gestazionale del soggetto; ritmi rapidi tipici di una età gestazionale
più immatura rispetto a quella del soggetto in esame;
Neurofisiologia ed elettroencefalografia neonatale
c) tracciati subnormali; si tratta di tracciati presentanti anomalie
non considerate nei due gruppi precedenti;
d) tracciati normali; le caratteristiche di questi ultimi sono state
considerate nel capitolo dedicato alla maturazione bioelettrica.
Il significato prognostico di tale distinzione verrà estesamente considerato nel capitolo dedicato alla prognosi. Anche altri Autori in questi
ultimi anni hanno sottolineato l’importanza dell’EEG nella sofferenza
neurologica del neonato pretermine. Radvanyi () ha sottolineato
l’importanza dell’EEG nel riconoscere crisi elettriche infracliniche o
crisi cliniche atipiche, molto frequenti nei pretermine ed ha attribuito
valore prognostico sfavorevole alla associazione di crisi EEG, alterazioni della attività di fondo e assenza di criteri maturativi. Ferrari ()
ha sostenuto giustamente che, proprio in quanto la sintomatologia
del pretermine è aspecifica e indifferenziata, l’EEG rappresenta un
aiuto prezioso essendo in grado di documentare la presenza di una
sofferenza cerebrale, di indicarne la entità, di meglio caratterizzare le
crisi convulsive atipiche. In definitiva, oggi esistono pochi dubbi sul
valore dell’EEG nella sofferenza neurologica del neonato pretermine,
sia perché l’EEG è spesso insostituibile nel diagnosticare le crisi convulsive (nel pretermine esiste più spesso che nel neonato a termine
una dissociazione elettroclinica e spesso le crisi cliniche sono atipiche); sia perché esistono grafoelementi evocatori della leucomalacia
periventricolare (le punte rolandiche positive) e della necrosi sottocorticale (punte temporali positive); sia perché, infine, l’EEG riveste
valore prognostico (le anomalie maggiori si accompagnano a prognosi grave). L’evoluzione dell’EEG studiata con registrazioni seriate a
diverse età gestazionali consente, anche attraverso la determinazione
della maturazione bioelettrica e dell’ontogenesi dell’organizzazione
del sonno, di acquisire elementi indicativi riguardo all’entità del danno
subito dal S.N.C. e ai possibili meccanismi di recupero di quest’ultimo.
Capitolo VI
Valore prognostico dell’EEG neonatale
È obbligatorio dedicare un capitolo a parte al valore prognostico
dell’EEG neonatale, anche se cenni su questo argomento sono stati già
fatti nei capitoli precedenti, perché l’apporto che I’EEG può dare nella
formulazione precoce di un giudizio prognostico è forse l’aspetto più
significativo di tutta l’elettroencefalografia neonatale.
Per lungo tempo il valore prognostico dell’EEG è stato un problema controverso: alcuni Autori negavano qualsiasi valore all’EEG
neonatale (Harris e Tizard , Torres e Blaw ); altri, sulla base
dei risultati di studi longitudinali lo ritenevano invece utile (Dreyfus
Brisac , Engel , Dubois–Dalcq , Monod e Ducas );
altri ancora sostenevano che neonati ad alto rischio presentavano
tracciati più alterati rispetto a neonati a basso rischio (Imperato ,
Landucci–Rubini e Faienza , Rosen e Satran , , , Tibbles
e Prichard ). Tali differenze erano indubbiamente dovute alla difficoltà di condurre adeguati studi longitudinali, ma anche alla difficoltà
di classificare correttamente le alterazioni EEG.
Il lavoro pubblicato da Monod nel , basato sullo studio di
neonati ha poi dimostrato inequivocabilmente per il neonato a termine e per il “late preterm” che esistono numerose alterazioni EEG
correlate con sequele neurologiche a distanza, mentre, d’altro lato,
un tracciato neonatale normale si accompagna generalmente ad una
evoluzione favorevole. Tale lavoro riveste una importanza capitale
nell’ambito dell’elettroencefalografia neonatale ed occorre quindi
illustrarne i risultati estensivamente
L’attività di fondo è la caratteristica EEG più utile ai fini prognostici
(Nosralla ); nella Tabella I sono schematizzati e semplificati i
risultati ottenuti da Monod.
In pratica, un EEG di fondo normale ha una prognosi sostanzialmente favorevole (i casi a prognosi sfavorevole sono tutti deceduti
Neurofisiologia ed elettroencefalografia neonatale
per cause extracerebrali), mentre, al contrario, il tracciato inattivo, il
tracciato parossistico, il tracciato di basso voltaggio + grafoelementi
patologici (ritmi theta, crisi, bouffées parossistiche) hanno tutti una
prognosi catastrofica. Il tracciato lento e quello di basso voltaggio sono
a prognosi sfavorevole se persistono al di là della seconda settimana di
vita.
Per quanto riguarda le alterazioni della organizzazione spaziale e
temporale il lavoro di Monod attribuisce importanza in senso peggiorativo per la prognosi alla assenza di labilità, alla marcata asinergia, alla
attività occipitale persistentemente di basso voltaggio e alla asimmetria
molto marcata e persistente associata alla asincronia.
Per quanto concerne le alterazioni localizzate, le crisi EEG rivestono un significato prognostico sfavorevole soprattutto quando si ha la
cosiddetta dissociazione elettroclinica e quando le crisi sono di tipo
multifocale, in accordo quest’ultimo dato con quanto già affermato
da Rose e Lombroso (). Riguardo alle punte, solo quelle rapide,
ripetitive e localizzate, persistenti per più di una settimana sono a
prognosi sfavorevole, come pure i ritmi beta con ampiezza maggiore
di microvolts e i ritmi delta e subdelta diffusi e ripetuti.
I risultati del lavoro di Monod sono tuttora la base per la attribuzione del valore prognostico all’EEG del neonato a termine; tra gli
apporti successivi più significativi vanno segnalati quelli di Varner
() che ha dimostrato l’importanza delle asimmetrie di ampiezza di
valore superiore al %, di Arfel () che ha meglio caratterizzato il
significato prognosticamente sfavorevole dell’eccesso di punte difasiche frontali, di Tharp () che nella sua eccellente review ha meglio
caratterizzato i limiti tra EEG patologico ed EEG normale. Holmes
() ha confermato che la attività di fondo elettroencefalografica
è un parametro eccellente per predire l’evoluzione neurologica di
neonati a termine con asfissia, più sensibile dell’esame neurologico
clinico: il tracciato inattivo, quello di basso voltaggio e quello a tipo
“burst suppression” sono risultati fortemente correlabili con sequele
neurologiche gravi. Anche il lavoro di Caravale () ha confermato
il valore prognostico molto alto dell’EEG in soggetti con encefalopatia
neonatale.
Dati significativi sul valore prognostico dell’EEG nel pretermine
sono apparsi in letteratura molto più tardi; il primo Autore che ha
pubblicato un lavoro su questo argomento è stato Ellingson () che
. Valore prognostico dell’EEG neonatale
An.
EEG.
mag.
ev.
sequele
norm. min.
sequele
mag.
morti
Tabella .
però ha studiato solo le caratteristiche elettroencefalografiche maturative in una popolazione di pretermine apparentemente normali. Le
conclusioni dell’Autore sono state che lo studio della sequenza maturativa dell’EEG è di scarsa utilità nel predire l’evoluzione neurologica
a distanza (nella popolazione in esame le caratteristiche maturative
dell’EEG erano sempre risultate normali, mentre al follow up il %
di questi soggetti risultò con anomalie neurologiche).
Ma è con lo studio di Tharp, Cukier e Monod (–) che si è
sufficientemente chiarito il valore prognostico dell’EEG anche nei pretermine: basandosi sulla distinzione delle anomalie EEG in gruppi,
come riportato nel capitolo precedente, gli Autori hanno dimostrato
una correlazione statisticamente molto significativa tra anomalie EEG
“maggiori’‘ e prognosi sfavorevole; per quanto concerne il gruppo delle anomalie moderate, il valore prognostico è risultato meno evidente,
mentre un giudizio prognostico favorevole è possibile attribuire a
coloro che per tutto il periodo neonatale presentino tracciati normali
o solo moderatamente alterati.
Negli anni successivi ricerche riguardanti il valore prognostico dell’EEG neonatale sono state condotte anche nell’Università di Roma.
Allemand nel ha studiato le correlazioni tra l’evoluzione a distanza ed alcune caratteristiche EEG neonatali (attività di fondo, labilità,
organizzazione del sonno, crisi EEG, grafoelementi patologici) in
soggetti, pretermine e a termine. I risultati ottenuti hanno messo in evidenza che alterazioni gravi della attività di fondo, assenza di
labilità, assenza di organizzazione del sonno, presenza di crisi EEG,
si accompagnano nel neonato a termine a prognosi molto grave e
sono in grado di distinguere una popolazione a prognosi infausta da
una popolazione con evoluzione normale o moderatamente alterata;
nei neonati pretermine la presenza di anomalie “maggiori” secondo
Tharp () è risultata correlabile con evoluzione sfavorevole. Tali
Neurofisiologia ed elettroencefalografia neonatale
risultati sono sostanzialmente in accordo con quanto riportato in letteratura e confermano quindi le conclusioni riportate precedentemente.
Ma particolarmente degno di nota è il risultato delle ricerche personali
riguardanti i grafoelementi patologici (encoches frontali, attività beta
ritmica, punte ed onde aguzze, disritmia lenta anteriore) sovraccaricanti un tracciato di voltaggio normale (Allemand ). Questo
parametro era stato sempre considerato dai diversi Autori che si sono
interessati di elettroencefalografia neonatale di significato relativo; la
presenza in grado eccessivo (superiore ai limiti riportati da Statz nel
) di grafoelementi “patologici” è risultata invece ben correlabile
con una maggior incidenza di problemi lievi di sviluppo neurologico. L’EEG normale è quindi in grado non solo di discriminare una
popolazione a prognosi molto grave, ma anche una popolazione con
problemi lievi di sviluppo; e ciò è di grande interesse perché induce
a considerare I’EEG neonatale strumento capace di contribuire ad
individuare una patologia neurologica più sfumata, fino ad ora spesso
misconosciuta, ma che è quella di più frequente riscontro e quindi,
forse, la più importante attualmente.
Negli ultimi anni apporti importanti sono stati quelli di Le Bihannic
() sul valore prognostico dell’EEG nei pretermine al di sotto delle
settimane, che attualmente sono la popolazione più importante
in neonatologia. E di Almubarak sui nati a termine () che ha
confermato la grande validità prognostica dell’EEG neonatale.
Capitolo VII
L’EEG in patologia neurologica neonatale
.. Le convulsioni neonatali
La convulsività rappresenta indubbiamente il campo di applicazione
più importante dell’elettroencefalografia neonatale: I’EEG è infatti utile e spesso insostituibile per far diagnosi di crisi convulsive e dà anche
un apporto significativo alla formulazione di un giudizio prognostico
precoce.
Diagnosi
Il S.N.C. del neonato permette difficilmente la sincronizzazione delle scariche cellulari e non riesce a generare né punte ad alta frequenza
né potenziali post–sinaptici eccitatori, caratteristiche queste che sembrano formare il substrato per la epilettogenesi del cervello maturo;
la rete sinaptica non è ancora sufficientemente sviluppata, la mielinizzazione dendritica non è completa e ciò ostacola la propagazione delle
scariche convulsive, impedendo sia la diffusione transcorticale che la
sincronizzazione bilaterale (Cavazzuti ). In realtà, studi successivi
(Patrizi ) hanno dimostrato che anche nei pretermine la crisi elettrica è in grado di diffondere e generalizzarsi abbastanza agevolmente.
Sulla base di questi accenni di neurofisiologia e neuroanatomia si
comprende come le crisi neonatali siano molto spesso parziali, a volte
con una sintomatologia clinica molto sfumata, ambigua, addirittura
completamente assente; e questo è ancor più vero in alcune situazioni particolari: l’interessamento delle strutture del tronco cerebrale
(presenza soprattutto di crisi atipiche quali l’apnea convulsivante, le
crisi oculogire, il nistagmo, la suzione stereotipata etc.), la prematurità
(nel pretermine più che nel neonato a termine esiste una dissociazione elettroclinica con crisi esclusivamente elettroencefalografiche e
le crisi cliniche sono frequentemente atipiche); la curarizzazione di
neonati in respiratore (nella casistica di Coen [] presentavano crisi
Neurofisiologia ed elettroencefalografia neonatale
esclusivamente EEG soggetti su ; si imporrebbe quindi per questi
soggetti una monitorizzazione elettroencefalografica continua).
Ne deriva quindi necessariamente che in molti casi la diagnosi di
crisi è possibile solo con l’ausilio dell’EEG. È vero che in rarissime
circostanze possono aversi crisi cliniche indubbie senza corrispettivo
EEG con tracciato generalmente inattivo (l’encefalo è talmente danneggiato da non riuscire nemmeno a “convulsivare’‘); ma è molto
più frequente che si verifichi la situazione opposta: la presenza di crisi
esclusivamente EEG o atipiche dal punto di vista clinico non altrimenti diagnosticabili con sicurezza che attraverso I’EEG (Fig. –). E la
diagnosi immediata di crisi convulsive è spesso di importanza capitale
per iniziare il trattamento e impedire il ripetersi di tali fenomeni. Non
vi sono dubbi infatti sul rischio che ogni crisi rappresenta per l’integrità del S.N.C. anche quando si tratti di crisi atipiche (Goldberg ;
Perlman ).
I meccanismi più importanti attraverso i quali crisi convulsive ripetute possono causare danno cerebrale sono rappresentati dalla deplezione energetica, dall’iperafflusso cerebrale e dall’effetto tossico
del glutammato che produce una cascata di eventi simile a quella
dell’EII. Più in dettaglio, in caso di crisi può aversi ipoventilazione
grave e apnea con conseguente ipossia e ipercapnia. L’ipossia è di per
sé un’importante causa di danno, soprattutto se il S.N.C. è già stato
gravemente compromesso (lbrahim ) e può inoltre determinare
collasso cardiovascolare e conseguente ischemia cerebrale.
L’ipercapnia, insieme all’aumento di lattato e di H+ secondari alla
attivazione della glicolisi anaerobia, ed insieme all’aumento della pressione arteriosa dimostrata da Lou () in caso anche di crisi atipiche,
determina aumento marcato del flusso cerebrale, evento questo evidenziato da Perlman e Volpe () tramite la tecnica Doppler anche
in soggetti pretermine con crisi “minime” ; tale aumento del flusso
può causare emorragia a livello della zona germinativa. Ma crisi ripetute possono essere all’origine di danno cerebrale anche a prescindere
dai disturbi della ventilazione e della perfusione. Le crisi determinano
aumento marcato del metabolismo cellulare (Pape e Wigglesworth
), conseguente consumo rapido di glucosio cerebrale e di ATP e
danno strutturale neuronale. E marcato aumento della produzione
di glutammato con apertura dei canali del calcio e successivo danno
strutturale.
. L’EEG in patologia neurologica neonatale
In effetti crisi ripetute e difficilmente controllabili con la terapia si
accompagnano ad evoluzione più sfavorevole (Allemand ) e questi
risultati sono un contributo clinico a favore dell’ipotesi che le crisi
convulsive siano di per sé dannose.
Occorre quindi ribadire la necessità assoluta di registrazioni EEG
ripetute in tutti i casi in cui si sospetti la possibilità di crisi clinicamente
difficili da diagnosticare.
D’altra parte, se spesso I’EEG è indispensabile per riconoscere le crisi convulsive, a volte è allo stesso modo indispensabile per escluderle.
Esistono infatti numerose situazioni che possono simulare perfettamente crisi convulsive senza esserlo; nella gran parte dei casi si tratta
di eventi facilmente confondibili con le crisi atipiche (apnee “neurogene”, segni oculari, cloni palpebrali quasi impercettibili, etc.), ma
possono simulare crisi anche le ipertonie posturali, i cloni e i tremori a bassa frequenza e, in generale, tutto il corteo sintomatologico
della sindrome da ipereccitabilità. Di particolare interesse è il lavoro
di Ishizaki () che ha dimostrato come lo stesso midazolam sia in
grado di determinare movimenti parossistici capaci di mimare una
crisi. In tal caso per non continuare a curare con un farmaco antiepilettico pseudo crisi causate dal farmaco stesso, l’apporto dell’EEG è
insostituibile.
Anche in questo ambito, spesso, quindi, senza l’aiuto dell’EEG
possono commettersi degli errori di valutazione e far diagnosi precipitosamente di convulsioni con conseguente intervento terapeutico del
tutto ingiustificato.
L’EEG può essere utile anche per chiarire l’eziologia di alcune
crisi convulsive. Infatti, la cessazione delle crisi registrate sull’EEG a
seguito di somministrazione di un metabolita che si sa o si suppone
carente (calcio, magnesio etc.) è la miglior prova di una eziologia
primitivamente metabolica della crisi. Viceversa, la persistenza della
crisi nonostante la somministrazione del metabolita mancante induce
ad ipotizzare un’eziologia primitivamente diversa da quella metabolica e lo squilibrio metabolico soltanto un epifenomeno. Prognosi: il
tracciato EEG intercritico è il più importante fattore nel determinare
la prognosi a distanza delle convulsioni neonatali (Monod ; Rose
e Lombroso ; Allemand ); nella Tabella . sono riportati i
risultati della casistica personale. In particolare, i tracciati con anomalie
Neurofisiologia ed elettroencefalografia neonatale
EEG
normali
Deceduti
Seq. gravi
Seq. lievi
Normali
Persi
Totale
Anomalie
moderate
Anomalie Anomalie
gravi
gravissime
X
,
P<,
Tabella .: Prognosi delle convulsioni neonatali in funzione del
tracciato EEG intercritico
gravissime (inattivo e parossistico) e i tracciati con anomalie gravi
(lento e di basso voltaggio+grafoelementi patologici) hanno sempre
una prognosi gravissima, mentre, al contrario, un tracciato intercritico
normale ha sostanzialmente una prognosi favorevole.
Inoltre le anomalie unifocali hanno una prognosi migliore delle
anomalie multifocali (Rose e Lombroso ). Valore prognostico
ha anche la presenza o l’assenza di correlazione tra caratteristiche
EEG e caratteristiche cliniche: se si osserva una buona correlazione
elettroclinica la prognosi è meno sfavorevole che se si riscontra una
dissociazione elettroclinica (Monod ), cioè crisi EEG senza corrispettivo clinico e crisi cliniche senza corrispettivo EEG. Secondo Rose
e Lombroso () rivestono significato prognostico sfavorevole segni
clinici atipici che si accompagnino a chiari segni EEG.
Lo studio della organizzazione del sonno è un altro elemento utile per la prognosi: l’assenza di organizzazione del sonno per due o
tre giorni è un segno prognostico sfavorevole, mentre la persistenza
dell’organizzazione del sonno (con maggiore o minore corrispondenza tra parametri comportamentali e EEG) può accompagnarsi sia ad
evoluzione favorevole che sfavorevole (Allemand ).
. L’EEG in patologia neurologica neonatale
.. Encefalopatia ipossico–ischemica
Per encefalopatia ipossico–ischemica (EII) si intendono i quadri neuropatologici e clinici caratteristici del danno cerebrale neonatale su base
ipossica e/o schemica. L’E.I.I. costituisce tuttora il capitolo più significativo della neurologia neonatale e la causa più importante di sequele
neurologiche a distanza. È nell’ambito di tale patologia che I’EEG
dà un contributo utile ed è per questo che tratterò maggiormente
questo argomento. Per comprendere adeguatamente l’apporto che
I’EEG può dare dal punto di vista della diagnosi, delle correlazioni con
i dati neuropatologici e della prognosi a distanza occorre considerare,
anche se brevemente, la fisiopatologia del danno cerebrale e gli aspetti
neurologici clinici.
Fisiopatologia
I meccanismi eziopatogenetici e le caratteristiche neuropatologiche
differiscono nettamente a seconda che si tratti di neonato a termine o
pretermine.
) Neonato a termine.
Il danno su base ipossico–ischernica nel neonato a termine è caratterizzato dall’edema cerebrale e dalla necrosi neuronale a carico
della corteccia, del tronco, dei nuclei della base e del talamo. Estremamente utili per comprendere l’insorgenza di tali alterazioni sono
gli studi sperimentali storici compiuti sulle scimmie: i primi lavori
sono stati realizzati da Rank e Windle (); nel corso dei due decenni
successivi Myers e il suo gruppo hanno ripreso e perfezionato queste
prime esperienze; verrà qui preso in considerazione essenzialmente
il lavoro del i cui risultati sono sufficientemente sovrapponibili
ai dati della patologia umana, pur tenendo presente che la qualità e
l’intensità degli insulti ipossico–schemici non possono mai essere ben
caratterizzati nell’uomo. Myers ha realizzato due forme di sofferenza cerebrale in base a circostanze sperimentali ben definite: l’asfissia
parziale e l’asfissia totale. Quest’ultima viene realizzata nella scimmia
neonata per clampaggio del cordone ombelicale e la testa del feto è
mantenuta in un sacco di plastica riempito di soluzione fisiologica
al fine di impedire qualsiasi atto respiratorio. L’asfissia parziale, che
rappresenta il modello animale che più può aiutare nella compren-
Neurofisiologia ed elettroencefalografia neonatale
sione della patogenesi del danno nell’uomo, può essere realizzata in
differenti modi:
— compressione della aorta addominale della madre con riduzione del flusso utero–placentare e dunque degli scambi gassosi
madre–figlio;
— perfusione di ossitocici alla madre che determini anomalie nella
contrazione uterina e quindi della perfusione placentare;
— inalazione da parte della madre di fluotano, che diminuisce la
pressione sistemica; o di monossido di carbonio, che riduce le
capacità di fissazione dell’ ossigeno.
Nella clinica, in realtà, circostanze schematiche si realizzano raramente; anche se si ha una asfissia totale, ad essa generalmente si
associa una asfissia parziale più prolungata; comunque questo studio
iniziale ha dimostrato chiaramente il rapporto tra ipossia intrauterina
e tipo di danno cerebrale. Sempre sulla base di questi primi esperimenti si è stabilito che esiste un valore soglia di contenuto di ossigeno
al di sotto del quale si ha il danno cerebrale; tale valore corrisponde a
,–, vol.% ed è enormemente più basso di quello che determina alterazioni della frequenza cardiaca fetale (,–, vol.%); la gravità della
ipossia, dunque, giuoca un ruolo essenziale nel determinare il danno.
Tuttavia ci si è ben presto resi conto che altri fattori intervengono; ulteriori studi sperimentali (Myers ) hanno dimostrato l’importanza
nel determinismo del danno dell’accumulo di lattato nel tessuto cerebrale; ad una concentrazione di – micromoli/g di tessuto il lattato
determina profonde trasformazioni delle proprietà della membrana
cellulare, ingresso di liquido nel comparto intracellulare, edema e
distruzione tissutale; la produzione di lattato aumenta evidentemente
in condizioni di glicolisi anaerobia, ma sarà tanto maggiore quanto più
glucosio è disponibile. Questi ultimi dati non possono essere trasferiti
agevolmente nella pratica clinica; inducono comunque a cercare di
evitare situazioni che conducono alla iperglicemia (stress, abuso delle
soluzioni glucosate) in condizioni a rischio per l’ipossia cerebrale. In
sintesi, dai primi studi sperimentali si ricava che il danno si verifica
se il contenuto di ossigeno scende a valori pari o inferiori al % del
normale e se tale evento è sufficientemente prolungato nel tempo;
che comunque agiscono anche altri elementi metabolici più sottili;
. L’EEG in patologia neurologica neonatale
tra questi sembra giuocare un ruolo importante l’aumento di concentrazione di lattato. La fisiopatologia del danno a questo punto può
essere così schematizzata: se si determina una asfissia intrauterina
si ha una generale redistribuzione del flusso ematico con aumentata
perfusione di cervello, cuore e surrene e una diminuita perfusione
degli altri organi; inizialmente, quindi, vi è un aumento del flusso
cerebrale al fine di mantenere un adeguato apporto di ossigeno e
glucosio: se l’ipossia persiste le cellule cominciano ad essere carenti
in ossigeno e, verosimilmente attraverso un iniziale accumulo di
lattato, si ha un aumento del contenuto in acqua del cervello e passaggio di liquidi dallo spazio extracellulare a quello intracellulare
con conseguente iniziale edema cerebrale; contemporaneamente
aumenta la pCO che inizialmente determina aumento del flusso
cerebrale; ma, successivamente, l’acidosi tissutale secondaria sia
all’ipercapnia sia all’accumulo di lattato causa una grave alterazione della autoregolazione del flusso cerebrale che in alcune zone
comincia a ridursi; si hanno zone focali di ischemia che poi aumentano determinando danno cellulare ed edema generalizzato;
quest’ultimo determina aumento della pressione intracranica che a
sua volta fa diminuire il flusso cerebrale, producendo una ischemia
con riduzione ulteriore di apporto di O alle cellule, minor possibilità di eliminare i radicali acidi e conseguente necrosi (Allemand
).
Tale schema interpretativo è stato largamente condiviso ed assegna un ruolo fondamentale all’edema cerebrale nel determinismo
del danno. Ma anche un altro schema fisiopatologico può essere
ipotizzato ed è sostenuto da Autori quali Lou () e Volpe ().
In base a tale schema l’edema non giocherebbe un ruolo nella
patogenesi del danno ma sarebbe un evento terminale, mentre i
parametri decisivi sarebbero l’ipotensione arteriosa sistemica, la
perdita di autoregolazione e conseguente marcata riduzione del
flusso ematico cerebrale con conseguente necrosi. Questa seconda ipotesi può senz’altro verificarsi quando in patologia umana si
riproducono le condizioni tipiche dell’asfissia totale che anche sperimentalmente non determina edema; del resto in circa la metà dei
neonati con E.I.I. non si hanno i segni clinici della ipertensione endocranica (Brown ) che possano far ipotizzare l’ esistenza di un
edema cerebrale imponente.
Neurofisiologia ed elettroencefalografia neonatale
Si può quindi ragionevolmente sostenere che entrambi gli schemi
di interpretazione patogenetica siano verosimili in situazioni differenti
e che, anzi, uno degli scopi principali del clinico sia quello di capire
se ci si trovi di fronte ad un quadro ormai conclamato di necrosi neuronale per il quale si è sostanzialmente disarmati o ad una situazione
in cui sia l’edema l’evento patologico dominante e nell’ambito della
quale interventi terapeutici sono possibili e auspicabili. E l’EEG dà
un contributo notevolissimo alla comprensione di questo problema:
se infatti si registra un tracciato inattivo o parossistico o di basso voltaggio + bouffées parossistiche, con assenza di labilità, assenza dell’
organizzazione del sonno e dell’organizzazione spaziale e presenza
di crisi EEG spesso ripetute, non vi sono dubbi che il corrispettivo
neuropatologico sia la necrosi neuronale massiva interessante spesso
sia il tronco che la corteccia cerebrale; e tale certezza può raggiungersi
molto precocemente, quando altri supporti strumentali quali l’ecoencefalografia o la stessa RMN sono di modesto aiuto. Se invece l’attività
di fondo è meno alterata con EEG di basso voltaggio, persistenza
dell’organizzazione del sonno, presenza di crisi EEG sporadiche e contemporaneamente vi sono segni clinici o strumentali di ipertensione
endocranica e diminuzione della pulsatilità dei vasi all’ecografia, si
può ragionevolmente sostenere che ci si trovi di fronte ad un quadro
di edema cerebrale citotossico. In tal caso si deve prendere in seria
considerazione la possibilità di un trattamento mediante restrizione
dei liquidi, apporto appena sufficiente di glucosio, phenobarbital in
caso di crisi e, se si è esclusa la presenza di emorragia intracranica, si
può ipotizzare l’utilizzo del mannitolo al %. Fenichel () riporta
effetti drammatici del mannitolo sul voltaggio dell’EEG che aumenta
significativamente dopo l’ infusione.
Successivamente si è molto valorizzato il ruolo degli aminoacidi
eccitatori quali il glutammato nel determinismo del danno: in caso
di insulto ipossico–ischemico si ha un aumento di produzione di tale
neurotrasmettitore e una riduzione del reuptake. Ciò comporta un aumento marcato della concentrazione di glutammato nello spazio sinaptico e una apertura totale e prolungata dei canali del sodio e del calcio
con possibile morte neuronale sia precoce che, più frequentemente,
tardiva.
In questi ultimi anni, però, si è capito che i danni maggiori si
hanno durante la fase di riperfusione che avviene nelle ore succes-
. L’EEG in patologia neurologica neonatale
sive alla noxa patogena iposssico–ischemica. I clinici hanno quindi
potenzialmente il tempo di intervenire prima che il danno divenga
irreparabile.
La terapia più efficace sembra essere attualmente il cooling, come
verrà descritto più in dettaglio successivamente e gli altri tentativi terapeutici (diuretici, antiepilettici, calcio–antagonisti, solfato di magnesio
etc.) sono stati progressivamente abbandonati.
) Neonato pretermine
Il danno cerebrale ipossico nel pretermine è del tutto diverso da
quello del neonato a termine, sia dal punto di vista neuropatologico sia
fisiopatologico; questo è n relazione al differente grado di maturazione
sia del tessuto cerebrale sia del letto vascolare; nel pretermine le
alterazioni cerebrali predominanti sono:
a) l’emorragia della zona germinativa e la conseguente emorragia
intraventricolare, la cui patogenesi non è ancora ben chiara ma
che sicuramente è in relazione anche con la ipossia;
b) la leucomalacia periventricolare, lesione più tipicamente ischemica. La patogenesi di queste lesioni può essere così schematizzata: in condizioni di ipossia e/o di ipercapnia si ha vasodilatazione e aumento del flusso cerebrale, aumento che si
verifica anche in seguito a sbalzi improvvisi di pressione sistemica, quando il sistema autoregolatore del flusso cerebrale è
inefficace (e l’anossia lo rende inefficace — Lou ); la vasodilatazione persistente determina iperperfusione; l’acidosi
secondaria alla ipercapnia e all’accumulo di lattato determina
danno endoteliale; si costituiscono quindi condizioni favorenti la rottura di vasi sottili, rottura che avviene a livello della
zona germinativa, più irrorata nel pretermine: si determina
quindi emorragia subependimale e, per rottura dell’ependima,
emorragia intraventricolare.
L’emorragia può determinare riduzione del flusso cerebrale
attraverso una riduzione della pressione sistemica e può quindi
complicarsi con lesioni ischemiche. La leucomalacia può quindi essere una complicanza dell’emorragia ma, più spesso, si
produce autonomamente attraverso un deficit di perfusione
delle zone di confine tra arterie cerebrali centripete e centrifu-
Neurofisiologia ed elettroencefalografia neonatale
ghe, zone di confine che sono appunto le zone periventricolari.
Sperimentalmente la leucomalacia periventricolare è stata prodotta in feti di pecora sottoposti nel corso dell’ultimo terzo di
gravidanza a marcata ipossia senza contemporanea ipercapnia
e acidosi; sembrerebbe quindi che il meccanismo patogenetico
all’origine della leucomalacia possa essere sia l’ischemia che
l’ipossia pura.
Anche nel caso dell’E.I.I. del pretermine I’EEG può dare un apporto chiarificatore. Innanzi tutto, come già detto nel capitolo sulla
convulsività, I’EEG è un elemento insostituibile nel far diagnosi di
crisi convulsive nel pretermine ; e le crisi sono una componente di
primaria importanza del quadro clinico della EI.I. Inoltre, sia in caso
di emorragia peri–intraventricolare che di leucomalacia, le alterazioni
EEG sono generalmente molto significative, tipo “anomalie maggiori”
secondo Tharp (); infine, in caso di emorragia l’incidenza di punte
rolandiche positive è significativamente minore che se ci si trova di
fronte ad una lesione leucomalacica, di cui costituisce grafoelemento
quasi patognomonico (tale argomento verrà ripreso più estesamente
nel capitolo dedicato alle emorragie intracraniche).
Segni Clinici
Usualmente la sintomatologia della encefalopatia ipossico–ischemica
viene suddivisa in tre gradi progressivi di gravità (Sarnat ; Amiel–
Tison ).
Già questi Autori, quindi, avevano enucleato le caratteristiche EEG
tipiche dei tre gradi di E.I.I.; sulla base della esperienza personale
ritengo che quanto affermato da Sarnat sia sostanzialmente corretto
anche se, a mio avviso, alcune modifiche dovrebbero essere apportate:
nel grado I l’EEG è normale sia nella veglia che nel sonno attivo e calmo; del resto, come già ampiamente sottolineato, è difficile registrare
tracciati di veglia sufficientemente lunghi e senza artefatti. Nel grado
il tracciato di basso voltaggio è caratterizzato da ritmi di frequenza
molto variabile, dalla banda delta alla beta ed è il più tipico di tale stato,
mentre il cosiddetto tracciato periodico, che in questo testo è stato definito “di basso voltaggio + grafoelementi patologici”, si riscontra più
di frequente nel grado . Nel grado non necessariamente il tracciato
parossistico precede quello inattivo. A volte il quadro EEG iniziale è
. L’EEG in patologia neurologica neonatale
già il tracciato piatto; inoltre, abbastanza frequentemente, al contrario
di quanto affermato da Sarnat, si riscontrano crisi EEG, spesso con
dissociazione elettroclinica.
Le caratteristiche EEG nei tre gradi di E.I.I. potrebbero essere
quindi schematizzate nel seguente modo:
Grado
Att. di fondo normale
ciclo dei sonno
presente
Grado
Tracciato di basso
voltaggio
ciclo del sonno
alterato
crisi elettrocliniche
Grado
Tracciato inattivo
e parossistico
ciclo del sonno
assente
crisi con dissociazione elettroclinica
Comunque non vi sono dubbi che il tracciato piatto e il tracciato
parossistico siano i tracciati tipici del grado della E.I.I.: se il primo
è indice naturalmente di necrosi massiva e generalizzata, il secondo
potrebbe essere interpretato come espressione della perdita dei ritmi
corticali intrinseci (fase inattiva) e della conservazione della capacità di
risposta corticale agli stimoli provenienti dal talamo e dal tronco (fase
di attività parossistica). Un tracciato simile si riscontra fisiologicamente
nei soggetti pretermine di – settimane che hanno un inadeguato sviluppo sinaptico corticale. Nei soggetti a termine con E.I.I. di
grado si ha verosimilmente un disturbo grave della trasmissione
sinaptica a livello corticale e I’EEG diventa simile a quello normale
del pretermine che fisiologicamente ha un numero di sinapsi ridotto.
La suddivisione in tre gradi della E.I.I. sulla base della sintomatologia clinica e dei segni EEG è di grandissima importanza dal punto di
vista prognostico: la prognosi è favorevole per il grado , gravissima
per il grado , mentre per il grado la prognosi è favorevole se i segni
clinici ed EEG tornano nella norma entro giorni e se la anamnesi
è negativa per i criteri di rischio proposti da Scheiner nel e da
Allemand (– ).
In effetti l’apporto che I’EEG può dare nel formulare un giudizio
prognostico precoce in neonati con E.I.I. è di grandissima importanza.
Sarnat riconosce ai seguenti quadri EEG valore prognostico sfavorevole: tracciato inattivo, tracciato parossistico, tracciato di basso voltaggio
Neurofisiologia ed elettroencefalografia neonatale
+ grafoelementi patologici persistente per più di giorni, passaggio
da un tracciato periodico ad uno abnormemente lento e di basso
voltaggio. Monod () suddivide le alterazioni EEG in anomalie
moderate, anomalie gravi e anomalie gravissime. Gli ultimi due gruppi sono a prognosi sfavorevole e sono rappresentati dal tracciato di
basso voltaggio + grafoelementi patologici, dal tracciato parossistico e
da quello inattivo. D’altro canto un tracciato normale si accompagna
generalmente ad evoluzione favorevole. A risultati analoghi è giunto
Holmes () secondo il quale EEG normali o con “ritardo maturativo” hanno una prognosi favorevole, mentre il tracciato di basso
voltaggio, l’inattivo e il parossistico, prognosi sfavorevole.
In definitiva, non vi sono dubbi sul valore prognostico che l’attività
EEG di fondo riveste nell’ambito della E.I.I..Anzi, l’apporto che in
questo senso I’EEG può dare non ha eguali sia per precocità che per
precisione (Lamblin –Walsh –Walsh –Flisberg ).
.. Emorragie intracraniche
Le emorragie intracraniche sono un importante problema anatomo–
patologico e clinico, a causa dell’elevata frequenza con cui si verificano
e della prognosi severa che spesso comportano.
Negli ultimi anni l’incidenza relativa delle varie forme di emorragia è cambiata profondamente: ad una marcata riduzione delle
emorragie su base traumatica, quali l‘emorragia subdurale, riduzione legata al miglioramento della assistenza ostetrica, ha fatto riscontro un aumento marcato delle emorragie della zona germinativa e
peri–intraventricolari tipiche dei pretermine, causato dalla aumentata
sopravvivenza di questi ultimi a seguito dei rapidi progressi avvenuti nella terapia intensiva neonatale. I tipi principali di emorragia
intracranica neonatale sono esposti da Volpe ().
Vedremo adesso quale apporto può dare in questo campo della
patologia neonatale l’elettroencefalografia.
Emorragia subdurale: nella maggior parte dei casi l’emorragia
è bilaterale e si accompagna a necrosi neuronale su base ipossico–
ischemica; è evidente. quindi, che si manifesta solo eccezionalmente
con dei segni EEG di tipo focale, quali depressione parziale della
attività di fondo, crisi EEG focali, punte aguzze a focolaio.
. L’EEG in patologia neurologica neonatale
Per lo più I’EEG è l’espressione delle lesioni anossico–ischemiche
che frequentemente accompagnano tale emorragia e si ha quindi
il tracciato piatto, il tracciato parossistico etc. (Allemand ). Nei
rari casi in cui l’emorragia è l’evento patologico dominante, per lo
più si hanno tracciati di basso voltaggio non specifici, raramente con
asimmetria di ampiezza tra i due emisferi (fig. ) e con crisi elettriche,
queste ultime molto più frequenti in caso di contemporanea presenza
di necrosi neuronale. L’apporto dell’EEG alla diagnosi di emorragia
subdurale è quindi di scarso rilievo; tuttavia in alcuni casi una lesione
monolaterale può effettivamente tradursi in alterazioni EEG di tipo
focale e persistenti (fig.–); in tal caso è consigliabile ricorrere alle
neuroimmagini (Tharp ).
Emorragia subaracnoidea: non ha un corrispettivo elettroencefalografico specifico; per lo più I’EEG è normale o solo modicamente
alterato con incidenza più elevata della norma di punte rapide o onde
aguzze. In tali casi il quadro clinico è praticamente silente; a volte possono essere presenti crisi EEG ma con tracciato intercritico sempre
alterato in maniera modesta. Solo quando l’emorragia subaracnoidea
si accompagna anche a grave necrosi neuronale su base ipossica o
ischemica, l’attività di fondo EEG è gravemente alterata e, come già
detto per l’emorragia subdurale, le alterazioni EEG sono in relazione
con la necrosi e non con l’emorragia subaracnoidea.
Emorragia della zona germinativa e intraventricolare: la patogenesi
di questa che è la più importante catteristica neuropatologica del pretermine è stata trattata schematicamente nel capitolo precedente. Qui
verranno considerati esclusivamente gli aspetti EEG a complemento
di quanto detto nel capitolo sulla E.I.I.
Nel Cukier ha pubblicato uno studio su neonati con emorragia intraventricolare sospettata clinicamente o accertata al tavolo
anatomico; I’EEG di di questi neonati presentava onde aguzze rolandiche positive di alto voltaggio e tale grafoelemento fu considerato
caratteristico della emorragia intraventricolare. Murat () ha ottenuto risultati simili pur trovando le punte rolandiche positive (PRP)
anche in pretermine senza emorragia intraventricolare ma con patologia di altra natura (leucomalacia, meningite, etc.); tuttavia egli
conclude che l’elevata incidenza di punte rolandiche positive si associa
significativamente all’emorragia intraventricolare. In entrambi questi
studi la diagnosi di emorragia era fatta su base clinica o post–mortem.
Neurofisiologia ed elettroencefalografia neonatale
Successivamente, con l’avvento soprattutto dell’ecoencefalografia
e della RMN cerebrale si è dimostrato che l’emorragia della zona
germinativa è un evento molto più frequente di quanto si potesse
sospettare (sarebbe presente nel % dei soggetti di peso inferiore a
g secondo Papile ) e il significato diagnostico delle punte
rolandiche positive si è ridimensionato: in uno studio riportato da
Tharp () l’incidenza di tale grafoelemento nei soggetti con emorragia era solo del %; nel lavoro di Watanabe () di poco superiore
al %; entrambi gli Autori sottolineano però il valore prognostico
dell’elettroencefalogramma in tali soggetti, superiore, secondo Watanabe, rispetto alle neuroimmagini; e propongono già allora l’ipotesi
che all’origine delle PRP ci sia soprattutto l’ischemia. Inoltre, anche
se le punte rolandiche positive non possono più essere considerate
una caratteristica specifica della emorragia intraventricolare, non vi
è dubbio che pretermine presentanti tale grafoelemento debbano
essere esaminati ecograficamente al fine di accertare o di escludere
la presenza di emorragia, ma soprattutto per mettere in evidenza la
presenza di una lesione ischemica periventricolare. Si è infatti capito
sempre di più negli ultimi decenni che all’origine delle PRP ci può
essere qualsiasi causa che determini necrosi periventricolare, in particolare la leucomalacia. Si può ritenere che i casi descritti da Cukier
fossero tutti accompagnati da infarcimento emorragico della sostanza
bianca o da copresenza di necrosi ischemica.
.. L’EEG nelle infezioni del SNC
Le opinioni circa l‘utilità dell’EEG nelle infezioni del SNC sono molto
controverse e certamente scarsa è la letteratura in proposito. Nei lavori
più importanti l’EEG è nominato molto raramente e per lo più con
poche frasi che sottolineano la aspecificità dei reperti.
Sono invece numerose le circostanze in cui I’EEG può intervenire
in modo utile come supporto alla clinica, unitamente, è chiaro, a tutti
gli altri elementi semeiologici di laboratorio che rimangono primari.
In questo capitolo prenderemo in considerazione l’utilità o meno
dell’EEG rispetto alla diagnosi, I’EEG come parametro di controllo dell’evoluzione della forma morbosa e della efficacia della terapia nei casi in cui questo sia possibile e specificamente nel caso del-
. L’EEG in patologia neurologica neonatale
le meningiti batteriche; e infine la significatività o meno dei quadri
eettroencefalografici rispetto alla prognosi a distanza.
) Meningiti batteriche.
Nonostante che la loro incidenza sia fortunatamente ridotta rispetto
al passato, rappresentano comunque un evento clinico di primaria
importanza, soprattutto in considerazione del fatto che la prognosi
favorevole è strettamente legata alla diagnosi precoce e alla terapia
immediata così da giungere il più presto possibile alla sterilizzazione
del liquor.
La prima domanda che ci si deve porre è se esistono delle anomalie elettroencefalografiche specifiche delle meningiti batteriche.
La risposta è negativa: i quadri elettroencefalografici sono gli stessi
che si riscontrano in altre affezioni acute del S.N.C. (encefalopatia
ipossico–ischemica, emorragia intracranica). Anche perché le lesioni
anatomopatologiche in caso di meningite sono soprattutto su base
ipossico–ischemico–emorragica.
a) alterazioni della attività di fondo: raramente il tracciato inattivo
e il tracciato parossistico; più spesso il tracciato di basso voltaggio, a volte con sovraccarico di bouffées parossistiche e di ritmi
theta, e il tracciato lento. Si tratta di tracciati già incontrati nella
E.I.I e ciò non è strano se si considera, come già accennato, che
può essere presente una necrosi cerebrale severa e che l’edema vasogenico e citotossico sono una delle caratteristiche più
tipiche del quadro neuropatologico delle meningiti batteriche;
b) alterazioni della organizzazione spaziale e temporale: può esservi asinergia interemisferica, asincronia, mancanza di labilità,
asimmetrie di ampiezza e frequenza;
c) alterazioni dell’organizzazione del sonno: raramente si ha assenza del ciclo del sonno; più spesso si ha un disturbo della
normale relazione tra i vari parametri fisiologici che costituiscono uno stato e conseguente impossibilità o, almeno, difficoltà a
classificare gli stati stessi;
d) presenza di grafoelementi patologici: possono aversi crisi elettriche (fig. ) e punte di localizzazione variabile.
Posta questa grossa limitazione all’utilità dell’EEG nella diagnosi di
meningite, vediamo in quali circostanze esso può essere di qualche aiuto
Neurofisiologia ed elettroencefalografia neonatale
(Klinger ). In genere si è d’accordo nel dire che in caso di meningite
i segni clinici aspecifici, non neurologici in senso stretto, sono i primi ad
apparire. Ebbene, in questa fase spesso I’EEG è già alterato; in particolare
è l’organizzazione degli stati ad essere alterata molto presto. L’EEG quindi può indirizzare precocemente il clinico verso una affezione acuta del
S.N.C. in assenza di una sintomatologia neurologica eclatante. Inoltre,
anche in caso di convulsioni che sono il sintomo iniziale neurologico più
frequente non è raro, soprattutto nei pretermine, che la estrinsecazione clinica delle crisi sia assente o a tipo convulsioni atipiche, ambedue
circostanze nelle quali solo la registrazione poligrafica permette di evidenziare la sintomatologia convulsiva. L’EEG, quindi, pur non essendo
direttamente utile alla diagnosi di meningite, può in qualche caso essere
indirettamente di ausilio mostrando alterazioni quando la sintomatologia è ancora ambigua e evidenziando una sintomatologia convulsiva
clinicamente latente.
Per quanto riguarda la prognosi a distanza non vi è dubbio che
I’EEG rivesta un significato maggiore. L’apporto dell’EEG alla formulazione della prognosi può essere così schematizzato:
a) perché il tracciato abbia valore prognostico occorre che venga
registrato all’inizio del processo morboso; un tracciato tardivo
è di molta minore utilità essendo già intervenuta la terapia
a mascherare sensibilmente il quadro. Da qui la necessità di
registrazioni precoci; quanto detto, valido sempre in elettroencefalografia neonatale, è stato dimostrato per le meningiti da
Lerique ();
b) la presenza di crisi elettriche ripetute e difficilmente controllabili terapeuticamente ha influenza negativa sulla prognosi.
Comunque è l’attività intercritica ad essere più significativa in
proposito;
c) la prognosi è peggiore quando le anomalie elettroencefalografiche persistono nonostante la terapia. Nella casistica di Lerique
in casi i tracciati migliorarono a seguito dell’intervento terapeutico: di questi ebbero una evoluzione favorevole, soltanto
morirono; dei casi con anomalie persistenti nonostante il
trattamento, uno solo ha avuto una evoluzione favorevole; gli
altri sono tutti deceduti o hanno mostrato sequele gravissime.
. L’EEG in patologia neurologica neonatale
In definitiva, un tracciato iniziale anormale e che rimane anormale
nonostante la terapia ben difficilmente si accompagna ad evoluzione
favorevole; se quindi l’EEG è di scarso aiuto al momento della diagnosi
di meningite, fornisce però dati significativi sulla severità del danno
cerebrale e sulla prognosi a distanza.
Anche l’aEEG si è dimostrato di alto valore prognostico nelle sepsi
e nelle meningiti neonatali (ter Horst ).
) Infezioni connatali.
Prima di prendere specificamente in considerazione le più importanti tra le forme connatali, cercheremo di mettere in luce alcune
caratteristiche generali, comuni alle varie affezioni: da una parte l’estremo polimorfismo delle lesioni a livello centrale nel caso dello
stesso tipo di infezione si accompagna necessariamente ad una estrema variabilità dei quadri EEG (si può andare da tracciati praticamente
normali fino al tracciato inattivo nel caso dell’idranencefalia); d’altro
canto, la similarità di lesioni del S.N.C. in differenti eventi morbosi
può accompagnarsi a quadri elettroencefalografici sovrapponibili pur
essendo l’agente eziologico diverso: le alterazioni elettroencefalografiche, quindi, sono correlate soprattutto con il tipo e l’estensione della
lesione a prescindere dall’agente eziologico (Dreyfus–Brisac ).
Poste queste premesse appare chiaro come sia estremamente difficile
enucleare anomalie elettroencefalografiche specifiche e quindi di aiuto diagnostico; per lo più le anomalie sono aspecifiche. Nonostante
ciò numerosi Autori hanno cercato di raggiungere qualche risultato
positivo: nel caso della toxoplasmosi, ad esempio, Monnier e Bamatter
() giunsero alla conclusione che esisteva un quadro elettroencefalografico specifico della toxoplasmosi connatale caratterizzato da
assenza del ritmo alfa nelle regioni occipitali, rallentamento diffuso,
asimmetria ìnteremisferica, presenza di punte e bouffées parossistiche,
a volte in relazione alle aree con calcificazioni; tali aspetti caratteristici
non sono poi stati riscontrati da altri Autori: Lalisse (), Fiorillo
(), Laget e Salbreux () hanno tutti sostenuto la aspecificità
dell’EEG, sovrapponibile e a quello di altre affezioni del S.NC.; non
solo, ma questi Autori, come pure Collomb (), sottolineano che è
proprio in età neonatale che il tracciato è meno caratteristico, presentando spesso solo alterazioni della organizzazione temporo–spaziale
con asimmetria, asincronia ed asinergia interemisferica.
Neurofisiologia ed elettroencefalografia neonatale
Sulla base dell’ esperienza personale, crediamo che alle alterazioni
suddette si debbano aggiungere anche la presenza di graoelementi
patologici sovraccaricanti il tracciato, di crisi elettriche e alterazioni della organizzazione del sonno, senza dimenticare che nel caso
dell’idranencefalia si ha un tracciato piatto.
Per quanto riguarda la rosolia connatale, Desmont (), nella sua
serie di pazienti studiati dal punto di vista elettroencefalografico ha
trovato anomalie nel % dei casi. Tale percentuale si innalza però di
molto se ci si limita ai tracciati del primo mese di vita; una più alta percentuale di anomalie EEG fu riscontrata in neonati che poi giunsero
all’exitus e nei neonati con cataratta; EEG anormale fu trovato con
frequenza uguale nei neonati con convulsioni rispetto a quelli senza
convulsioni; le anomalie che Desmont sottolinea di più e che sono
state riportate anche da Barnet () sono: la presenza di onde difasiche di alto voltaggio; la presenza di onde ritmiche di alto voltaggio
soprattutto sulle regioni frontali; l’esistenza di caratteristiche elettroencefalografiche tipiche dei pretermine nei neonati a termine. Si tratta
comunque di alterazioni non specifiche e quindi poco utilizzabili per
la diagnosi.
Lo stesso discorso vale per le alterazioni della attività di base e
le alterazioni focali descritte per la malattia citomegalica e per il
rallentamento diffuso descritto per la meningoencefalite luetica.
Nonostante tali limiti, numerosi Autori sostengono comunque l’importanza dell’EEG nel caso di infezioni connatali (Dreyfus–Brisac ,
Allemand , Tharp ); vi sarebbe infatti correlazione tra entità
e tipo del danno a livello cerebrale e entità delle alterazioni EEG; il
tracciato sarebbe quindi di grande aiuto nell’indicare la severità delle
lesioni: non è questa, ad ogni modo una opinione universalmente
sostenuta. Lalisse (), ad esempio, e Collomb (), limitatamente
alla toxoplasmosi, sostengono che in età neonatale, nonostante alterazioni anatomiche estese, possono esservi solo lievi anomalie EEG.
Sulla base dell’esperienza personale credo sia più sostenibile la prima
ipotesi e cioè che vi sia correlazione, anche se non in modo assoluto,
tra gravità delle lesioni anatomiche e gravità delle alterazioni EEG. Va
inoltre ribadito qui quello che è stato già sottolineato nel caso delle
meningiti batteriche e cioè che I’EEG, permettendo di far diagnosi di
crisi convulsive quando l’espressione clinica è dubbia o assente, indirizza subito il pediatra verso una affezione grave del S,N.C.; questo,
. L’EEG in patologia neurologica neonatale
evidentemente, nel caso non raro che la sintomatologia neurologica
esordisca con le convulsioni.
) Meningo–encefalite da herpes virus.
È questo l’unico caso di infezione connatale del S.N.C. con un
quadro EEG più specifico; la prima descrizione dell’elettroencefalogramma nella encefalite erpetica è stata fatta da Radermecker nel ;
successivamente sono stati segnalati accuratamente gli elementi EEG
caratterisitici di questa forma morbosa nell’adulto: in un primo stadio,
molto precoce, è presente una attività delta polimorfa che interessa
soprattutto le regioni temporo–insulari, spesso predominante da un
lato; molto presto appare l’attività periodica tipica, caratterizzata da
onde aguzze stereotipe, pseudoregolari che sopravvengono ad intervallo di – secondi, generalmente su un solo lato; l’attività periodica
non è specifica in senso assoluto della encefalite da herpes, ma è più
specifico il fatto che essa sia, almeno all’inizio, focale e che la periodicità sia di tipo breve secondo la definizione di Gaches () cioè con
intervallo inferiore a secondi. Tale quadro è stato poi riscontrato in
animali da laboratorio inoculati con herpes virus.
Sternberg e Lerique () l’hanno descritto nei lattanti; Estivill e
Monod () nel neonato: la sintomatologia neurologica era iniziata
in a giornata di vita con convulsioni e al primo tracciato registrato
tra due crisi il neonato aveva mostrato attività ritmica a – c/s sull’emisfero destro, inabituale in età neonatale, e punte negative rolandiche
destre presentanti una certa periodicità nel sonno calmo; a giorni
di vita il tracciato mostrava delle oscillazioni lente con sovrapposte
punte negative che apparivano sempre nella medesima fase dell’onda
lenta (fig. ); tali complessi erano localizzati in rolandica destra ed
erano presenti in entrambi gli stati del sonno con la stessa periodicità,
si aveva quindi un quadro con attività periodica focale e con periodicità
breve, le caratteristiche tipiche cioè dell’EEG nell’encefalite erpetica;
a giorni l’attività cominciò a degradarsi, le punte rolandiche scomparvero e persistette solo l’attività lenta identica nei due stati del sonno
(fig. ); a giorni il tracciato divenne inattivo ma con persistenza di
un ciclo del sonno organizzato, verosimilmente perchè le strutture
troncoencefaliche erano rimaste integre. Tharp () sostiene che
oltre a questo quadro periodico esistono altre due possibili alterazioni
EEG:
Neurofisiologia ed elettroencefalografia neonatale
a) onde lente di ampiezza modesta, monomorfe, intervallate da
tratti di tracciato inattivo o di basso voltaggio
b) presenza di onde aguzze unifocali o multifocali spesso positive,
frequentemente associate a crisi EEG. Quindi si può affermare
con Radermecker che i patterns elettroencefalografici, tipici
anche se transitori, unitamente ai dati clinici, possono far porre
diagnosi di encefalite necrotizzante da herpes virus e permettere l’inizio della terapia in attesa della conferma che verrà dagli
studi immunologici e dalla biopsia.
In conclusione si può affermare:
a) nel caso delle meningiti batteriche le alterazioni elettroencefalografiche non sono specifiche; l’EEG è però utile ai fini della
prognosi: alle alterazioni più gravi corrisponde una prognosi
peggiore; in particolare la prognosi è sfavorevole se le anomalie
EEG persistono nonostante il trattamento;
b) anche nel caso della gran parte delle infezioni connatali le anomalie EEG sono aspecifiche ma sono generalmente più o meno
severe a seconda del tipo e della estensione delle lesioni del
S.N.C.; I’EEG è quindi di aiuto nell’indicare la severità della
patologia;
c) nel caso della meningo–encefalite erpetica le anomalie EEG
sono specifiche, caratterizzate da attività periodica con periodicità breve; I’EEG in questo caso può essere quindi utile per la
diagnosi. In definitiva, nonostante i grossi limiti sottolineati nel
corso della trattazione, I’EEG neonatale è utile anche nel caso
delle infezioni del S.N.C.
È importante però che all’EEG non si richiedano risposte impossibili e che esso venga considerato per quello che realmente è e cioè un
mezzo utile ma, indubbiamente, tranne forse nel caso della encefalite
erpetica, subalterno rispetto alla clinica e agli altri accertamenti di
laboratorio.
. L’EEG in patologia neurologica neonatale
.. Malformazioni cerebrali e anomalie cromosomiche
Considerata la grande varietà di alterazioni neuropatologiche possibili,
è naturale che anche le anomalie EEG siano molteplici; possono aversi
tracciati inattivi o di basso voltaggio, spesso dovuti a lesioni corticali;
si riscontrano a volte crisi elettriche, inattività localizzate, sovraccarico
di grafoelementi patologici di vario tipo: disritmia lenta anteriore,
onde delta ritmiche, ritmi rapidi. Tali alterazioni EEG usualmente
sono aspecifiche ma possono suggerire la diagnosi se sono considerate
nel contesto della storia clinica. Se un tracciato fortemente alterato è
registrato in un soggetto con malformazioni o dismorfismi e con una
storia negativa per problemi perinatali, è indicato ovviamente l’uso
della RMN cerebrale.
Interessanti sono anche gli studi sulla organizzazione del sonno in
soggetti con malformazioni cerebrali e/o anomalie cromosomiche: la
gran parte hanno un sonno ridotto in durata e una maggiore quantità
di veglia.
Quando dormono, il loro sonno è spesso molto disturbato: in genere in ogni stato vi è una scarsa correlazione tra i vari parametri che
concorrono a determinarlo e questo comporta un aumento dello stato
indifferenziato (fino al %) e una marcata riduzione del sonno attivo
e calmo. Nei soggetti con sindrome di Down una riduzione del sonno
attivo era stata descritta da Jouvet (); i dati personali depongono
per una riduzione anche del sonno calmo.
Le correlazioni tra alterazioni dell’organizzazione del sonno e lesioni neuropatologiche sono difficili a porsi: è stato descritto da Theorell
() un caso di idrocefalia nel quale l’assenza di attività corticale
si accompagnava a persistenza dei parametri comportamentali che
determinano la organizzazione del sonno; in generale la persistenza
dell’organizzazione del sonno e del sonno attivo si ha in soggetti con
tronco cerebrale normale e normale locus coeruleus, ma l’assenza
del sonno attivo non significa necessariamente che tronco e locus
coeruleus siano anormali; l’assenza di sonno attivo è quindi un segno negativo di minor valore che deve essere confermato da ripetute
registrazioni.
Riassumendo, la persistenza del ciclo del sonno in un neonato con
malformazioni cerebrali depone per l’integrità del tronco cerebrale,
ma l’assenza del sonno attivo non è necessariamente indice di alte-
Neurofisiologia ed elettroencefalografia neonatale
razione del tronco e del locus coeruleus; una assenza completa di
organizzazione si ritrova per lo più in neonati con alterazioni diffuse
sia del tronco che della corteccia.
.. Disturbi metabolici
... Errori congeniti del metabolismo
L’EEG in un soggetto affetto da errore congenito del metabolismo è
spesso molto alterato (Seppalainen e Simila ; Mises ; Dreyfus–
Brisac ). Bouffées parossistiche e crisi EEG sono i quadri più
comuni. Nella gran parte dei casi le anomalie EEG non sono specifiche ma nell’acidemia metil–malonica, nell’acidemia isovalerica,
nell’iperglicinemia non chetotica e nella leucinosi sono state descritte alterazioni più specifiche caratterizzate da attività periodica con
complessi costituiti da onde aguzze di alto voltaggio (DreyfusBrisac
). Molto studiato è stato anche il rapporto tra Early Myoclonic
Encephalopathy con il suo caratteristico tracciato “suppression burst” e diverse malattie metaboliche, in particolare l’iperglicinemia non
chetotica (Rossi ).
... Alterazioni metaboliche transitorie
Le alterazioni più frequentemente riscontrabili sono: l’ipoglicemia;
l’ipocalcemia con o senza ipomagnesiemia; l’iponatremia; l’ipernatremia. In tutte queste condizioni possono aversi crisi convulsive; si
tratta generalmente di crisi elettrocliniche che scompaiono a seguito
di un trattamento adeguato su base eziologica. La persistenza delle
crisi nonostante la correzione dello squilibrio metabolico deve indurre
a considerare le convulsioni non ad eziologia primitivamente metabolica ma determinate da una causa che è all’origine sia delle crisi sia del
disturbo metabolico (ad esempio l’encefalopatia ipossico–ischemica
che si accompagna frequentemente ad ipoglicemia, ipocalcemia, iponatremia). A volte un disturbo metabolico non trattato tempestivamente (ad esempio una ipoglicemia persistente) può di per sé determinare
un danno a livello neuronale di tipo necrotico e le crisi possono quindi
persistere nonostante la correzione dello squilibrio metabolico.
. L’EEG in patologia neurologica neonatale
Se il disturbo è primitivamente metabolico e transitorio, I’EEG
intercritico è solo moderatamente alterato, con presenza in grado eccessivo di encoches frontali, di disritmia lenta anteriore e di ritmi theta,
questi ultimi abbondanti soprattutto dopo una crisi, e tende a normalizzarsi rapidamente dopo la correzione dello squilibrio metabolico
(Dreyfus–Brisac ).
Capitolo VIII
L’ aEEG (CFM)
In collaborazione con M. Stanca, C. Dosi, C. Ferone
Negli ultimi anni il monitoraggio elettroencefalografico continuo
è arrivato ad affiancare nelle unità di terapia intensiva neonatale i
monitoraggi di altri parametri fisiologici che già da tempo erano stati
introdotti come l’ECG, l’ossimetria, la temperatura corporea e la
pressione sanguigna.
Questo ritardo nell’utilizzo dell’EEG nelle TIN è dovuto sia ad
una maggiore difficoltà di registrazione ed interpretazione, che rende
ostico trarre delle accurate conclusioni sullo sviluppo neurologico
del neonato anche allo specialista più esperto, sia a problemi tecnici
di gestione del neonato sottoposto a cure intensive che impediscono
o rendono estremamente complesso il posizionamento stabile degli
elettrodi sullo scalpo per un tempo che superi qualche ora.
Questi inconvenienti hanno spinto a sviluppare strumenti di monitoraggio sempre più sofisticati che rilevano tracciati semplificati e
compressi nel tempo, meglio compatibili con le cure intensive.
I due principali mezzi strumentali si basano, il primo su variazioni
in ampiezza (aEEG), il secondo sulle variazioni di frequenza (CSA).
L’interpretazione del tracciato aEEG dipende fortemente dalla conoscenza del normale sviluppo dell’EEG dal periodo di prematurità
precoce allo stadio di post– termine. Questo include anche i pattern
elettroencefalografici nelle differenti fasi del ciclo sonno–veglia a
differente età gestazionale (fig.).
Informazioni riguardanti asimmetria e sincronia emisferica, la frequenza nell’attività elettroencefalografica delle burst, la presenza di
figure elettroencefalografiche specifiche di significato clinico e prognostico come delta brush, punte positive rolandiche etc. non sono
rilevabili all’aEEG. Di conseguenza è sempre raccomandato un EEG
Neurofisiologia ed elettroencefalografia neonatale
convenzionale per la loro rilevazione, da affiancare alla metodica
semplificata di monitoraggio.
Lo sviluppo evolutivo normale dei pattern dell’aEEG–CFM nei
neonati di differente età gestazionale segue lo sviluppo dell’EEG. In
parallelo con studi elettroencefalografici, si riscontrano nell’aEEG
variazioni cicliche corrispondenti ai differenti stati sonno–veglia.
Il periodo di traccia stretta nell’aEEG rappresenta l’ attività più continua durante la veglia o il sonno attivo, e il periodo di traccia larga rappresenta l’ attività più discontinua durante il sonno calmo. Negli studi
aEEG i pattern di ciclo sonno–veglia sono stati visti anche in registrazioni di neonati pretermine al di sotto delle settimane di gestazione.
Corrispondentemente al graduale passaggio dal pattern di tracciato
discontinuo in neonati pretermine con attività interburst di voltaggio
molto basso al tracciato alternante del neonato a termine, il livello di
attività minima del tracciato CFM aumenta progressivamente.
Nei neonati a termine patologici all’interno delle terapie intensive neonatali c’è una buona concordanza tra l’aEEG e l’EEG convenzionale nella stima del grado di patologia dell’attività di fondo e
nell’identificazione di pattern di crisi.
In questo manuale abbiamo usato la seguente classificazione dell’attività di base dell’aEEG nei nati a termine:
— il pattern di voltaggio normale e continuo (CNV) con voltaggio –
microvolts con periodi di aumentata variabilità dovuta al sonno calmo;
— attività di base discontinua ; periodi di attività di voltaggio molto
basso (suppression) alternati ad attività di alto voltaggio (burst);
— voltaggio prevalentemente continuo e di voltaggio normale con
periodi di voltaggio intermittente più discontinuo;
— attività di base di voltaggio basso;
— voltaggio molto basso, soprattutto tracciato inattivo con attività
sotto i microvolts.
È difficile differenziare un tracciato di fondo discontinuo dal burst
suppression nei neonati molto prematuri con un pattern di tracciato
discontinuo e periodi interburst di ampiezza molto bassa.
La quantificazione degli intervalli fra le fasi di burst o il conto delle
burst/h può dare informazioni aggiuntive rispetto al solo giudizio
visivo del tracciato CFM.
. L’ aEEG (CFM)
Nei prematuri e nei nati a termine patologici con attività di fondo
discontinua, lo stimolo al risveglio dovuto all’accudimento o a procedure diagnostiche spesso causa periodi transitori di attività EEG
continua. Nel tracciato aEEG, questo è visibile come un periodo di
incremento del livello minimo del tracciato. Questo effetto può essere
scambiato erroneamente per un momento isolato di attività convulsiva. Quindi, l’handling del bambino dovrebbe sempre essere annotato
sul tracciato, per non correre il rischio di sovrastimare l’attività critica.
Occasionalmente, un’attiva stimolazione può causare uno passaggio più prolungato dall’attività discontinua alla continua. In neonati
a termine con una migliore condizione di salute che presentano il
pattern CNV, la stimolazione al risveglio causa un transitorio aumento
delle componenti EEG di bassa ampiezza e alta frequenza e una diminuzione delle componenti a bassa frequenza. Questo di solito non
produce uno shift individuabile nel tracciato aEEG presentato in scala
logaritmica o semilogaritmica. Questa è probabilmente la ragione
per cui la presenza o l’assenza della risposta al risveglio nel tracciato
aEEG non è stato provato avere un significato prognostico. A volte,
procedure di assistenza frequenti nei neonati prematuri sembrano
causare un deterioramento di un pattern discontinuo, piuttosto che
un effetto di attivazione.
.. Errori e avvertenze
Per ridurre il rischio di errori di interpretazione occorre seguire
obbligatoriamente le seguenti regole:
— l’aEEG dovrebbe sempre essere calibrato prima di ogni registrazione;
— quando calibrato, il livello zero è il più importante e dovrebbe
essere perfettamente corretto;
— durante registrazioni di lunga durata l’aEEG dovrebbe essere
calibrato ogni ore;
— l’impedenza durante la registrazione dovrebbe essere tenuta
costantemente sotto i kΩ;
— la ventilazione ad alta frequenza può rendere la registrazione
aEEG inattendibile;
Neurofisiologia ed elettroencefalografia neonatale
— non applicare gli elettrodi ad ago sulla fontanella o a livello delle
suture;
— non applicare gli elettrodi sopra cefaloematomi o altre anomalie
del cranio;
— non posizionare gli elettrodi a contatto con il lettino;
— annotazioni frequenti durante la registrazione renderanno la
fase di lettura più agevole;
— nei bambini sottoposti a registrazione aEEG andrebbe sempre
fatta almeno una registrazione convenzionale EEG.
.. aEEG e le convulsioni neonatali
Il rilevamento di attività convulsiva è una delle indicazioni principali
per il monitoraggio aEEG nei neonati (Hakeem ). Le convulsioni
sono un evenienza piuttosto comune nei neonati con patologia neurologica o che abbiano presentato un distress respiratorio grave. Le
convulsioni sono spesso secondarie e causate da disturbi transitori
nell’apporto di ossigeno al cervello, nel metabolismo cellulare e nel
flusso ematico cerebrale.
Le cause più comuni di convulsioni nei neonati sono l’encefalopatia
ipossico–ischemica, l’emorragia intracranica, le alterazioni metaboliche e le infezione del sistema nervoso centrale. Le malformazioni
cerebrali congenite sono relativamente rare, ma possono causare
convulsioni severe e ricorrenti.
L’incidenza di convulsioni in una unità di terapia intensiva neonatale sono variabili a seconda della popolazione, dei criteri diagnostici e
dei metodi in uso per porre diagnosi. Quando era un criterio diagnostico per la diagnosi di convulsioni neonatali l’attività convulsiva clinica
e/o una registrazione EEG standard, l’incidenza in una popolazione
di TIN era del ,%. Quando l’EEG convenzionale e l’aEEG erano
combinati per diagnosticare i neonati con convulsioni, l’incidenza saliva al , %. Comunque la prevalenza di attività convulsiva può salire
fino al % quando si attua un monitoraggio EEG continuo in una
popolazione selezionata ad alto rischio.
Convulsioni elettroencefalografiche probabilmente non sono infrequenti in neonati durante L’ECMO. In più, oltre il –% dei neonati
pretermine che stanno sviluppando un emorragia della matrice ger-
. L’ aEEG (CFM)
minativa o altre lesioni ischemico – emorragiche presentano attività
convulsiva, spesso subdola o del tutto subclinica. Neonati moderatamente pretermine (– settimane di EG) sembrerebbero avere la
minor incidenza di convulsioni.
Ci sono alcuni aspetti delle convulsioni del neonato, come abbiamo
già detto, che sono peculiari del periodo neonatale: la maggioranza
delle convulsioni neonatali sono subcliniche o si presentano solo con
sintomi lievi (Mizrahi ).
Non è infrequente che un bambino in una TIN abbia convulsioni
subcliniche che perdurano per diverse ore. Non è affatto eccezionale
inoltre che le convulsioni clinicamente manifeste proseguano in forma
di convulsioni subcliniche dopo la somministrazione di un farmaco
(Hellstrom–Westas ).
Le convulsioni neonatali possono essere difficili da distinguere
dagli altri movimenti del paziente. Si è infatti dimostrato, facendo uso
del video EEG, che il sospetto clinico di convulsione spesso non si
accompagna alle convulsioni elettroencefalografiche. Un metodo per
distinguere le convulsioni cliniche da altri movimenti è stato suggerito
da Volpe (). Movimenti da irritabilità, miocloni del sonno e altre
manifestazioni non epilettiche cessano con la flessione passiva del
segmento interessato.
La maggior parte dei neonati con convulsioni presenta sia episodi
clinici che subclinici.
Le convulsioni neonatali, come abbiamo già accennato, sono di
difficile diagnosi attraverso la sola osservazione clinica. Un approccio
diagnostico che includa accurata osservazione clinica o monitoraggio
video, monitoraggio aEEG in neonati ad alto rischio e EEG standard a
completamento dell’aEEG rappresenta l’optimum per diagnosticare
correttamente le convulsioni neonatali.
La convulsività neonatale è associata ad aumento della mortalità e
ad outcome neurologico avverso. Convulsioni non trattabili o associate a un EEG di fondo che presenti anomalie severe ha la prognosi
peggiore. Recenti dati indicano che le convulsioni subcliniche e brevi
scariche ritmiche sono spesso associate ad un andamento negativo
(Allemand ).
Le convulsioni non sono associate con un outcome severo nei neonati asfittici con HIE lieve, ma sono correlati con un peggior quadro
esitale nei neonati con un quadro di HIE moderato o severo.
Neurofisiologia ed elettroencefalografia neonatale
Il trattamento dell’attività convulsivante subclinica può essere associata con un minor rischio di successiva recrudescenza, anche se
questo fatto non è stato verificato con studi randomizzati controllati.
Gli studi che hanno analizzato i possibili effetti negativi dell’attività
convulsiva sull’encefalo del neonato hanno dato risultati contrastanti.
Ci sono differenti punti di vista sul fatto che le convulsioni subcliniche necessitino o meno di una terapia farmacologica, ma sembra
ragionevole concludere che sia importante diagnosticare le convulsioni subcliniche nei neonati in modo da mettere il neonatologo nella
posizione di prendere le giuste decisioni.
Le convulsioni hanno caratteri sia clinici che elettroencefalografici
vari. Possono essere focali o generalizzate; possono apparire singolarmente o come convulsioni ripetitive di durata variabile e con un
intervallo intercritico variabile. I corrispettivi EEG sono solitamente
ritmici e variabili nella frequenza, nell’ampiezza, nella durata e nella
localizzazione. La durata minima di un pattern EEG ritmico per essere
classificato come un episodio convulsivo neonatale varia nei diversi
studi, ma è di solito di almeno – secondi.
I pattern aEEG di convulsione neonatale sono a volte difficili da
diagnosticare poiché possono essere tipo attività continua ritmica lenta
o di voltaggio molto basso e non sempre contengono onde aguzze.
Nella maggioranza dei casi, però, l’EEG standard è dirimente.
L’attività convulsiva nell’aEEG è discernibile perché rappresenta
un cambiamento transitorio (sia in frequenza che in ampiezza) dell’attività elettrocorticale di fondo (fig.). L’attività convulsiva nell’aEEG
è solitamente caratterizzata da un transitorio innalzamento dell’attività
di fondo (fig.). Il reperto più comune è un rapido innalzamento sia
del margine più basso che del margine più alto del tracciato. L’attività
parossistica convulsiva ricorrente nell’aEEG, corrispondente allo stato
di male epilettico o a convulsioni subentranti, ha l’aspetto a “ dente
di sega”(Archbald ) (fig.). La desincronizzazione dell’EEG nell’ipsaritmia durante gli spasmi infantili si manifesta invece come una
transitoria diminuzione dell’ampiezza dell’aEEG.
Le convulsioni neonatali possono essere erroneamente diagnosticate nell’aEEg per le seguenti ragioni:
— può non essere possibile rilevare attività elettrica parossistica
molto breve;
. L’ aEEG (CFM)
— se l’attività convulsiva è continua e senza interruzioni, c’è il
rischio che possa essere misconosciuta poiché non c’è un cambiamento nell’ampiezza dell’aEEG di fondo. Questo è relativamente raro, ma può essere sospettato in un aEEG di ampiezza
costantemente molto alta. Un EEG standard rivela in tal caso
l’attività convulsiva senza difficoltà;
— la stimolazione durante le procedure assistenziali spesso risulta
in un transitorio innalzamento dell’aEEG di fondo e può essere
erroneamente interpretata come attività epilettica. È importante, come già detto, che tutte le procedure di assistenza vengano
segnalate sul tracciato, per facilitarne l’interpretazione;
— il numero limitato di elettrodi rende l’aEEG un metodo semplice da usare nella routine clinica. Bisogna comunque tener
presente che un attività epilettica molto focale può anche non
essere rilevata.
Capitolo IX
Encefalopatia ipossico–ischemica
emorragia intracranica e aEEG
L’EEG neonatale è depresso durante e subito dopo un insulto ipossico–
ischemico. La durata e il grado di depressione dell’EEG si correla con
la severità del danno cerebrale (fig. –).
Durante il periodo di recupero, il susseguente EEG contiene informazioni sulla severità dell’ insulto ipossico–ischemico che lo ha
preceduto. Nei neonati, l’attività corticale è predittiva in modo altamente sensibile del quadro esitale neurologico se registrata a ridosso
dell’insulto ipossico–ischemico. Diversi studi hanno dimostrato che
l’outcome può essere predetto accuratamente da un aEEG durante la
prima ora di vita (Archbald , Thornberg ).
Nei neonati a termine asfittici, l’aEEG può predire accuratamente
l’outcome nell’% dei neonati a ore di vita e nel % dei bambini a
ore postnatali. L’attività di fondo dell’ aEEG più precoce nei neonati
asfittici si correla con il grado di HIE, con i livelli di enolasi neurone
specifica nel fluido cerebrospinale (Thornberg ), e con il metabolismo cerebrale del glucosio più in là nel periodo neonatale. Dati
preliminari indicano che un approccio combinato che includa aEEG e
valutazione clinica dell’EII implementa l’accuratezza predittiva dopo
l’asfissia (Shalak ).
Al momento, l’aEEG precoce è usato per la valutazione dei bambini prima dell’inclusione negli studi di intervento terapeutico con
ipotermia sui postasfittici.
L’attività di fondo elettroencefalografica è il più importante fattore
per predire il quadro evolutivo anche nei pretermine (Greisen ).
La presenza di attività convulsiva (fig.) non sembra essere un fattore
predittivo altrettanto valido. Le convulsioni non sembrano influenzare
l’outcome se l’attività di fondo aEEG è normale.
Neurofisiologia ed elettroencefalografia neonatale
L’attività di fondo si normalizza e il tracciato diventa CNV nella
maggior parte dei neonati a termine nell’arco di – settimane dopo un evento ipossico–ischemico. Dopo i primi giorni di vita, un
EEG standard è molto migliore per studiare l’evoluzione di anomalie
elettrocorticali, dal momento che i reperti attesi sono così difficili
da identificare tanto da essere a volte non identificabili con l’aEEG
(segni di immaturità o presenza di punte rolandiche positive in neonati
pretermine con leucomalacia periventricolare).
Neonati in situazione critica e non stabilizzati possono andare incontro a diversi eventi durante le cure intensive che possono influenzare
negativamente le funzioni cerebrali (periodi con bassa saturazione o
variabile ossigenazione e pressione del sangue). Con l’aEEG è impossibile seguire l’impatto sull’encefalo di queste situazioni sia nei neonati
a termine che nei pretermine. La capacità dell’aEEG di predire l’outcome neurologico dopo un evento ipossico ischemico successivamente
al periodo neonatale è stata poco studiata, anche se i dati, seppur scarsi,
indicano che l’attività di fondo dell’ aEEG e il grado di recupero sono
correlati con il quadro esitale.
L’attività di fondo del’EEG in neonati che hanno avuto bisogno
dell’ECMO sembra essere un fattore predittivo dell’evoluzione neurologica; e attività convulsiva subclinica durante l’ECMO non è rara.
L’attività burst–suppression è di solito un marker di danno cerebrale severo nei neonati a termine e sembra costituire una disconnessione
nei circuiti neuronali tra la corteccia cerebrale e gli strati più profondi
come il talamo. In feti di pecora asfittici, il ripetersi di un tracciato
EEG con un reperto continuo di convulsioni a basso voltaggio sembra essere un marker di danno parasagittale. Indagini neurologiche
post–mortem hanno dimostrato una relazione diretta tra il numero
di neuroni danneggiati e l’attività di fondo dell’EEG sia nei neonati a
termine che nei pretermine. Aso e colleghi () hanno mostrato che
l’inattività EEG era correlata con una necrosi disseminata che comprendeva la corteccia cerebrale, il nucleo striato, il talamo, mesencefalo e
ponte in studi post–mortem su neonati. L’attività burst–suppression è
inoltre correlata con danno cerebrale multifocale severo ma non è stata
identificata nessuna struttura specifica interessata in questi neonati
(Grigg–Damberger ).
La scoperta che la frequenza delle burst dopo EII sia correlata
con il successivo quadro esitale è supportata anche da uno studio
. Encefalopatia ipossico–ischemica emorragia intracranica e aEEG
su neonati pretermine. In questi pazienti la frequenza di bouffées
durante le prime ore postnatali identifica i neonati con un outcome
severamente compromesso e quelli con un quadro esitale buono.
Nelle lesioni cerebrali asimmetriche (infarto della arteria cerebrale
media) una concomitante asimmetria dell’EEG è comune.
È stato dimostrato che il tracciato EEG di fondo dell’emisfero interessato è predittivo del quadro futuro: una attività di fondo adeguata
è indicativa di una evoluzione normale, mentre un ‘attività di fondo
anomala aumenta i rischi che il bambino sviluppi una emiplegia.
L’aEEG non è stato valutato per queste situazioni, nonostante l’asimmetria possa essere vista se l’aEEG è registrato da più di un canale.
Comunque è sempre raccomandabile che l’EEG standard e l’aEEG
siano usati di concerto in lesioni cerebrali asimmetriche.
L’evoluzione neurologica è di difficile predizione nei neonati di
età gestazionale molto molto bassa nei primi giorni di vita. Questi
neonati vanno incontro ad un lungo periodo di cure intensive e possono occorrere numerose complicanze che possono compromettere la
funzionalità cerebrale (apnee severe, sepsi). Studi precedenti suggeriscono l’esecuzione di EEG ripetuti nel tempo per la predizione del
quadro esitale in questi neonati, attraverso una puntuale valutazione
maturativa, d’altronde, sia lo sviluppo di una emorragia della matrice
germinativa periventricolare che la leucomalacia periventricolare, si
associano ad un EEG depresso ed alla presenza di attività convulsiva elettrica in bambini di età gestazionale molto bassa. Il grado di
depressione dell’attività di fondo è correlata sia con la dimensione
dell’emorragia che con il numero di strutture cerebrali danneggiate
dalla necrosi ischemica (Greisen ). In neonati pretermine con età
gestazionale media di settimane, l’aEEG durante la prima settimana
di vita ha mostrato avere la stessa accuratezza dell’ecografia cerebrale
nel predire il quadro esitale. Inoltre la presenza del ciclo sonno–veglia
si associa con un migliore outcome.
I dati che riflettono l’impatto sull’EEG da parte di chiari episodi
ipossico –ischemici–emorragici sono relativamente modesti. Connell
e colleghi () hanno trovato che la depressione all’EEG spesso precede reperti all’ecografia, sia durante il presentarsi di emorragia della
matrice germinativa, che della leucomalacia periventricolare. Attività
convulsiva, spesso subclinica o con solo sottili manifestazioni cliniche,
come abbiamo già accennato, è relativamente comune durante lo
Neurofisiologia ed elettroencefalografia neonatale
sviluppo dell’emorragia della matrice germinativa e della leucomalacia periventricolare. Studi più recenti dimostrano che lesioni della
sostanza bianca possono essere rilevate prima con il monitoraggio
EEG che valuti gli spettri di frequenza (Hellstrom–Westas ).
.. Emorragia intracranica GMH–IVH e aEEG
Questo capitolo analizza l’uso dell’ aEEG nei neonati pretermine con
emorragia della matrice germinativa e periventricolare (GMH–IVH)
e nei neonati a termine con emorragia intracerebrale.
Anomalie dell’attività di fondo sono comuni in neonati pretermine
con GMH–IVH e possono precedere l’identificazione di anomalie
all’ecografia cerebrale. I primi cambiamenti acuti dell’EEG, quando
l’emorragia si sta sviluppando, sono caratterizzati da depressione dell’attività di fondo e dalla presenza di attività convulsiva. Il grado di
riduzione dell’attività di fondo dell’EEG e della depressione dell’attività di fondo dell’aEEG si correla in modo diretto alla dimensione della GMH–IVH. Questa correlazione è stata inoltre confermata
da studi effettuati post–mortem. Di solito la depressione dell’EEG
di fondo scompare in – settimane. Nei neonati pretermine con
un’ampia GMH–IVH il grado di recupero è predittivo dell’evoluzione
neurologica.
L’attività convulsiva (fig.), spesso interamente subclinica o con
solo sottili manifestazioni cliniche, è comune durante lo sviluppo di
una GMH–IVH (Clancy ). In uno studio su neonati prematuri
di età gestazionale media pari a settimane, che erano sottoposti
ad un aEEG durante i primi giorni di vita, attività convulsiva è stata
rinvenuta in / dei neonati che hanno sviluppato una GMH–IVH.
In uno studio che includeva neonati di età gestazionale inferiore (EG
media settimane) sottoposti ad un aEEG durante la prima settimana
di vita, attività convulsiva è stata presentata dal % dei neonati che
hanno sviluppato una GMH–IVH. L’attività convulsiva che è associata
alla GMH.IVH è di solito presente solo durante i primi giorni di vita,
mentre l’emorragia si sta sviluppando. L’impatto delle convulsioni
sulle funzioni cerebrali e il loro rapporto con il futuro quadro clinico
non è conosciuto. Tuttavia, nei neonati con un ampia IVH, convulsioni
. Encefalopatia ipossico–ischemica emorragia intracranica e aEEG
ripetitive non sembrano essere associate necessariamente con un
outcome severo.
La precoce capacità predittiva dell’outcome neurologico data dall’aEEG è comunque più incerta nei neonati pretermine con emorragia
rispetto ai neonati a termine asfittici, poiché il grado di prematurità
e altri problemi non correlati influenzano il quadro esitale. Tuttavia
esiste una correlazione tra l’aEEG di fondo e il grado di GMH–IVH
e la precoce attività elettrocorticale di fondo registrata in questi casi
contiene anche informazioni prognostiche nei neonati pretermine.
Nei neonati pretermine con un II o III grado di GMH–IVH, il numero massimo di burst/h all’aEEG durante le prime ore di vita si
sono dimostrate predittive dell’outcome tardivo. Questo è in accordo
con le scoperte sperimentali durante il periodo successivo all’insulto
ipossico–ischemico–emorragico nell’animale da esperimento: quando le burst comparivano la frequenza delle burst era predittiva del
quadro esitale (Scherman ). I neonati pretermine con ampia IVH
e una frequenza di burst più alta di burst/h avevano un –% di
possibilità di sopravvivere in piena salute o con un handicap minore
o moderato. Tuttavia, il cut–off di non può essere direttamente e
facilmente usato, visto che lo studio era retrospettivo e la gran parte
dei neonati prendevano il phenobarbital.
La presenza del ciclo sonno–veglia verso la fine della prima settimana si è dimostrato inoltre predittivo di un futuro neurologico
relativamente buono. L’alternarsi di sonno–veglia nell’aEEG è inoltre
associato con un buon quadro esitale nei neonati di età gestazionale
molto bassa con assenza di IVH o presenza di una piccola GMH–IVH
(Hellstrom–Westas ).
Nei neonati a termine, una emorragia intracerebrale (ICH) è spesso associata con un trauma alla nascita, coagulopatie o malformazioni
vascolari. Non ci sono reperti aEEG associati con ICH in neonati a
termine. Come per i neonati pretermine con GMH–IVH, l’emorragia intracerebrale nei neonati a termine è spesso accompagnata da
depressione elettrocorticale e attività convulsiva. Il grado di anomalie
di fondo è correlato alla severità dell’insulto cerebrale.
Neurofisiologia ed elettroencefalografia neonatale
.. Conclusioni
Da quanto detto sinora, risulta chiaro che anche il CFM si è ormai
ritagliato un ruolo importante in neurologia neonatale, sia per la sua
validità oggettiva e per il contributo nelle diverse forme di patologia
del SNC, sia soprattutto per la semplicità di esecuzione e di interpretazione. Non va però mai dimenticato che tuttora il gold standard
dell’EEG è l’EEG convenzionale.
Non ci sembra ci siano dubbi sul fatto che i due strumenti si debbano integrare, lasciando all’aEEG il compito di monitorare per lunghi
periodi l’attività bioelettrica, soprattutto allo scopo di individuare crisi
convulsive infracliniche e di valutare il voltaggio dell’attività di fondo.
Ma non si può fare a meno di ricorrere anche al cEEG per studiare i
diversi grafoelementi, l’asimmetria e l’asincronia interemisferica, le
crisi di brevissima durata, le depressioni isolate dell’attività di fondo
etc. Un uso coordinato dei due tipi di EEG è attualmente il modo
migliore di utilizzarli, soprattutto se registrati insieme al video e se
integrati dalla clinica, dalle neuro immagini e dal laboratorio.
Capitolo X
Nuove applicazioni dell’EEG neonatale
.. Assistenza al neonato con encefalopatia ipossico–ischemica
(EII) tramite trattamento ipotermico
Il trattamento ipotermico del neonato con insulto cerebrale postasfittico è a tutt’oggi l’unico strumento a disposizione per minimizzare il
danno ipossico–ischemico cerebrale. Nei protocolli di reclutamento
e di assistenza giocano un ruolo molto importante l’EEG e l’aEEG.
Ci è parso quindi opportuno trattare questo argomento perché per
l’ennesima volta l’EEG ha mostrato l’importanza del suo ruolo in
neonatologia.
... Incidenza dell’EII
L’encefalopatia ipossico–ischemica (EII) è tuttora una delle cause più
comuni di paralisi cerebrale infantile (circa il % del totale (Blair
). L’incidenza di asfissia intrapartum è di circa – per nati
vivi (Low )); la incidenza di EII severa o moderata (Badawi ),
in assenza di altre anomalie pre–concezionali o antepartum, è di circa
. per . nati vivi. L’EII di grado moderato o severo è gravata da
una mortalità compresa tra il e il %; tra i sopravvissuti il %
sviluppa sequele neurologiche significative(Shankaran ).
... Meccanismi patogenetici del danno cerebrale ipossico–ischemico
Il danno a livello cerebrale è un processo evolutivo che inizia durante l’insulto ipossico–ischemico e, nei casi più gravi, continua in un
periodo successivo o di riperfusione. In fase acuta avviene la necrosi neuronale conseguente all’ipossia cellulare con esaurimento del
metabolismo cellulare (insufficienza energetica primaria). Tuttavia
Neurofisiologia ed elettroencefalografia neonatale
molti neuroni non muoiono durante la prima fase ma solo dopo la
riossigenazione del neonato, da a ore dopo l’insulto ipossico–
ischemico. Si tratta prevalentemente di morte neuronale per apoptosi,
un processo che può perdurare anche per alcuni giorni (Perlman
).
L’interpretazione sempre più corretta di questi meccanismi patogenetici ha permesso nuove strategie terapeutiche che vanno ad
aggiungersi a quanto fatto finora, ovvero al semplice mantenimento
dell’omeostasi e al controllo delle convulsioni. Le nuove opportunità
terapeutiche possono inserirsi nell’intervallo che segue la rianimazione di un neonato asfittico prima che la fase secondaria del danno
energetico metabolico sia completamente in atto.
... Raffreddamento cerebrale
Attualmente l’ipotermia rappresenta il trattamento di scelta dell’EII
(Gluckman ), riducendo tra l’altro l’edema vasogenico, il rilascio
di neurotrasmettitori eccitatori e di radicali liberi dell’ossigeno, l’attivazione di citochine ed il metabolismo cerebrale. Una metanalisi della
letteratura ( Jacobs ) ha riportato una riduzione di mortalità nei
neonati trattati con ipotermia rispetto ai controlli.
Attualmente le modalità di trattamento ipotermico sono fondamentalmente due: ipotermia sistemica ed ipotermia selettiva con risultati
pressoché sovrapponibili.
La conclusione è pertanto che l’ipotermia è una terapia efficace
in una popolazione selezionata di neonati con encefalopatia ipossico–
ischemica moderata o severa, ma solo se il trattamento è iniziato
prima delle sei ore di vita.
I criteri di eleggibilità si applicano esclusivamente a neonati di età
gestazionale > settimane.
Devono essere presenti entrambi i criteri A e B:
— A. ipossia intrapartum definita da almeno uno dei seguenti
criteri:
– punteggio di Apgar < a minuti di vita oppure;
– necessità di proseguire la rianimazione con tubo endo–
tracheale o maschera e pallone ancora a minuti di vita
oppure.
. Nuove applicazioni dell’EEG neonatale
— Acidosi fetale o neonatale definita come
– pH < . oppure BE > mmol/l (il prelievo deve essere eseguito il prima possibile, preferibilmente da arteria
ombelicale; nel caso di più di un’emogasanalisi (EGA)
nei primi 0 di vita, considerare quella con i valori più
patologici.
– B. encefalopatia ipossico–ischemica moderata o severa
secondo la classificazione di Sarnat & Sarnat valutata tra
e minuti di vita.
... Compiti del centro di riferimento di – livello
Nei neonati che soddisfano i criteri A e B: avvio della valutazione EEG
mediante CFM o cEEG di almeno minuti possibilmente prima della somministrazione di terapia sedativa/antiepilettica (fenobarbitale,
fentanil, midazolam) (Shany ).
a) Patterns patologici (al Naqeeb ) alla valutazione aEEG che
indicano la necessità di iniziare trattamento ipotermico:
a) attività moderatamente anormale (margine superiore >
microvolts e margine inferiore < microvolts);
b) attività severamente anormale (margine superiore < microvolts e margine inferiore < microvolts; questo tracciato di
basso voltaggio può essere accompagnato da burst di punte ad
alto voltaggio che appaiono come singoli spikes sopra l’attività
di base);
c) attività elettrica convulsiva: tracciato a dente di sega.
b) Anomalie importanti (Lamblin ) all’EEG standard che indicano la ncessità di trattamento ipotermico (almeno uno dei seguenti
patterns):
a) burst suppression;
b) basso voltaggio continuo < microvolts;
c) attività elettrica convulsiva.
Neurofisiologia ed elettroencefalografia neonatale
In caso di patterns aEEG e/o EEG patologici iniziare ipotermia
selettiva o sistemica, per la durata totale di ore, con monitoraggio
continuo della temperatura cutanea e rettale profonda:
a) ipotermia selettiva con lieve ipotermia sistemica: raffreddamento ad
una temperatura rettale di – ‘C tempo medio di raggiungimento
della temperatura target: minuti
b) ipotermia sistemica (Shankaran ): raffreddamento ad una
temperatura rettale di –.
NB: occorre prestare particolare attenzione al mantenimento di una
temperatura rettale costante. La somministrazione di sedativi, anticonvulsivanti, oppiacei, rilassanti muscolari e l’ipossia possono ridurre
la temperatura corporea (Thoresen ) e, causando eccessiva ipotermia, potrebbero favorire l’instabilità del neonato e l’insorgenza
di effetti collaterali. I sistemi con servo–controllo della temperatura
possono prevenire le eccessive oscillazioni di temperatura.
) Assistenza durante ipotermia: proseguire la normale assistenza al
neonato asfittico.
a) posizionamento catetere ombelicale o altra via venosa centrale.
Può essere utile una via arteriosa per il monitoraggio della PA
e per l’esecuzione dei prelievi;
b) trattamento delle eventuali convulsioni. Esistono protocolli
diversi basati su opinioni di esperti che adottano i seguenti
farmaci: fenobarbitale o fenitoina (di solito come prima scelta), benzodiazepine (midazolam, lorazepam), lidocaina (Volpe
);
c) minimizzare gli stimoli esterni (luce, rumori, manipolazioni);
porre attenzione al controllo posturale e ove possibile prevedere variazioni posturali. Sedo–analgesia con morfina o fentanil
in infusione continua. INIZIARE SEMPRE CON I DOSAGGI
PIU’ BASSI CONSIGLIATI (Roka );
d) mantenimento di livelli glicemici > mg/dI e di una adeguata
PA arteriosa (PA media > mmHg). In caso di ipotensione:
dopamina e dobutamina. Non è consigliato l’uso routinario
della dopamina nel neonato asfittico (Hunt );
e) supporto farmacologico cardiovascolare su base clinico–strumentale (valutazione ecocardiografica);
. Nuove applicazioni dell’EEG neonatale
f ) gestione attenta dei liquidi in quanto il neonato asfittico è a
rischio di insufficienza renale.
) Monitoraggio durante ipotermia:
a) valutazione peso, diuresi oraria;
b) importante proseguire registrazione dell’aEEG o dell’EEG
durante il trattamento e il riscaldamento;
c) parametri vitali: FC, FR, SatO e altri come da necessità clinica;
d) monitoraggio continuo della temperatura rettale, temperatura
della testa (quest’ultima in caso di ipotermia selettiva);
e) monitoraggio PA o rilevazione pressione arteriosa – ECO
quotidiano.
Conclusioni
A conclusione di questa esposizione riteniamo opportuno ribadire
il concetto già più volte espresso che l’uso sempre più diffuso di
moderni mezzi diagnostici strumentali quali la RMN cerebrale, l’ecoencefalografia, la PET, la tecnica Doppler per lo studio della velocità
del flusso cerebrale etc., non hanno affatto ridotto l’interesse e il campo di applicazione della elettroencefalografia neonatale: basti pensare
alle convulsioni neonatali, alla necrosi neuronale, alla leucomalacia
periventricolare, all’IVH, all’encefalite erpetica e soprattutto all’apporto insostituibile che l’ EEG dà nel formulare un corretto giudizio
prognostico già dalle primissime ore di vita. Anzi, le attuali possibilità
di più esatte correlazioni elettro–cliniche e elettro–anatomiche aprono
nuovi amplissimi spazi alla utilizzazione dell’ elettroencefalogramma
in età neonatale. Anche il più importante approccio terapeutico all’EII,
l’ipotermia, presuppone l’utilizzo dell’EEG.
È nostro augurio e nostra speranza che questa esposizione stimoli
i neonatologi, i tecnici EEG e i neurologi infantili ad interessarsi di
più a questo argomento, ad utilizzare sempre più e meglio questo
strumento e a determinare di conseguenza un più rapido progredire
dell’elettroencefalografia neonatale in particolare e, in generale, di
tutta la neurologia neonatale.
Appendice illustrativa
Figura .
Appendice illustrativa
Figura .
Appendice illustrativa
Figura . Artefatto da cattivo contatto morsetto–elettrodo simulante
una crisi EEG.
Appendice illustrativa
Figure –.
Figura . Artefatto da pulsazione di una arteria simulante una crisi
EEG.
Appendice illustrativa
Figure ––. In senso orario: artefatto secondario ad attività respiratoria simulante una crisi EEG; artefatto da singhiozzo simulante punte;
artefatto da ammiccamento simulante encoches frontali.
Appendice illustrativa
Figure –. Sopra: EEG di un neonato di settimane di età gestazionale. Sotto: esempio di sonno REM di un neonato di settimane
di età gestazionale.
Appendice illustrativa
Figure ––. Sopra: EEG di un neonato di settimane di età
gestazionale; presenza di ritmi theta e di onde lente occipitali sovraccaricate di ritmi rapidi. Sotto: esempio di sonno calmo di un neonato
di settimane di età gestazionale; presenza di encoches frontali di un
neonato con età gestazionale a settimane.
Appendice illustrativa
Figure ––. In senso orario: EEG di un neonato di settimane di
età gestazionale con presenza di onde lente occipitali sovraccaricate di
ritmi rapidi acuti; esempio di sonno calmo di neonato a termine con
attività continua; tracciato di sonno REM di neonato a termine: fase
che precede il sonno calmo.
Appendice illustrativa
Figura . Neonato di settimane di età gestazionale: esempio di
sonno calmo con attività alternante.
Appendice illustrativa
Figura . Esempio di convulsione “apneizzante”.
Appendice illustrativa
Figura . Tracciato inattivo.
Appendice illustrativa
Figura . Tracciato parossistico.
Appendice illustrativa
Figura . Tracciato parossistico.
Appendice illustrativa
Figura . Tracciato di basso voltaggio.
Appendice illustrativa
Figure –. Sopra: tracciato di basso voltaggio con sovraccarico di
bouffées parossistiche. Sotto: esempio di asimmetria di ampiezza per
riduzione del voltaggio sull’emisfero sinistro.
Appendice illustrativa
Figura . Asincronia.
Appendice illustrativa
Figura . Esempio di punte rolandiche positive.
Appendice illustrativa
Figura a. Crisi esclusivamente EEG interessante l’emisfero destro.
Appendice illustrativa
Figura . Tracciato di neonato di settimane di età gestazionale con
caratteristiche maturative mal identificabili.
Appendice illustrativa
Figura . Crisi interessanti l’emisfero destro.
Appendice illustrativa
Figure –. Sopra: crisi elettroncefalografica caratterizzata nelle derivazioni rolandiche di destra con onde aguzze e in quelle di sinistra
da un ritmo “alfa–like”. Sotto: crisi EEG con ritmi pseudo–alfa.
Appendice illustrativa
Figura . Asimmetria di ampiezza per riduzione del voltaggio maggiore sull’emisfero sinistro con emorragia sub–durale
parieto–occipitale sinistra (M N., A F., G S., ).
Appendice illustrativa
Figure ––. Sopra: Focolaio persistente di punte di basso voltaggio in temporale destra; neonato con emorragia sub–durale temporo–
parietale destra (M N., A F., G S., ). Sotto:
Particolare a maggiore ingrandimento.
Appendice illustrativa
Figura . Crisi multifocali.
Appendice illustrativa
Figura . Attività periodica in neonato con encefalite erpetica
(E, M, A, ).
Figura . Trasformazione della attività periodica presentata nella fig.
: neonato con encefalite erpetica (E, M, A, ).
Appendice illustrativa
CFM
Figura . Tracciati normali.
Appendice illustrativa
Figura . Crisi.
Appendice illustrativa
Figura . Crisi.
Figura . Dente di sega.
Figura . Tracciato fortemente depresso con burst di attività.
Appendice illustrativa
Figura . Tracciato estremamente depresso.
Figura . Crisi.
Figura . Crisi.
Bibliografia
A F., M N., L J.C., L’électroencéphalogramme dans les hémorragies sous–durales du nouveau–né. Rev. Electroencephalogr. Neurophysiol.
––.
A F., O S., O L. C P.: La prognosi delle convulsioni
nel neonato a termine, Studio di casi. Neuropsichiatria infantile – –.
A F.: L’EEG in età neonatale. Aggiornamento pediatrico, ––.
A F. T C., O S.: L’apnea nel neonato. Rapporti con l’età gestazionale, il ritardo di crescita intrauterino e le differenti fasi del sonno. Riv.Ital. Ped.
––.
A F., O L., T C., O S.: Encefalopatia ipossico–ischemica
neonatale di grado medio: follow up a due anni. Riv. Ital. Ped. ––.
A F., R F., S M. A A.: Perinatal HIE: epileptic and paretic
outcome at one year of age. Ital J Pediatr , , .
A S., W P.K. Long term clinical outcome of neonatal EEG findings.
J.Clin.Neurophysiol ––.
A N N, : Assessment of neonatal encephalopathy by amplitude–integrated
EEG. Pediatrics , , .
A–T C.: Les états de souffrance cérébrale chez les nouveau–né à terme. Revue
du praticien ––.
A T., E R., P A.: Manual of standardized terminology techniques
and criteria for scoring of states of sleep and wakefulness in newborn infants. UCLA
brain information Service, BRI Los Angeles .
A O., L N., M F.: Dénsité et dynamique des encoches pointues
frontales dans le sommeil du nouveau–né et nourisson. Rev. Electroencephalogr.
Neurophysol. ––.
A K, A–B M, S MS: EEG and neuropathology in premature neonates
with intraventricular hemorrhage. J Clin Neurophysiol , , .
B N : Intrapartum risk factors for newborn encephalopathy: the western
Australia case–control study. BMJ , .
B A.B.: Prenatal infections involving the brain. Handbook of EEG and clinical
neurophysiology. Vol I. B––.
Bibliografia
B R.M.: Electrical parameter of the brain during ontogeny. In ‘Brain and
early behaviour”. Ac. Press New York .
B J.K., P R.J., F J.O., C F.: Neurological aspects of perinatal
asphyxia. Develop. Med. Child. Neurol. ––.
B E, W L.: Epidemiology of cerebral palsy. Semin Fetal Neonatal Med.
––.
B G., B L., M C., O’F B., R J.: International survey
of EEG use in the neonatal intensive care unit An. Acta Paediatr , ; .
B A.C., B M.H.: Respiratory control in newborn infants. Read before the
Congress for perinatal medicine. Berlin .
C B., A F., L M.H.: Factors Predictive of Seizures and Neurological Outcome in Perinatal Depression. Pediatr Neurol ––.
C GB., D G E.: La sindrome convulsiva. in “Neurologia neonatale” a cura di Ottaviano S. e Allemand F., Verduci .
C W.F.: Studies of the maturational changes in the EEG during sleep and
wakefulness in the monkey. In Kellaway P. and Petersen I. “Neurological and
electroencephalographic studies in infancy”. Grune & Stratton New York .
C P. J., S R.M., V G.H.: Thecnical Standards for Recording and
Interpretation of Neonatal EEG in Clinical Practice. Ann Indiana Cad Neurol
–; .
C C., F D., F A., F A., M P E.: Differentiation between two states in the active sleep of the newborn IRCS ––.
C RR, D L. E : Agreement between long–term neonatal background
classification by conventional and aEEG. J. Clin. Neurophysiol .
C R.W., MC CB.,. W D., S J. G FE.: Continuous
monitoring of the EEG following perinatal asphyxia. J. Pediatr. ––.
C H., D M., G P.L.: Parassitosis of the central nervous system.
Handbook of EEG and clinical neurophysiology. VoI A –.
C J, O R : Continuous channel EEG monitoring in the evaluation of
echodense ultrasound lesions and cystic leukomalacia. Arch Dis Child , ,.
C E., A M., M N., D–B C.: Apport de I’EEG au diagnostic des hémorragies intra–ventriculaires du prématuré. Rev. Electroencephalogr.
Neurophysiol. ––.
C–D L., P E.: Mouvements respiratoires au cours du sommeil
du nouveau–né à terme: comparaison des enregistrements thoraciques et abdominaux.
Rev. Electroencephalog r. Neu rophysiol. ––.
Bibliografia
C–D L.: Thoracico–abdominal respiratory correlations in infants: constancy and variability in different sleep states. Early Human develop. / –– .
D MM., W G.S., M.L., S D.B., Z TE., R A.J.,
P RG., Z M., B R.J.: Congenital! rubella encephal/itis J. Pediatric.
––.
D–B C Activité électrique cérébrale du foetus et du très jeune prématuré.
Trans. Fourth. Internat. Congr. of Electroenceph. Clin. Neurophysiol. Acta
Med. BeIg. –.
D–B C. M N., S P., D P. M M.: L’EEG dans les six
premiers mois de la vie, après reanimation prolongée et états de mal néonatal. Recherche
d’éléments de prognostic. V Congrès Intern Electroenceph. o n. Neurophysiol.
Excerpta Med. nt. Congr. Series ––.
D–B C.: The EEG of the premature infant and fulI–term newborn. Normal
and abnormal development of waking and sleeping patterns. In Kellaway P. and
Petersen I. : “Neurological and electroencephalographic correlative studies in
infancy”. Grune & Stratton New York – .
D–B C.: Sleep ontogenesis in early human prematurity of – weeks of CA..
Dev. Psychobiol. – –.
D–B C.: Ontogenesis of sleep in human premature after weeks of CA..
Dev. Psychobiol. ––.
D–B C.: Critères électrophysiologiques de maturation et retard de croissance
intrauterine. XXIII congrès de l’Association dos pédiatres de Iangue franqaise.
––.
D–B C., M N.: Sleeping behaviour in abnormal newborn infants.
Neuropediatrics –– .
D–B C.: Ontogenesis of brain electrical activity and sleep organization in
neonates and infants. In Falkner F. and Tanner J.M. ‘Human Growth” Vol. .
D–B C.: Neonatal electroencephalography. in “Reviews of perinatal medicine” edited by E. Scarpelli and E. Cosmi – voi. – Raven Press, New York
a.
D–D M.: Contribution à l’étude du fonctionnement du sistème nerveux du
nouveau–né à terme. Acta paediat. Belg. ––.
E R.J.: Studies of electrical activity of the developing human brain. Progress in
Brain Research ––.
E R., D . M M.: EEG of prematures: – years follow up
study. Dev. Psychobiol. ––.
Bibliografia
E AN., K K.L.: Neonatal smiling, frowling and rapid eye movements states.
Sleep cycle studies. J. Am. Acad. Chiid Psychiatry ––.
E R.: Abnormal electroencephalograms in the newborn period and their significance.
Amer. J. ment. Defic. ––.
E R.: Abnormal electroencephalograms in the neonatal period. CC. Thomas,
Springfield .
E E., M N. A–T C.: Etude électroéncephalographique d’un
cas d’encéphalite herpétique néo–natale. Rev, Electroencephaiogr. Neurophysiol.
––.
F G., P C.: L’EEG del neonato normale. In “Neurologia neonatale” a cura
di Ottaviano A. e Allemand F., Verduci .
F F., C L.: L’EEG nella sofferenza neurologica del neonato. In “Neurologia neonatale” a cura di Ottaviano S., Allemand F., Orlandi L., Verduci
.
F G.M.: Neonatal Neurology. Churchill Livingstone .
F A.M., A F F. M R R.: Aspectos neurologicos
e electroencephalographicos da toxoplasmose. Arch. Neuro–psiquiat. (. Paulo) –
–. ) Flisberg A., Kielmer K.J., Lofhede J., Lindecrantz K., Thordstein
M.,: Prognostic capacity of automated quantification of suppression time in the
EEG of post–asphyctic fullterm neonates. Acta Paediatr , ; .
G M., A M., S F.J.: Apneic spells and sleep states in preterm infants.
Pediatrics ––.
G J.: Activités périodiques en EEG. Rev. EEG Neurophysiol. ––.
G R.N., G S.L., R RE., F R.: Detection of seizure activity
in the paralyzed neonate using continuous monitoring. Pediatrics ––.
G L., K MV., H M.: Effects of chronic intrauterine asphyxia on
organ maturation. In Gluck L.: “Intrauterine asphyxia and developing fetal brain”
Chicago .
G PD, W JS . Selective head cooling with mild systemic hypothermia
after neonatal encephalopathy: multicentre randomised trial. Lancet , , .
G JB., G L., K MV.: The relationship between accelerated neurological
maturity in certain chronically stressed pregnancies. Am.J. Obstet Gynecol. ––
.
G A.: Neuro–ontogeny of sleep in the rat. In ‘Basic sleep mechanisms’.
Petre–Quadens O., Shag J.D. Eds. AC. Press New York .
G G : EEG depression and germinal layer hemmorrhage in the newborn.
Acta Paediatr Scand ,,.
Bibliografia
G G, P O: Low CBF discontinuous EEG activity and periventricular brain
injury in ill preterm neonates. Brain Dev , , .
G–D MM : Neonatal burst–suppression: its developmental significance. Pediatr Neurol , , .
G C., P R., S M., D W.C.: Apneas during sleep in
infants. Possible relationship with SIDS. Science ––.
G C., S M.: Sleep states and relative pathology. In Korobkin R.,
Guileminault C. “Advances in perinatal neurology’, .
H R., B AO., B M.H., G G.: Neonatal chest wall afferents and
regulation of respiration. J. Appl. Physiol ––.
H VF, W SJ: EEG monitoring of theraphy for neonatal seizures. Dev Med
Child Neurol , , .
H A. T J.P.: The electroencephalogram in neonatal convulsions. J. Pediatr.
– –.
H M : Background EEG activities of very preterm infants born at less than
weeks gestation: a study of the degree of continuity. Arch Dis Fetal Neonatal Ed
, F, .
H–V L, R I, S NW, Silent seizures in sick infants in
early life. Acta Pediatr Scand ,,.
H–V L, K H : Early prediction of outcome with aEEG in
preterm infants with large intraventricular hemorrhages. Neuropediatrics , ,
.
H–V L, V LS R I, An atlas of aEEG in the newborn
Parthenon .
H–S D.J., R D.J.C.: Depression of intercostal and abdominal muscle
activity and vulnerability to asphyxia during active sleep in the newborn. In Alan. R.
“Sleep apnea syndrome’ Liss. Pub. New York .
H G., R J., H J., S A., T M. Z A.: Prognostic value ofthe electroencephalogram in neonatal asphyxia. Eectroencephalogr.
Clin. Neurophysiol. ––.
H T., H J.E., H R.M., H E.. S MG D.J.: Polygraphic studies of normal infants during the first six months of life.
III: incidence of apnea and periodic breathing. Pediatrics – –.
H J.G., E B. B U.A.: EEG of newborn. IV. Abnormal EEG of
neonate. Amer. J. Dis. Child. ––.
H R, O D: Dopamine for prevention of morbidity and mortality in term
newborns infants with suspected perinatal asphyxia. Cochrane database Syst Rev
CD .
Bibliografia
H A.M.: Rewiev of neonatal EEG. Am J Electroneurodiagnostic technol ;
.
M.Z.: The response of the brain to hypoxia and ischaemia. J. Neurol. Sc.
––.
I Y., W S. .: Paroxysmal automatic movements mimiching neonatal
seizures induced by Midazolam. No To Hattatsu ––.
I O. L–R L.: Reperti EEG nei traumi cerebrali da parto e nella
loro evoluzione. Il Lattante, ––.
K T, O A. : aEEG in preterm infants with cystic periventricular
leukomalacia. Early Hum Dev .
K G : Prognostic value of EEG in neonatal bacterial meningitis. Pediatr
Neurol , , .
J S, H R, T–M W, I T, D P. Cooling for newborns with
hypoxic ischaemic encephalopathy. Cochrane database Syst.Rev. CD .
J J., L N. D–B O.: Spatio–temporal organization of EEG in
premature infant and full–term newborns. Electroencephalogr. Clin. Neurophysiol.
– – .
J D., V J., J M.: Étude polygraphique du sommeil du chaton. Compte
rendu des societés biologiques. ––.
J M. P–Q O.: Le sommeil paradoxal et le rève chez les debiles
mentaux. Acta Neurol. Belg. ––.
L V, S F, S M, A A, D FR, A F:
Il valore prognostico dell’EEG nel periodo neonatale. Gior Neuropsich Età Evol
...
L P. S R.: Atlas d’électroencéphalographie infantile. Masson. Paris .
L A., M J. D OH.: Les altérations électroencéphalographiques dans
la toxoplasmose congenitale et acquise. Ann. Pédiatr. A––.
L MD : EEG nouveau né premature et à term. Aspects maturativs et du
glossaire. Neurophysiol Clin , , .
L M.D., A M. .: Indication of EEG in the newborn. Arch Pediatr
––.
L M.D., A M.: EEG of the fullterm newborn. Normal features and hypoxic
ischemic encephalopathy. Neurophysiol Clin ––.
L J.O.: Nécrose cérébrale massive chez le nouveau–né. Ses rapports avec la
maturation, son expression clinique et bioélectrique. Biol. Neonat. (Basel) ––
.
L–R L.: Indicazioni e valore diagnostico dell’indagine elettroencefalografica
nel neonato. Minerva Nipiol. –– .
Bibliografia
L B A., B K., B A., T B C., F A.: Prognostic value
of EEG in very premature newborns. Arch Dis Child Fetal Neonatal –.
L–K A.: EEG in neonatal meningitis and cerebral hemorrages. Handbook of EEG and Clinical Neurophysiology. Voi. B –.
L J., T M. .: Automatic classification of background of EEG activity
in healthy and sick neonates. J Neural Ang ––.
L O.T.: Neurophysiological observations in diseased newborns. Biol. Psichiat.
––.
L O.T.: Quantified graphic scales on preterm healthy newborns followed up
to – weeks by serial polygraphic recordings. Electroencephalogr. Clin. Neurophysiol. ––.
L AL., N H.E., G H.: Electrical potentials of the human brain. J.
Exp. Psycol. ––.
L HO., L N.A., F–H B.: lmpaired autoregolation of cerebral blood
flow in the distressed newborn infant. J. Pediatr. – –.
L JA: Determining the contribution of asphyxia to brain damage in the neonate. J
Obstet Gynaecol res ––.
M J., M F., P P. S M.: Etude du tracé des premiers
jours de vie dans les aminoacidophaties. Rev. EEG Neurophysiol. ––.
M EM, K P: Characterization and classification of neonatal seizures
Neurology , , .
M M. B F.: Le syndrome électroencéphalografique des embryopathies
par toxoplasmose. Schweiz. Arch. Neurol. Psychiat. ––.
M N., D–B O.: Les premières étapes de l’organisation du sommeil chez
le prématuré et le nouveau–né. In “Le sommeil de nuit normal et pathologique”.
Masson Paris .
M N D P.: The prognostic value of the electroencephalogram in the first
two years of life. in Verma and I. Petersen “Clinical electroecephalography of
children” Stockholm .
M N. D–B C. E S Z.: Depistage et prognostic de l’état de mal
néonatal d’après l’étude de cas. Arch. Franc. Pédiatr. ––.
M N. G L.: Auditory responsivity of the human premature. Biol Neonat.
(Basel) ––.
M N P N., G S.: The neonatal EEG: Statistical studies and prognostic
value in full–term and pre–term Electroencephaogr. Clin. Neurophysiol. ––
.
Bibliografia
M N. C–D L., G S.. V S.: Pauses respiratoires et
sommeil chez le nouveau–né et le nourissor Rev. EEG Neurophysiol. –– .
M N. T B.: Activité électroencéphalographique normale du nouveau–né au
cours des états de veille et de sommeil. Rev. EEG Neurophysiol. –– .
M N. A F. G S.: Importanza dell’EEG nella diagnosi delle lesioni
traumatiche e anossiche del neonato a termine “Neurologia neonatale” a cura di
Ottaviano S. e Allemand F. Verduci .
M I.: lntérét discriminatif des pointes rolandiques. Contribution au diagnostic des
hemorragies intraventriculaires. Thèse pour le doctorat en medecine. Paris .
M RE.: Two patterns of perinatal brain damage and their conditions of occurrence.
Am. J. Obstet. Gynecol. ––.
M R,S.: Lactic acid accumulation as cause of brain edema and cerebral necrosis
resulting from oxigen deprivation. n A. Korobkin and C. Guilleminault ‘Advances
in perinatal neurology” Spectrum Publ. .
N D., O D. .: Recording Conventional and a EEG in Neonatal
Intensive Care Unit. Eur J Paediatr Neurol ––.
N R., W U., G: Bioelectric brain maturation in small for date infants.
Develop. Med. Child Neurol ––.
N A., H G.: A polygraphic study of bioelectrical brain maturation in preterm
infants. Develop. Med. Child Neurol. ––.
N M O., S D., B R.V.: Significance of backgroud of activity and positive sharp waves in neonatal EEG as prognostic of cerebral palsy. Arq
Neuropsiquiatr ––.
N M.L., C J.C.: Sleep and Epilepsy in Neonates. Sleep Med ––.
P K.E. W J.W.: Hemorrage, ischaemia and the perinatal brain. W.
Heineman Medica Books, London .
P L., B J., B A. K H.: lncidence and evolution of
subendymal and intraventricular hemorrage. A study of infants with birth weigth less
when g. J. Pediatr. ––.
P A., S F., A Y., W W., S M. S E.:
Maturation of EEG activity during sleep in premature infants. Electroencephalogr.
Clin. Neurophysiol ––.
P P., C J. R M.: L’Electroencéphalographie au cours de
la maturation cérébrale. Montpellier Méd. ––.
P P. C J.: EEG and clinical study of epilepsy during maturation in
man. Epilepsia – –.
P S., H G.L., O M., A F.: Neonatal Seizures: characteristics of EEG ictal activity in the preterm and fullterm infants. Brain Dev ––.
Bibliografia
P J.M. V J.J.: Seizure in the preterm infant: effects on cerebral blood flow
velocity, intracranical pressure, and arterial blood pressure. J. Pediatr. ––.
P JM: Summary proceedings from the neurology group on hypoxic–ischemic
encephalopathy. Pediatrics , , .
P–Q O.: On the different phases of the newborn with special reference to the
activated phase or phase d. J. Neuro. Sci. ––.
P P., M F., L A., M J., L P. N Y.: Evolution clinique après un tracé néonatal consideré comme grave. Rev.. EEG
Neurophysiol. ––.
P H.F.R. B O.: The neurological examination of the newborn. W.
Heineman Med. Books, London .
P D.: Developmental pathobiology of cortical neurons in immature human brain.
In L. Gluck: “Intrauterine ashyxia and the developing fetal brain”. Chicago .
R J.: Systématique et électroencéphalographie des encéphalites et
encéphalopaties. Masson Paris .
R M.F.: L’EEG nel prematuro patologico. Atti ° Convegno di Neurologia Neonatale. Modena .
R J.B. W W.F.: Brain damage in the monkey macaca mulatta by ashpyxia
neonatorum. Exp. Neurol. ––.
R N.: Effect of acute hypoxia on blood pressure and electroencephalogram of
newborn babies. Arch. is. Child, ––.
R A : Elevated morphine concentrations in neonates treated with morphine and
prolonged hypothermia for hypoxic ischemic encephalopathy. Pediatrics , e,
.
R A. L C.: Neonatal seizure states. Pediatrics –– .
R M.G. S R.: Neonatal electroencephalography. Results of a pilot study.
Amer. J. Obstet. Gynecol. ––.
R MG. S R.: Neonatal EEG. II. The EEG of the high risk infant. Amer.
J. Obstet. Gynecol. ––.
R M.G. S A.: The neonatal electroencephalogram. Clinical application.
Amer. J. Dis. Child. – – .
R S., D I., B P., M M., L G.: Early myoclonic
Encephalopathy and non ketotic hyperglycinemia. Pediatr Neurol ––.
S–D D.: L’EEG du premature jusqu’à l’age de trois mois et du nouveau–né
a terme. Thèse Med. Foulon Paris .
S H,B., S MS.: Neonatal encephalopaty following fetal distress. Arch.
Neurol., ––.
Bibliografia
S D, A M, H JM: Normal EEG in very premature infants: reference
criteria. Clin Neurophysiol , , .
S LF, L AR, V SC, P JM: The EEG coupled with an early
neurologic exam is an important adjunct method for enrollment of high risk term
infants in neuroprotective stratyegie. Pediatr Res , , .
S E : Influence of the antiepilectic drugs on amplitude integrated EEG. Pediatr
Neurol , , .
S S, L AR : Whole body hypothermia for neonates with hypoxic–
ischemic encephalopathy. N.Engl J Med , , .
S S: Prevention, diagnosis and treatment of cerebral palsy in near term infants.
Clin Obstet Gynecol , , .
S E, B I.: Neonatal EEG: Review of a practical approach. J Child Neurol
––.
S A.P.: Perinatal asphyxia: factors that predict developmental outcome. Develop.
Med. Child. Neurol. ––.
S M.S., J M.W., L S.M., L K.: Physiological brain dysmaturity in late preterm infants. Pediatr Res––.
S F.J., H G. S G.: Maternal toxemia, fetal malnutrition and
bioelectric brain activity of the newborn. Neuropediatrie ––.
S F.J.: Developmental aspects of the neuronal control of breathing. In “Human
growth” vol. F. Falkner and J M. Tanner Eds. .
S FG., A M., S H., B K.: Neuronal control of neonatal
respiration. sleep apnea and the sudden infant death syndrome. Neuropediatrics
––.
S A. S S.: Electroencephalographic flndings in three patients with
nonketotic hypergiycinemia. Epilepsia ––.
S DC., M D.W., G J.B., T ID., D J.: Central hypoventilation during quiet sleep in two infants. Pediatrics –– .
S DL : Quantitative EEG during early recovery from hypoxic–ischemic
injury in immature piglets: burst occurrence and duration. Clin Electrioencephalogr
, , .
S A., D A., M D., D G.: Transient EEG patterns during sleep in
healthy newborns. Neuropediatrics – –.
S B., L–K A., M J. P P.: Étude morphologique des
anomalies dites “periodiques” chez l‘enfant. Rev. EEG NeurophysioL ––.
S MB. H I.: The development of sleep–waking and rest–
activity patterns from fetus to adult in man. In “Brain devdopment and behaviour”
Sterman MB., McGynty D.J. and Adinolfi A.M. Eds. Acc. Press New York .
Bibliografia
T A., T E., M W., L G., B G.B.: Performance
Assessment for EEG–Based Neonatal Seizures Detectors. Clin Neurophysiol –
–.
T H H.J., V O M. E .: The prognostic value of amplituted integrated
EEG in Neonatal Sepsis and/or Meningitis. Acta Paediatr ––.
T B. C F. M N.: Valeur prognostic de l‘EEG du prématuré. Rev.
EEG Neurophysiol. ––.
T B.: Neonatal electroencephalography. In “Progress in perinatal Neurology” R.
Korobkin and C. Guilleminault Eds Baltimore .
T B., C F. M N.: The prognostic value of the electroencephalogram in
premature infants. Electroencephalogr. Clin. Neurophysiof. ––.
T K., P H.F.R. V J.E.: A polygraphic study of normal and
abnormal newborn infants. Neuropediatrics –– .
T E, E–J B: CFM: a method of predicting outcome in term
neonates after severe perinatal asphyxia. Acta Pediatr , , .
T E, T K, H H, K I: Neuron specific enolase in
asphyxiated newborns: association with encephalopathy and CFM trace. Arch dis
Child , F, .
T J.A.R. P J.S.: The prognostic value of the electroencephalogram in
neonatal convulsions. Pediatrics ––.
T F. BI M.: Longitudinal electroclinical correlations in children from birth
to four years of age. Pedatrics ––.
V JJ: Neonatal seizures: current concepts and revised classification. Pediatrics –
.
V J.J.: Neurology of the newborn. Saunders .
V J.L., E R.J., D J., N B.: Interhemispheric amplitude
symmetrie of the EEG of normal full–term newborn. Electroencephalogr. Clin.
Neurophysiol. ––.
W B.H., L E., B C.O., M D.M., B G.B.: Early continuous
video EEG in neonatal stroke. Dev Med Child Neurol ––.
W B.H., M D.M., B G.B.: The use of conventional EEG for The
Assessment of HIE in the Newborn: Review. Clin Neurophysiol ––.
W K., H S., K M., Y T., T T.: Electroencephalographic study of intraventricular hemorrage in the preterm newborn. Neuropediatrics –– .
W P.H.: The causes, control, and organization of behaviour in the neonate. Psychological issues Monograph. International Universities Press New York .
–
– Scienze matematiche e informatiche
– Scienze fisiche
– Scienze chimiche
– Scienze della terra
– Scienze biologiche
AREA
– Scienze mediche
– Scienze agrarie e veterinarie
– Ingegneria civile e architettura
– Ingegneria industriale e dell’informazione
– Scienze dell’antichità, filologico–letterarie e storico–artistiche
– Scienze storiche, filosofiche, pedagogiche e psicologiche
– Scienze giuridiche
– Scienze economiche e statistiche
– Scienze politiche e sociali
Il catalogo delle pubblicazioni di Aracne editrice è su
www.aracneeditrice.it
Compilato il luglio , ore :
con il sistema tipografico LATEX 2ε
Finito di stampare nel mese di luglio del
dalla «ERMES. Servizi Editoriali Integrati S.r.l.»
Ariccia (RM) – via Quarto Negroni,
per conto della «Aracne editrice S.r.l.» di Roma