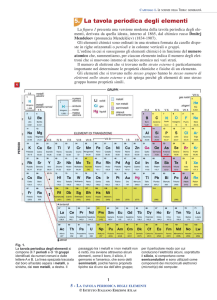
DESCRIVERE LA TAVOLA PERIODICA Nel 1869 Dmitrij Mendeleev ordinò i 63 elementi noti in base alla massa atomica crescente, e costruì la prima tavola periodica degli elementi. Nella tavola periodica che Mendeleev pubblicò nel 1871, gli elementi erano ordinati in dodici file orizzontali e otto verticali secondo la massa atomica crescente e non comparivano i gas nobili. Oggi conosciamo più di 63 elementi. Il numero di elementi è tanto elevato che bisogna organizzarli in una tavola periodica moderna in base al numero atomico Z crescente e in un ordine che permette di riconoscere le proprietà dei diversi atomi, che sono dette periodiche, perché si ripetono con regolarità a seconda della posizione occupata. Se analizziamo, infatti, la tavola periodica, individuiamo: •
•
•
7 file orizzontali, chiamate periodi; 18 colonne verticali, chiamate gruppi; 2 file separate per lantanoidi e attinoidi; La tavola periodica degli elementi può essere suddivisa in quattro grandi regioni o blocchi (blocco s, blocco p, blocco d, blocco f) costituiti da raggruppamento di elementi nei quali si riempiono orbitali dello stesso tipo. I blocchi s e p sono divisi in 8 gruppi. I blocchi d e f contengono rispettivamente gli elementi di transizione e di transizione interna. Appartengono al blocco s gli elementi dei gruppi I e II nei quali si sta riempiendo il sottolivello s. Gli elementi del gruppo I della tavola periodica sono metalli alcalini: altamente reattivi, non sono presenti in natura allo stato libero. Essi presentano un solo elettrone nel loro strato elettronico più esterno (configurazione elettronica ns1) e hanno un numero atomico di una sola unità più grande del gas raro più vicino. Questo unico elettrone di valenza, a causa della bassa energia di ionizzazione, può essere facilmente perso, quando formano un legame ionico con altri elementi. Gli elementi metallici del gruppo II della tavola periodica sono i metalli alcalino-­‐terrosi, che si presentano soffici e con una densità bassa. Presentano due elettroni nel loro strato elettronico più esterno (configurazione elettronica ns2) e numero di ossidazione +2, che li rende molto reattivi. Come i metalli alcalini, hanno una tendenza a perdere elettroni, trasformandosi nei corrispondenti cationi. La regione all'estrema destra della tavola periodica è costituita dagli elementi dei gruppi III, IV, V, VI, VII, VIII appartenenti al blocco p, nei quali si stanno riempiendo gli orbitali di tipo p. I metalli dei gruppi III, IV e V sono elementi duttili e malleabili, ma diversi dagli elementi di transizione, a differenza dei quali, infatti, non mostrano stati di ossidazione variabili e i loro elettroni di legame sono presenti solo nello strato più esterno. Tutti questi elementi sono solidi, hanno una densità relativamente alta e sono opachi. I semimetalli sono gli elementi posizionati al limite tra i metalli e i non metalli, e presentano proprietà sia dei metalli che dei non metalli. Alcuni semimetalli, come il silicio e il germanio, sono semiconduttori. I non metalli sono gli elementi dei gruppi IV, V, VI della tavola periodica: non sono buoni conduttori né di calore né di elettricità e, al contrario dei metalli, sono molto fragili. I non metalli sono gas, come l’ossigeno o l’azoto, o solidi, come il carbonio, non hanno lucentezza metallica e non riflettono la luce (l’unico elemento non metallico allo stato liquido è il bromo, che appartiene al gruppo degli alogeni, VII). Il gruppo VII è quello degli alogeni, cinque elementi non metallici: fluoro (F), cloro (Cl), bromo (Br), iodio (I) e astato (At). Tutti gli alogeni hanno 7 elettroni nello strato più esterno, per cui hanno un numero di ossidazione di −1 (alcuni di essi formano composti con numero di ossidazione +1, +3, +5 o +7). Il gruppo VIII è costituito dai gas nobili, elementi chimici che presentando l’orbitale p saturo di elettroni, si mostrano quasi del tutto non reattivi e non partecipano,se non in casi limite, alla formazione di composti. Nella zona centrale della tavola periodica troviamo gli elementi appartenenti al blocco d, definiti elementi di transizione:gli elementi appartenenti al quarto periodo hanno gli ultimi elettroni nel sottolivello 3d, quelli del quinto periodo nel sottolivello 4d, quelli del sesto nel 5d e quelli del settimo nel 6d. I “metalli di transizione” sono 38 elementi che, come tutti i metalli, si presentano duttili, malleabili, buoni conduttori dell’elettricità e del calore. I loro elettroni di valenza sono presenti in più di uno strato elettronico: per questo motivo presentano spesso più stati di ossidazione. Nella zona in basso della tavola periodica sono presenti gli elementi appartenenti al blocco f nei quali si stanno disponendo 14 elettroni nei 7 orbitali di tipo f. Gli elementi del blocco f sono detti comunemente elementi di transizione interna o terre rare, perché si pensava che fossero poco diffusi in natura. Sulla tavola periodica sono solitamente disposti separatamente dagli altri elementi, per dare maggior organicità alla tavola periodica stessa. Avremo quindi la serie dei lantanidi o lantanoidi (6° periodo) e degli attinidi o attinoidi (7° periodo). Un elemento della serie dei lantanidi (prometio) e la maggior parte degli elementi della serie degli attinoidi sono sintetici, vale a dire ottenuti artifi cialmente. Periodo della Tavola Periodica Gli atomi degli elementi di uno stesso Periodo hanno struttura elettronica esterna che varia con regolarità e sono caratterizzati da una regolare variazione delle proprietà chimiche e fisiche. A partire dal quarto Periodo e per ciascuno dei successivi Periodi, vi sono una serie di elementi di transizione in cui si riscontrano variazioni modeste del raggio atomico, dell'elettronegatività e dell'energia di ionizzazione. Invece, gli elementi non di transizione appartenenti allo stesso Periodo, presentano sensibili variazioni di tali grandezze: i raggi atomici diminuiscono spostandoci da sinistra verso destra lungo un Periodo ( cioè aumenta la distanza tra nucleo ed elettrone ext) mentre i valori dell'energia di ionizzazione e dell'elettronegatività aumentano ( cioè ci vuole più energia per togliere l’ultimo elettrone di valenza). Queste variazioni indicano che, procedendo da sinistra a destra lungo un Periodo ed escludendo le serie di transizioni ( cioè il blocco centrale) che, come si è detto, rappresentano delle zone di stasi, il carattere metallico degli elementi diminuisce; si passa da elementi con spiccate proprietà metalliche ad elementi con proprietà anfotere ad elementi con proprietà non metalliche ( cioè spostandoci verso destra della tavola si perdono le caratteristiche metalliche, cioè gli elementi reagiscono meno, formano meno legami ). Gruppo della Tavola Periodica Che cosa rappresenta il gruppo della tavola periodica Nella tavola periodica degli elementi sono presenti colonne verticali che rappresentano i Gruppi della tabella. I Gruppi della tavola periodica hanno una doppia numerazione: la prima in numeri arabi (da 1 a 18), la seconda in numeri romani (da I a VIII). Quest'ultima numerazione, presente solo per i gruppi principali della tavola periodica, indica il numero di elettroni di valenza degli elementi appartenenti a quel Gruppo. Gli elementi appartenenti allo stesso Gruppo hanno configurazione elettronica esterna dello stesso tipo. Poiché sono gli elettroni esterni di un atomo quelli che vengono coinvolti nei fenomeni chimici, le proprietà chimiche degli atomi di uno stesso Gruppo presentano analogie ( cioè chimicamente si comportano in modo simile). Man mano che si scende lungo un Gruppo i valori dell'energia di ionizzazione e dell'elettronegatività diminuiscono.