Corso: “Principi e metodi della raccolta
classificazione e codifica dei tumori
Tarquinia, 25 novembre 2010
Biologia dei tumori,
fattori di rischio,
diagnosi, stadiazione
Stefano Ferretti
Associazione Italiana Registri Tumori
nomenclatura
Tumori “benigni”
•Monoclonali
•Crescita “espansiva”
•Assenza di atipie citologiche
•Crescita lenta
•Assenza di infiltrazione
•Assenza di metastasi a distanza
•Prognosi buona
Tumori “maligni”
• Monoclonali
•Presenza di atipie citologiche
•Crescita veloce
•Crescita infiltrativa
•Metastasi a distanza
•Prognosi spesso infausta
percorso
benigno?
maligno?
genetica e ambiente
Tessuto di riferimento
Tumori benigni
Tumori maligni
Epiteli
Papilloma, Adenoma
Carcinoma,
adenocarcinoma
Mesenchima
Fibroma, lipoma,
condroma, angioma,
leiomioma
(Fibro, lipo, condro, angio,
Leio, rabdomio…)sarcoma
Linfoemopoietici
Mieloma, linfoma,
leucemia
Tess. Nervoso
Glioma, neurinoma
Astrocitoma, (glio, neuro,
retino)blastoma
Melanociti
Nevo
Melanoma
Altri
Teratoma
Carcinoma embrionale
genetica e ambiente
cancerogenesi, basi
molecolari
danni
genetici
non letali
proto-oncogeni
geni
oncosoppressori
geni regolatori
geni riparatori
cancerogenesi
I tumori conseguono alla
perdita del normale
controllo della crescita
cellulare
Nei tessuti normali c’è un
bilanciamento tra il tasso di
crescita e quello di morte
cellulare
Nei tumori questo
bilanciamento si rompe
Ciò può essere dovuto ad
una crescita cellulare
incontrollata o alla perdita
dell’apoptosi, il
meccanismo attraverso il
quale avviene
l’autodistruzione delle
cellule
percorso
cellula normale
agenti ambientali
responsabili
del danno al DNA
Riparazione
con successo
danno al DNA
Riparazione
fallita
mutazioni ereditarie a carico
di geni regolatori
mutazione genoma
cellule somatiche
attivazione di oncogeni
promuoventi la crescita
alterazioni geni
regolatori dell’apoptosi
inattivazione geni
oncosoppressori
espressione di prodotti genici alterati
perdita prodotti genici di regolazione
sorveglianza
immunitaria
espansione clonale
mutazioni aggiuntive
eterogeneità
neoplasia (maligna)
Da: Cotran, Kumar, Collins 2005 (modificato)
cancerogenesi
teoria
della
progressione
lineare
cancerogenesi
teoria
della
patologia
parallela
agenti cancerogeni
agenti cancerogeni
agenti cancerogeni
fattori di rischio
Classificazione dei carcinogeni per l’uomo
•Gruppo 1 - cancerogeni
•Gruppo 2 - probabilmente cancerogeni
•Gruppo 3 - possibilmente cancerogeni
•Gruppo 4 - non classificabili per cancerogenicità
•Gruppo 5 - probabilmente non cancerogeni
il rischio
Predisposizione genetica
(mutazioni ereditarie: < 10% dei pazienti)
1.Forme autosomiche dominanti
2.Sindrome del “mismatch repair”
3.Forme familiari
-Insorgenza precoce
-Tumori multipli/bilaterali
-Coinvolgimento di più parenti
-Modalità di trasmissione non chiara
Condizioni non ereditarie e predisponenti
-Fattori geografici ed ambientali
-Età
-Infiammazione cronica
-Condizioni precancerose
progressione
Esposizione
Inizio
malattia
A
Prevenzione
primaria
Diagnosi
precoce
Inizio
sintomi
B
C
Prevenzione
secondaria
Prevenzione
terziaria
Guarigione
Stabilizzaz.
Morte
progressione
Da una cellula ad un grammo = 30 duplicazioni (109 cellule)
Da 1 g a 1.000g = 10 duplicazioni (1012 cellule)
Fattori:
1. Tempo di duplicazione
• Tempo di crescita teorico e reale (latenza)
2. Frazione di crescita
• Decorso clinico
• Sensibilità alla terapia
3. Frazione di perdita
4. Risposta immunitaria
angiogenesi
Funzioni:
1.
2.
3.
Perfusione (ossigeno e fattori nutritivi)
Stimolo alla crescita
• Fattori crescita prodotti dagli endoteli
• Sensibilità alla terapia
Processo di metastasi
progressione-eterogeneità
Determinanti:
1.
2.
3.
Fenotipo tumorale
Instabilità genetica
Rapporto cellula/ospite
progressione
invasione e metastasi
•Distacco delle
cellule tumorali
•Attacco alle componenti
della matrice
•Degradazione
della matrice
•Migrazione delle
cellule tumorali
• rapporto tumore-ligandi degli
organi bersaglio
vie metastatiche
1. Continuità
vie metastatiche
2. Contiguità
vie metastatiche
3. Via linfatica
vie metastatiche
3. Via linfatica
vie metastatiche
3. Via linfatica
“linfonodo sentinella”
?
LGH
sentinell
a
tumore
vie metastatiche
4. Via ematica
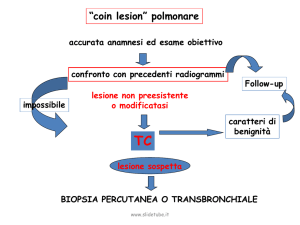
stadiazione
La classificazione in stadi del cancro ha
essenzialmente lo scopo di:
•aiutare il clinico nel progettare il trattamento
•fornire informazioni relative alla prognosi
•aiutare nella valutazione dei risultati del trattamento
•facilitare lo scambio di informazioni fra i vari Centri
•contribuire alla continua ricerca sul cancro nell’uomo
Per raggiungere tali obiettivi è necessario
un sistema di classificazione:
•i cui princìpi siano applicabili a tutte le sedi senza tener conto del
trattamento
•che possano, in un secondo tempo, essere integrati da ulteriori
informazioni ottenute con l’esame istopatologico e/o con la chirurgia
il sistema TNM
il sistema TNM
Applicabilità a
(quasi) tutte
le sedi anatomiche
Universalità
Suscettibilità di ulteriori
informazioni
cTNM
Simboli
m,y,r,a
pTNM
Descrizioni
L,V,C,R
Raggruppamento
in stadi
i-+/mol-+/sn
classificazione TNM
Il sistema TNM, per descrivere l’estensione anatomica del
tumore, si basa su tre componenti:
N = linfonodi regionali
•Nx = linfonodi regionali non valutabili
•N0 = linfonodi regionali esenti da metastasi
•N1,N2, N3 = metastasi ai LGH regionali
M = metastasi a distanza
•Mx = non accertabili
•M0 = assenti
•M1 = presenti*
T = tumore primitivo
•Tx = tumore primitivo non definibile
(*) PUL, OSS, HEP, BRA, LYM,
•T0 = tumore primitivo non evidenziabile
MAR, PLE, PER, ADR, SKI, OTH
•Tis = carcinoma in situ
•T1, T2, T3, T4 = estensione del tumore primitivo
sistema TNM - criteri
Norme generali del sistema TNM
1. Tutti i casi devono essere confermati istologicamente.
Altrimenti debbono essere riportati separatamente
2. Per ogni sede vengono descritte due classificazioni:
•
Classificazione clinica cTNM
•
Classificazione patologica pTNM
3. Le categorie TNM possono essere raggruppate in stadi
4. In caso di dubbi sulla corretta categoria TNM va scelta la categoria di grado
inferiore
5a. Nel caso di tumori multipli simultanei in un organo deve essere classificato
il tumore con la categoria più alta
5b. In caso di tumori simultanei in organi pari ogni tumore va classificato
indipendentemente (salvo eccezioni)
6. Le definizioni delle categorie TNM e il raggruppamento in stadi possono
essere ampliati o ridotti per scopi clinici o di ricerca senza modificare le
definizioni di base
In tumori multipli:
Dopo terapia:
Su recidiva:
Su autopsia:
mTNM
yTNM
rTNM
aTNM
descrittori aggiuntivi
L - invasione linfatica
LX non definibile; L0 assente; L1 presente
V - invasione venosa
VX non def.; V0 assente; V1 micro, V2 macro
Pn – invasione perineurale
PnX non val.; Pn0 assente; Pn1 presente
R - residui tumorali
Fattore C
C1 stad. da strumenti diagnostici standard
C2 strumenti diagnostici speciali
C3 esplorazione chirurgica
C4 esame anatomopatologico
C5 esame autoptico
RX non def.; R0 assente; R1 micro, R2 macro
pTNM
categorie cTNM accertate istologicamente
Linfonodo sentinella.
•pNX(sn) = non valutabile
•pN0(sn) = assenza di metastasi
•pN1(sn) = presenza di metastasi
Cellule tumorali isolate.
•pN0(i-) = assenza di ITC (morf.)
Suddivisioni del pTNM.
•pN0(i+) = presenza di ITC (morf)
•pT1mic, pT1a, pT1b, pT1c...
•pN0(mol-) = assenza di ITC (non morf.)
•pN0(sn)(i-) = assenza di metastasi
•pN0(mol+) = presenza di ITC (non morf.)
•Grading istopatologico
•Gx = non valutabile
•G1 = bene differenziato
•G2 = moderatamente
differenziato
•G3 = scarsamente differenziato
•G4 = indifferenziato
0 = pNx
1 = pN0 (se non presenti altre val.)
10 = pN0(sn) (pN0 su LGH sn)
2 = pN0(i-) - 12 se pN0(i-)(sn)
3 = pN0(i+) - 13 se pN0(i+)(sn)
4 = pN0(mol-) - 14 se pN0(mol-)(sn)
5 = pN0(mol+) - 15 se pN0(mol+)(sn)
20 = pN1 nas
21 = pN1mi
22 = pN1a
23 = pN1b
24 = pN1c
30 = pN2 nas
31 = pN2a
32 = pN2b
40 = pN3 nas
41 = pN3a
42 = pN3b
43 = pN3c
50 = linfonodi positivi, livello NAS
88 = Mancante perché IN SITU
99 = Ignoto
versioni pTNM
0 = pNx
1 = pN0
20 = pN1 nas
21 = pN1a
22 = pN1b (se non è spec.il sottoliv.)
23 = pN1bi
24 = pN1bii
25 = pN1biii
26 = pN1biv
30 = pN2
40 = pN3
50 = linfonodi positivi, livello NAS
88 = Mancante perché IN SITU
99 = Ignoto
struttura TNM
Regioni anatomiche e sedi
ogni regione o sede è descritta secondo le seguenti voci
•norme per la classificazione
•regioni anatomiche e sottosedi
•definizione dei linfonodi regionali
•classificazione clinica TNM
•classificazione patologica TNM
•grading istopatologico G
•raggruppamento in stadi
•sommario per regione o sede
raggruppamento in stadi
STADIO 0
Tis
N0
M0
STADIO IA
T1 a,b
N0
M0
STADIO I B
T2 a
N0
M0
STADIO II A
T2 b
N0
M0
T1 a,b
N1
M0
T2 a
N1
M0
T2 b
N1
M0
T3
N0
M0
T1 a,b; T2 a,b
N2
M0
T3
N1, N2
M0
T4
N0, N1
M0
T4
N2
M0
Ogni T
N3
M0
Ogni T
Ogni N
M1
STADIO II B
STADIO III A
STADIO III B
STADIO IV
stadiazione Ann-Arbor
Stadio I
Coinvolgimento di una sola regione linfatica (I); coinvolgimento limitato di
un singolo organo o sito extralinfatico (IE)
Stadio II
Coinvolgimento di due o più regioni linfatiche dallo stesso lato del
diaframma (II), oppure interessamento localizzato di un solo organo o sito
extralinfatico assieme all'interessamento di una o più sedi linfatiche dallo
stesso lato del diaframma (IIE)
Stadio III
Impegno di più regioni linfatiche sopra e sotto il diaframma (III), che può
essere accompagnato da interessamento localizzato di un organo o sito
extralinfatico (IIIE), o della milza (IIIS)o di entrambi (IIIES)
Stadio IV
Coinvolgimento diffuso o disseminato di uno o più organi o siti extralinfatici
con o senza coinvolgimento di sedi linfatiche. Gli organi interessati sono
indicati con un simbolo: H (fegato), L (polmoni), M (midollo), P (pleura), O
(ossa), D (cute)
grading (mammella)
Formazione tubuli
> 75% - Score 1
10 - 75% - Score 2
<10% - Score 3
Pleomorfismo nucleare
minimo
- Score 1
moderato
- Score 2
marcato
- Score 3
Mitosi (hpf=0,50 mm)
fino a 7 x10 hpf
- Score 1
da 8 a 14 x10hpf
- Score 2
15 ed oltre x10 hpf
- Score 3
Elston, Ellis 1991
TUB+
NUC+
MIT=
3-5:
6-7:
8-9:
G1
G2
G3
check-lists
integrazioni
Dimensioni del tumore : E’ spesso un dato determinante per la definizione
dello stadio T, ma in molte neoplasie consente un dettaglio di estensione
più preciso, altrettanto determinante per la valutazione della sensibilità
diagnostica (es. nel tumore della mammella in corso di screening).
Numero dei linfonodi prelevati e metastatici : E’ un parametro aggiuntivo
che migliora notevolmente la sensibilità dello stadio N. In caso di tumori
N0 il numero dei linfonodi totali repertati assume un importante ruolo di
controllo della qualità della stadiazione.
Un’ulteriore modalità di stadiazione riguarda il Disease Staging (D.S.)
Questo sistema utilizza un sistema di classificazione dei pazienti che
misura anche la gravità clinica del paziente, determinandone
l’inclusione in stadi che presentano una prognosi simile e necessità
assistenziali uguali.
E’ utilizzato in particolare per i tumori gastroenterici, per i quali il
trattamento chirurgico può avvenire in condizioni di urgenza (per
occlusioni, perforazioni, sanguinamenti, etc.) e quindi la gravità clinica
del paziente può giustificare, a parità di stadio, differenze importanti
nella sopravvivenza nel breve periodo
caratterizzazione
biologica
Individuazione di marcatori molecolari considerati:
potenziali fattori prognostici
bersaglio terapie mirate
Carcinoma mammario:
•Recettori estroprogestinici (ER, PR)
•Attività proliferativa (MIB-1)
•Oncogeni (HER2/neu)
•Oncosoppressori (p53)
Carcinoma colorettale:
•Indicatori di DNA repair
•Instabilità microsatelliti (MSI)
•Oncogeni/oncosoppressori
•Proliferazione cellulare
•Angiogenesi
•Markers di invasione
caratterizzazione
biologica
Recettori
per estrogeni
metodiche
procedure
Recettori
per progesterone
riproducibilità?
scale
misura
Attività
proliferativa
refertazione
Her-2 / Neu
conclusione…
“nodi”
strategici:
accuratezza
efficacia/efficienza
integrazione
tempestività