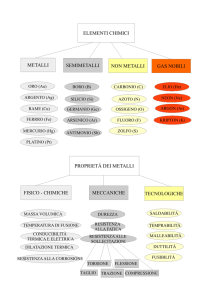
METALLI
L'88% degli elementi sono METALLI
9 metalli dei gruppi principali: alcalini, alcalino-terrosi e Al
9 metalli di transizione: tre serie di 10 gruppi (più importanti 1a serie,
a destra: Cr, Mn, Fe, Co, Ni, Cu, Zn)
PROCESSI DI ESTRAZIONE DEI METALLI DAI MINERALI
(METALLURGIA)
1. Metalli da CLORURI (Na da NaCl)
Riduzione mediante elettrolisi:
catodo:
2Na+(l) + 2e- -----> 2Na(l)
anodo:
2Cl-(l) -----> Cl2(g) + 2e----------------------------------------------------2Na+(l) + 2Cl-(l) -----> 2Na(l) + Cl2(g)
Caratteristiche:
9
9
9
9
9
T = 600 °C (elettrolita fuso)
aggiunta di CaCl2 (abbassa T fusione)
si forma Na fuso (Tf = 98 °C)
il Cl2 gassoso è un sottoprodotto prezioso
sono necessari 14 kJ di energia elettrica per 1 g di Na
2. Metalli da OSSIDI (Al da Al2O3; Fe da Fe2O3)
2a. Ossidi di metalli molto reattivi sono ridotti per elettrolisi:
2Al2O3(l) -----> 4Al(l) + 3O2(g)
Caratteristiche:
9 minerale: BAUXITE (Al2O3)
9 T = 1000 °C (ossido fuso)
9 aggiunta di criolite, Na3AlF6 (abbassa T fusione da 2000 °C)
9 sono necessari 30 kJ di energia elettrica per 1 g di Al (questa
elevata richiesta energetica spiega in larga parte la necessità di
riciclaggio delle lattine)
2b. Ossidi di metalli meno attivi sono ridotti usando un opportuno agente
chimico riducente (il più comune è il carbone)
Caratteristiche:
9 minerale: EMATITE (Fe2O3 mescolato con SiO2)
9
9
9
9
9
riduzione in altoforno (30 x 10 m) a T = 1800 °C
carica dall'alto: minerale + carbone + calcare (CaCO3)
dal basso aria compressa o O2 puro a 500 °C
si forma Fe fuso (Tf = 1600 °C) che si deposita sul fondo
si forma una scoria (CaSiO3) utilizzata in cementi per strade
Reazioni:
I.
conversione carbonio in monossido di carbonio:
in basso: C(s) + O2(g) -----> CO2(g)
salendo: C(s) + CO2(g) -----> 2CO(g)
----------------------------------------∆H < 0
2C(s) + O2(g) -----> 2CO(g)
II. riduzione degli ioni Fe3+ a Fe:
Fe2O3(s) + 3CO(g) -----> 2Fe(l) + 3CO2(g)
III. formazione di scorie:
a T = 800 °C
CaCO3(s) -----> CaO(s) + CO2(g)
con impurezze
CaO(s) + SiO2(s) -----> CaSiO3(l)
materiale vetroso, meno denso del ferro, su cui forma uno strato
superficiale
Il prodotto è GHISA GREZZA, molto impura (ca. 4% di C; quantità minori
di Si, Fe, P). In un giorno si producono 1000 t di ghisa.
Per la produzione di ACCIAIO (C < 2%) si usa il processo a ossigeno
basico:
I. si prepara una miscela composta da 75% Fe fuso da altoforno +
25% rottami di Fe o acciaio + 5% calcare
II. si fa gorgogliare O2 puro a 10 atm attraverso la miscela (il C forma
CO2 gassoso; le impurezze si ossidano e reagiscono con il calcare
formando la scoria)
III. si interrompe l'immissione di O2 quando il contenuto in C è
sufficientemente ridotto
Il processo dura 30 min - 1 h e produce 200 t di acciao
3. Metalli da SOLFURI (Cu da Cu2S)
In generale, i solfuri subiscono la calcinazione (riscaldamento con aria o
O2 puro)
a. con metalli di transizione relativamente reattivi (ex. Zn) si forma
l'ossido
2ZnS(s) + 3O2(g) -----> 2ZnO(s) + 2SO2(g)
e il metallo viene poi ridotto con il carbone
b. con metalli di transizione meno attivi (ex. Hg, Cu) si forma il metallo
libero durante la calcinazione
HgS(s) + O2(g) -----> Hg(g) + SO2(g)
(HgS = CINABRO)
Il più importante minerale del rame, la CALCOCITE, contiene Cu2S in
forma altamente impura e la percentuale di Cu nel minerale è dell'1% o
anche meno. I processi necessari sono quindi:
I. flottazione (particelle di solfuro finemente suddivise sono
intrappolate in bolle di sapone, mentre la roccia scende verso il fondo);
arricchimento fino al 40%
II. calcinazione in aria ad alta T (> 1000 °C)
Cu2S(s) + O2(g) -----> 2Cu(s) + SO2(g)
il prodotto è il "rame a bolle" per aria inglobata quando è ancora allo
stato fuso; ancora impuro
III. elettrolisi per la purificazione
anodo: rame a bolle (ca. 300 kg)
Cu(s, impuro) -----> Cu2+(aq)) + 2eelettrolita: CuSO4 0.5 - 1.0 M; pH = 0 per H2SO4
catodo: rame puro (ca. 150 kg)
Cu2+(aq) + 2e- -----> Cu(s, puro)
Il rame elettrolitico è puro al 99,95%.
4. Metalli NATIVI (Au)
Pochissimi metalli (Ag e Au) si trovano in natura in forma elementare
mescolati con grandi quantità di materiale roccioso.
Per molti secoli l'oro è stato estratto sfruttando la sua elevata densità
(19,3 g/ml).
Oggi:
I. ossidazione (O2) e complessazione (cianuro di sodio 0,01 M)
4Au(s) + 8CN-(aq) + O2(g) + 2H2O(l) -----> 4[Au(CN)2]-(aq) + 4OH-(aq)
II. riduzione con Zn
Zn(s) + 2[Au(CN)2]-(aq) -----> [Zn(CN)4]2-(aq) + 2Au
REAZIONE DEI METALLI ALCALINI E ALCALINO-TERROSI
Sono tra i più reattivi di tutti gli elementi; hanno bassi potenziali di
ionizzazione e si ossidano facilmente a +1 (1° gruppo) o +2 (2° gruppo).
1. Reazioni con idrogeno -----> IDRURI (ionici, contengono H-)
Reagiscono con acqua liberando idrogeno:
NaH(s) + H2O(l) -----> H2(g) + Na+(aq) + OH-(aq)
CaH2(s) + 2H2O(l) -----> 2H2(g) + Ca2+(aq) + 2OH-(aq)
Fonti solide di idrogeno gassoso
2. Reazioni con acqua -----> soluzione acquosa di IDROSSIDO
I metalli alcalini reagiscono violentemente e spesso il calore
sviluppato incendia l'idrogeno:
2Na(s) + 2H2O(l) -----> H2(g) + 2Na+(aq) + 2OH-(aq)
Dei metalli alcalino-terrosi, Ca, Sr e Ba reagiscono come gli alcalini:
Ca(s) + 2H2O(l) -----> H2(g) + Ca2+(aq) + 2OH-(aq)
Il Be non reagisce e il Mg reagisce con vapore ad alta T
3. Reazioni con ossigeno -----> sono possibili prodotti diversi
OSSIDI [O]2-; PEROSSIDI [O2]2-; SUPEROSSIDI [O2]1° gruppo: solo il Li forma direttamente l'ossido; gli altri ossidi vengono
preparati con altri mezzi;
Il sodio brucia con ossigeno per dare il perossido:
2Na(s) + O2(g) -----> Na2O2(s)
I metalli più pesanti (K, Rb, Cs) bruciano con ossigeno per dare il
superossido:
K(s) + O2(g) -----> KO2(s)
2° gruppo: reagiscono con O2 per dare direttamente l'ossido.
Gli ossidi dei metalli del 1° e 2° gruppo reagiscono con H2O per formare
gli idrossidi:
Li2O(s) + H2O(l) -----> 2LiOH(s)
CaO(s) + H2O(l) -----> Ca(OH)2(s)
Il perossido di sodio reagisce con H2O per dare il perossido di idrogeno:
Na2O2(s) + 2H2O(l) -----> 2Na+(aq) + 2OH-(aq) + H2O2(aq)
Il superossido di potassio reagisce con H2O per dare l'idrossido e
generare ossigeno:
4KO2(s) + 2H2O(l) -----> 3O2(g) + 4KOH(s)
CHIMICA DI OSSIDORIDUZIONE DEI METALLI DI TRANSIZIONE
I metalli di transizione possono avere diversi numeri di ossidazione: nei
bassi stati di transizione (+1, +2, +3) sono presenti come cationi; negli
stati di ossidazione più alti (da +4 a +7) sono legati in genere ad
ossigeno.
1. Reazioni con ossigeno -----> si formano gli ossidi: Cr2O3, Mn3O4,
Fe2O3, Co3O4, NiO, Cu2O, CuO, ZnO, CdO, HgO.
Gli ossidi M3O4, sono in realtà ossidi misti: MO + M2O3
Altri ossidi si preparano per via indiretta:
-) sale di Ag con base forte: 2Ag+(aq) + 2OH-(aq) -----> Ag2O(s) + H2O(l)
-) decomposizione di carbonato: CoCO3(s) -----> CoO(s) + CO2(g)
2. Reazioni con acidi
-) tutti i metalli con E° di riduzione negativo vengono ossidati dagli ioni
H+ di un acido; si formano idrogeno gassoso e il catione del metallo di
transizione:
Ni(s) + 2H+(aq) -----> 2Ni2+(aq) + H2(g)
-) i metalli con E° di riduzione positivo non reagiscono con H+:
• il Cu può essere ossidato da HNO3:
3Cu(s) + 8H+(aq) + 2NO3-(aq) -----> 3Cu2+(aq) + 2NO(g) + 4H2O(l)
• l'Au può essere ossidato solo acqua regia HCl/HNO3 3/1:
Au(s) + 4H+(aq) + 4Cl-(aq) + NO3-(aq) -----> AuCl4-(aq) + NO(g) + 2H2O(l)
3. Equilibri tra cationi diversi di un metallo di transizione
E° di riduzione:
Cromo
Cr3+
Manganese
Mn3+
Ferro
Fe3+
Cobalto
Co3+
Rame
Cu2+
Oro
Au3+
Mercurio
Hg2+
- 0,408 V
+ 1,559 V
+ 0,769 V
+ 1,953 V
+ 0,161 V
+ 1,400 V
+ 0,908 V
Cr2+
Mn2+
Fe2+
Co2+
Cu+
Au+
Hg22+
- 0,912 V
- 1,182 V
- 0,409 V
- 0,282 V
+ 0,518 V
+ 1,695 V
+ 0,796 V
Cr
Mn
Fe
Co
Cu
Au
Hg
Usando i dati in Tabella è possibile stabilire le stabilità relative dei diversi
cationi dei metalli di transizione in soluzione acquosa: ex. cationi con E°
di riduzione alto, facilmente ridotti, instabili.
4. Ossianioni di metalli di transizione
Il CROMO in stato di ossidazione +6 forma 2 ossianioni:
ione cromato: CrO42- (giallo), stabile in soluzione basica o neutra
ione bicromato: Cr2O72- (arancione), stabile in soluzione acida
2CrO42-(aq) + 2H+(aq) -----> Cr2O72-(aq) + H2O(l)
lo ione bicromato è un forte ossidante:
Cr2O72-(aq) + 14H+(aq) + 6e- -----> 2Cr3+(aq) + 7H2O(l)
E° = 1,33 V
Il MANGANESE in stato di ossidazione +7 forma lo ione permanganato:
MnO4- (viola)
lo ione permanganato è un forte ossidante in ambiente acido:
E° = 1,51 V
MnO4-(aq) + 8H+(aq) + 5e- -----> Mn2+(aq) + 4H2O(l)
e meno potente in soluzione debolmente basica:
E° = 0,596 V
MnO4-(aq) + 2H20(l) + 3e- -----> MnO2(s) + 4OH-(aq)