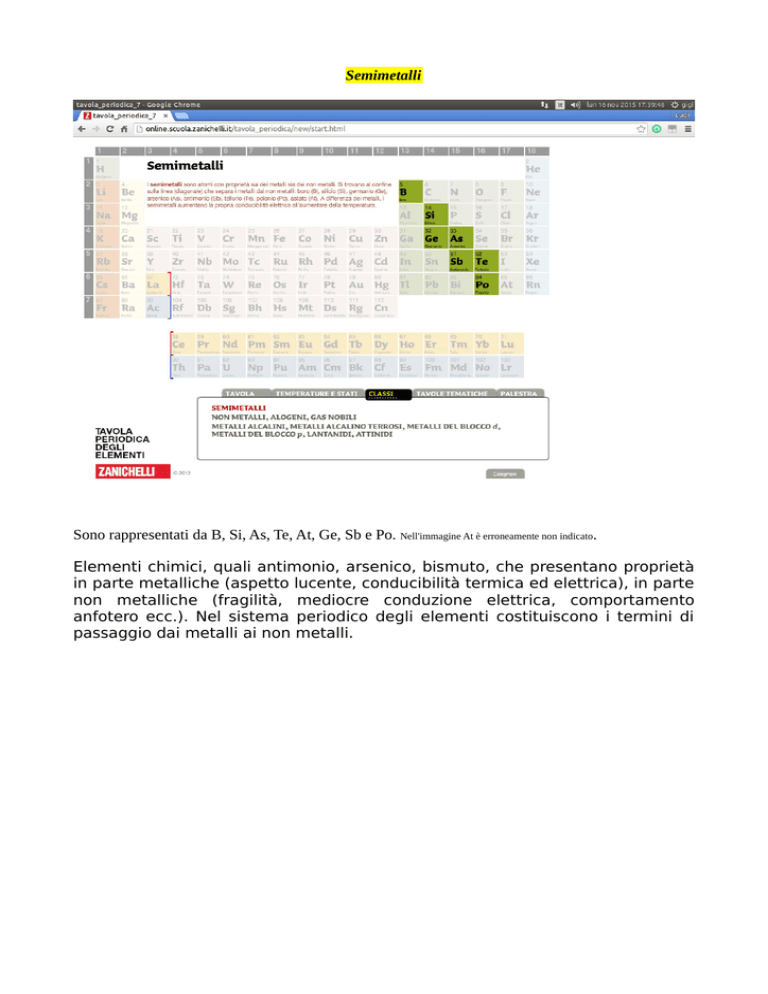
Semimetalli
Sono rappresentati da B, Si, As, Te, At, Ge, Sb e Po. Nell'immagine At è erroneamente non indicato.
Elementi chimici, quali antimonio, arsenico, bismuto, che presentano proprietà
in parte metalliche (aspetto lucente, conducibilità termica ed elettrica), in parte
non metalliche (fragilità, mediocre conduzione elettrica, comportamento
anfotero ecc.). Nel sistema periodico degli elementi costituiscono i termini di
passaggio dai metalli ai non metalli.
Non metalli e metalli
Non metallo: elemento chimico che possiede caratteristiche chimiche e
fisiche assai differenti da quelle che caratterizzano lo stato metallico (chiamato
un tempo metalloide). I n. sono cattivi conduttori del calore e dell’elettricità,
con l’ossigeno formano ossidi a carattere acido o neutro, in soluzione possono
dare origine solo a ioni negativi (anioni). Alcuni n. sono gassosi a temperatura
ordinaria (azoto, idrogeno, ossigeno) o facilmente liquefacibili (cloro); altri sono
liquidi molto volatili (bromo) o solidi a basso punto di fusione (fosforo, zolfo,
iodio); altri infine sono difficilmente fusibili, come il carbonio. I non metalli sono
tutti gli elementi della tavola periodica che si trovano sulla tavola a destra della
linea diagonale congiungente B, Si, As, Te, At, quindi non solo quelli evidenziati
in figura. L'idrogeno viene considerato un non metallo.
Metalli: sono la maggior parte degli elementi della tavola periodica (circa i
3/4), vi troviamo tutti gli elementi che nella tavola sono a sinistra della linea
diagonale congiungente B, Si, As, Te, At (fatta eccezione per Ge, Sb e Po che
sono semimetalli per H che è un non metallo). I metalli hanno diverse
proprietà: conducibilità elettrica elevata, che all'aumentare della temperatura
diminuisce; manifestano con poco dispendio energetico l'effetto fotoelettrico e
termoionico, ossia possono liberare facilmente elettroni dalla loro superficie per
azione della luce o del calore; straordinaria conducibilità termica; duttilità (si
lasciano ridurre in fili sottili) e malleabilità (si lasciano ridurre in lamine sottili);
hanno una lucentezza caratteristica; sono tipicamente elettropositivi, cioè
tendono a cedere elettroni diventando ioni positivi; hanno un a struttura
organizzata (reticolo cristallino).
Alogeni
In chimica il termine alogeni è stato utilizzato da Berzelius (1825) per gli
elementi capaci di combinarsi con i metalli per dare sali non contenenti
ossigeno (sali aloidi). Più specificamente, gli elementi chimici del gruppo VII o
17 del sistema periodico: fluoro, cloro, bromo, iodio, astato. Per le loro proprietà
fisiche e chimiche, gli a. sono gli elementi che differiscono maggiormente dai
metalli.
Gas nobili
Si caratterizzano per una notevole stabilità e quindi scarsissima reattività con gli altri atomi.
Appartengono al gruppo VIII o 18.
Metalli alcalini
Metalli del primo gruppo del sistema periodico (litio, sodio, potassio, rubidio,
cesio e francio); elettropositivi, reagiscono facilmente e violentemente con
l’acqua sviluppando idrogeno e dando idrossidi basici. Non si trovano liberi in
natura ma sotto forma di composti; la reattività cresce gradualmente passando
dagli elementi a minore a quelli a maggiore massa atomica.
Metalli alcalino terrosi
Sono rappresentati da berillio, calcio, magnesio, stronzio, bario e radio, che sono rubricati come
appartenenti al secondo gruppo del sistema periodico perché i loro ossidi presentano reazione
alcalina e perché non si alterano con il calore (proprietà delle ‘terre’ secondo gli antichi chimici).
Metalli del blocco d
Detti anche elementi di transizione, sono caratterizzati dal progressivo riempimento elettronico
degli orbitali dei sottolivelli 3d, 4d, 5d e 6d o anche (n-1)d.
Metalli del blocco p
Gli elementi del blocco p metallici sono quelli evidenziati in figura, va però ricordato che il blocco
p interessa i gruppi da 13 a 18 nella loro interezza e si caratterizza per il progressivo riempimento di
sottolivelli p.
Lantanidi
Costituiscono gli elementi delle serie interne di transizione, in essi si realizza il progressivo
riempimento elettronico di orbitali interni dei sottolivelli 4f secondo la regola (n-2)f.
Attinidi
Costituiscono gli elementi delle serie interne di transizione, in essi si realizza il progressivo
riempimento elettronico di orbitali interni dei sottolivelli 5f secondo la regola (n-2)f.
Elementi tipici o rappresentativi
Corrispondono agli elementi dei gruppi I, II, III, IV, V, VI e VII o anche, secondo la numerazione
IUPAC, 1, 2, 13, 14, 15, 16 e 17. Hanno una configurazione elettronica esterna variabile da ns 1 a ns2
np5. Secondo alcuni autori anche i gruppi 11 e 12 (famiglie del Cu - Cu, Ag, Au - e dello Zn – Zn,
Cd, Hg) dovrebbero essere collocate in questa classe piuttosto che negli elementi di transizione in
quanto hanno i sottolivelli d già riempiti ma le somiglianze notevoli di questi elementi con quelli
che li precedono suggeriscono di considerarli comunque nelle serie di transizione.
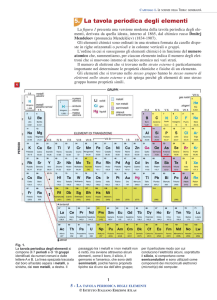
La tavola periodica