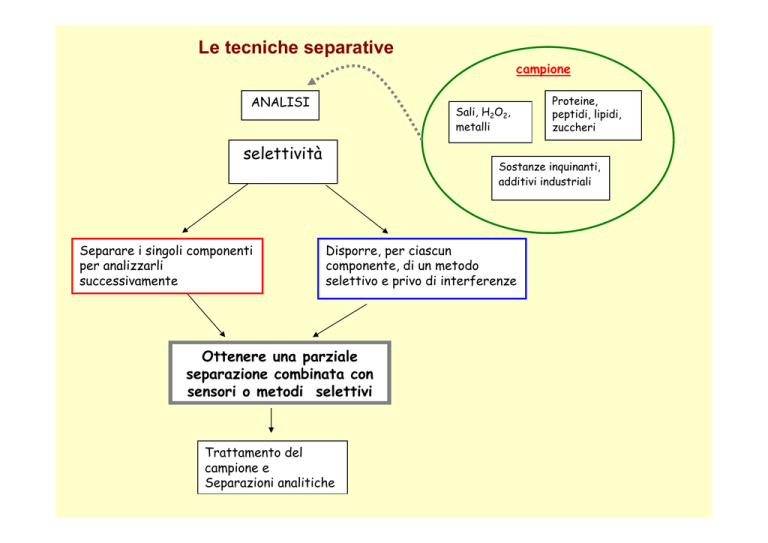
Le tecniche separative
campione
ANALISI
Sali, H2O2,
metalli
selettività
Separare i singoli componenti
per analizzarli
successivamente
Proteine,
peptidi, lipidi,
zuccheri
Sostanze inquinanti,
additivi industriali
Disporre, per ciascun
componente, di un metodo
selettivo e privo di interferenze
Ottenere una parziale
separazione combinata con
sensori o metodi selettivi
Trattamento del
campione e
Separazioni analitiche
IL CAMPIONE
Classificazione fisica
Campione omogeneo (es. soluzione)
Campione eterogeneo (sospensione, solido + liquido, gas disciolti in spazi
fisicamente definiti)
Classificazione chimica
Campione omogeneo (es. cosituito da tutte sostanze idrofile)
Campione eterogeneo (es. cosituito sostanze idrofile e idrofobiche)
Caratteristiche su cui si basano
le TS
¾Caratteristiche chimiche
¾Caratteristiche fisiche
Vantaggi della preparazione del campione:
·
selettività, riduzione delle interferenze
·
possibilità di utilizzare detector sempre più sensibili
·
aumentare il numero di campioni misurabili per unità di tempo
·
ridurre il tempo di analisi strumentale e di interpretazione dei risultati
·
incrementare la vita delle colonne per cromatografia (HPLC e GC)
(adsorbimento di molecole sulle pareti della colonna)
·
possibilità di arricchire il campione (preconcentrazione)
(aumentare la sensibilità del metodo)
·
automazione delle analisi
Svantaggi
·
trattamento chimico-fisico del campione
(l’analisi non avviene sul campione, ma su un estratto)
Il metodo di estrazione deve essere quantitativo
[A]
1°
[A]
estrazione
estrazione
[A]
[A]
analisi
analisi
Dato analitico
50 mg/L
Dato analitico
150 mg/L
+ [A]100 mg/L
2°
estrazione
[A]
analisi
Dato analitico
100 mg/L
+ [A]100 mg/L
RECUPERO: quantità di analita, espressa in %, ottenuta da una matrice
con un metodo metodo di estrazione.
·
Cristallizzazione (precipitazione)
Tecnicha basata sulla possibilità di ottenere cristalli insolubili in soluzione
mediante: aggiunta di opportuno reagente, variazione delle condizioni della
soluzione (pH, temperatura).
Ultrafiltrazione
FILTRAZIONE
Tecnica basasta sull’uso di membrane semipermeabili. Il
passaggio è guidata da un gradiente di pressione.
P
Membrana con pori da 0.2 µm
Membrana per osmosi inversa
Ultrafiltrazione per l’industria delle bevande
Rimozione tramite uso di fibre per ultrafiltrazione di materiale colloidale e organico dall’acqua di processo
nell’industria delle bevande. Ad esempio, acqua della rete pubblica appare avere torbidità, e contenere acidi
fulvici e umici che conferiscono colore giallastro,
Studio su scala pilota di membrana G50 –
ultrafiltrazione.
Constituent
Raw Water
G-50
Permeate
%
Reduction
Bacteria, No/ml
0.00
0.00
NA
Yeast, No/ml
43.00
0.00
100
Turbidity (NTU)
0.52
0.09
83
Color
Highly
Colored
No Color
100
Iron, ppm
0.15
< 0.01
> 93
TOC, ppm
3.00
< 1.00
> 67
separazione tramite l’utilizzo di fibre da microdialisi
La diffusione all’interno della fibra dipende dalle dimensioni dei pori della fibra e dal coefficiente di diffusione della molecola.
membrana
Direzione del liquido di estrazione
pompa
[A] i=K d[A]e
[A]i
[A]e
Distillazione
Tecnica basata sul diverso punto di ebollizione di due o più liquidi in miscela
Estrazione liquido-liquido
iIl grado al quale sostanze (organiche o inorganiche) si distribuiscono tra 2 liquidi non miscibili
tra loro differisce enormemente. Queste differenze possono essere sfruttate per scopi
analitici per separare interferenti.
SSeparazione dei costituenti di una miscela in liquidi non miscibili tra di loro.
o
La tecnica si basa sulle caratteristiche chimiche delle sostanze da separare.
o
Può separare sostanze con punti di ebolllizione vicini (non separabili per distillazione).
Il risultato è una nuova miscela (2 o più costituenti)
Coefficiente di distribuzione
Costante di equilibrio che descrive la distribuzione
di un soluto tra due solventi non miscibili
A(acq)
Kd=
A(org)
[A]org
[A]acq
Imbuto separatore
Rapporto di distribuzione D = rapporto di tutte le specie del soluto in ciascuna fase es. se A è un acido
debole
KD=
Ka =
[A]org
D =
[A]acq
[AH] (acq) + [A-] (acq)
[H+] (acq) + [A-] (acq)
[AH] (org) =
[AH] (acq)
KD [AH] (acq)
[AH] (org)
[A-] (acq) = Ka [AH] (acq)
[H+] (acq)
D =
=
KD [AH] (acq)
[AH] (acq) + Ka [AH]
(acq)
/ [H+] (acq)
KD
1 + Ka/[H+] (acq)
Se [H+] >> Ka D ≅ KD e AH viene estratto nello strato organico
Se [H+] << Ka D = KD [H+] /Ka è più piccolo e AH rimane nello strato acquoso, in soluzione alcalina
l’acido non può essere estratto!
Se si usano volumi diversi bisogna correggere per la variazione
L’efficienza di estrazione è indipendente dalla concentrazione di soluto!
Estrazione di metalli con agenti chelanti
(difeniltiocarbazone)
D = KDMRn Kf Kan
KDHRn
[HR]o
=
K
[H+]a
[HR]o
[H+]a
Se ci sono 2 o più metalli come vengono
separati?
Solo Kf e KDMRn sono funzioni del metallo e
quindi possiamo esprimere un fattore di
separazione β = D1/D2 = Kf1 KDMRn1 / Kf2 KDMRn2
Estrazione in stadi multipli
E’ facilmente dimostrabile come sia molto più efficiente estrarre quantitativamente un
composto operando su estrazione multiple che su una singola estrazione con volumi
grandi di solvente.
Estrazione controcorrente
Tubi di Craig
La frazione di soluto Fr,n contenuta nel r-esimo tubo
dopo n trasferimenti (volumi uguali di solventi) è
Fr,r
=
n! / r!(n-r!) (1 / D+1)n Dr
Estrazione liquido-liquido
Solvente organico – non H2O mix
-di eluizione
Strato acquoso contenente il campione
Terra di diatomee
Gas cromatografo
Applicazione all'analisi di alimenti:
molecole non polari da tessuti animali e vegetali.
Terra di diatomee offre grande superficie Æ film polare di campione che
offre una ampia superficie di scambio fase polare/fase apolare
Vantaggio: ridotto volume di solvente di estrazione utilizzato
Estrazione SPE (solid phase extraction)
Vantaggi:
¾Semplicità
¾Efficienza
¾Versatilità
¾Disponibilità commerciale di colonne pre-impaccate
In SPE si utilizzano 2 strategie alternative:
1.
Ritenzione degli interferenti
2.
Ritenzione dell’analita
1
Interferenti
Materiale:
¾Colonna impaccata con materiale adsorbente
¾Eluente
Le 2 strategie si basano sul diverso grado di affinità di
analita e interferenti per il materiale di impaccamento e
per il solvente di eluizione
2
analita
Interferenti
analita
1. Si usa quando [A] è elevata
2. Si usa quando [A] è bassa Æ ARRICCHIMENTO
Estrazione SPE (ARRICCHIMENTO)
Aggiunta di ripetuti volumi di
campione e eluizione in volume
ridotto Æ concentrazione
Arricchimento 1
Arricchimento
2
Arricchimento
n
eluizione
Es:
3 x 100 ml [A] = 2 ng/ml
Eluente 1 ml
Quale concentrazione nell’eluito?
SPE viene eseguita in tre modalità:
¾Fase diretta (normal phase)
¾Fase inversa (reversed phase)
¾Scambio ionico (ion exchange)
Fase adsorbente polare
Eluente bassa polarità
Fase adsorbente apolare
Eluente alta polarità
Fase adsorbente polare
Eluente alta polarità
Uso di colonna C18 (bassa polarità)
EsempioA: estrazione degli acidi organici da vini rossi
Step 1: acidificazione del campione
Step 2: aggiunta a colonna C18 (fase adsorbente apolare)
Step 3: analisi dell’eluito
2
Pigmenti interferenti
adsorbiti
Acidi organici eluiti
analisi
Esempio B: estrazione dei pigmenti fenolici da vini rossi
Step
Step
Step
Step
1:
2:
3:
4:
acidificazione del campione
aggiunta a colonna C18 (fase adsorbente apolare)
eliminazione dell’eluito
eluizione con eluente più forte
2
4
Eluente più apolare
Pigmenti fenolici
adsorbiti
Acidi organici e zuccheri interferenti
Pigmenti fenolici
analisi
Schema generale per SPE in fase diretta
Fase adsorbente polare (alumina, silica gel, ammino gruppi)
1.
2.
3.
4.
5.
Condizionare la colonna con solvente NON POLARE
Caricare il campione in colonna
Eluire interferenti con solvente non polare
Eluire i primi componenti di interesse con solvente polare
Aumentare progressivamente la polarita dell’eluente
Schema generale per SPE in fase inversa
Fase adsorbente apolare (C8, C18, )
1.
2.
3.
4.
5.
Condizionare la colonna con metanolo, acetonitrile poi lavare con acqua
Caricare il campione in soluzione fortemente polare in colonna
Eluire interferenti con solventi fortemente polari
Eluire i primi componenti di interesse con solvente a polarità decrescente
Aumentare progressivamente la apolarita dell’eluente
Schema generale per SPE a scambio ionico
Fase adsorbente polare a forte carattere ionico
1.
2.
3.
4.
5.
Condizionare la colonna con acqua
Caricare il campione in soluzione acquosa (acqua o tampone)
Eluire interferenti con tampone debole
Eluire i primi componenti di interesse con tampone più forte o aggiustando il pH
Aumentare progressivamente le caratteristiche eluenti del tampone
Estrazione di sostanze volatili
Le sostanze volatili possono essere estratte:
1.
Dalla fase sovrastante la matrice (SPAZIO DI TESTA)
2.
Direttamente dalla matrice
chiusura ermetica
La complessità chimico-fisica della
matrice influenza la distribuzione dei
volatili nello spazio di testa in base alla
diversa ‘affinità’ per la fase ‘matrice’.
spazio di testa
matrice
La composizione dello spazio di testa può
non rappresentare la composizione dei
volatili in una data matrice
SPME – microestrazione in fase solida
Non prevede uso di reagenti, il campione è desorbito generalmente per via termica
fibra
capillare
pulsante
ago
Ago: serve a forare il setto in gomma di vial di campionamento
Fibra: silice fusa rivestita di fase stazionaria appropriata a volatili o a liquidi da estrarre
Capillare: serve da protezione e sostegno alla fibra
Pulsante: serve a comandare la posizione di ‘iniezione’ e ‘campionamento’
ago
capillare
fibra
Chromatography
Chromatographyisisaamature
maturetechnique
techniquenow.
now.
©Gary Christian, Analytical Chemistry,
6th Ed. (Wiley)
Descrizione generale della cromatografia
I metodi cromatografici sono accomunati dalla separazione di sostanze presenti in miscela
attraverso l’uso di una fase stazionaria e di una fase mobile.
I componenti sono trasportati lungo la fase stazionaria dal flusso della fase mobile (Eluizione).
La diversa ripartizione tra queste due fasi determina la separazione dei componenti.
Fase stazionaria: fase fissa in una determinata posizione (o colonna o superficie planare)
Fase mobile: fase che si muove lungo, o attraverso la fase stazionaria, trasportando con sé l’analita
Classificazione
La fase stazionaria è contenuta
C. su colonna all’interno di un capillare e la fase
mobile passa attraverso la fase
stazionaria per gravità o per pressione.
Cromatografia
C. planare
La fase stazionaria è supportata su una
superficie piana e la fase mobile passa
attraverso la fase stazionaria per
capillarità.
Classificazione generale
Metodo specifico
Fase stazionaria
Tipo di equilibrio
Cromatografia liquida (LC),
fase mobile: liquido
Liquido-liquido
Liquido adsorbito su solido
Ripartizione tra liquidi non
miscibili
Liquido, a fase legata
Specie organiche legate a
superficie solida
Ripartizione tra liquido e
superficie legata
Liquido-solido
Solido
Adsorbimento
Scambio ionico
Resina a scambio ionico
Scambio ionico
Esclusione dimensionale
Liquido in interstizi di solido
polimerico
Ripartizione/setacciamento
Gas-liquido
Liquido adsorbito su solido
Ripartizione tra gas e liquido
Gassoso, a fase legata
Specie organiche legate a
superficie solida
Ripartizione tra gas e
superficie legata
Gas-solido
solido
Adsorbimento
Gas-cromatografia,
Fase mobile: gas
Cromatografia di eluizione
FASE MOBILE
campione
A+B
B
Colonna impaccata
B
A
B
RILEVATORE
A
B
SEGNALE
CROMATOGRAMMA
A
B
TEMPO
FASE MOBILE
1.
2.
B
A
Il movimento lungo la colonna avviene solo
quando il soluto si trova nella fase mobile
La velocità dipende quindi dal tempo che il
soluto trascorre nella fase mobile
La frazione di tempo è piccola per composti molto trattenuti
(B), mentre è grande per composti poco trattenuti (A).
La ripartizione di un soluto tra fase stazionaria e fase mobile determina quindi i
tempi di eluizione, e la possibilità di separare miscele complesse.
CROMATOGRAMMA
SEGNALE
A
B
TEMPO
POSIZIONE DEI PICCHI
Informazioni QUALITATIVE
Informazioni QUANTITATIVE
DIMENSIONI (ALTEZZA E AREA) DEI PICCHI
NECESSITA’ DI AVERE PICCHI BEN DEFINITI
Velocità di migrazione dei soluti
Dalla velocità relativa di 2 o più molecole da separare dipende l’efficacia della colonna
La velocità dipende dai rapporti di ripartizione dei soluti nella FM e FS
Rapporto di ripartizione o coefficiente di ripartizione
Amobile
Astazionaria
K=CS/CM
CS =K CM
Questa proporzionalità è valida in un ampio intervallo di concentrazione, ciò determina
l’indipendenza del tempo di eluizione dalla concentrazione
Tempo morto e tempo di ritenzione
SEGNALE
tM
tR
tM: tempo necessario ad una specie non
trattenuta per attraversare una colonna
B
A
TEMPO
tR: tempo che passa tra l’iniezione di un
campione in colonna e la comparsa di un picco
sul cromatogramma
Specie non trattenuta
Velocità media lineare del soluto e della fase mobile
L
v=L/TR
u=L/TM
Coefficiente di ripartizione e velocità di migrazione
KA=CS/CM
V = u x frazione di tempo che il soluto trascorre in FM
v= u x numero di moli di soluto in fase mobile/numero di moli totali di soluto
v=u
CM VM
1
=uX
X
CM VM + CS VS
v= u X
1 + CS VS /CM VM
1
1 + KAVS/VM
CS =KA CM
Fattore di capacità, indice della velocità di migrazione del soluto
¾Parametro che può essere calcolato sperimentalmente
k’A =
v=uX
KA VS
1
v=uX
1 + KAVS/VM
VM
1
L/TR =L/TM x
1 + k’A
u=L/TM
1
k’A=
1 + k’A
SEGNALE
tM
v=L/TR
A
t R - tM
tM
tR
B
TEMPO
k’A ideale tra 1 e 5!
Fattore di selettività, indice della velocità di migrazione relativa di due soluti
¾Parametro che può essere calcolato sperimentalmente
k’B=
A
B
VM
KB
KA
α> 1
K’A=
SEGNALE
tM
A
tM
KB VS
K’B=
α=
t R - tM
α=
(tR)B - tM
(tR)A - tM
KA VS
VM
tR
B
TEMPO
k’A=
t R - tM
tM
Geometria del picco e efficienza della colonna
SEGNALE
Fronting
TEMPO
Tailing
Tailing e fronting sono prodotti da un
coefficiente di distribuzione non lineare
A
A
1
A2
variazione di geometria del picco
B
detector
Fase stazionaria
Interfaccia di scambio
A
flusso
B
Fase mobile
SEGNALE
considerando che una molecola è capace di effettuare migliaia di trasferimenti fase mobile-fase stazionaria
possiamo immaginare il picco come centrato sul valore effettivo di tR attorno al quale c’è una distribuzione di
errori “ casuali” di percorso
Efficienza di una colonna cromatografica
Altezza di un piatto teorico H
N=L/H
Numero di un piatti teorici N
L
L’efficienza di una colonna è proporzionale ad N, quindi inversamente proporzionale all’altezza di un piatto.
L-1σ
L+1σ
tR
H= σ2/ L
Picco asimmetrico
(tailing)
W
TEMPO
N= 16 (tR/W)2
Intensità di colore = numero di molecole di analita
N = 41.7(tR/W0.1)2/(A/B + 1.25)
Variabili che influenzano l’efficienza di una colonna
¾Velocità lineare della fase mobile
¾Coefficiente di diffusione nella fase mobile (DM)
¾Coefficiente di diffusione nella fase stazionaria (DS)
¾Fattore di capacità
¾Diametro delle particelle della fase stazionaria impaccata
¾Spessore del film liquido sulla fase stazionaria
¾Velocità lineare della fase mobile
H
Max efficienza
0.5
¾Cromatografia liquida colonne 25-50 cm
¾Gas-cromatografia fino a decine di m
1.0
1.5
cm/sec
Teoria dell’allargamento della banda; equazione di Van Deemter
H=B/u + CSu + CMu
Diffusione longitudinale:
direttamente
proporzionale
coefficiente di diffusione
importante in GC che in LC
Coefficiente di trasferimento di massa nella fase stazionaria:
Film di liquido su particella solida - direttamente proporzionale a
(spessore)2 , inversamente proporzionale a DS nel film
Fase stazionaria solida – direttamente proporzionale al tempo
adsorbimento/desorbimento
supporto
Fase stazionaria liquida o
solida
al
più
Fase mobile
Coefficiente di trasferimento di massa nella fase mobile:
inv. prop. a DM, funzione di (diametro particelle)2 (diametro
colonna)2 e u
La diffusione turbolenta diminuisce a
flussi bassi di fase mobile
L’allargamento di banda può essere
minimizzato dall’utilizzo di particelle
piccole e regolari (p.es. sfere)
Diffusione turbolenta
Risoluzione di una colonna
Sovrapposizione del 4%
Sovrapposizione dello 0.3%
Controllo di flusso
SCHEMA DI UN GAS CROMATOGRAFO
I Igas
gasdiditrasporto
trasportoinerti
inertiutilizzati
utilizzatisono
sonoHe,
He,Ar,
Ar,
NN2, , CO
2 e H2. La pressione in ingresso è
2 CO2 e H2. La pressione in ingresso è
10-50
10-50 psi
psi corrispondenti
corrispondenti aa 30-150
30-150 mL/min
mL/min
per
colonne
impaccate
e
1-25
mL/min
per colonne impaccate e 1-25 mL/min per
per
2=6.89 x 103
colonne
capillari.
(1
psi=lb/inch
2
colonne capillari. (1 psi=lb/inch =6.89 x 103
-2
Pa=6.8
Pa=6.8xx10
10-2Atm)
Atm)
IlIl campione
campione (vol
(vol da
da nL
nL fino
fino aa 20
20 µL)
µL) èè
iniettato
iniettato mediante
mediante siringa
siringa inin una
una camera
camera aa
rapida
rapidavaporizzazione
vaporizzazioneinintesta
testaalla
allacolonna
colonna
Le
Lecolonne
colonnepossono
possonoessere
essereimpaccate
impaccateoocapillari
capillari(lunghezza
(lunghezzada
da22aa50
50m)
m)eesono
sonoininacciaio,
acciaio,vetro,
vetro,
silice
fusa
o
teflon.
La
t
deve
essere
controllata
a
livello
di
decimi
di
grado
e
deve
essere
appena
silice fusa o teflon. La t deve essere controllata a livello di decimi di grado e deve essere appena
superiore
superiorealla
allatemperatura
temperaturadidiebollizione
ebollizionedell’analita.
dell’analita.Per
Percampioni
campionicomplessi
complessisisiusano
usanogradienti
gradientididi
temperatura
temperaturaprogrammabili.
programmabili.
Colonne
lunghezza
Colonneimpaccate:
impaccate:
lunghezza2-3
2-3m,
m, riempimento
riempimentoterra
terradididiatomee
diatomee(dia
(dia0.15-0.25
0.15-0.25mm;
mm;area
area
2
superficiale
>
1m
/g)
ricoperto
di
fase
stazionaria
liquida
2
superficiale > 1m /g) ricoperto di fase stazionaria liquida
Colonne
Colonnetubolari
tubolariaperte
aperte(WCOT):
(WCOT):colonne
colonnecapillari
capillaricon
conpareti
paretiricoperte
ricoperteda
dafase
fasestazionaria
stazionaria
Colonne
Colonnetubolari
tubolariaperte
aperteaasupporto
supportoricoperto
ricoperto(SCOT):
(SCOT):alla
allaparete
paretedel
delcapillare
capillaresono
sonoadese
adeseparticelle
particelle
solide
ricoperte
di
fase
stazionaria
solide ricoperte di fase stazionaria
Le
Lecolonne
colonnecapillari
capillariaabase
basedi
disilice
silicefusa
fusahanno
hannouna
unarisoluzione
risoluzionemigliore
migliore
¼ inch dia. x 6ft impaccata
0.03 inch dia. X 500 ft acciaio
capillare
0.25 dia. X 50 m in vetro
capillare
Gas cromatogramma di estratto di menta piperita
La
Lachiave
chiaveper
perlalarisoluzione
risoluzioneèèrappresentata
rappresentatadalle
dallediverse
diversefasi
fasi
stazionarie.
stazionarie.Tra
Tralelepiù
piùcomuni
comunicicisono
sonoI Ipolisilossani.
polisilossani.
I Irivelatori
rivelatoripiù
piùcomuni
comunisono
sonoaaionizzazione
ionizzazionedi
difiamma,
fiamma,aaconducibilità
conducibilitàtermica,
termica,
termoionici
termoionicieequelli
quelliaaspettrometria
spettrometriadi
diMassa!
Massa!
Le
Lecondizioni
condizionicromatografiche
cromatograficherappresentano
rappresentanosempre
sempreun
uncompromesso
compromessotra
tra
tempo
tempodi
dianalisi,
analisi,risoluzione
risoluzioneeesensibilità
sensibilità
Fig. 20.6. Analisi con temperatura programmata .
L’uso
L’usodi
distandard
standardinterni
internièècomune
comune
in
GC.
Questi
migliorano
l’analisi
in GC. Questi migliorano l’analisi
minimizzando
minimizzandovariazioni
variazionitra
tradiversi
diversi
strumenti,
nella
prparazione
strumenti, nella prparazione dei
dei
campioni
campioni ee nella
nella iniezione
iniezione del
del
campione.
campione.
Per
Per calcolare
calcolare lala concentrazone
concentrazone
della
specie
si
usa
il
della specie si usa ilrapporto
rapportotra
traI I
picchi
picchianalita/standard
analita/standardinterno.
interno.
autocampionatore
Strumento GC-MS da banco
Schema a blocchi di uno spettrometro di massa
La sorgente di ionizzazione converte molecole neutre in ioni che vengono separate
secondo il loro rapporto m/z. Ogni molecola si frammenta (carica) in ioni caratteristici in
base alla sorgente.
Le
Lesorgenti
sorgentiaaimpatto
impattoelettronico
elettronicosono
sonoad
adelevata
elevataenergia
energiaeeframmentano
frammentanolele
molecole
molecolein
inmodo
modocosì
cosìintenso
intensoche
cheaavolte
volte manca
mancalo
loione
ionemolecolare.
molecolare.Da
Da
informazioni
sulla
struttura
della
molecola.
informazioni sulla struttura della molecola.
Le
Lesorgenti
sorgentiaaionizzazione
ionizzazionechimica
chimicasono
sonoaaenergia
energiainferiore,
inferiore,lo
loione
ionemolecolare
molecolareèè
sempre
sempredominante.
dominante.
Le
Lesorgenti
sorgentiaaElettrospray
ElettrosprayeeMALDI
MALDIsono
sonousate
usatein
inHPLC
HPLC
I Ipicchi
picchivengono
vengononormalizzati
normalizzatiassegnando
assegnandoililvalore
valoremassimo
massimoalalpicco
piccopiù
piùfrequente
frequente(picco
(piccobase)
base)
+ (m/z = 31), m/z = 32 è il picco molecolare e c’è un
Nell’esempio
+ (m/z = 31), m/z = 32 è il picco molecolare e c’è un
Nell’esempioililpicco
piccobase
basecorrisponde
corrispondeaa CH
CH2OH
OH
2
13
piccolo
picco
a
m/z=33
corrispondente
allo
ione
molecolare
piccolo picco a m/z=33 corrispondente allo ione molecolareper
perl’isotopo
l’isotopo 13CC(abbondanza
(abbondanzarelativa
relativa==
1.1%)
1.1%)
Le
Letabelle
tabelledidiabbondanza
abbondanzarelativa
relativasono
sonousate
usateper
perassegnare
assegnareI Ivari
varipicchi
picchi
Spettro di massa EI del metanolo
Nella
Nellaionizzazione
ionizzazionechimica
chimica un
ungas
gasreagisce
reagiscecon
conl’analita
l’analitaattraverso
attraversotrasferimento
trasferimentodi
di
protoni
o
idruri
e
da
una
frammentazione
limitata,
lo
ione
molecolare
è
sempre
protoni o idruri e da una frammentazione limitata, lo ione molecolare è sempre
+
+
dominante.
dominante.Ad
Adesempio
esempioililmetano
metanoproduce
produceCH
CH5 +eeCC2HH5 + che
chereagisce
reagiscecosì:
così:
5
+
+
CH
CH55+++MH
MH==MH
MH22+++CH
CH44
CC2HH5++++MH
==MM++++CC2HH2
MH
2 5
2 2
La
Laframmentazione
frammentazioneda
daluogo
luogoaaioni
ioniM-H
M-HooM+H
M+H
2
5
Analizzatore
Analizzatorepiù
piùutilizzato
utilizzatoper
perGC-MS.
GC-MS.
Una
Unadifferenza
differenzadi
dipotenziale
potenziale(U)
(U)diretta
direttaeeuna
unadifferenza
differenzadi
dipotenziale
potenzialeoscillante
oscillanteaa
radiofrequenze
radiofrequenze(V
(Vcos
cosωt)
ωt)vengono
vengonoapplicate
applicatealle
alle44barre
barreparallele.
parallele. (ω
(ω==frequenza,
frequenza,t t==
tempo).
tempo).
Due
Duepoli
polisono
sonopositivi
positivi(U
(U++VVcos
cosωt)
ωt)eedue
due negativi
negativi[-(U
[-(U++VVcos
cosωt)].
ωt)]. IlIlpotenziale
potenziale
applicato
determina
la
traiettoria
degli
ioni.
Solo
quelli
con
rapporto
m/z
applicato determina la traiettoria degli ioni. Solo quelli con rapporto m/zparticolare
particolare
raggiungono
il
rivelatore.
raggiungono il rivelatore.
spettrometro di massa a quadrupolo.
L’analizzatore
L’analizzatoreaatempo
tempodi
divolo
volo(TOF)
(TOF)èèadatto
adattoper
permolecole
molecolegrandi,
grandi,gli
gliioni
ionivengono
vengono
accelerati
ed
entrano
nel
tubo
con
energia
cinetica
identica.
accelerati ed entrano nel tubo con energia cinetica identica.
Ioni
Ionicon
conm/z
m/zdivers
diversraggiungono
raggiungonoililrivelatore
rivelatoreaatempi
tempidifferenti.
differenti.
Spettrometro di massa a tempo di volo
sopra:
sopra:gas
gascromatogramma
cromatogramma(corrente
(correnteionica
ionicatotale)
totale)didicocaina
cocainainincampione
campionedidiurina
urina
InInmezzo:
mezzo:spettro
spettrodidimassa
massadel
delpicco
piccoaa 11.5
11.5min.
min.
Sotto
Sottospettro
spettrodidimassa
massadidiuno
unostandard
standarddidicocaina.
cocaina.
Conferma di Cocaina per GC-MS
UltraFast GC-TOF-MS of 30 pesticides in 3 minutes
RT: 1.31 - 2.96
2.49
100
2.25
95
90
85
80
75
70
65
1µg/ml, 1 µl splitless
25 spectra/sec
50-600 u
ramp rate 210°C/min
2.26
2.38
2.28
2.89
2.59
2.48
2.69
2.55
Relative Abundance
60
55
2.14
50
No deconvolution
45
1.78
40
35
1.90
2.78
2.00
1.96
1.62
30
2.65
2.32
1.84
2.40
2.86
2.17
1.72
2.03
25
2.20
1.57
20
2.82
2.94
15
10
5
0
1.4
1.5
1.6
1.7
1.8
1.9
2.0
2.1
2.2
Time (min)
2.3
2.4
2.5
2.6
2.7
2.8
2.9
K. Patel et al – Poster presentation - 16th IMSC 2003
Componenti per cromatografia liquida ad alta risoluzione (HPLC)
Vengono
Vengonousate
usatecolonne
colonneimpaccate
impaccatecon
conpiccole
piccoleparticelle,
particelle,iningrado
gradodidioperare
operareaapressioni
pressioni 1000-3000
1000-3000
psi
psi
I Icontenitori
contenitoriper
per I Isolventi
solventipossono
possonocontenere
conteneresolventi
solventiaadiversa
diversapolarità
polaritàper
pereffettuare
effettuareeluizioni
eluizioniinin
gradiente
gradiente
Una
Unapre-colonna
pre-colonnaèèpresente
presenteper
pertrattenere
trattenerecomposti
compostiad
adelevato
elevatoadsorbimento
adsorbimentoche
chenon
nonsarebbero
sarebbero
eluiti
e
materiale
particolato.
eluiti e materiale particolato.
I Irivelatori
rivelatoriclassici
classicisono
sonoad
adindici
indicididirifrazione,
rifrazione,UV,
UV,DAD,
DAD,aafluorescenza
fluorescenzaeevoltammetrici
voltammetriciooMS
MS
La
Ladiffusione
diffusionemolecolare
molecolareèèmeno
menoimportante
importantenei
neiliquidi
liquidi
IlIltrasferimento
trasferimentodi
dimassa
massaèèpiù
piùimportante
importante
L’allargamento
L’allargamentodi
dibanda
bandaèèdovuto
dovutoaaeffetti
effettiextra
extracolonna
colonna
H=B/u + CSu + CMu
Nelle
Nellesfere
sferemicroporose
microporoseililsoluto
solutodiffonde
diffondenella
nellafase
fasemobile
mobilestagnante
stagnante
bagnando
i
pori.
bagnando i pori.
Le
Lemicrosfere
microsfereaaperfusione
perfusionehanno
hannoun
unmix
mixdi
dipori
porigrandi
grandieepiccoli
piccolivengono
vengono
usate
a
flussi
elevati
per
molecole
grandi
e
proteine.
.
usate a flussi elevati per molecole grandi e proteine. .
Microsfere
Microsferenon
nonporose
porosesono
sonopiccole
piccole (1.5-2.5
(1.5-2.5µm
µmvs.
vs.3-10
3-10µm).
µm).IlIlfilm
film
sottile
non
presenta
fase
mobile
stagnante
per
un
trasporto
di
massa
sottile non presenta fase mobile stagnante per un trasporto di massaed
ed
una
separazione
rapidi.
Presentano
una
capacità
inferiore
ed
una
una separazione rapidi. Presentano una capacità inferiore ed una
contropressione
contropressioneelevata.
elevata.
Colonne HPLC
N = 9000-15000
misura
iniezione
dalla pompa
loop
dalla pompa
loop
alla cella
scarico
alla cella
scarico
valvola ad iniezione
Cromatografia
Cromatografialiquida
liquida di
diripartizione
ripartizioneaafase
faselegata
legata
Gruppi
Gruppisilanolici
silanolicisulla
sullafase
fasestazionaria
stazionariadidisilice
silicefusa
fusavengono
vengonolegati
legatiaaclorosilani
clorosilaniper
per
produrre
una
fase
organica
lipofilica
(C-8;
C18)
produrre una fase organica lipofilica (C-8; C18)
La
Lacromatografia
cromatografiasisidice
dicedidiripartizione
ripartizioneaafase
faseinversa
inversa
In
InHPLC,
HPLC, lelecondizioni
condizionidi
diseparazione
separazionevengono
vengonovariate
variatecambiando
cambiandolalafase
fase
mobile.
mobile.
Nell’esempio
Nell’esempiolalapolarità
polaritàdel
delsolvente
solventeèèstata
stataaggiustata
aggiustataalalfine
finedi
diottenere
ottenere
valori
di
0.5
to
20
(α
=
k
/k
).
valori di 0.5 to 20 (α = k2 /k1 ).
2
1
Cromatografia
Cromatografiaad
adesclusione
esclusionedimensionale
dimensionale
Le
Lemolecole
molecolepenetrano
penetranonel
nelgel
gelininfunzione
funzionedella
dellagrandezza
grandezzaeedella
della forma
forma
©Gary Christian, Analytical Chemistry,
6th Ed. (Wiley)
Cromatografia
Cromatografiaaascambio
scambioionico
ionico
La
Lamaggior
maggiorpate
patedelle
delleseparazioni
separazioniutilizza
utilizzaresine
resinecon
conscambiatore
scambiatoreacido
acidoforte.
forte.
Resine
Resinead
adacido
acidodebole
debolevengono
vengonoutilizzate
utilizzateper
perproteine
proteineeepeptidi
peptidiritenuti
ritenutitroppo
troppo
fortemente
da
quelle
ad
acido
forte.
fortemente da quelle ad acido forte.
L’eluizione
L’eluizioneviene
vieneeffettuata,
effettuata,ininquesto
questocaso,
caso,con
conuna
unasoluzione
soluzionedidiuno
unoione
ioneiningrado
gradodidi
competere
competere con
con gli
gli analiti
analiti per
per i i gruppi
gruppi ionici
ionici della
della resina,
resina, ilil frazionamento
frazionamento avviene
avviene inin
2+
2+
2+
base
baseaaKK(p.es
(p.esper
peruna
unaresina
resinaad
adacido
acidosolfonico
solfonicoKKva
vanell’ordine
nell’ordine Ba
Ba2+ >>Pb
Pb2+>>Ca
Ca2+
2+
2+
+
+
+
+
+
+
>>Ni
Ni2+ >>Cd
Cd2+>>>
>>>Ag
Ag+>>Cs
Cs+>>KK+>Na
>Na+ >>HH+>>LiLi+. .Si
Sipuò
puòlavorare
lavorarecon
conun
unsistema
sistemaaa
colonna
colonnasingola
singolaoocon
consoppressore
soppressore
L’uso
L’usodella
dellacolonna
colonnasoppressore
soppressoreha
hapermesso
permessolaladeterminazione
determinazioneaabassi
bassilivelli
livellidi
di
ioni
mediante
rivelatori
conduttimetrici
ioni mediante rivelatori conduttimetrici
La
Lacolonna
colonnaanalitica
analiticasepara
separagli
glianaliti
analitiionici,
ionici,lalacolonna
colonnasoppressore
soppressoreneutralizza
neutralizzailil
solvente
solventeriducendone
riducendonelalaconducibilità
conducibilitàeepuò
puòconvertire
convertireI Isali
saliad
adacidi
acidioobasi
basiforti
forti
L’interfaccia
L’interfacciaper
perun
unHPLC-MS
HPLC-MSdeve
deveessere
esserein
ingrado
gradodi
dirimuovere
rimuovereililsolvente
solventeeedi
di
convertire
convertiresoluti
solutilabili
labilinon-volatili
non-volatiliin
informa
formagassosa.
gassosa.
Nell’interfaccia
Nell’interfaccia“particle
“particlebeam”
beam”L’eluente
L’eluenteviene
vienenebulizzato
nebulizzato con
conHe
Hein
inun
unaerosol
aerosolin
inuna
una
camera
camerariscaldata
riscaldataaabassa
bassapressione.
pressione. He
Heeeililsolvente
solventesono
sonopiù
piùleggeri
leggerieesono
sonoeliminati
eliminati
tramite
una
pompa
tramite una pompa
Gli
Glianaliti
analitivengono
vengonointrodotti
introdottiin
inuna
unasorgente
sorgentead
adimpatto
impattoelettronico
elettronico(EI).
(EI).
L’interfaccia
L’interfacciapiu
piuutilizzata
utilizzataèèl’elettrospray
l’elettrosprayperchè
perchèrappresenta
rappresentaun
unprocesso
processodi
di
ionizzazione
ionizzazionesoft.
soft.
IlIlcampione
campioneviene
vienenebulizzato
nebulizzatoed
edèècomtemporaneamente
comtemporaneamentesoggetto
soggettoad
aduna
unaelevata
elevata
differenza
di
potenziale
all’interno
dell’interfaccia.
Si
formano
delle
goccioline
differenza di potenziale all’interno dell’interfaccia. Si formano delle goccioline
cariche
caricheche
chevengono
vengonodesolvatate
desolvatatetramite
tramitecalore
caloreeegas
gasinerte.
inerte.Le
Lemolecole
molecolecariche
cariche
entrano
nel
rivelatore.
entrano nel rivelatore.
John
JohnFenn
Fenn ha
haricevuto
ricevutonel
nel 2002
2002ililpremio
premio Nobel
Nobelin
inchimica
chimicaper
perlo
losviluppo
sviluppodell’ESI
dell’ESI
L’eluente
L’eluentesale
saleper
percapillarità.
capillarità.IlIlcontenitore
contenitoreviene
vienechiuso
chiusoper
perprevenire
prevenire
l’evaporazione.
l’evaporazione.
Vengono
Vengonoutilizzate
utilizzatelelestesse
stessefasi
fasistazionarie
stazionarieutilizzate
utilizzatein
incromatografia
cromatografialiquida
liquidasu
su
colonna
colonna
Cromatografia su strato sottile
Per
Per elettroforesi
elettroforesi capillare
capillare sisi intende
intende tutta
tutta una
una serie
serie didi tecniche
tecniche separative
separative che
che utilizzano
utilizzano
capillari
capillari (25-75
(25-75 µm
µm diadia- 25-100
25-100 cm
cm lunghezza)
lunghezza) nei
nei quali
quali sisi realizzano
realizzano migrazioni
migrazioni
differenziali
differenziali didi sostanze
sostanze cariche
cariche sotto
sotto l’influenza
l’influenza didi un
un intenso
intenso campo
campo elettrico
elettrico (voltaggi
(voltaggi
compresi
tra
10-50
KVolt)
compresi tra 10-50 KVolt)
Elettroforesi capillare
I I gruppi
gruppi sul
sul capillare
capillare ionizzano
ionizzano oltre
oltre pH
pH 22 ee producono
producono cariche
cariche negative
negative che
che
formano
formanoun
undoppio
doppiostrato
stratocon
congli
gliioni
ionipositivi
positividel
deltampone
tampone
La
La fase
fase mobile
mobile solvatata
solvatata (diffuse
(diffuse layer)
layer) carica
carica migra
migra verso
verso ilil catodo
catodo ee ilil
solvente
solventeviene
vienetrascinato
trascinato (flusso
(flussoelettroosmotico)
elettroosmotico)
Tutti
Tutti gli
gli analiti
analiti vengono
vengono trasportati
trasportati ma
ma aa velocità
velocità diverse
diverse dovute
dovute alla
alla diversa
diversa
2
mobilità
mobilitàelettroforetica
elettroforetica(µ).
(µ).IlIltempo
tempodi
dimigrazione
migrazioneèèdato
datoda
da LL==l l2/µ/V
/µ/Vdove
dovel lèè
la
lalunghezza
lunghezzadel
delcapillare
capillareeeVVililvoltaggio
voltaggioapplicato
applicato
Distribuzione di carica e flusso elettroosmotico
IlIlflusso
flussoelettrosmotico
elettrosmoticogenerato
generatoèècostante
costantelungo
lungotutto
tutto ililcapillare
capillare
Gli
Glianaliti
analitisisimuovono
muovonoalla
allastessa
stessavelocità
velocitàlungo
lungotutto
tuttoililcapillare,
capillare,laladispersione
dispersione
èèminima
e
i
picchi
molto
stretti.
minima e i picchi molto stretti.
L’efficenza
L’efficenzadi
diseparazione
separazioneèècirca
circa10-100
10-100volte
voltemaggiore
maggiorerispetto
rispettoall’HPLC.
all’HPLC.
IlIlvolume
volumetotale
totalenel
nelcapillare
capillareèèdell’ordine
dell’ordinedei
deiµL,
µL,ililvolume
volumedi
dicampione
campioneiniettato
iniettato
èènell’ordine
dei
nL!
nell’ordine dei nL!
Separazione di 2-7 attomoli di una miscela di 18 aminoacidi (rivelazione fluorimetrica)
ANALISI ENZIMATICA
Comprende le tecniche di dosaggio che
comportano l’uso di enzimi. Molto importanti a
livello biochimico e analitico. Sfruttano la
selettività di riconoscimento tra un enzima ed i
suoi substrati.
E’ possibile dosare sia l’attività enzimatica che i
substrati.
DOSAGGIO DELL’ATTIVITA’ ENZIMATICA
In opportune condizioni sperimentali, la velocità di una reazione
enzimatica è direttamente proporzionale alla concentrazione di
enzima.
L’attività enzimatica viene espressa in unità internazionali o in Katal
(Kat). 1 U = quantità di enzima che trasforma una µmol di substrato
al min in condizioni sperimentali costanti; 1 Kat = una mole di
substrato al secondo. 1 Kat = 6 × 107 U.
Nel caso in cui il PM del substrato non è noto (proteinasi, DNAsi,
RNAasi) si usano unità arbitrarie.
La velocità di una reazione enzimatica varia nel tempo a causa della
diminuzione del substrato o inibizione da prodotto o per catalisi
della reazione inversa è quindi necessario dosare l’attività
enzimatica alla velocità iniziale (v0). E’ opportuno non superare il
5% della reazione complessiva.
I metodi di dosaggio continui sono sempre da preferire a quelli
discontinui per una determinazione accurata della v0
FATTORI CHE INFLUENZANO L’ATTIVITA’ ENZIMATICA
Concentrazione di enzima. Purchè sia valida la condizione alla
base dell’equazione di Michaelis ([S] >> [E]) v0 è direttamente
proporzionale a [E].
Concentrazione di substrato. La dipendenza tra concentrazione di substrato
e v0 è data dalla Michaelis
v0 =VMAX S /Km S
La Km è indipendente dalla quantita di E
Per [S] << Km la reazione è di pseudo primo ordine (dipendendente dalla
[S]) per [S] >> Km, la reazione è di ordine zero
Valori di v0 pari al 91%, 95%, 98% e 99% di VMAX si raggiungono per
valori di [S] di 10 Km, 19 Km, 49 Km e 99 Km. Per determinare l’attività
enzimatica bisogna lavorare più vicino possibile alla VMAX
(condizioni saturanti di substrato).
La Km varia con le condizioni sperimentali (p.es. enzimi da varie
fonti).
Per reazioni a più substrati la cinetica è più complessa.
Temperatura. Nelle reazioni semplici la temperatura influenza secondo
l’equazione di Arrhenius
k = a e-Ea/RT
In quelle enzimatiche, oltre una certa temperatura c’è una
diminuzione dovuta ad inattivazione termica. Nel tratto ascendente il
Q10 (variazione per 10° C) è uguale a ≈ 2. La temperatura influenza
anche la Km!
pH. Se sono presenti 2 amminoacidi con gruppi dissociabili all’interno
del sito attivo si ha una curva a campana con un optimum di pH. Se è
presente un solo gruppo si avrà un solo tratto della curva, se non ci
sono gruppi dissociabili v0 è indipendente da pH.
Sia il tipo di tampone utilizzato che la sua forza ionica possono
influenzare la misura, è opportuno utilizzare un tampone con pK
vicino al pH ottimale della reazione
Modificatori. Molto spesso è necessario aggiungere alla miscela di
reazione attivatori della reazione enzimatica (p.es. ADP per la
glutammico deidrogenasi, Mg2+ per alcune chinasi) o composti che
mantengano lo stato redox attivo dell’enzima (glutatione o cisteina per la
riduzione degli SH dell’enzima).
Altre volte è invece necessario prevenire l’inibizione dell’enzima (p.es.
con EDTA per eliminare l’inibizione da metalli)
TECNICHE DI DOSAGGIO
Reazioni semplici. I substrati (anche di sintesi) o i prodotti della
reazione possono essere rilevati per via spettrofotometrica,
fluorimetrica, elettrochimica etc. (p.es . Deidrogenasi NAD(P)
dipendenti).
Reazioni accoppiate. Quando non è possibile determinare la reazione
direttamente, si accoppia con una o più reazioni indicatrici. La reazione
indicatrice deve essere molto rapida in modo da non influenzare la
cinetica della reazione da determinare.
S → P →Q
La reazione S → P è catalizzata dall’enzima da dosare, quella P → Q
dall’enzima indicatore. All’inizio della reazione, la concentrazione di P è
bassa e l’enzima indicatore non può lavorare alla Vmax. Questo produce un
ritardo (fase lag).
Misura del bianco
Attività = (∆E/min) /ε d n × (V/v) = U/mL
ε = coefficiente di estinzione molare; d = cammino ottico; n=
stechiometria della reazione; V = volume di reazione (in mL); v =
volume di campione (in mL)
PROBLEMI
a = saggio OK
b = non è stato sottratto il
bianco
c = poco E indicatore,
d = presenza di attivatore
e = presenza di inibitore
irreversibile
DOSAGGIO DI ANALITI
Condizioni:
L’azione dell’enzima deve essere specifica, l’enzima deve essere ad
elevato grado di purificazione, nel campione non devono essere
presenti inibitori, la reazione deve essere veloce.
Esistono due metodi per la misura di analiti mediante analisi
enzimatica: a termine (end-point), cinetico.
End-point: si lascia che la reazione enzimatica raggiunga l’equilibrio,
non è rilevante ne la quantità di enzima usato ne il tempo di analisi. Il
segnale, (p.es. assorbanza) prima e dopo l’aggiunta di E da la
concentrazione di analita. Non è necessaria una retta di taratura (se si
conosce ε)
E’ necessario che l’equilibrio della reazione sia spostato fortemente
verso destra. Talvolta vengono usati accorgimenti per spostarlo, quali
uso di agenti sequestranti i prodotti o variazione di pH.
Si può calcolare la quantità di enzima da usare nel saggio
dal’espressione cinetica delle reazione di primo ordine ([S]<<Km)
t = 1/k 2,3 log [S]0 / ([S]0 – x]
k = VMAX/Km ; [S]0 = concentrazione del substrato al t = 0 ; x =
concentrazione del substrato al tempo t
Per una reazione completa al 99%:
t = 1/k 2,3 log 1 / (1 - 0.99) = 4.6 /k = 4.6 Km/VMAX
Se voglio il 99% della reazione in 4.6 min Km/VMAX deve essere 1!
Analogamente si può calcolare la quantità di enzima necessaria a far
avvenire la reazione nel tempo desiderato.
I kit enzimatici spettrofotometrici in commercio utilizzano metodi endpoint.
Metodi cinetici. La concentrazione di substrato viene determinata in
base alla velocità della reazione enzimatica. Sono importanti la
quantità di enzima utilizzato e il tempo. E’ necessaria sempre una retta
di taratura.
Misura diretta: è utilizzata negli analizzatori automatici perché è
necessario misurare la velocità in tempi rapidi perché il substrato
viene consumato immediatamente.
Dosaggio catalitico e amplificazione enzimatica: una reazione
rigenerante l’analita viene usata per poter misusare a tempi più lunghi
e aumentare la sensibilità
Dosaggio di acido lattico con lattato ossidasi (LOD) e lattico
deidrogenasi (LDH):
LOD
lattato + O2 → piruvato + H2O2
LDH
piruvato + NADH + H+ → lattato + NAD+
IMMOBILIZZAZIONE ENZIMATICA
Uso dello stesso enzima per un
numero elevato di analisi
Possibilità di posizionare l’enzima su
un sensore (p.es elettrodi ad enzima) o
in un reattore per analisi in flusso
Immobilizzazione di tipo fisico (non
covalente) : maggiore attività ritenuta
dall’enzima, tempo di vita inferiore.
Immobilizzazione di tipo chimico
(covalente). Minore attività iniziale,
maggiore stabilità. Si usano supporti
polimerici
contenenti
gruppi
funzionali che possono essere legati a
quelli enzimatici (p.es. amino gruppi
dell’enzima + aminogruppi del
supporto + glutaraldeide).
Che cosa cambia con l’immobilizzazione covalente?
• La Km (apparente) aumenta
• L’attività è 0.5-5% della iniziale
• L’optimum di pH dell’attività viene spostato
• L’enzima è più resistente ad attivatori ed inibitori
• L’enzima può essere utilizzato più volte (tempo di vita operazionale e
di mantenimento)
L’immobilizzazione su reattore permette in genere di ritenere una
maggior quantità di enzima rispetto a quella su membrana. Questo
aumenta l’efficienza di reazione (% di substrato convertito) ed il tempo
di vita.












