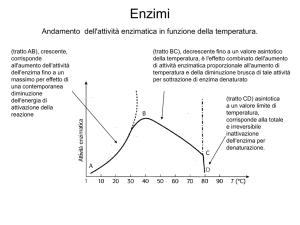
Inibizione e regolazione enzima.ca Copyright © 2013 Zanichelli editore S.p.A.
L'inibizione enzimatica
Conce1 chiave • Gli inibitori enzimatici interagiscono reversibilmente o
irreversibilmente con un enzima alterandone i valori di
KM e/o di Vmax. • Un inibitore competitivo si lega al sito attivo
dell'enzima e fa aumentare il valore apparente di KM
della reazione. • Un inibitore enzimatico non competitivo influenza
l'attività catalitica diminuendo i valori apparenti sia di KM
sia di Vmax. • Un inibitore enzimatico misto altera sia l'attività
catalitica sia il legame del substrato diminuendo il valore
apparente di Vmax e aumentando o diminuendo quello di
KM. Inibizione irreversibile: I veleni
per il sistema nervoso
I veleni
per il sistema nervoso
Inibizione irreversibile: gli
antibiotici
Gli inibitori
enzimatici dell'HIV
inibitori della trascrittasi inversa;
inibitori della proteasi (inibizione
reversibile);
inibitori della fusione;
inibitori dell'integrasi;
inibitori del co-recettore.
Inibizione enzimatica competitiva
Inibizione competitiva: il trattamento con
etanolo dell'avvelenamento da metanolo
Inibizione enzimatica competitiva
Inibizione enzimatica competitiva
Inibizione enzimatica incompetitiva
Inibizione enzimatica incompetitiva
Inibizione enzimatica mista
(noncompetitiva)
Inibizione enzimatica mista
(noncompetitiva)
Effetti degli inibitori enzimatici
L'inibizione enzimatica
Punto di verifica • Cosa consente di distinguere un inibitore da un
inattivatore?
• Perché il substrato di un enzima, il suo stato di
transizione e il prodotto della reazione che catalizza
sono tutti punti di partenza per la progettazione di un
inibitore competitivo?
• Descrivete gli effetti degli inibitori competitivi,
incompetitivi e misti su KM e Vmax.
• In che modo si può quantificare il legame di un
inibitore a un enzima?
• In che cosa differisce l'inibizione non competitiva dalle
altre forme di inibizione?
Il controllo dell'attività enzimatica
Conce1 chiave • Gli effettori allosterici si legano agli enzimi costituiti da
diverse subunità quali la aspartato transcarbamilasi,
inducendo cambiamenti conformazionali cooperativi che
alterano l'attività catalitica dell'enzima. • La fosforilazione e la defosforilazione di un enzima
come la glicogeno fosforilasi possono modificarne
l’attività spostando l'equilibrio tra la conformazione più
attiva e quella meno attiva dell'enzima. La via di biosintesi delle pirimidine:
l'inibizione retroattiva dell‘aspartato transcarbamilasi (ATCasi)
Gli effettori allosterici della
reazione dell'ATCasi
Confronto tra lo stato T e
lo stato R dell'ATCasi
ATCasi di E. coli PDBids 5AT1 and 8ATC Cambiamenti conformazionali
dell'ATCasi
Il controllo per modificazione covalente:
la fosforilazione
Il prodotto della glicogeno fosforilasi
Glicogeno fosforilasi di
muscolo di coniglio
Cambiamenti conformazionali
della glicogeno fosforilasi
Glicogeno fosforilasi PDBids 8GPB and 7GPB L’attività di
enzimi
particolarmente
importanti, come
la glicogeno
fosforilasi
muscolare (che
regola il
metabolismo
glucidico), è
finemente
regolata mediante
meccanismi
multipli:
fosforilazioni,
regolazioni
allosteriche ed
Controllo dell'attività della glicogeno
fosforilasi tramite fosforilazione
Le diverse proteina chinasi riconoscono specifiche sequenze consenso per la fosforilazione di specifiche proteine bersaglio La regolazione mediante fosforilazioni mul.ple ad opera di diverse proteina chinasi permeGe un controllo molto accurato dell’a1vità enzima.ca Attivazione del tripsinogeno a tripsina
Alcuni enzimi ed altre proteine sono regola. per scissione proteoli.ca di un precursore enzima.co (deGo zimogeno o proenzima nel caso degli enzimi) Esempi di zimogeni Zimogeni pancrea.ci Chimitripsinogeno Tripsinogeno Proelastasi Prolipasi (co-­‐lipasi) Zimogeno stomaco Pepsinogeno Zimogeni del sistema di coagulazione Protrombina FaGore XI … Protransglutaminasi (FaGore XIII) La cascata della coagulazione del
sangue
La cascata della coagulazione del
sangue
Il controllo dell'attività enzimatica
Punto di verifica • Paragonate l'azione di un effettore allosterico, di un
inibitore competitivo e non competitivo di un enzima. • Spiegate le basi strutturali del legame cooperativo al
substrato e della regolazione allosterica nel caso della
ATCasi. • Perché gli enzimi allosterici sono costituiti da più di
una subunità?
• Descrivete in che modo la fosforilazione e la
defosforilazione controllano l'attività della glicogeno
fosforilasi. • Elencate alcuni vantaggi dei sistemi a cascata che
funzionano per fosforilazione e defosforilazione rispetto
alla regolazione allosterica semplice.