Liquidi e Solidi
1
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Confronto fra Gas, Liquidi e Solidi
– I Gas sono fluidi comprimibili. Le loro molecole sono ben separate.
– I Liquidi sono fluidi relativamente incomprimibili. Le loro molecole sono
molto più fortemente impaccate.
– I Solidi sono pressochè incomprimibili e rigidi. Le loro molecole o ioni
sono a stretto contatto e non possono muoversi.
Stati della Materia
Proprietà dei Liquidi
La Tensione Superficiale è la quantità di energia richiesta
per aumentare la superficie di un liquido.
Forze
intermolecolari
forti
Alta
tensione
superficiale
3
Proprietà dei Liquidi
Coesione è l’attrazione intermolecolare fra molecole simili
Adesione è un’attrazione fra molecole diverse
Adhesion
Cohesion
4
Proprietà dei Liquidi
Viscosità è la misura della resistenza al flusso di un fluido.
Forze
intermolecolari
forti
Alta
viscosità
5
Un solido cristallino possiede un ordine rigido ed a lungoraggio. In un solido cristallino, gli atomi, le molecole o gli ioni
occupano posizioni specifiche (prevedibili).
Un solido amorfo non ha una ben definita disposizione ed un
ordine molecolare a lungo raggio.
Una cella unitaria è l’unità strutturale ripetitiva di base di un
solido cristallino.
lattice
point
Unit Cell
At lattice points:
Unit cells in 3 dimensions
•
Atoms
•
Molecules
•
Ions
6
Sette Celle Unitarie
7
Tre Tipi di Celle Cubiche
8
Arrangement of Identical Spheres in a Simple Cubic Cell
9
Arrangement of Identical Spheres in a Body-Centered
Cubic Cell
10
Number of Atoms Per Unit Cell
1 atom/unit cell
2 atoms/unit cell
4 atoms/unit cell
(8 x 1/8 = 1)
(8 x 1/8 + 1 = 2)
(8 x 1/8 + 6 x 1/2 = 4)
11
Tipi of Cristalli
Cristalli Ionici
• Formati da cationi ed anioni
• Legame ionico
• Duri, fragili, punti di fusione elevati
• Cattivi conduttori di calore ed elettricità
CsCl
ZnS
CaF2
12
Tipi di Cristalli
Cristalli Covalenti
• Unità costituite da atomi
• Legami covalenti
• Duri, elevati punti di fusione
• Cattivi conduttori di calore ed elettricità
carbon
atoms
diamond
graphite
13
Tipi di Cristalli
Cristalli Molecolari
•
•
•
•
Unità fatte da molecole
Forze intermolecolari
Molli, bassi punti di fusione
Cattivi conduttori di calore ed elettricità
acqua
benzene
14
Tipi di Cristalli
Cristalli Metallici
• Unità costituite da atomi
• Legame metallico
• Molli o duri, punti di fusione variabili
• Buoni conduttori di calore ed elettricità
Cross Section of a Metallic Crystal
nucleus &
inner shell emobile sea
of e-
15
Fasi della Materia
I cambiamenti di fase richiedono energia
per vincere le forze intermolecolari
© Dario Bressanini
Cambi di Fase
Minor
Ordine
Maggior
Ordine
17
Transizioni di Fase
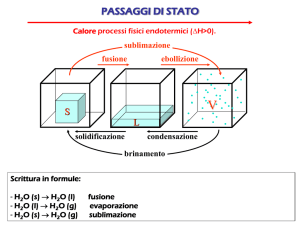
• Fusione: solido - liquido.
• Congelamento: liquido - solido.
• Vaporizzazione: solido (o liquido)
- gas. Solido - vapore viene
chiamata sublimazione.
• Condensazione: gas – liquido (o
solido). Gas - solido viene definita
deposizione.
H2O(s) → H2O(l)
H2O(l) → H2O(s)
H2O(l) → H2O(g)
o
H2O(s) → H2O(g)
H2O(g) → H2O(l)
o
H2O(g) → H2O(s)
Equilibrio Solido-Liquido
H2O (s)
H2O (l)
Il punto di fusione di un
solido (o il punto di
congelamento di un liquido)
è la temperatura in cui la
fase solida e la fase liquida
coesistono
19
Il Calore Molare di fusione (ΔHfus) è l’energia richiesta per
fondere 1 mole di una sostanza solida al suo punto di
congelamento.
20
Equilibrio Solido-Gas
H2O (s)
H2O (g)
Il Calore Molare di
sublimazione (ΔHsub) è
l’energia richiesta per
sublimare 1 mole di un
solido.
ΔHsub = ΔHfus + ΔHvap
( Legge di Hess)
21
La tensione di vapore è la pressione esercitata dal vapore
quando esiste un equilibrio dinamico fra condensazione ed
evaporazione
H2O (l)
H2O (g)
Equilibrio Dinamico
Velocità di
condensazione
=
Velocità di
evaporazione
22
Misura della Tesione di Vapore
Prima della
evaporazione
All’ Equilibrio
23
Il punto di ebollizione è la temperatura in cui la tensione di
vapore di un liquido eguaglia la pressione esterna.
24
La temperatura critica (Tc) è la temperatura sopra la quale
esiste il gas, che si distingue dal vapore perchè non può
essere liquefatto per semplice compressione.
La pressione critica
(Pc) è la pressione
minima che deve
essere applicata per
liquefare una
sostanza alla
temperatura critica.
25
Il Calore Molare di vaporizzazione (ΔHvap) è l’energia
richiesta per vaporizzare 1 mole di un liquido al punto di
ebollizione.
Equazione di Clausius-Clapeyron
P = (equilibrium) vapor pressure
ΔHvap
ln P = +C
T = temperature (K)
RT
R = gas constant (8.314 J/K•mol)
Vapor Pressure Versus Temperature
26
Forme integrate dell’ Equazione di Clausius-Clapeyron
A due temperature
o
27
Diagrammi di Fase
Un diagramma di fase mostra le fasi di una sostanza
presenti ad una certa pressione e temperatura
GAS
1atm
(VAPORE)
Liquido
Solido
LIQUIDO
Vapore
SOLIDO
O°C
© Dario Bressanini
100°C
Diagrammi di fase
• Le linee mostrano dove due fasi coesistono.
• Al punto triplo coesistono tre fasi.
• La linea Liquido/Vapore termina al punto critico
© Dario Bressanini
Punto Critico
"
Al punto critico Liquido e Gas sono indistinguibili
© Dario Bressanini
Diagrammi di Fase: Caratteristiche
"
Pendenza della linea Solido/Liquido
Ghiaccio
meno
denso dell’acqua
© Dario Bressanini
Ghiaccio secco:
più denso della CO2 liquida
Diagramma di Stato dell’Acqua
• Come variano i punti di ebollizione e
solidificazione variando la pressione?
© Dario Bressanini
Diagramma di stato dell’acqua
Come è possibile
pattinare sul Ghiaccio ?
Basta osservare il
diagramma di fase!!
© Dario Bressanini
3-D Struttura dell’Acqua
L’acqua è una Sostanza Unica
Massima Densità
4°C
Density of Water
Il ghiaccio è meno denso dell’acqua
34
Diagramma di Fase dell’Acqua
• Sono presenti:
– una fase liquida
– una fase gassosa
– varie fasi solide.
Ghiaccio
© Dario Bressanini
Acqua
Esempi di Diagrammi di Fase
Diossido di Carbonio
© Dario Bressanini
Carbonio
Fasi Metastabili
• È possibile raffreddare
l’acqua liquida sotto 0 °C, e
riscaldarla sopra i 100 °C,
mantenendola allo stato
liquido.
• La fase è metastabile, e tende
a trasformarsi,
rispettivamente, in ghiaccio o
vapore
• Si parla di liquido
superraffreddato o
superriscaldato
© Dario Bressanini