Reagente per isoenzima CK-MB
SCHEDA SINTETICA DEL PRODOTTO
Stabilità:
7 giorni a 2-8 °C
Intervallo di misurazione : fino a 1000 U/l
Tipo di campione
: siero
Metodo
:
cinetico
Preparazione del reagente : aggiungere il volume specificato
di tampone.
Simboli sulle etichette del prodotto
Rappresentante autorizzato per
l’Europa
Per uso diagnostico in vitro
Codice partita/numero lotto
Limiti di temperatura
Utilizzare entro/data di scadenza
Numero catalogo
ATTENZIONE. Consultare le
istruzioni per l’uso.
Consultare le istruzioni per l’uso
Produttore
Reagente A
Reagente B
Pericolo per la salute
USO PREVISTO
Questo reagente è destinato all’uso per la determinazione quantitativa in vitro di CK-MB
(CK-2) nel siero umano.
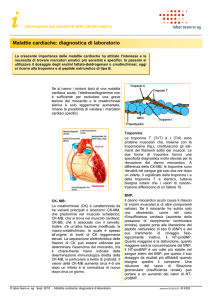
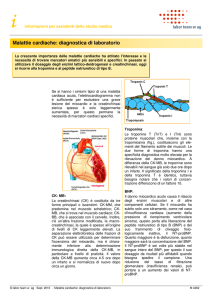
SIGNIFICATO CLINICO
La creatina chinasi (ATP: creatina N-fosfotransferasi, EC2.7.3.2) è un enzima dimerico
composto da due tipi di subunità monomeriche, M (muscolare) e B (Brain, cerebrale).
Le subunità si legano a formare tre distinti isoenzimi CK, CK-BB (CK-1), CK-MB (CK-2) e
CK-MM (CK-3). CK-MM è la forma predominante di CK nella muscolatura scheletrica. CK-BB
è presente nella muscolatura cerebrale e liscia. CK-MB ha sede in concentrazioni elevate nel
miocardio (tra il 14 e il 42%) e, in misura minore, nella muscolatura scheletrica. In assenza di
condizioni patologiche, la maggior parte dell’attività di CK è dovuta all’isoforma di CK-MM.
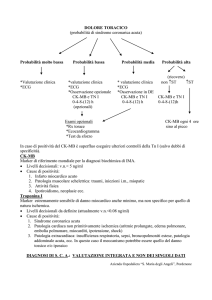
Una lesione del miocardio, analogamente a quella che si produce in caso di infarto del
miocardio acuto (IMA), determina un aumento dei livelli in circolo dell’isoforma di CK-MB.
Di norma, i livelli di CK-MB aumentano dopo 4-6 ore dall’esordio del dolore toracico,
raggiungendo il picco dopo 12-24 ore, per tornare su livelli basali nell’arco di 48 ore. In
caso di sospetto IMA, si raccomanda la determinazione dei livelli di CK-MB solitamente al
ricovero e dopo 6 ore, 12 ore e 24 ore.
Simbolo di pericolo: Pericolo per la salute
Parola di segnalazione: Pericolo
1,2
METODOLOGIA
Per la separazione e la quantificazione dei livelli di CK-MB, esiste tutta una serie di metodi
in elettroforesi e immunoinibizione. I metodi di immunoinibizione presentano il vantaggio di
essere facilmente automatizzati.
Il metodo Thermo Scientific CK-MB si basa sull’impiego di un metodo di immunoinibizione.
Il reagente contiene una miscela di anticorpi monoclonali con il monomero CK-M e, in tal
modo, inibisce interamente l’attività di CK-MM e metà dell’attività di CK-MB. L’attività
misurata è quella relativa alla subunità del monomero B inibito di CK-MB, che rappresenta
metà dell’attività di CK-MB. Il metodo presume che l’attività dell’isoenzima di CK-BB nel
siero sia essenzialmente pari a zero.
In questo metodo il siero viene aggiunto a un reagente per CK-NAC modificato, che contiene
l’anticorpo anti-M. Durante l’incubazione iniziale avvengono le seguenti reazioni:
1. CK-MM + Anticorpo ————> CK-MM inibita
CK-MB + Anticorpo ————> 50% CK-MB inibita
2. CK-B inattivata ————> NAC ————> CK-B attivata
L’attività di CK-B si determina mediante l’impiego della seguente sequenza di reazione:
CK-B
3. Creatinfosfato + Mg-ADP ————>
Creatina + ATP
HK
4. ATP + Glucosio ————> Glucosio-6-fosfato + ATP
G6PDH
5. G6P + NADPH+ ——————>
6-GP + NADPH
L’adenilato chinasi (miochinasi) è inibita da AMP e P1P5-diAP
AK // ———> AMP + ATP
6. 2ADP + NADPH+ ————
Abbreviazioni
ADP =
ATP =
HK =
G-6-P =
NADP+
=
G-6-PDH =
6-PG =
NADPH =
AMP =
AK =
P1P5-diAP=
adenosin-5’-difosfato
adenosin-5’-trifosfato
esochinasi
glucosio-6-fosfato
nicotinamide adenin dinucleotide fosfato
glucosio-6-fosfato deidrogenasi
6-fosfogluconato
NADP ridotta
adenosin-5’-monofosfato
adenilato chinasi
P1P5-di(adenosin-5’-)pentafosfato
COMPOSIZIONE DEL REAGENTE
Principi attivi
Concentrazione
Miscela di anticorpi monoclonali umani anti-CK sufficiente per inibire fino a 2000 U/l
di CK-M a 37 °C
Imidazolo acetato
100 mmol/l
AMP
5 mmol/l
NADP
2 mmol/l
1 5
P P -diAP
10 mmol/l
EDTA
2 mmol/l
Mg acetato
10 mmol/l
ADP
2 mmol/l
D-Glucosio
20 mmol/l
NAC
20 mmol/l
Creatinfosfato
30 mmol/l
Esochinasi (lievito)
>3.000 U/l
G-6PDH (Leuconostoc)
>2.000 U/l
Contiene anche cariche non reattive e stabilizzatori.
pH 7,00 ± 0,2 a 20 °C
Frasi di rischio
H360 Può compromettere la fertilità o danneggiare il feto
Indicazioni di prudenza - Prevenzione
Procurarsi le istruzioni speciali prima dell’uso
Non manipolare prima di avere letto e compreso tutte le precauzioni di sicurezza
Utilizzare dispositivi di protezione personale secondo necessità
Indicazioni di prudenza - Intervento
In caso di esposizione o dubbi, rivolgersi a un medico
Indicazioni di prudenza - Immagazzinamento
Conservare sotto chiave.
Indicazioni di prudenza - Smaltimento
Smaltire i contenitori e il contenuto in un centro autorizzato allo smaltimento dei rifiuti.
Pericoli non altrimenti classificati
Non applicabile
Tossicità non nota
Lo 0,448% della miscela consiste di ingredienti di tossicità ignota.
Altre informazioni
Nessuna informazione disponibile
Per informazioni aggiuntive, consultare la scheda dati di sicurezza del prodotto (Safety Data
Sheet, SDS).
La confezione di questo prodotto contiene gomma naturale secca. Usare cautela nella
manipolazione di fascette e fiale di vetro rotto per il rischio di lesione da contatto con bordi taglienti.
PREPARAZIONE DEL REAGENTE
Ricostituire il Reagente A con il volume di tampone, Reagente B, indicato sull’etichetta della fiala.
Agitare con cautela fino alla dissoluzione.
STABILITÀ E CONSERVAZIONE
Prima dell’uso:
Se conservato in atmosfera refrigerata a 2-8 °C, il reagente è stabile fino alla data di scadenza
indicata sul flacone e sull’etichetta della confezione del kit.
Reagente ricostituito:
Quando conservato chiuso a 2-8 °C, il reagente è stabile per almeno 7 giorni.
Indicazioni di deterioramento del reagente:
•
Torbidità,
•
Assorbanza >0,7 a 340 nm (1 cm) e o
•
Mancato recupero dei valori di controllo entro il range assegnato.
RACCOLTA E MANIPOLAZIONE DEI CAMPIONI3,4
Raccolta: In caso di sospetto IMA, si raccomanda il prelievo di campioni ematici per la
determinazione di livelli di CK-MB al ricovero e dopo 6 ore, 12 ore e 24 ore. Il numero minimo
assoluto di campioni è 2, da prelevarsi 12 e 24 ore dopo l’esordio dei sintomi.
Siero: Usare siero non emolizzato.
Plasma: Non raccomandato. L’eparina, EDTA, il fluoruro e il citrato inibiscono l’attività di CK.
Conservazione: CK è stabile per 1 giorno a 4 °C. La stabilità può tuttavia subire lievi variazioni
in base al singolo siero, in base alla distribuzione dell’isoenzima e dell’equilibrio acido-base del
paziente. In caso di periodi di conservazione superiori, congelare a -20 °C.
STRUMENTAZIONE ACCESSORIA NECESSARIA NON IN DOTAZIONE
•
Se necessarie, pipette per un’erogazione accurata dei volumi misurati.
•
Un analizzatore chimico-clinico in grado di mantenere costante la temperatura (37° C) e
misurare l’assorbanza a 340 nm.
•
Prodotti di consumo specifici per analizzatori, quali provette per campioni.
•
Materiale di controllo normale e anomalo.
PROCEDIMENTO OPERATIVO
Si consigliano i parametri di sistema elencati di seguito. Su richiesta del gruppo di supporto tecnico
sono disponibili singole applicazioni per gli strumenti.
PARAMETRI DI SISTEMA
Temperatura
Lunghezza d’onda
Tipo di dosaggio
cinetica
Rapporto campione: reagente
es.: Vol. campione
Vol. reagente
Ritardo/Tempo di latenza
Tempo lettura
Bianco del reagente
(340 nm, cammino ottico 1 cm)
30/37 °C
340 nm (334, 365 nm)
Velocità/Direzione
Incremento
1:20
10 µl
200 µl
300 secondi
300 secondi
Inferiore 0,0 AU
Superiore 0,7 AU
Linearità
Sensibilità
(340 nm, cammino ottico 1 cm)
Fino a 1000 U/l
0,15 DmA/min per U/l
3.
CALCOLI
I risultati vengono calcolati di solito automaticamente dallo strumento nel seguente modo:
Attività in U/l = DAss./min x Fattore
4.
Con questo sistema di analisi, è stata inoltre riscontrata l’interferenza da parte di isoenzimi
atipici di CK. La presenza di una forma, complesso di CK-BB e immunoglobulina G (Macro CK
di tipo 1), è più frequentemente rilevabile nella popolazione anziana femminile. La presenza
di isoenzimi atipici di CK non compromette la validità del sistema di analisi, poiché il pattern
enzimatico nel tempo mostra uno stato costante. In caso di sospetto IMA, i valori di CK-MB
aumenteranno e rientreranno nella norma nell’arco di 48 ore.6
Young DS ha pubblicato un elenco esaustivo di farmaci e sostanze che potrebbero interferire
con questo sistema di analisi.9
TV x 1000
Fattore = ——————— x 2
6,3 x SV x P
VALORI DI RIFERIMENTO10,11
CK totale A 37 °C
Uomini
A 30 °C
Uomini
in cui:
TV
=
SV = 6,3 = P
=
2
=
CK-MB
Volume totale della reazione in ml
Volume del campione in ml
coefficiente di assorbimento in millimoli di NADH a 340 nm
(Vedere nota 4).
Tracciato della cuvetta in cm.
La moltiplicazione del valore di CK-B per 2 determina
la stima dell’attività di CK-MB.
Percentuale di CK-MB:
Attività di CK-MB in % =
CK-MB U/l
————————
CK U/l totale
x
100
Esempio:
CK totale
=
350 U/l
CK-MB =
53 U/l
53 U/l
Attività di CK-MB in % = —————
x 100
350 U/l
Attività di CK-MB in % = 15%
NOTE
1. I volumi del campione e del reagente possono essere alterati proporzionalmente in
funzione dei diversi requisiti dello spettrofotometro.
2. In primo luogo occorre determinare CK totale con il reagente per CK a fiala singola
Thermo Scientific IFCC o reagente per CK IFCC a 2 fiale. Se la variazione di assorbanza
è superiore a 0,55/min, ripetere il dosaggio con siero diluito. La frazione di volume del
siero nel sistema di reazione per CK è tuttavia fondamentale. Eventuali variazioni nella
frazione di volume, come si osservano in caso di prediluizione del campione, non
producono variazioni stechiometriche nella velocità della reazione. Se è necessario
procedere alla fase di diluizione, si raccomandano 150 mmol/l di NaCl. A fronte di una
diluizione con rapporto 1:2, è previsto un incremento apparente massimo di CK pari
al 10%.5,6 In alternativa, la diluizione può inoltre essere effettuata mediante l’utilizzo
di un pool di sieri privi di CK. Il siero privo di CK può essere prodotto riscaldando il
siero a 56 °C per due ore.
3. La validità dei risultati dipende dall’accuratezza della calibrazione degli strumenti, dalle
tempistiche e dal controllo della temperatura.
4. Coefficiente di assorbimento in millimoli per NADH a 334 nm = 6,18 e a 365 nm = 3,40.
5. Conversione unità U/l x 16,67 x 10-3 = µkat/l
CALIBRAZIONE
Non richiesta. La velocità di reazione è convertita in U/l di attività mediante l’impiego di
un fattore di calcolo. Consultare la sezione relativa al calcolo di questo foglio illustrativo.
CONTROLLO QUALITÀ
Per garantire un adeguato controllo della qualità, è necessario utilizzare controlli normali
e anomali
con i valori saggiati come campioni sconosciuti:
•
Almeno una volta al giorno o secondo quanto stabilito dal laboratorio.
•
Quando si utilizza un nuovo flacone di reagente.
•
Dopo un intervento di manutenzione preventiva o di sostituzione di un componente
fondamentale del dispositivo.
Risultati dei controlli superiori o inferiori al limite superiore o inferiore degli intervalli stabiliti
sono indicativi del fatto che l’analisi potrebbe essere fuori controllo.
In tali situazioni si consigliano le seguenti azioni correttive:
•
Ripetere gli stessi controlli.
•
Se i risultati dei nuovi controlli non rientrassero
•
nei limiti, preparare un nuovo siero di controllo e ripetere il test.
•
Se i risultati su materiale di controllo nuovo persistono su valori fuori dai limiti, ripetere
il test con un nuovo reagente.
•
Qualora i risultati fossero ancora fuori controllo, contattare il servizio di assistenza
tecnica o il distributore di zona.
LIMITI
1. Sono stati condotti studi per la determinazione del livello di interferenza da emoglobina,
bilirubina e lipemia su un sistema chimico-clinico automatizzato. I risultati ottenuti
sono stati i seguenti:
Emoglobina: I campioni emolizzati sono da evitarsi al fine di ridurre al minimo
l’interferenza con l’adenilato chinasi e altri intermediari di reazione come ATP e G-6-P.7
Bilirubina: nessuna interferenza da bilirubina fino a 340 µmol/l (20 mg/dl).
Lipemia: nessuna interferenza da lipemia, con riferimento ai trigliceridi, fino
a 2,4 mmol/l (210 mg/dl).
2. CK-BB, se presente nel siero, è un potenziale fattore interferente in questo sistema di
analisi. Studi hanno dimostrato che la presenza di CK-BB nel siero si rileva soltanto
di rado.8
Fisher Diagnostics
una divisione di Fisher Scientific Company, LLC
parte di Thermo Fisher Scientific, Inc.
Middletown, VA 22645-1905 USA
Telefono:800-528-0494
540-869-3200
Fax:540-869-8132
WMDE
Bergerweg 18
6085 AT Horn
Paesi Bassi
JL840889-it (R0)
A 37 °C
A 30 °C
<200 U/l
<130 U/l
Donne
Donne
<180 U/l
<113 U/l
<25 U/l
<16 U/l
CK-MB %Un rapporto CK-MB compreso tra 6 e 25% è in linea con una diagnosi di infarto del
miocardio acuto (vedere Limite 3).
I valori citati sono rappresentativi dell’intervallo di riferimento per questo metodo e devono essere
usati a titolo puramente orientativo. Si raccomanda a ogni laboratorio di verificare l’applicabilità
di questo intervallo alla propria popolazione di pazienti e, se necessario, di determinare intervalli
di riferimento propri.
DATI SULLE PRESTAZIONI
I seguenti dati sulle prestazioni sono stati acquisiti con il reagente per CK-MB su un sistema
chimico-clinico automatizzato.
IMPRECISIONE
Il livello di imprecisione è stato valutato usando due livelli di controlli commerciali sulla base della
procedura NCCLS EP5-T12.
Intra-analisi
LIVELLO I
LIVELLO II
Numero di punti dati 80 80
Media (U/l) 37 156
SD (U/l) 1,7 2,5
CV (%) 4,6 1,6
Tra un giorno e quello successivo
LIVELLO I
LIVELLO II
Numero di punti dati 80 80
Media (U/l) 37 156
SD (U/l) 1,3 3,3
CV (%) 3,4 2,1
METODO DI CONFRONTO
Sono stati condotti studi comparati mediante l’impiego di un altro metodo disponibile in commercio
a titolo di riferimento. Sono stati analizzati campioni di siero in parallelo e i risultati confrontati con
il metodo dei minimi quadrati. Si sono ottenuti i dati statistici elencati di seguito:
Numero di coppie di campioni
66
Intervallo dei risultati dell’analisi dei campioni 4 - 227 U/l
Media dei risultati con il metodo di riferimento
45 U/l
Media dei risultati con CK-MB
44 U/l
Pendenza0,96
Intercetta
1,5 U/l
Coefficiente di correlazione
0,999
INTERVALLO DI MISURAZIONE
Se l’analisi è corretta, il dosaggio risulta lineare fino a 1000 U/l.
SPECIFICITÀ
Gli studi di inibizione condotti indicano che il reagente per l’isoenzima CK-MB ha prodotto
un’inibizione efficace superiore al 99% di tutta l’attività di CK-MM in un campione con CK-MM
da 2000 U/l.
SENSIBILITÀ ANALITICA
Se l’analisi è corretta, la sensibilità del dosaggio è 0,15 DmA/min per U/l.
BIBLIOGRAFIA
1. Bremmer FW. Cardiac disease and hypertension in “Clinical chemistry theory, analysis and
correlation.” Kaplan L and Pesce A (Ed) CV Mosby company, 1987.
2. Chapman JF, Woodard LL and Silverman LM. Creatine kinase isoenzymes in Clinical Chemistry
theory, analysis and correlation.” Kaplan L and Pesce A (Ed) CV Mosby company, 1987.
3. Bremer WF. Cardiac Disease and Hypertension in Clinical Chemistry theory, analysis and
correlation.” Kaplan L and Pesce A (Ed) CV Mosby company, 1987;28:500-501.
4. Hørder M., Elser R.C., Gerhardt W., et al. Journal of the IFCC 1989; 1:130-8.
5. Strömme JH et al. Scand. J. Clin. Lab. Invest. 1976; 36:711-23.
6. Stein W. CK-MB methods and clinical significance. Proceedings of the CK-MB symposium,
Philadelphia, 1981; 61-74.
7. Burtis CA, Ashwood ER, “Tietz textbook of Clinical Chemistry” Second Edition, 1994; 805.
8. Mattenheimer H. CK-MB methods and clinical significance. Proceedings of the CK-MB
symposium, Philadelphia, 1981; 51-59.
9. Young DS. Effects of drugs on clinical laboratory tests. Third edition, 1990; 3: 120-22.
10. Bais R, et al. Pathology 1988; 20:367-72.
11. Henderson AR et at. Clin Chem. 1992; 38/7:1365-1370.
12. National Committee for Clinical Laboratory Standards. User evaluation of Precision Performance
of Clinical Chemistry Devices. NCCLS; 1984, NCCLS Publication EP5-T.
© 2012 Thermo Fisher Scientific Inc. Tutti i diritti riservati. ILab 600 è un marchio commerciale registrato
di Instrumentation Laboratory Company, Lexington, MA 02421. Tutti gli altri marchi commerciali sono
di proprietà di Thermo Fisher Scientific Inc. e delle sue affiliate.
Informazioni per gli ordini
N. di catalogo
TR14314
20 x 5 ml
1 x 100 ml