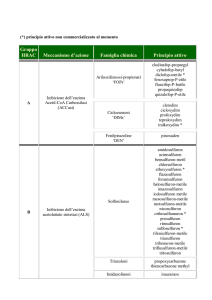
Biol. Mar. Medit. (2006), 13 (2): 322-323
P. Bandiera, F. Trombetti, V. Ventrella, M. Pirini, A.R. Borgatti, A. Pagliarani
Dipartimento di Biochimica “G. Moruzzi”, Sezione di Biochimica Veterinaria
Alma Mater Studiorum, Università di Bologna,
Via Tolara di Sopra, 50 – 40064 Ozzano Emilia (BO), Italia.
[email protected]
EFFETTO DEL TBT SULLA Mg-ATPasi
IN MITOCONDRI DI MANTELLO DI MITILO
TBT EFFECT ON MITOCHONDRIAL Mg-ATPase
OF MUSSEL MANTLE
Abstract - The in vitro effect of tributyltin (TBT) on the mitochondrial Mg-ATPase activity in the
mantle of the bivalve Mytilus galloprovincialis was investigated. Results show that Mg-ATPase can be
an organotin target, being inhibited by increasing TBT doses. A non-competitive inhibition of the enzyme
activity was found, since the Km for ATP does not change in presence of TBT, while a decrease of Vm
was observed.
Key-words: mussel, pollutants, Mg-ATPase, inhibition.
Introduzione - I composti organostannici, largamente impiegati, specie in passato,
come biocidi, costituiscono tuttora, nonostante le restrizioni normative, una possibile
minaccia per la salubrità dei prodotti ittici: essendo infatti persistenti e soggetti a bioaccumulo, tramite la catena alimentare, sono trasmissibili a diversi livelli di consumatori,
fino all’uomo (Boscolo et al., 2004). La tossicità di tali composti sembra esplicarsi a
vari livelli, tramite meccanismi d’azione diversi e non ancora completamente chiariti.
È stato pertanto condotto uno studio nel mitilo per valutare gli effetti in vitro dello
stagno tributile (TBT) sul complesso enzimatico della Mg-ATPasi mitocondriale, riportata fra i possibili bersagli dei composti organostannici (Von Ballmoos et al., 2004).
Materiali e metodi - Le preparazioni mitocondriali di mantello sono state ottenute come descritto in Trigari et al. (1992), utilizzando 5 pool di 50 animali ciascuno.
L’attività dell’ATPasi, nella sua funzione di idrolisi dell’ATP, è stata valutata dosando
il Pi liberato (Fiske e Subbarow, 1925) nel sistema di reazione (etanolammina 75 mMHCl 50 mM, pH 9,3, ATP 4 mM, MgCl2 2 mM) in presenza e assenza di oligomicina
4 µg/mL ed è espressa in µmoli di Pi×mg proteina-1×h-1. L’effetto del TBT è stato saggiato come descritto da Pagliarani et al. (2006). Il meccanismo di interazione del TBT
con l’enzima è stato studiato valutando l’attività enzimatica a concentrazioni attivanti
del substrato ATP in presenza e assenza del contaminante. È stata inoltre valutata
la capacità dell’agente riducente 1,4-ditioeritritolo (DTE) di protezione dall’inibizione
da TBT. I dati rappresentano la media di almeno tre determinazioni su preparazioni
mitocondriali distinte e riferibili a pool di animali diversi. La significatività delle differenze fra i valori di attività enzimatica in presenza e assenza di TBT è stata valutata
mediante ANOVA.
Risultati - L’attività ATPasica Mg-dipendente, oligomicina sensibile, è risultata
progressivamente inibita dalle concentrazioni di TBT saggiate nell’intervallo 0-34 µΜ,
mostrando la massima inibizione, pari a circa il 75%, alla concentrazione di contaminante di 0,6 µM.Lo studio dell’attivazione dell’enzima da parte del substrato ATP,
nell’intervallo delle concentrazioni 0,2-4,0 mM, in presenza e in assenza della concentrazione di TBT 0,17 µΜ, che causa un'inibizione dell'enzima rilevante e prossima al
60%, ha consentito di evidenziare il meccanismo di inibizione del contaminante. L'elaborazione cinetica dei dati mostra infatti che il valore di Km 1,7 mM, ottenuto per
323
l'attivazione da parte dell'ATP in assenza di TBT, rimane pressoché invariato anche
in presenza del contaminante (Km=1,4 mM). In presenza di TBT si osserva invece
una diminuzione della velocità massima ottenibile, evidenziata dai valori di Vm di
31,1 e 16,7 µmoli di Pi×mg proteina-1×h-1, rispettivamente in assenza e in presenza di
TBT. I risultati ottenuti indicano che l’inibitore e il substrato si legano in siti distinti
dell’enzima, evidenziando quindi per il TBT un meccanismo di inibizione di tipo non
competitivo. L’agente riducente DTE, riportato in grado di prevenire l’inibizione da
parte di organostannici mantenendo in forma ridotta i gruppi -SH della proteina enzimatica (Ohno et al., 2005), alle due concentrazioni saggiate di 10 e 50 µΜ, non ha
impedito l'inibizione esercitata dal TBT, sia quando immesso direttamente nel sistema
di reazione, sia quando incubato preventivamente con i mitocondri. In entrambi i casi,
infatti, il TBT alla concentrazione di 0,6 µΜ esercita ancora la massima inibizione
osservata.
Conclusioni - La Mg-ATPasi mitocondriale, è risultata un possibile bersaglio del
TBT, essendo inibita da concentrazioni crescenti dello stesso. I parametri cinetici, in
particolare, hanno evidenziato per il TBT un meccanismo di inibizione di tipo non
competitivo. A differenza di quanto osservato precedentemente per la Na,K-ATPasi
(dati non mostrati), il DTE non è in grado di proteggere l’enzima dall’azione del TBT,
facendo quindi ipotizzare in questo caso un meccanismo di interazione diverso. I risultati ottenuti sono in accordo con quanto riportato in letteratura sia per quanto concerne l’entità dell’inibizione massima osservata (70-80%), sia per quanto riguarda il
sito di interazione del TBT con l’enzima che, secondo alcuni autori, sarebbe localizzato
nella subunità a di F0 e quindi distinto da quello dell’ATP (Von Ballmoos et al., 2004;
Ueno et al., 2005).
Bibliografia
BOSCOLO R., CACCIATORE F., BERTO D., NARIN M.G., GIANI M. (2004) - Contamination of
natural and cultured mussels (Mytilus galloprovincialis) from the northern Adriatic Sea by tributyltin and dibutyltin compounds. Applied Organometallic Chemistry, 18: 614-618.
FISKE J.L., SUBBAROW Y. (1925) - The colorimetric determination of phosphorus. JBC., 66: 375-400.
OHNO S., NAKAJIMA Y., NAKAJIN S. (2005) - Triphenyltin and Tributyltin inhibit pig testicular 17β−hydroxysteroid dehydrogenase activity and suppress testicular testosterone biosynthesis.
Steroids, 70: 645-651.
PAGLIARANI A., BANDIERA P., VENTRELLA V., TROMBETTI F., PIRINI M., BORGATTI
A.R. (2006) - Response to alkyltins of two Na+-dependent ATPase activities in Tapes philippinarum
and Mytilus galloprovincialis. Toxicology in vitro: (in stampa).
TRIGARI G., PIRINI M., VENTRELLA V., PAGLIARANI A., TROMBETTI F., BORGATTI
A.R. (1992) - Lipid composition and mitochondrial respiration in warm- and cold-adapted sea
bass. Lipids, 27: 371-377.
UENO H., SUZUKI T., KINOSITA K.Jr., YOSHIDA M. (2005) - ATP-driven stepwise rotation of
F0F1-ATP synthase. PNAS, 102 (5): 1333-1338.
VON BALLMOOS C., BRUNNER J., DIMROTH P. (2004) - The ion channel of F-ATP synthase is
the target of toxic organotin compounds. PNAS, 101 (31): 11239-11244.