Capitolo 245 Virus della varicella-zoster n 1161
Capitolo 245
Virus della varicella-zoster
Philip S. LaRussa e Mona Marin
Il virus della varicella-zoster (VZV) causa infezioni primarie, latenti
e ricorrenti. L’infezione primitiva si manifesta come varicella e
determina lo stabilirsi di un’infezione latente dei neuroni sensitivi
gangliari che dura tutta la vita. La riattivazione dell’infezione
latente causa l’herpes zoster (fuoco di Sant’Antonio). Anche se
spesso la varicella è una malattia lieve nell’infanzia, può causare
una sostanziale morbilità e mortalità in bambini altrimenti sani;
essa causa un’aumentata morbilità e mortalità nei lattanti, negli
adolescenti, negli adulti immunocompetenti e nei soggetti immunocompromessi e predispone a infezioni severe da streptococco
di gruppo A e da Staphylococcus aureus. La varicella e l’herpes
zoster possono essere trattati, se necessario, con farmaci antivirali.
L’infezione iniziale può essere prevenuta mediante vaccinazione
con VZV vivo attenuato (vaccino della varicella). Un vaccino
specifico contro l’herpes zoster (vaccino zoster), contenente lo
stesso ceppo di VZV utilizzato nel vaccino della varicella sebbene
più potente, è raccomandato per i soggetti ≥60 anni di età al
fine di stimolarne l’immunità al VZV e ridurre così l’incidenza
dell’herpes zoster e della sua principale complicanza, la nevralgia
posterpetica dolorosa.
EZIOLOGIA
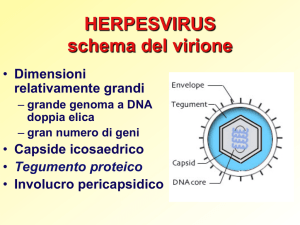
VZV è un herpes virus neurotropo umano che somiglia al virus
herpes simplex, che è anche un a-herpes virus. Questi virus possiedono un involucro e un genoma di DNA a doppio filamento che
codifica più di 70 proteine, di cui alcune sono bersagli dell’immunità cellulare e umorale.
EPIDEMIOLOGIA
Prima dell’introduzione del vaccino nel 1995, la varicella era una
malattia infettiva trasmissibile dell’infanzia, quasi universale negli Stati Uniti. La maggior parte dei bambini si infettava entro i
15 anni di età e meno del 5% degli adulti rimaneva suscettibile.
In tutti i Paesi a clima temperato, l’infezione compare caratteristicamente in giovane età. Nelle aree tropicali, la varicella compare
in soggetti più grandi e molti casi si registrano fra gli adulti. Negli
Stati Uniti, epidemie annuali di varicella si verificavano in inverno
e primavera, con circa 4 milioni di casi, 11.000-15.000 ricoveri
e 100-150 decessi ogni anno. La varicella è una malattia severa
con tassi elevati di complicanze e decessi nei lattanti, negli adulti
e nei soggetti immunocompromessi. All’interno delle famiglie, la
trasmissione del VZV agli individui suscettibili si verifica a un tasso
del 65-86%; un contatto più casuale, come quello che avviene
in una classe scolastica, si associa a tassi di attacco minori nei
bambini suscettibili. I pazienti con varicella sono contagiosi da 2448 ore prima della comparsa del rash e fino a quando le vescicole
hanno formato le croste, di solito 3-7 giorni dopo l’esordio del
rash. I bambini suscettibili possono inoltre acquisire la varicella
in seguito a un contatto stretto e diretto con adulti o bambini con
herpes zoster.
A partire dall’implementazione del programma vaccinale per
la varicella, consistente nella somministrazione di una sola dose
del vaccino, vi è stato un sostanziale declino della morbilità e
della mortalità di questa malattia negli Stati Uniti. Nel 2005, la
copertura vaccinale aveva raggiunto il 90% e i casi di varicella
erano diminuiti del 90-91% rispetto al 1995 nei luoghi dove era
stata condotta una sorveglianza attiva. Nel 2002, i ricoveri per
varicella erano diminuiti dell’88% rispetto al 1994 e al 1995. Tra
il 1990-1994 e il 2003-2005 i decessi erano diminuiti dell’87%;
tra i soggetti <20 anni di età erano scesi del 96%. Morbilità e
mortalità sono declinate in tutti i gruppi di età, compresi i bambini
<12 mesi di età che sono protetti dall’esposizione in seguito agli
effetti indiretti della vaccinazione. Sebbene l’incidenza sia diminuita
per tutti i gruppi di età, i casi di varicella si osservano ora principalmente in bambini della scuola elementare superiore più che in
età prescolare. Il cambiamento dell’epidemiologia della varicella
sottolinea l’importanza di offrire il vaccino a tutti i bambini, gli
adolescenti e gli adulti suscettibili.
Il fatto che continuino a manifestarsi infezioni anche tra soggetti
vaccinati, anche se di solito lievi, ha spinto nel 2006 all’adozione
di un programma vaccinale di routine per la varicella che prevede
la somministrazione di 2 dosi del vaccino a tutti i bambini privi di
evidenza di immunità verso la malattia, a prescindere dall’età.
L’herpes zoster è causato dalla riattivazione di un VZV latente.
Non è frequente nell’infanzia e la sua incidenza non ha una variazione stagionale. L’esposizione a un paziente con varicella non
rientra tra i fattori scatenanti dell’herpes zoster; l’esposizione alla
varicella, infatti, stimola la risposta immunitaria cellulo-mediata al
VZV nei soggetti precedentemente infettati, riducendo la probabilità che il virus latente si riattivi. Il rischio per tutta la vita di herpes
zoster per gli individui con un’anamnesi di varicella è del 10-20%
e il 75% dei casi si verifica dopo i 45 anni di età. L’herpes zoster
è molto raro nei bambini sani <10 anni di età, eccetto in quelli
infettati in utero o nel 1° anno di vita, che sono maggiormente a rischio di sviluppare la malattia nei primi anni di vita. L’herpes zoster
nei bambini tende a essere più lieve della malattia negli adulti ed è
meno frequentemente associato a nevralgia posterpetica. Tuttavia,
l’herpes zoster si verifica più frequentemente, occasionalmente
più volte, e può essere severo nei bambini trattati con terapia
immunosoppressiva per neoplasie maligne o altre malattie e in
quelli con infezione da HIV. Il vaccino specifico contro l’herpes
zoster, raccomandato per gli adulti a partire dai 60 anni di età,
riduce l’incidenza sia dell’herpes zoster sia della sua complicanza
più frequente, la nevralgia posterpetica.
Il VZV attenuato presente nel vaccino della varicella può stabilire un’infezione latente e riattivarsi come herpes zoster. Tuttavia,
nei bambini immunocompromessi, il rischio di sviluppare successivamente un herpes zoster è minore con il virus vaccinico che con
l’infezione naturale da VZV. I dati disponibili dopo l’approvazione
del vaccino suggeriscono la stessa tendenza nei vaccinati sani.
PATOGENESI
Il VZV si trasmette con le secrezioni respiratorie e con il liquido
delle lesioni cutanee, per diffusione aerea o per contatto diretto.
L’infezione primitiva (varicella) deriva dall’inoculo del virus sulla
mucosa delle vie respiratorie superiori e del tessuto linfoide tonsillare. Durante la prima parte del periodo di incubazione di 10-21 giorni, il virus si replica nel tessuto linfoide locale con una successiva
viremia subclinica di breve durata che diffonde il virus al sistema
reticoloendoteliale. Le lesioni cutanee diffuse si verificano durante
una seconda fase viremica che dura 3-7 giorni. Le cellule mononucleate del sangue periferico trasportano il virus infettante generando
nuovi gruppi di vescicole durante questo periodo di viremia. Il
VZV è trasportato anche a ritroso alle mucose delle vie respiratorie
superiori e alla mucosa orofaringea nel corso dell’ultima parte
del periodo di incubazione, permettendo la diffusione ai contatti
suscettibili 1-2 giorni prima della comparsa del rash. Le risposte
immunitarie dell’ospite limitano la replicazione virale e facilitano
la guarigione dall’infezione. Nel bambino immunocompromesso, le
mancate risposte immunitarie, specialmente quelle cellulo-mediate,
determinano una continua replicazione virale che può causare
un’infezione disseminata con complicanze a livello polmonare,
epatico, cerebrale e di altri organi. Il virus viene trasportato in
modo retrogrado attraverso gli assoni sensitivi ai gangli delle radici
dorsali lungo il midollo spinale, dove stabilisce un’infezione latente
nei neuroni e nelle cellule satelliti associati a questi assoni. La
successiva riattivazione del virus latente causa l’herpes zoster, un
rash vescicolare che di solito ha una disposizione dermatomerica.
1162 n Parte XVII Malattie infettive
Figura 245.1 A. Negli individui non
vaccinati, le lesioni della varicella mostrano
una caratteristica distribuzione in gruppi,
o si presentano in cluster; la presenza
in contemporanea di lesioni in vari stadi
di evoluzione è caratteristica della varicella.
B. Le lesioni della varicella nei soggetti vaccinati
sono prevalentemente maculopapulose
e le vescicole sono meno frequenti; la malattia
è generalmente lieve con <50 lesioni.
(A. Per gentile concessione dei Centers
for Disease Control and Prevention [CDC];
B. Per gentile concessione dei CDC
e del Dr. John Noble, Jr.)
Nel corso della malattia, possono verificarsi alterazioni necrotiche
nei gangli associati. Le lesioni cutanee della varicella e dell’herpes
zoster sono istopatologicamente identiche e in entrambe è presente
il VZV infettante. La varicella stimola un’immunità umorale e
cellulo-mediata che è altamente protettiva contro la reinfezione
sintomatica. La soppressione dell’immunità cellulo-mediata al
VZV è correlata a un rischio aumentato di riattivazione del VZV
come herpes zoster.
MANIFESTAZIONI CLINICHE
La varicella è una malattia esantematica acuta che era comune
nei bambini prima del programma di vaccinazione universale
nell’infanzia. Ha una severità variabile, ma di solito è autolimitata.
Può essere associata a complicanze severe, tra cui sovrainfezione
stafilococcica e streptococcica, polmonite, encefalite, disordini
emorragici, infezione congenita e un’infezione perinatale potenzialmente fatale. L’herpes zoster, infrequente nei bambini, causa
sintomi cutanei localizzati, ma può disseminarsi nei pazienti immunocompromessi.
Varicella
La malattia di solito inizia 14-16 giorni dopo l’esposizione, anche
se il periodo di incubazione può variare da 10 a 21 giorni. La
varicella subclinica è rara; quasi tutti i soggetti suscettibili esposti
presentano un rash. Possono essere presenti sintomi prodromici, in
particolare nei bambini più grandi e negli adulti. Febbre, malessere,
anoressia, cefalea e occasionalmente dolore addominale di lieve
entità possono presentarsi 24-48 ore prima della comparsa del
rash. L’aumento della temperatura è di solito moderato, da 38 a
39 °C circa, ma può giungere anche a 41 °C; febbre e altri sintomi
sistemici persistono durante i primi 2-4 giorni dopo l’esordio del
rash.
Le lesioni della varicella spesso appaiono dapprima sul cuoio
capelluto, sul viso o sul tronco. L’esantema iniziale consiste in macule eritematose intensamente pruriginose che evolvono attraverso
uno stadio papuloso per formare vescicole chiare piene di liquido.
In 24-48 ore compaiono intorbidamento e un’ombelicatura centrale delle lesioni. Mentre le lesioni iniziali formano una crosta, si
formano nuovi gruppi di lesioni sul tronco e quindi sulle estremità;
la simultanea presenza di lesioni in vari stadi di evoluzione è caratteristica della varicella (Fig. 245.1). La distribuzione del rash è
prevalentemente centrale o centripeta, al contrario del vaiolo, in cui
il rash è più evidente sul viso e sulle estremità distali. Sono comuni
anche lesioni ulcerative della mucosa orofaringea e vaginale; molti
bambini hanno lesioni vescicolari sulle palpebre e sulla congiuntiva, ma l’interessamento corneale e in generale una malattia oculare
severa sono rari. Il numero medio di lesioni della varicella è di
circa 300, ma i bambini sani possono averne da meno di 10 a più
di 1.500. Nei casi derivanti da diffusione secondaria all’interno di
una famiglia e nei bambini più grandi, si verificano di solito più
lesioni e nuovi gruppi di vescicole possono continuare a svilupparsi
per un periodo di tempo più prolungato. L’esantema può essere più
esteso nei bambini con patologie cutanee, come eczema o ustioni
recenti. Un’ipopigmentazione o un’iperpigmentazione delle aree
sedi di lesioni può persistere per un periodo variabile tra giorni
e settimane in alcuni bambini, ma cicatrici severe sono insolite a
meno che le lesioni presentino un’infezione secondaria.
La diagnosi differenziale della varicella comprende rash vescicolari causati da altri agenti infettivi virali, come virus herpes
simplex, enterovirus, vaiolo delle scimmie, rickettsiosi (rickettsial
pox) o S. aureus; da reazioni ai farmaci; da herpes zoster disseminato; da dermatite da contatto e da morsi di insetti. Prima
dell’eradicazione del vaiolo, la varicella severa era la malattia più
comunemente confusa con il vaiolo.
Varicella in individui vaccinati
Una dose di vaccino è efficace in >97% dei casi nel prevenire una
varicella severa e più frequentemente ha un’efficacia dell’85%
circa (range: 44-100%) nel prevenire tutti i tipi di malattia dopo
esposizione a VZV wild-type. Ciò significa che in seguito a un’esposizione ravvicinata al VZV, come può avvenire in ambito domestico o nel corso di un’epidemia a scuola o alla scuola materna, 1
bambino su 5 a cui è stata somministrata una dose di vaccino può
sviluppare varicella. L’esposizione al VZV può inoltre determinare
un’infezione asintomatica nel bambino precedentemente vaccinato.
Al contrario, la malattia in soggetti vaccinati è una varicella che
si verifica in un soggetto vaccinato >42 giorni prima dell’esordio
del rash ed è causata dal VZV di tipo wild-type. Nelle fasi iniziali
del programma vaccinale per la varicella, un rash che si presentava
nelle prime 2 settimane dopo la vaccinazione era più comunemente
dovuto al VZV wild-type ed era indicativo di un’esposizione al
virus avvenuta prima che il vaccino potesse avere effetto. Il rash
che si presentava 2-6 settimane dopo la vaccinazione poteva essere dovuto al virus vaccinico o al virus wild-type. Con il continuo
declino dei casi di varicella, i rash nell’intervallo di 0-42 giorni
dopo la vaccinazione sono causati meno frequentemente dal VZV
wild-type. Il rash della varicella in soggetti vaccinati è frequentemente atipico, prevalentemente maculopapuloso, le vescicole sono
meno frequenti e la malattia è più comunemente lieve con <50
lesioni, rash di minore durata, meno complicanze e febbre scarsa
o assente. Ciononostante, il 25-30% circa dei casi di varicella in
soggetti vaccinati non sono affatto lievi e presentano caratteristiche
cliniche simili all’infezione da virus wild-type. I casi di varicella
in soggetti vaccinati sono meno contagiosi delle infezioni da virus
wild-type in ambito familiare, ma la loro contagiosità è direttamente proporzionale al numero di lesioni: i casi tipici in soggetti
vaccinati (<50 lesioni) sono contagiosi nella misura di circa 1/3
rispetto ai casi non vaccinati, mentre i casi in soggetti vaccinati
con ≥50 lesioni sono contagiosi come i casi da virus wild-type.
Pertanto, i bambini vaccinati che presentano varicella devono essere considerati potenzialmente infettivi ed esclusi dalla scuola fino
Capitolo 245 Virus della varicella-zoster n 1163
alla formazione delle croste o, se non sono presenti vescicole, fino a
quando cessa la formazione di nuove lesioni. È stata documentata
la trasmissione della varicella da soggetti che erano stati vaccinati
in ambito familiare, nelle scuole materne e nelle scuole.
L’efficacia del regime di vaccinazione a 2 dosi è stata oggetto di
un numero inferiore di studi. Secondo uno studio clinico, l’efficacia
di tale regime nel prevenire tutti i tipi di malattia è pari al 98%.
Sono stati segnalati casi di varicella in soggetti ai quali erano state
somministrate 2 dosi del vaccino, ma in generale chi ha ricevuto 2
dosi del vaccino è meno a rischio di contrarre la malattia rispetto
a chi ne ha ricevuta solo una.
Varicella progressiva
La varicella progressiva, con interessamento degli organi viscerali,
coagulopatia, emorragie severe e continuo sviluppo di nuove lesioni
vescicolari, è una temuta complicanza dell’infezione primitiva da
VZV. Questa può essere preannunciata da dolore addominale
severo, che può riflettere l’interessamento dei linfonodi mesenterici o del fegato, o dalla comparsa di vescicole emorragiche in
adolescenti e adulti altrimenti sani, bambini immunocompromessi,
donne gravide e neonati. Anche se raro nei bambini sani, il rischio
di varicella progressiva è più elevato nei bambini con patologie
da immunodeficienza cellulare congenita e in quelli con neoplasia
maligna, particolarmente se è stata somministrata la chemioterapia nel periodo di incubazione e la conta leucocitaria assoluta è
<500 cellule/mm3. Il tasso di mortalità nei bambini con varicella
acquisita in corso di trattamento per una neoplasia maligna e che
non sono stati trattati con terapia antivirale si avvicina al 7%; i
decessi correlati a varicella si verificano entro 3 giorni dalla diagnosi di polmonite varicellosa. Anche i bambini che contraggono
la varicella dopo trapianto di organo sono a rischio di infezione
progressiva da VZV. I bambini in terapia a lungo termine con
corticosteroidi sistemici a basso dosaggio non sono considerati
a rischio più elevato di varicella severa, ma nei pazienti trattati
con corticosteroidi ad alte dosi si verifica una varicella progressiva che è stata riportata in soggetti trattati con corticosteroidi
inalatori come anche in asmatici trattati con cicli brevi multipli
di corticosteroidi sistemici. Caratteristiche cliniche insolite della
varicella, comprese lesioni che sviluppano un peculiare aspetto
ipercheratosico e una continua formazione di nuove lesioni per
settimane o mesi, sono state descritte nei bambini con infezione da
HIV in stadio avanzato non trattata. La vaccinazione dei bambini
con infezione da HIV con conta dei linfociti T CD4+ ≥15% e dei
bambini con leucemia e neoplasie degli organi solidi in remissione
in cui la chemioterapia di mantenimento può essere interrotta per
2 settimane durante il periodo di vaccinazione o è già terminata,
ha ridotto questo problema. A partire dall’avvento del programma
vaccinale universale, molti bambini risultano protetti prima che la
malattia o il trattamento possano indurre uno stato di immunocompromissione in età più avanzata; inoltre, in conseguenza della
sua ridotta incidenza, i bambini immunocompromessi hanno una
minore probabilità di essere esposti alla varicella.
Varicella neonatale
I neonati hanno una mortalità particolarmente elevata quando una
madre suscettibile contrae la varicella nel peripartum. I neonati la
cui madre sviluppa una varicella nel periodo da 5 giorni prima del
parto a 2 giorni dopo sono ad alto rischio di varicella severa. Il
bambino acquisisce l’infezione per via transplacentare in seguito
alla viremia materna, che può verificarsi fino a 48 ore prima del
rash materno. A seconda di quando il virus attraversa la placenta, il
rash del bambino può verificarsi verso la fine della 1ª settimana fino
ai primi giorni della 2ª settimana di vita (anche se può verificarsi
già dopo 2 giorni). Poiché la madre non ha ancora sviluppato
una risposta anticorpale significativa, il bambino riceve un carico
virale elevato senza gli effetti moderatori degli anticorpi materni
anti-VZV. Se la madre sviluppa una varicella >5 giorni prima del
parto, può ancora passare il virus al figlio nascituro, ma l’infezione
è attenuata dalla trasmissione di anticorpi materni attraverso la
placenta. Questo effetto moderatore degli anticorpi materni si
verifica se il parto avviene dopo la 30ª settimana di gestazione
quando le IgG materne sono in grado di attraversare la placenta.
Le raccomandazioni per la somministrazione di immunoglobuline
umane per la varicella-zoster (VariZIG) riflettono i differenti rischi
per il neonato esposto. I neonati le cui madri sviluppano la varicella
da 5 giorni prima a 2 giorni dopo il parto devono ricevere 1 fiala
di VariZIG il prima possibile. Anche se la varicella neonatale può
verificarsi in circa la metà di questi bambini nonostante la somministrazione delle VariZIG, è di solito lieve. Ogni neonato prematuro
nato a <28 settimane di gestazione da madre con varicella attiva al
momento del parto (anche se il rash materno è stato presente per
>1 settimana) deve ricevere le VariZIG. Qualora le VariZIG non
siano disponibili, si può ricorrere alle immunoglobuline endovenose
(IVIG), sebbene i titoli anticorpali specifici per la varicella possono
variare da lotto a lotto. Poiché la varicella acquisita nel peripartum
può essere fatale, il neonato deve essere trattato con aciclovir
(10 mg/kg ogni 8 ore ev) quando compaiono le lesioni. La varicella
neonatale può inoltre fare seguito a un’esposizione post partum di
un neonato partorito da una madre suscettibile al VZV, anche se
la frequenza di complicanze declina rapidamente nelle settimane
successive alla nascita. Anche i neonati con varicella acquisita in
comunità che sviluppano una varicella severa, specialmente quelli
che sviluppano complicanze quali polmonite, epatite o encefalite,
devono essere trattati con aciclovir ev (10 mg/kg ogni 8 ore). I
neonati con varicella neonatale che ricevono un’immediata terapia
antivirale hanno una prognosi eccellente.
Sindrome della varicella congenita
Il VZV può essere trasmesso in utero; ciononostante, poiché la
maggior parte degli adulti in aree a clima temperato è immune,
è raro che una gravidanza possa essere complicata da varicella.
Quando una donna gravida contrae la varicella nelle prime fasi della gravidanza, gli esperti stimano che almeno il 25% dei feti possa
infettarsi. Fortunatamente, una malattia clinicamente evidente nel
neonato è infrequente: un’embriopatia da VZV si osserva in circa
lo 0,4% dei feti le cui madri hanno avuto la varicella prima della
13ª settimana di gestazione e in circa il 2% di quelli le cui madri
hanno avuto la varicella tra la 13ª e la 20ª settimana di gestazione.
Prima dell’introduzione del vaccino per la varicella negli Stati Uniti,
si stimavano 44 casi di sindrome della varicella congenita ogni
anno. Tale sindrome è caratterizzata da lesioni cutanee cicatriziali
con distribuzione analoga a quella dell’herpes zoster, ipoplasia
degli arti e anomalie neurologiche (ad es. microcefalia, atrofia
corticale, convulsioni e ritardo mentale), oculari (corioretinite,
macroftalmia e cataratte), renali (idrouretere e idronefrosi) e del
sistema nervoso autonomo (vescica neurogena, disturbo della
deglutizione e polmonite da aspirazione). La maggior parte delle
stigmate può essere attribuita al danno indotto dal virus a carico
del sistema nervoso, anche se non esiste un’evidente spiegazione del
perché certe regioni del corpo siano infette in modo preferenziale
nel corso dell’infezione fetale da VZV. La lesione cutanea caratteristica è stata denominata come cicatrice a zigzag con distribuzione
dermatomerica, spesso associata ad atrofia dell’arto affetto (Fig.
245.2). Molti neonati con manifestazioni severe di sindrome della
varicella congenita (atrofia e cicatrizzazione di un arto) hanno
deficit neurologici significativi.
I casi riportati di anomalie fetali conseguenti allo sviluppo
di herpes zoster nella madre sono rari e non è chiaro se siano
realmente rappresentativi della sindrome della varicella congenita.
La sindrome della varicella congenita conseguente a herpes zoster
materno è estremamente rara.
La diagnosi di fetopatia da VZV si basa soprattutto sull’anamnesi di varicella in corso di gravidanza associata alle stigmate
osservate nel feto. Il virus non può essere coltivato nel neonato
affetto, ma può essere identificato DNA virale con la PCR in
campioni di tessuti. Alcuni neonati hanno IgM specifiche antiVZV nel sangue del cordone ombelicale, anche se il titolo delle
IgM declina rapidamente dopo il parto e può essere positivo in
1164 n Parte XVII Malattie infettive
Figura 245.3 Herpes zoster che interessa il dermatomero lombare. (Da Mandell GL,
Bennett JE, Dolin R [editors]: Principles and practice of infectious diseases, 6th ed, Vol 2,
Philadelphia, 2005, Elsevier, p 1783.)
Figura 245.2 Neonato con sindrome della varicella congenita. Il bambino aveva severe
malformazioni di entrambe le estremità inferiori e cicatrici in corrispondenza della parte
sinistra dell’addome.
modo non specifico. Sono stati utilizzati l’esame dei villi coriali e
il prelievo di sangue fetale per la ricerca del DNA virale, del virus
o degli anticorpi nel tentativo di diagnosticare l’infezione fetale
e l’embriopatia. L’utilità di questi esami per il trattamento del
paziente e per il counseling non è stata definita. Poiché questi esami
possono non distinguere tra infezione e malattia, la loro utilità può
essere primariamente quella di fornire una rassicurazione quando
i risultati sono negativi. Un titolo anticorpale di IgG anti-VZV
persistentemente positivo dopo i 12-18 mesi di età è un indicatore
affidabile di infezione prenatale nel bambino asintomatico, così
come lo sviluppo dello zoster nel 1° anno di vita senza evidenze
di infezione postnatale.
Anche se le immunoglobuline per la varicella vengono spesso somministrate alla madre suscettibile esposta alla varicella,
è incerto se ciò modifichi l’infezione nel feto. Allo stesso modo,
può essere effettuato il trattamento con aciclovir nella madre con
varicella severa. Un registro prospettico dell’uso di aciclovir nel
1° trimestre ha dimostrato che l’incidenza di difetti alla nascita si
avvicina a quella osservata nella popolazione generale. L’aciclovir
è un farmaco di classe B per l’uso in gravidanza e il suo impiego
dovrebbe essere limitato ai soli casi in cui i benefici per la madre
superino i rischi potenziali per il feto. L’efficacia del trattamento
con aciclovir delle donne gravide nel prevenire o modificare la
severità della varicella congenita non è nota; tale trattamento deve
però essere preso in considerazione per proteggere la madre da
una malattia severa. Infine, poiché il danno causato dall’infezione
fetale da VZV non progredisce nel post partum, il trattamento dei
neonati con sindrome da VZV congenita non è indicato.
Herpes zoster
L’herpes zoster si manifesta sotto forma di lesioni vescicolari raggruppate all’interno di 1 o, meno comunemente, 2 dermatomeri
adiacenti (Fig. 245.3). Nell’anziano, l’herpes zoster caratteristicamente inizia con dolore urente seguito dalla comparsa di gruppi di
lesioni cutanee con disposizione dermatomerica. Quasi la metà degli anziani con herpes zoster sviluppa complicanze; la complicanza
più frequente è la nevralgia posterpetica, una condizione dolorosa
che colpisce i nervi nonostante la risoluzione delle lesioni cutanee
dell’herpes zoster. A differenza dell’herpes zoster degli adulti, nei
bambini questo è infrequentemente associato a dolore, iperestesia e
Figura 245.4 Gruppi di vescicole sul braccio di un bambino con herpes zoster.
(Da Weston WL, Lane AT, Morelli JG: Color textbook of pediatric dermatology, 3rd ed,
Philadelphia, 2002, Mosby, Fig. 8-28.)
prurito localizzati e a febbre di basso grado. Nei bambini, il rash è
lieve, con nuove lesioni che appaiono per alcuni giorni, i sintomi di
neurite acuta sono minimi e la risoluzione completa si verifica entro
1-2 settimane. Al contrario degli adulti, la nevralgia posterpetica
è molto rara nei bambini. Il 4% circa dei pazienti presenta un 2°
episodio di herpes zoster, mentre sono rari 3 o più episodi. La
mielite trasversa con paralisi transitoria è una rara complicanza
dell’herpes zoster. Un aumento del rischio di herpes zoster precoce
nel corso dell’infanzia è stato descritto in bambini che contraggono
la varicella in utero o nel 1° anno di vita (Fig. 245.4).
I soggetti immunocompromessi possono avere un herpes zoster
più severo, simile a quello degli adulti, compresa la nevralgia posterpetica. I pazienti immunocompromessi possono anche presentare una malattia cutanea disseminata che simula la varicella, come
anche disseminazione viscerale con polmonite, epatite, encefalite
e coagulazione intravascolare disseminata. I bambini severamente
immunocompromessi, in particolare quelli con infezione da HIV
avanzata, possono presentare non frequentemente una malattia
cutanea cronica o ricorrente, una retinite o un interessamento del
sistema nervoso centrale (SNC) senza rash. Un rischio minore di
herpes zoster in bambini vaccinati con leucemia rispetto a quelli
che hanno avuto la varicella suggerisce che il virus del vaccino
della varicella si riattivi meno frequentemente del VZV wild-type.
Il rischio di herpes zoster in bambini sani vaccinati può essere più
basso che nei bambini che hanno avuto varicella da virus wildtype, anche se sono necessari molti più anni di follow-up per la
conferma.
Capitolo 245 Virus della varicella-zoster n 1165
DIAGNOSI
La valutazione di laboratorio non è stata considerata necessaria per
la diagnosi o il trattamento dei bambini sani con varicella o herpes
zoster. Tuttavia, con il declino dell’incidenza della malattia, può essere necessaria la conferma di laboratorio di tutti i casi di varicella.
La natura atipica della varicella nei soggetti vaccinati, con una più
elevata percentuale di rash papulosi piuttosto che vescicolari, pone
problemi diagnostici. Inoltre, i casi severi di varicella, per essere
distinti dalle infezioni da virus del vaiolo, possono richiedere la
conferma virologica.
Nelle prime 72 ore è tipica una leucopenia: segue una linfocitosi relativa e assoluta. Anche i risultati dei test di funzionalità
epatica sono di solito (75%) leggermente elevati. I pazienti con
complicanze neurologiche della varicella o con herpes zoster non
complicato hanno una lieve pleiocitosi linfocitica e un aumento
da leggero a moderato delle proteine del liquido cerebrospinale; la
concentrazione di glucosio è di solito normale.
La diagnosi rapida di laboratorio è importante: lo è spesso nei
pazienti ad alto rischio e talvolta per il controllo dell’infezione.
La conferma della varicella (o virus herpes simplex) può essere
ottenuta presso la maggior parte dei laboratori ospedalieri di
riferimento e presso tutti i laboratori statali. Il VZV può essere
identificato con il test dell’immunofluorescenza diretta sulle cellule
delle lesioni cutanee (liquido vescicolare) in 15-20 minuti, con
coltura rapida con colorazione di immunofluorescenza (tecnica
shell vial) in 48-72 ore e con la PCR (liquido vescicolare, croste)
in 2 ore o alcuni giorni, secondo la disponibilità. Anche se cellule
giganti multinucleate possono essere osservate con le colorazioni
non specifiche (striscio di Tzanck), queste hanno una scarsa sensibilità e non distinguono il VZV dalle infezioni da virus herpes
simplex. Il virus infettante può essere isolato mediante metodiche
di coltura su tessuti la cui applicazione richiede una competenza
specifica; il tempo necessario per la coltura può variare da giorni a
settimane. Le IgG anti-VZV possono essere identificate con diverse
metodiche e anche un aumento di 4 volte o superiore delle IgG
conferma un’infezione acuta. Il dosaggio delle IgG anti-VZV può
essere utile anche per determinare lo stato immunitario degli individui la cui storia clinica per la varicella è sconosciuta o equivoca.
La ricerca delle IgM anti-VZV non è utile ai fini diagnostici, in
quanto le metodiche disponibili in commercio non sono affidabili
e la cinetica della risposta IgM non è ben definita. Esami per la
ricerca delle IgM specifiche per VZV sono disponibili in alcuni laboratori di riferimento e un capture-IgM assay è disponibile presso
il laboratorio nazionale per il VZV presso i CDC. L’identificazione dei ceppi (genotipizzazione) permette di distinguere il VZV
wild-type dal virus vaccinico; la genotipizzazione viene però
eseguita solo presso laboratori di riferimento altamente specializzati.
TRATTAMENTO
Il trattamento antivirale modifica il decorso sia della varicella
sia dell’herpes zoster. La resistenza agli antivirali è rara, ma si è
verificata in bambini con infezione da HIV che sono stati trattati
con aciclovir per periodi di tempo prolungati; il foscarnet è l’unico
farmaco disponibile per il trattamento delle infezioni da VZV
resistenti all’aciclovir.
Varicella
L’unico farmaco antivirale disponibile in formulazione liquida
approvato per l’uso pediatrico è l’aciclovir. Considerato il profilo
di sicurezza dell’aciclovir e la sua dimostrata efficacia nel trattamento della varicella, il trattamento di tutti i bambini, adolescenti e adulti con varicella è accettabile. Tuttavia, la terapia con
aciclovir non è raccomandata di routine dall’American Academy
of Pediatrics per il trattamento della varicella non complicata nei
bambini altrimenti sani, a causa del beneficio marginale, del costo
del farmaco e del basso rischio di complicanze della varicella. La
terapia orale con aciclovir (20 mg/kg/dose, dose massima 800 mg/
dose), somministrato in 4 dosi/die per 5 giorni, deve essere usata
per il trattamento della varicella non complicata negli individui
non in gravidanza >13 anni di età e nei bambini >12 mesi di età
con dermopatie croniche o pneumopatie croniche, negli individui trattati con corticosteroidi a breve termine, a intermittenza
o in aerosol, in quelli trattati a lungo termine con salicilati ed
eventualmente nei casi secondari tra i contatti familiari. Per essere più efficace il trattamento deve iniziare il più precocemente
possibile, preferibilmente entro 24 ore dall’esordio dell’esantema. Il beneficio clinico è dubbio se l’inizio del trattamento è
ritardato più di 72 ore dopo l’esordio dell’esantema. La terapia
con aciclovir non interferisce con l’induzione dell’immunità per
il VZV. La terapia endovenosa è indicata per la malattia severa
e per la varicella nei pazienti immunocompromessi (anche dopo
72 ore dalla comparsa del rash). L’aciclovir è stato usato per il
trattamento della varicella in donne gravide; la sua sicurezza per
il feto non è stata stabilita. Alcuni esperti raccomandano l’uso
del famciclovir o del valaciclovir nei bambini più grandi che sono
in grado di inghiottire le compresse. Questi farmaci non hanno
indicazioni specifiche approvate dall’FDA per il trattamento della
varicella, ma sono altamente attivi contro il VZV con lo stesso
meccanismo dell’aciclovir e vengono meglio assorbiti per via orale
rispetto all’aciclovir.
Qualsiasi paziente con segni di malattia disseminata da VZV,
tra cui polmonite, epatite severa, trombocitopenia o encefalite,
deve ricevere un trattamento immediato. La terapia con aciclovir ev (500 mg/m2 ogni 8 ore ev) iniziata entro 72 ore dallo
sviluppo dei sintomi iniziali riduce la probabilità di varicella
progressiva e disseminazione viscerale nei pazienti ad alto rischio. Il trattamento deve essere continuato per 7-10 giorni o
fino a quando non sono comparse nuove lesioni per 48 ore. Non
è consigliabile ritardare la terapia antivirale nei pazienti ad alto
rischio finché non è sicura una formazione prolungata di nuove
lesioni, in quanto la disseminazione viscerale si verifica nello
stesso intervallo di tempo.
Un VZV resistente all’aciclovir è stato identificato nei bambini
con infezione da HIV. Questi bambini possono essere trattati con
foscarnet ev (120 mg/kg/die somministrati per via endovenosa
a intervalli di 8 ore per un massimo di 3 settimane). Il dosaggio
deve essere modificato in presenza di insufficienza renale. È stata
segnalata resistenza al foscarnet in caso di uso prolungato.
Herpes zoster
I farmaci antivirali sono efficaci nel trattamento dell’herpes zoster.
Negli adulti sani, aciclovir (800 mg 5 volte al giorno per os per 5
giorni), famciclovir (500 mg 3 volte al giorno per os per 7 giorni)
e valaciclovir (1.000 mg 3 volte al giorno per os per 7 giorni)
riducono la durata della malattia e il rischio di sviluppare una
nevralgia posterpetica; il contemporaneo uso di corticosteroidi
migliora la qualità della vita nell’anziano. In bambini altrimenti
sani, l’herpes zoster è una malattia meno severa e la nevralgia
posterpetica è rara. Pertanto, il trattamento dell’herpes zoster non
complicato nel bambino con un farmaco antivirale può non essere
sempre necessario, anche se alcuni esperti trattano con aciclovir
orale (20 mg/kg/dose, dose massima 800 mg/dose) per ridurre la
durata della malattia. È importante che la terapia antivirale venga
iniziata il prima possibile. L’efficacia della terapia risulta compromessa se questa non viene iniziata entro 72 ore dall’esordio
del rash.
Al contrario, l’herpes zoster in bambini immunocompromessi
può essere severo e la malattia disseminata può essere potenzialmente fatale. I pazienti ad alto rischio di malattia disseminata
devono ricevere aciclovir (500 mg/m2 o 10 mg/kg ogni 8 ore ev).
Aciclovir, famciclovir o valaciclovir per os sono opzioni nei pazienti
immunocompromessi con herpes zoster non complicato e che sono
considerati a basso rischio di disseminazione viscerale.
L’uso di corticosteroidi per l’herpes zoster in bambini altrimenti
sani non è raccomandato.
1166 n Parte XVII Malattie infettive
COMPLICANZE
Le complicanze dell’infezione da VZV si verificano con la varicella
o con la riattivazione dell’infezione, più frequentemente nei pazienti
immunocompromessi. Nel bambino altrimenti sano, è relativamente
comune una lieve epatite da varicella, che però raramente è clinicamente sintomatica. Una lieve trombocitopenia si verifica nell’1-2%
dei bambini con varicella e può essere associata a petecchie transitorie. Porpora, vescicole emorragiche, ematuria ed emorragia
gastrointestinale sono rare complicanze che possono avere serie
conseguenze. Altre complicanze della varicella, alcune delle quali
rare, comprendono atassia cerebellare, encefalite, polmonite, nefrite,
sindrome nefrosica, sindrome emolitico-uremica, artrite, miocardite, pericardite, pancreatite e orchite. A seguito dell’introduzione
del vaccino è lecito attendersi una riduzione del numero e della
frequenza delle complicanze della varicella. Solo raramente sono
state riportate complicanze gravi negli individui vaccinati. Inoltre,
la diminuzione nel numero di ricoveri e di decessi per varicella negli
Stati Uniti in seguito all’introduzione del programma vaccinale è
un’ulteriore prova del fatto che il vaccino della varicella consente
di ridurre le complicanze severe di questa malattia.
Infezioni batteriche
Infezioni secondarie della cute, di solito causate da streptococchi
di gruppo A e dallo S. aureus, possono verificarsi anche nel 5% dei
bambini con varicella. Queste variano da un’impetigine superficiale
a cellulite, linfoadenite e ascessi sottocutanei. Una manifestazione
precoce di un’infezione batterica secondaria è l’eritema alla base
di una nuova vescicola. Anche la recrudescenza della febbre 3-4
giorni dopo l’esantema iniziale può preannunciare un’infezione
batterica secondaria. La varicella è un ben noto fattore di rischio
di infezioni invasive severe causate dallo streptococco di gruppo
A, che possono avere un esito fatale. Le infezioni più invasive,
come varicella gangrenosa, sepsi batterica, polmonite, artrite,
osteomielite, cellulite e fascite necrotizzante, sono responsabili di
gran parte della morbilità e della mortalità della varicella in bambini altrimenti sani. Anche malattie batteriche mediate da tossine
(sindrome dello shock tossico) possono complicare la varicella. Un
sostanziale declino delle infezioni batteriche invasive correlate alla
varicella è stato associato all’uso del vaccino per la varicella.
Encefalite e atassia cerebellare
L’encefalite (1/50.000 casi di varicella in bambini non vaccinati) e
l’atassia cerebellare acuta (1/4.000 casi di varicella in bambini non
vaccinati) sono ben note complicanze neurologiche della varicella;
la morbilità da complicanze del SNC è più elevata nei pazienti
con meno di 5 anni o con più di 20 anni. La meningoencefalite è
caratterizzata da rigidità nucale, alterazioni dello stato di coscienza
e convulsioni. I pazienti con atassia cerebellare presentano un esordio graduale di alterazioni del cammino, nistagmo e rallentamento
del linguaggio. I sintomi neurologici di solito iniziano 2-6 giorni
dopo l’esordio del rash, ma possono verificarsi durante il periodo
di incubazione o dopo la risoluzione del rash. Il recupero clinico
è caratteristicamente rapido, si verifica entro 24-72 ore ed è di
solito completo. Anche se l’encefalite emorragica severa, analoga
a quella causata da virus herpes simplex, è molto rara nei bambini
con varicella, le conseguenze sono simili a quelle dell’encefalite da
herpes. La sindrome di Reye (disfunzione epatica con ipoglicemia
ed encefalopatia) associata a varicella e altre malattie virali, come
l’influenza, è divenuta rara da quando non si usano più i salicilati
come antipiretici di routine (Cap. 353).
Polmonite
La polmonite da varicella è una complicanza severa responsabile della maggior parte dell’aumento di morbilità e mortalità
negli adulti e in altri gruppi ad alto rischio; può complicare la
varicella anche nei bambini più piccoli. I sintomi respiratori, che
possono comprendere tosse, dispnea, cianosi, dolore toracico di
tipo pleurico ed emottisi, iniziano di solito entro 1-6 giorni dopo
l’esordio del rash. Il fumo è stato descritto come un fattore di rischio di polmonite severa come complicazione della varicella. La
frequenza della polmonite da varicella può essere maggiore nella
partoriente.
PROGNOSI
La varicella primitiva ha un tasso di mortalità di 2-3/100.000 casi,
con il tasso più basso nei bambini di 1-9 anni di età (<1 decessi/100.000 casi). Rispetto a questi gruppi di età, i lattanti hanno
un rischio di morte 4 volte superiore, gli adulti 25 volte superiore.
Prima dell’introduzione del vaccino per il VZV si verificavano ogni
anno negli Stati Uniti circa 100 decessi; le complicanze più comuni
nei soggetti deceduti per varicella erano polmonite, complicanze a
carico del SNC, infezioni secondarie e condizioni emorragiche. Il
tasso di mortalità dell’infezione primitiva non trattata nei bambini
immunocompromessi è del 7-14% e può raggiungere il 50% negli
adulti non trattati con polmonite.
La neurite dell’herpes zoster deve essere trattata con analgesici
appropriati. La nevralgia posterpetica può essere un problema severo negli adulti e può persistere per mesi, richiedendo il trattamento
da parte di uno specialista di terapia del dolore.
PREVENZIONE
La trasmissione del VZV è di difficile prevenzione, perché l’infezione è contagiosa per 24-48 ore prima della comparsa del rash.
Sono essenziali le pratiche di controllo dell’infezione, compreso il
confinamento dei pazienti infetti in camere di isolamento con sistemi di filtrazione dell’aria. Tutti gli operatori sanitari devono avere
un’immunità documentata (Tab. 245.1). Gli operatori sanitari non
vaccinati e senza evidenze di immunità che sono stati esposti al
VZV devono essere autorizzati ad assentarsi dal posto di lavoro
negli 8-21 giorni successivi all’esposizione, essendo potenzialmente
contagiosi durante questo periodo.
Vaccino
La varicella è una malattia prevenibile con il vaccino. Il vaccino
della varicella contiene VZV vivo attenuato (ceppo Oka) ed è
indicato per somministrazione sottocutanea. È raccomandata la
somministrazione di routine di 2 dosi di vaccino della varicella ai
Tabella 245.1 EVIDENZE DI IMMUNITÀ ALLA VARICELLA
L’immunità alla varicella si intende documentata in presenza di una qualsiasi
delle seguenti evidenze o condizioni:
• Documentazione attestante l’avvenuta vaccinazione contro la varicella secondo
le modalità stabilite per le varie fasce di età:
• Bambini in età prescolare (>12 mesi): 1 dose
• Bambini in età scolare, adolescenti e adulti: 2 dosi*
• Evidenze di laboratorio attestanti l’immunità† o confermanti la malattia
• Nascita negli Stati Uniti prima del 1980§
• Diagnosi o verifica di un’anamnesi di varicella effettuata da un operatore sanitario¶
• Diagnosi o verifica di un’anamnesi di herpes zoster effettuata da un operatore
sanitario
*Nei bambini che hanno ricevuto la 1ª dose a <13 anni di età e in cui l’intervallo fra le 2 dosi
è stato ≥28 giorni, la 2ª dose è considerata valida.
†
I test commerciali possono essere utilizzati per valutare l’immunità indotta dalla malattia,
ma non sono abbastanza sensibili da individuare in ogni caso l’immunità indotta dal vaccino
(potrebbero cioè dare risultati falsi negativi).
§
Per il personale sanitario, le donne gravide e gli individui immunocompromessi, la nascita prima
del 1980 non deve essere considerata evidenza di immunità.
¶
In caso di malattia tipica, la diagnosi o la verifica dell’anamnesi possono essere effettuate
da qualsiasi operatore sanitario (infermiere scolastico o delle cliniche del lavoro, infermiere
di pratica avanzata, assistente medico o medico). In caso di individui che presentano, o affermano
di aver sofferto di, una forma atipica o lieve della malattia, si raccomanda l’accertamento
di un medico o di personale da questo indicato volto a individuare: (1) un legame epidemiologico
con un caso tipico di varicella o con un caso confermato in laboratorio o (2) evidenze
delle conferme di laboratorio se ottenute durante la manifestazione della malattia acuta.
In assenza della suddetta documentazione, il soggetto è da considerarsi privo di una valida
conferma della malattia, poiché altre patologie possono simulare la varicella atipica lieve.
Capitolo 246 Virus di Epstein-Barr n 1167
bambini sani a 12-15 mesi e a 4-6 anni di età. Per i bambini e gli
adolescenti che hanno ricevuto soltanto una dose è raccomandata
una vaccinazione di recupero con la 2ª dose. La vaccinazione con
2 dosi è raccomandata per tutti gli individui senza evidenze di
immunità. L’intervallo minimo raccomandato tra le 2 dosi è di 3
mesi per i bambini ≤12 anni di età e 4 settimane per i bambini
più grandi, gli adolescenti e gli adulti. La somministrazione del
vaccino per la varicella entro 4 settimane da quella del vaccino
morbillo-parotite epidemica-rosolia (MPR) è stata associata a un
rischio aumentato di malattia in soggetti vaccinati; pertanto, si
raccomanda di somministrare i vaccini contemporaneamente in
siti differenti o a distanza di almeno 4 settimane.
Il virus per la varicella è controindicato nelle donne gravide e
negli individui con immunodeficienze cellulo-mediate, compresi
quelli con leucemia, linfoma e altri tumori maligni del midollo
osseo o del sistema linfatico. Il vaccino può essere somministrato
a bambini con leucemia in remissione e che soddisfano i criteri di
arruolamento in un protocollo di ricerca. Il vaccino deve essere
considerato anche nei bambini con infezione da HIV con una conta
dei linfociti T CD4+ ≥15%. Questi bambini devono ricevere 2 dosi
di vaccino a 3 mesi di distanza. Prima della vaccinazione devono
essere riviste le linee guida specifiche per la vaccinazione di questi
bambini. I bambini con immunodeficienze umorali isolate possono
ricevere il vaccino per il VZV.
Il vaccino specifico per l’herpes zoster è stato approvato nel
2006 per l’uso come vaccino singolo per i soggetti ≥60 anni di età
per la prevenzione dell’herpes zoster e per ridurre la frequenza di
nevralgia posterpetica. Non è indicato per il trattamento dell’herpes zoster o della nevralgia posterpetica.
I neonati le cui madri sviluppano una varicella da 5 giorni
prima a 2 giorni dopo il parto devono ricevere una fiala di VariZIG. Le VariZIG sono inoltre indicate per le donne gravide senza
evidenze di immunità, i neonati prematuri nati dopo <28 settimane di gestazione (o di <1.000 g di peso) esposti alla varicella
durante il periodo neonatale a prescindere dal fatto che la madre
sia o meno immune, e i neonati prematuri nati dopo >28 settimane di gestazione esposti alla varicella e le cui madri non hanno
evidenze di immunità per la varicella. Se possibile, prima della
somministrazione delle VariZIG, gli adulti devono essere testati
per la presenza di IgG anti-VZV, in quanto molti adulti senza
un’anamnesi clinica di varicella sono immuni. La profilassi con
anticorpi anti-VZV può migliorare la malattia, ma non elimina la
possibilità di malattia progressiva, né assicura che la varicella non
sia trasmessa ai contatti suscettibili più stretti; i pazienti devono
essere monitorati e, se necessario, trattati con aciclovir una volta
sviluppate le lesioni.
Anche il contatto stretto tra un paziente suscettibile ad alto
rischio e un paziente con herpes zoster rappresenta un’indicazione alla profilassi con VariZIG. La somministrazione passiva o il
trattamento passivo non riduce il rischio di herpes zoster né altera
il decorso clinico della varicella o dell’herpes zoster quando viene
effettuato dopo l’esordio dei sintomi.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Effetti indesiderati associati al vaccino
Il vaccino della varicella è sicuro e ben tollerato. L’incidenza della
reazioni osservate al sito di iniezione ≤3 giorni dopo la vaccinazione era leggermente inferiore dopo la 2ª dose (25%) rispetto alla
1ª dose (22%). Un lieve rash varicelliforme associato al vaccino
è stato riportato in circa l’1-3% dei vaccinati sani; si trattava
di 6-10 lesioni eritematose papulo-vescicolari che comparivano
prevalentemente 8-21 giorni dopo la vaccinazione. La trasmissione
del virus vaccinico a contatti suscettibili è un evento molto raro.
Profilassi postesposizione
Il vaccino somministrato a bambini normali entro 3-5 giorni dall’esposizione (preferibilmente non appena possibile) è efficace nel
prevenire o modificare la varicella, specialmente in un contesto
familiare in cui l’esposizione sfocia con ogni probabilità nell’infezione. Il vaccino per la varicella è attualmente raccomandato per
l’uso successivamente all’esposizione e per il controllo delle epidemie. L’aciclovir per os somministrato nella fase tardiva del periodo
di incubazione può modificare la successiva varicella nel bambino
normale; tuttavia, l’uso in tale periodo non è raccomandato fino
a quando non saranno disponibili altri dati.
Le immunoglobuline anti-VZV a titolo elevato come profilassi
dopo l’esposizione sono raccomandate nei bambini immunocompromessi, nelle donne gravide e nei neonati esposti a varicella
materna. Negli Stati Uniti le immunoglobuline umane anti-varicella-zoster (VariZIG) sono distribuite da FFF Enterprises, California
(1-800-843-7477). La dose raccomandata è 1 fiala (125 unità) per
ogni incremento di peso di 10 kg (dose massima, 625 unità) im non
appena possibile ma entro 96 ore dall’esposizione.
Anche se le preparazioni approvate di immunoglobuline ev
da pool di donatori (IVIG) contengono anticorpi anti-varicella, il
titolo è variabile da lotto a lotto. La dose raccomandata di IVIG
per la profilassi successiva all’esposizione (nei casi in cui non
appare possibile la somministrazione di VariZIG entro 96 ore
dall’esposizione) è di 400 mg/kg somministrati una volta entro
96 ore dall’esposizione. È prevedibile che i pazienti immunocompromessi cha hanno ricevuto IVIG ad alte dosi (100-400 mg/kg)
per altre indicazioni entro 2-3 settimane prima dell’esposizione al
VZV abbiano anticorpi sierici anti-VZV.
Capitolo 246
Virus di Epstein-Barr
Hal B. Jenson
La mononucleosi infettiva è la più nota sindrome causata dal virus
di Epstein-Barr (EBV). È caratterizzata da disturbi somatici sistemici che consistono soprattutto in faticabilità, malessere, febbre,
faringodinia e linfoadenopatia generalizzata. Descritta in origine
come febbre ghiandolare, la mononucleosi infettiva deriva il suo
nome dalla linfocitosi mononucleata con linfociti di aspetto atipico
che accompagna la malattia. Altre infezioni possono causare una
malattia simile alla mononucleosi infettiva.
EZIOLOGIA
L’EBV, un membro dei g-herpes virus, causa >90% dei casi di
mononucleosi infettiva. Sono stati caratterizzati 2 tipi distinti di
EBV, il tipo 1 e il tipo 2 (chiamati anche tipo A e tipo B), che hanno
un’omologia di sequenza del 70-85%. Il tipo 1 è maggiormente
prevalente a livello mondiale rispetto al tipo 2, anche se il tipo
2 è più comune in Africa che negli Stati Uniti e in Europa. Entrambi i tipi causano un’infezione latente che dura per tutta la
vita. Sono state documentate infezioni duali da entrambi i tipi di
virus nei soggetti immunocompromessi. L’EBV-1 induce una trasformazione di crescita in vitro delle cellule B più efficacemente
rispetto all’EBV-2, ma non sono state identificate manifestazioni
patologiche o differenze cliniche tipo-specifiche. L’acquisizione
contemporanea di più genotipi di EBV è stata dimostrata mediante
eteroduplex tracking assay e si verifica comunemente in pazienti
altrimenti sani con mononucleosi infettiva. Tuttavia, tende a essere
isolato soltanto un singolo genotipo.
Almeno il 5-10% delle forme simil-mononucleosiche è causato
da un’infezione primitiva da cytomegalovirus, Toxoplasma gondii,
adenovirus, epatite virale, HIV e forse dal virus della rosolia. Nella
maggior parte delle forme simil-mononucleosiche, la causa esatta
rimane sconosciuta.
1168 n Parte XVII Malattie infettive
EPIDEMIOLOGIA
L’epidemiologia della mononucleosi infettiva è correlata all’epidemiologia e all’età di acquisizione dell’infezione da EBV. L’EBV
infetta >95% della popolazione mondiale. Si trasmette attraverso i
rapporti sessuali con penetrazione e nelle secrezioni orali, come nei
“baci profondi” o bevendo da una stessa bottiglia. Tra i bambini,
la trasmissione può verificarsi con lo scambio di saliva da bambino
a bambino, come avviene nei nidi e nelle scuole materne. I contatti
non intimi, le fonti ambientali o i fomiti non contribuiscono alla
diffusione dell’EBV.
L’EBV è costantemente eliminato nelle secrezioni orali per >6
mesi dopo l’infezione acuta quindi in modo intermittente per tutta
la vita. Almeno il 20-30% delle persone sane con infezione da
EBV elimina il virus in un determinato momento. L’immunosoppressione consente la riattivazione dell’EBV latente; il 60-90% dei
pazienti immunosoppressi con infezione da EBV elimina il virus.
L’EBV si trova anche nelle secrezioni genitali maschili e femminili
e può diffondersi, specialmente il tipo 2, attraverso il contatto
sessuale.
L’infezione da EBV nei Paesi in via di sviluppo e nelle popolazioni economicamente svantaggiate dei Paesi sviluppati si verifica di
solito durante i primi mesi di vita e nella prima infanzia. In Africa
centrale, quasi tutti i bambini sono infettati a partire dai 3 anni
di età. L’infezione primitiva da EBV durante l’infanzia è di solito
inapparente o non distinguibile da altre infezioni dell’infanzia;
la sindrome clinica della mononucleosi infettiva è praticamente
sconosciuta nelle regioni sottosviluppate del mondo. Nelle popolazioni più affluenti dei Paesi industrializzati, l’infezione nel corso
dell’infanzia è comune, ma si verifica meno spesso, presumibilmente in conseguenza degli elevati standard igienici, mentre 1/3
circa delle infezioni è presente durante l’adolescenza e la giovane
età adulta. L’infezione primitiva da EBV negli adolescenti e negli adulti si manifesta in >50% dei casi con la classica triade di
astenia, faringite e linfoadenopatia generalizzata, che costituiscono
le principali manifestazioni cliniche della mononucleosi infettiva.
Questa sindrome può essere osservata a tutte le età, ma raramente
si osserva nei bambini <4 anni di età, quando la maggior parte
delle infezioni da EBV è asintomatica, o negli adulti >40 anni di
età, quando la maggior parte degli individui è già stata infettata
dall’EBV. La reale incidenza della sindrome della mononucleosi
infettiva è sconosciuta, ma è stimata in 20-70/100.000 casi/anno;
nei giovani adulti, l’incidenza aumenta a circa 1/1.000 casi/anno.
La prevalenza dell’evidenza sierologica di una pregressa infezione
da EBV aumenta con l’età; quasi tutti gli adulti negli Stati Uniti
sono sieropositivi.
PATOGENESI
Dopo l’acquisizione nella cavità orale, l’EBV inizialmente infetta le
cellule epiteliali orali e può così contribuire ai sintomi di faringite.
Dopo la replicazione virale intracellulare e la lisi cellulare con rilascio di nuovi virioni, il virus si diffonde alle strutture contigue come
le ghiandole salivari, con eventuale viremia e infezione dei linfociti
B nel sangue periferico e nell’intero sistema linforeticolare, compresi milza e fegato. I linfociti atipici caratteristici della mononucleosi
infettiva sono linfociti T CD8+ che hanno caratteristiche sia soppressorie sia citotossiche, che si sviluppano in risposta ai linfociti
B infettati. Questo aumento relativo e anche assoluto dei linfociti
CD8+ determina un’inversione transitoria del normale rapporto
2:1 tra linfociti T CD4+/CD8+. Molte delle manifestazioni cliniche
della mononucleosi infettiva possono derivare, almeno in parte,
dal rilascio di citochine per la risposta immunitaria dell’ospite,
che riduce efficacemente il carico di EBV a <1 copia/105 linfociti
B circolanti, equivalente a <10 copie/mg di DNA da sangue intero.
Il carico di EBV è più variabile nei soggetti immunocompromessi
e può essere >4.000 copie/mg di DNA.
Le cellule epiteliali della cervice uterina possono infettarsi con
la trasmissione sessuale del virus, anche se dopo quest’ultima non
sono stati descritti sintomi locali. L’EBV si ritrova costantemente
nelle fibrocellule muscolari lisce dei leiomiosarcomi dei soggetti
immunocompromessi.
L’EBV, come gli altri herpes virus, stabilisce un’infezione latente
per tutta la vita dopo la malattia primitiva. Il virus latente risiede
nelle cellule epiteliali orofaringee o sistematicamente nei linfociti
B di memoria come episomi multipli nel nucleo. Gli episomi virali
replicano con la divisione cellulare e si distribuiscono a entrambe
le cellule figlie. L’integrazione virale nel genoma cellulare non è
tipica. Soltanto poche proteine virali, compresi gli EBNA (antigeni
nucleari determinati dall’EBV), sono prodotte durante la latenza.
Queste proteine sono importanti nel mantenimento dell’episoma
virale nel corso dello stato di latenza. La progressione alla replicazione virale inizia con la produzione degli antigeni precoci
di EBV (EA), procede attraverso la replicazione del DNA virale,
è seguita dalla produzione di antigene del capside virale (VCA) e
culmina nella morte cellulare e nel rilascio di virioni maturi. La
riattivazione con replicazione virale si verifica a un tasso ridotto
nelle popolazioni cellulari con infezione latente ed è responsabile di
eliminazione virale intermittente nelle secrezioni orofaringee degli
individui infetti. La riattivazione è apparentemente asintomatica e
non sono noti sintomi clinici distintivi di accompagnamento.
ONCOGENESI
L’EBV è stato il primo virus umano a essere associato alle neoplasie maligne. L’infezione da EBV può determinare uno spettro di patologie proliferative che può variare da una malattia
autolimitata, di solito benigna, come la mononucleosi infettiva, a
patologie proliferative aggressive non maligne come la sindrome
emofagocitica associata al virus, fino a neoplasie maligne linfoidi e
delle cellule epiteliali. Le patologie proliferative benigne associate
all’EBV comprendono la leucoplachia capelluta orale, soprattutto
in adulti con AIDS, e la polmonite interstiziale linfoide, soprattutto
in bambini con AIDS. Le patologie proliferative maligne associate
all’EBV comprendono carcinoma nasofaringeo, linfoma di Burkitt,
malattia di Hodgkin, patologie linfoproliferative e leiomiosarcoma
nelle condizioni di immunodeficienza, compreso l’AIDS. Non
vi sono evidenze solide di sviluppo di quasi specie di EBV che
potrebbero contribuire alla patogenesi delle neoplasie maligne
EBV-positive.
Il carcinoma nasofaringeo si presenta in tutto il mondo, ma è
10 volte più diffuso nella Cina meridionale, dove rappresenta la
più comune neoplasia maligna negli uomini adulti. È frequente
anche nei bianchi in Africa settentrionale e negli Inuit in America
settentrionale. I pazienti di solito si presentano con linfoadenopatia cervicale, blocco delle tube di Eustachio e ostruzione nasale
con epistassi. Tutte le cellule maligne del carcinoma nasofaringeo
indifferenziato contengono un numero elevato di copie di episomi
di EBV. I soggetti con carcinoma nasofaringeo non cheratinizzato
indifferenziato e parzialmente differenziato hanno elevati titoli di
anticorpi anti-EBV che hanno un significato sia diagnostico sia
prognostico. Elevati livelli di IgA anti-EA e anti-VCA possono
essere identificati in individui asintomatici e utilizzati per seguire la
risposta alla terapia antitumorale (Tab. 246.1). Le cellule del carcinoma nasofaringeo cheratinizzato ben differenziato contengono
un basso numero di genomi di EBV o non ne contengono affatto;
gli individui con questa patologia hanno pattern sierologici relativi
all’EBV simili a quelli della popolazione generale.
TC e RM sono utili per identificare e definire le masse della testa
e del collo. La diagnosi è stabilita mediante biopsia della massa o
di un linfonodo cervicale sospetto. La chirurgia è importante per la
stadiazione e per la diagnosi. La radioterapia è efficace per il controllo del tumore primitivo e delle metastasi ai linfonodi regionali.
La chemioterapia con 5-fluorouracile, cisplatino e metotrexate è
efficace ma non sempre curativa. La prognosi è buona se il tumore
è localizzato.
Il linfoma di Burkitt endemico (africano), spesso localizzato
nella mandibola, è il più comune cancro dell’infanzia nell’Africa
Capitolo 246 Virus di Epstein-Barr n 1169
Tabella 246.1 CORRELAZIONE TRA STATO CLINICO E RISPOSTE SIEROLOGICHE ALL’INFEZIONE DA EBV*
STATO CLINICO
Reazione negativa
Suscettibile
Infezione primitiva acuta:
mononucleosi infettiva
Infezione primitiva recente:
mononucleosi infettiva
Infezione remota
Riattivazione: paziente
immunosoppresso
o immunocompromesso
Linfoma di Burkitt
Carcinoma nasofaringeo
ANTICORPI ETEROFILI
(Test Qualitativo)
IgM-VCA
†
RISPOSTA SIEROLOGICA
ANTICORPI SPECIFICI PER EBV
IgG-VCA
EA-D
†
†
EA-R
†
EBNA
†
−
−
+
1:8
−
da 1:32 a 1:256
1:10
−
da 1:160 a 1:640
1:10
−
da 1:40 a 1:160
1:10
−§
−§
1:2,5
−
− a 1:2,5
±
− a 1:32
da 1:320 a 1:1.280
da 1:40 a 1:160
−‡
da 1:5 a 1:10
−
−
−
−
da 1:40 a 1:160
da 1:320 a 1:1.280
−§
−§
− a 1:40
da 1:80 a 1:320
da 1:10 a 1:40
− a 1:160
−
−
−
−
da 1:320 a 1:1.280
da 1:320 a 1:1.280
−§
da 1:40 a 1:160
da 1:80 a 1:320
−|
da 1:10 a 1:80
da 1:20 a 1:160
EA-D, componente caratterizzata da colorazione diffusa dell’antigene precoce; EA-R, componente limitata al citoplasma dell’antigene precoce; EBNA, antigeni nucleari determinati da EBV; EBV, virus
di Epstein-Barr; IgG, immunoglobulina G; IgM, immunoglobulina M; VCA, antigene del capside virale; −, negativo; +, positivo.
*I dati sono stati ottenuti da numerosi studi. Possono verificarsi risposte individuali al di fuori del range caratteristico.
†
Oppure la più bassa diluizione del test.
‡
Nei bambini più piccoli e negli adulti con sieroconversione asintomatica, la risposta anti-antigene precoce può avere luogo principalmente nei confronti della componente EA-R.
§
Una minoranza di individui ha una risposta anti-antigene precoce principalmente nei confronti della componente EA-D.
|
Una minoranza di individui ha una risposta anti-antigene precoce principalmente nei confronti della componente EA-R.
Per gentile concessione di Jenson HB: Epstein-Barr virus. In Detrick B, Hamilton RG, Folds JD [editors]: Manual of molecular and clinical laboratory immunology, 7th ed, Washington, DC, 2006, American
Society for Microbiology.
orientale equatoriale e nella Nuova Guinea (Cap. 490.2). L’età
mediana all’esordio è di 5 anni. Queste regioni sono oloendemiche
per la malaria da Plasmodium falciparum e hanno un tasso elevato di
infezione da EBV nelle prime fasi della vita. La costante esposizione
alla malaria agisce come un mitogeno per i B-linfociti che contribuisce alla proliferazione di B-linfociti policlonali, inibisce il controllo
dei T-linfociti sui B-linfociti infettati da EBV e aumenta il rischio di
sviluppare un linfoma di Burkitt. Il 98% dei casi di linfoma di Burkitt endemico contiene il genoma dell’EBV rispetto al 20% soltanto
dei casi non endemici (sporadici o americani) di linfoma di Burkitt.
Gli individui con linfoma di Burkitt presentano livelli insolitamente
e caratteristicamente alti di anticorpi anti-VCA e anti-EA correlati
al rischio di sviluppare il tumore (si veda Tab. 246.1).
Tutti i casi di linfoma di Burkitt, compresi quelli EBV-negativi,
sono monoclonali e dimostrano una traslocazione cromosomica del
proto-oncogene c-myc sulla regione costante del locus della catena
pesante delle immunoglobuline, t(8;14), al locus costante k della
catena leggera, t(2;8), o al locus costante l della catena leggera,
t(8;22). Ciò provoca la deregolazione e la trascrizione costitutiva
del gene c-myc con un’eccessiva produzione di un prodotto c-myc
normale che autosopprime la produzione di c-myc sul cromosoma
non traslocato.
L’incidenza di malattia di Hodgkin ha un picco nell’infanzia nei
Paesi in via di sviluppo e nella prima età adulta nei Paesi sviluppati.
I livelli di anticorpi anti-EBV sono costantemente elevati prima dello
sviluppo della malattia di Hodgkin; soltanto una piccola minoranza
di pazienti è sieronegativa per l’EBV. L’infezione da EBV sembra
aumentare il rischio di malattia di Hodgkin di un fattore da 2 a 4.
L’EBV è associato a più della metà dei casi di malattia di Hodgkin
a cellularità mista e a 1/4 circa dei casi del sottotipo sclerosante
nodulare, ed è raramente associato alla malattia di Hodgkin a
predominanza linfocitaria. Gli studi immunoistochimici hanno localizzato l’EBV nelle cellule di Reed-Sternberg e nelle relative varianti,
le cellule maligne patognomoniche della malattia di Hodgkin.
Il mancato controllo dell’infezione da EBV può derivare da
deficit immunitari. Il prototipo è la sindrome linfoproliferativa Xlinked (sindrome di Duncan), una patologia recessiva del sistema
immunitario legata al cromosoma X e associata a infezione da
EBV severa, persistente e talvolta fatale (Cap. 118). I 2/3 circa di
questi pazienti maschi muoiono per una sindrome linfoproliferativa
disseminata e fulminante che interessa diversi organi al momen-
to dell’infezione primitiva da EBV. I pazienti che sopravvivono
sviluppano un’ipogammaglobulinemia, un linfoma a cellule B o
entrambi. La maggior parte dei pazienti muore entro 10 anni.
Numerose sindromi da immunodeficienza congenita e acquisita
sono associate a un’aumentata incidenza di linfoma B-linfocitico
associato all’EBV, specialmente il linfoma del sistema nervoso centrale e il leiomiosarcoma. L’incidenza di sindromi linfoproliferative
è parallela al grado di immunosoppressione. Un declino della
funzione T-cellulare permette evidentemente all’EBV di sfuggire
alla sorveglianza immunitaria. Le immunodeficienze congenite che
predispongono alla linfoproliferazione associata all’EBV comprendono la sindrome linfoproliferativa X-linked, l’immunodeficienza
comune variabile, l’atassia-teleangectasia, la sindrome di WiskottAldrich e la sindrome di Chédiak-Higashi. Gli individui con immunodeficienze acquisite che derivano da chemioterapia antineoplastica, immunosoppressione dopo trapianto di organo solido o di
midollo o da infezione da HIV hanno un rischio significativamente
aumentato di linfoproliferazione associata all’EBV. I linfomi possono essere focali o diffusi e di solito sono istologicamente policlonali, ma possono divenire monoclonali. La loro crescita non si
arresta con la cessazione dell’immunosoppressione.
L’EBV si trova a livello intracellulare in tutte le cellule muscolari
lisce dei leiomiosarcomi dei soggetti immunocompromessi, tra cui
pazienti con infezione da HIV e pazienti trapiantati, ma non nei
leiomiosarcomi dei soggetti immunocompetenti.
L’EBV è inoltre associato al carcinoma delle ghiandole salivari.
Altri tumori putativamente associati all’EBV comprendono alcuni
linfomi T-linfocitici (tra cui i tumori della linea mediana letali), il
linfoma angioimmunoblastico simil-linfoadenopatico, timomi e
carcinomi timici derivati da cellule epiteliali timiche, carcinomi
laringei sopraglottici, tumori linfoepiteliali delle vie respiratorie
e del tratto gastrointestinale e adenocarcinoma gastrico. L’esatto
contributo dell’EBV a queste varie neoplasie maligne non è ben
definito.
MANIFESTAZIONI CLINICHE
Il periodo di incubazione della mononucleosi infettiva negli adolescenti è di 30-50 giorni. Nei bambini può essere più breve. La
maggior parte dei casi di infezione primitiva da EBV nei lattanti
e nei bambini più piccoli è clinicamente silente. Nei pazienti più
1170 n Parte XVII Malattie infettive
grandi, l’esordio della malattia è di solito vago e insidioso. I pazienti possono lamentare malessere, astenia, febbre acuta o prolungata
(>1 settimana), cefalea, faringodinia, nausea, dolore addominale
e mialgie. Questo periodo prodromico può durare 1-2 settimane.
Faringodinia e febbre aumentano gradualmente fino a quando
il paziente cerca assistenza medica. La splenomegalia può essere
sufficientemente rapida da causare fastidio e dolore nel quadrante
addominale superiore sinistro, che possono essere i sintomi di
presentazione.
L’esame obiettivo è caratterizzato da linfoadenopatia generalizzata (90% dei casi), splenomegalia (50% dei casi) ed epatomegalia
(10% dei casi). Una linfoadenopatia si manifesta più comunemente nei linfonodi cervicali anteriori e posteriori e nei linfonodi
sottomandibolari, meno frequentemente nei linfonodi ascellari
e inguinali. La linfoadenopatia epitrocleare è particolarmente
suggestiva di mononucleosi infettiva. Epatite sintomatica o ittero
sono infrequenti, ma è comune l’aumento degli enzimi epatici. È
tipica una splenomegalia a 2-3 cm sotto il margine costale, ma un
ingrossamento massivo della milza è infrequente.
La faringodinia è spesso accompagnata da faringite da moderata
a severa con marcato ingrossamento tonsillare, occasionalmente
con essudati (Fig. 246.1). Si osservano frequentemente petecchie a
livello della congiunzione tra palato molle e palato duro. La faringite somiglia a quella causata dall’infezione streptococcica. Altri
segni clinici possono comprendere rash ed edema palpebrale.
I rash sono di solito maculopapulosi e sono stati riportati nel
3-15% dei pazienti. Se trattato con ampicillina o amoxicillina,
anche l’80% dei pazienti con mononucleosi infettiva può sperimentare un “rash da ampicillina”. Questo rash vasculitico è
probabilmente immunomediato e si risolve senza trattamento
specifico. L’EBV è associato anche a sindrome di Gianotti-Crosti,
un rash simmetrico delle guance con papule eritematose multiple
che possono riunirsi in placche e che persiste per 15-20 giorni. Il
rash ha l’aspetto della dermatite atopica e può comparire sulle
estremità e sulle natiche.
DIAGNOSI
La diagnosi di mononucleosi infettiva implica un’infezione primitiva da EBV. Una diagnosi presuntiva può essere fatta in base alla
presenza dei tipici sintomi clinici con linfocitosi atipica nel sangue
periferico. La diagnosi è di solito confermata dai test sierologici, sia
per gli anticorpi eterofili sia per gli anticorpi specifici per l’EBV.
La coltura dell’EBV è tediosa e richiede 4-6 settimane. Il metodo
colturale è il test di trasformazione, che si esegue con la coltivazione
contemporanea di secrezioni orofaringee o genitali, sangue periferico (10-30 mL) o tumore con linfociti di cordone ombelicale umano.
Le colture vengono tenute sotto osservazione per 6 settimane per
la ricerca dei segni di trasformazione cellulare: proliferazione e crescita rapida, figure mitotiche, grossi vacuoli, morfologia granulare
e aggregazione cellulare. L’EBV immortalizza le cellule di cordone
Figura 246.1 Formazione di tonsillite con membrane nella mononucleosi infettiva.
(Per gentile concessione di Alex J. Steigman, MD.)
ombelicale dando origine a linee cellulari che possono essere mantenute in perpetuo e che ospitano l’EBV isolato dal paziente.
Diagnosi differenziale
Malattie simili alla mononucleosi infettiva possono essere causate
da un’infezione primitiva da cytomegalovirus, T. gondii, adenovirus, epatite virale, HIV o eventualmente dal virus della rosolia. L’infezione da cytomegalovirus è una causa particolarmente comune
negli adulti. La faringite da streptococco può causare faringodinia
e linfoadenopatia cervicale che sono indistinguibili da quelle della
mononucleosi infettiva, ma non è associata a epatosplenomegalia. Il 5% circa dei casi di mononucleosi infettiva associata a
EBV ha una coltura positiva per lo streptococco di gruppo A; ciò
rappresenta una situazione di portatore di streptococco a livello
faringeo. Il mancato miglioramento di un paziente con faringite
streptococcica entro 48-72 ore deve far sorgere il sospetto di una
mononucleosi infettiva. Il problema più serio nella diagnosi della
malattia acuta insorge nel paziente occasionale con conta leucocitaria estremamente elevata o estremamente ridotta, trombocitopenia
moderata e anche anemia emolitica. In questi pazienti, l’esame del
midollo osseo e il consulto con un ematologo sono necessari per
escludere la possibilità di una leucemia.
REPERTI DI LABORATORIO
In >90% dei casi di infezione da EBV è presente leucocitosi con
10.000-20.000 cellule/mm3, delle quali almeno i 2/3 sono linfociti;
i linfociti atipici di solito rappresentano il 20-40% del numero
totale. Le cellule atipiche sono T-linfociti maturi che sono stati
antigenicamente attivati. Al microscopio, i linfociti atipici appaiono in generale più grandi dei linfociti normali, con nuclei
più voluminosi, plicati, indentati e posti eccentricamente con un
rapporto nucleo-citoplasma più basso. Anche se una linfocitosi
atipica può essere osservata in molte delle infezioni che di solito
causano linfocitosi, il grado più elevato di linfociti atipici si osserva
classicamente nell’infezione da EBV. Altre sindromi associate a
linfocitosi atipica comprendono l’infezione da cytomegalovirus acquisita (al contrario dell’infezione congenita da cytomegalovirus),
toxoplasmosi, epatite virale, rosolia, roseola, parotite epidemica,
tubercolosi, febbre tifoide, infezione da Mycoplasma e malaria,
come anche alcune reazioni da farmaci. Una lieve trombocitopenia
da 50.000-200.000 piastrine/mm3 si verifica in >50% dei pazienti,
ma solo raramente è associata a porpora. Un lieve aumento delle
transaminasi epatiche si verifica nel 50% circa dei casi non complicati, ma di solito è asintomatico e senza ittero.
Test degli anticorpi eterofili
Gli anticorpi eterofili agglutinano le cellule di specie differenti da
quelle del siero originale. Gli anticorpi eterofili transitori osservati
nella mononucleosi infettiva, noti anche come anticorpi di PaulBunnell, sono IgM individuabili con il test di Paul-Bunnell-Davidsohn per l’agglutinazione degli eritrociti di pecora. Gli anticorpi
eterofili della mononucleosi infettiva agglutinano gli eritrociti di
pecora o, per una maggiore sensibilità, eritrociti di cavallo, ma
non le cellule renali di cavia. Questa proprietà di adsorbimento
differenzia tale risposta dalla risposta eterofila che si osserva nei
pazienti con malattia da siero, malattie reumatiche e in alcuni
individui normali. Titoli >1:28 o >1:40, a seconda del sistema di
diluizione utilizzato, dopo adsorbimento con cellule renali di cavia
sono considerati positivi.
I risultati del test di agglutinazione degli eritrociti di pecora sono
spesso positivi per diversi mesi dopo la mononucleosi infettiva;
quelli del test di agglutinazione degli eritrociti di cavallo possono essere positivi anche per 2 anni. Il metodo più utilizzato è
il test rapido qualitativo su vetrino con eritrociti di cavallo. Esso
identifica gli anticorpi eterofili nel 90% dei casi di mononucleosi
infettiva associata all’EBV nei bambini più grandi e negli adulti,
ma soltanto in non più del 50% dei casi nei bambini con <4 anni
di età, in quanto questi sviluppano caratteristicamente un titolo
Capitolo 246 Virus di Epstein-Barr n 1171
più basso. Dal 5 al 10% dei casi di mononucleosi infettiva non è
causato dall’EBV e non è uniformemente associato a una risposta
anticorpale eterofila. Il tasso di falsi positivi è <10%, e di solito
deriva da un’interpretazione erronea. Se il test per gli eterofili è
negativo e si sospetta un’infezione da EBV, è indicata la ricerca
degli anticorpi specifici per l’EBV.
Anticorpi specifici per l’EBV
Il dosaggio degli anticorpi specifici per l’EBV è utile per la conferma
dell’infezione acuta da EBV, specialmente nei casi negativi per gli
eterofili, oppure per confermare l’infezione pregressa e determinare
la suscettibilità a una futura infezione. Sono stati caratterizzati
diversi sistemi antigenici distinti per l’EBV a scopo diagnostico
(Fig. 246.2; si veda Tab. 246.1). I sistemi antigenici EBNA, EA, e
VCA sono quelli maggiormente utili a scopo diagnostico. La fase
acuta della mononucleosi infettiva è caratterizzata da rapide risposte anticorpali IgM e IgG al VCA in tutti i casi e da una risposta
IgG all’EA nella maggior parte dei casi. La risposta IgM al VCA
è transitoria, ma può essere individuata per almeno 4 settimane
e occasionalmente fino a 3 mesi. Il laboratorio deve eliminare il
fattore reumatoide che può causare un risultato falso positivo delle
IgM per il VCA. La risposta IgG al VCA di solito presenta un picco
tardivo nella fase acuta, declina leggermente in un periodo che può
variare da settimane a diversi mesi dopo, e quindi persiste con un
livello relativamente stabile per tutta la vita.
Gli anticorpi anti-EA sono di solito identificabili per diversi
mesi, ma possono persistere o essere identificati in modo intermittente a bassi livelli per molti anni. Gli anticorpi contro la
componente di EA associata a colorazione diffusa, EA-D, sono
transitoriamente presenti nell’80% dei pazienti durante la fase
acuta della mononucleosi infettiva e raggiungono titoli elevati
nei pazienti con carcinoma nasofaringeo. Gli anticorpi contro
la componente di EA limitata al citoplasma, EA-R, emergono
transitoriamente nella convalescenza della mononucleosi infettiva
e spesso, nei pazienti con linfoma di Burkitt associato a EBV,
raggiungono titoli elevati che nella fase terminale della malattia
possono essere superati dagli anticorpi anti-EA-D. Livelli elevati
di anticorpi anti-EA-D o anti-EA-R possono essere osservati anche
in pazienti immunocompromessi con infezione persistente da
EBV e replicazione attiva di EBV. Gli anticorpi anti-EBNA sono
gli ultimi a comparire nella mononucleosi infettiva; compaiono
gradualmente 3-4 mesi dopo l’esordio della malattia e rimangono
Figura 246.2 Rappresentazione schematica dello sviluppo degli anticorpi contro i diversi
antigeni del virus di Epstein-Barr in pazienti con mononucleosi infettiva. I titoli anticorpali
sono calcolati come valori di medie geometriche espressi come reciproci della diluizione
sierica. La risposta IgM nei confronti dell’antigene del capside virale (VCA) è divisa a causa
delle significative differenze notate in base all’età del paziente. IgG, immunoglobulina G;
IgM, immunoglobulina M. (Per gentile concessione di Jenson HB: Epstein-Barr virus.
In Detrick B, Hamilton RG, Folds JD [editors]: Manual of molecular and clinical laboratory
immunology, 7th ed, Washington, DC, 2006, American Society for Microbiology.)
attestati su livelli bassi per tutta la vita. L’assenza di anticorpi
anti-EBNA quando sono presenti altri anticorpi implica un’infezione recente, mentre la presenza di anticorpi anti-EBNA implica
un’infezione verificatasi più di 3-4 mesi prima. L’ampio range
di risposte anticorpali individuali e i vari metodi di laboratorio
utilizzati possono occasionalmente rendere difficoltosa l’interpretazione di un profilo anticorpale. L’identificazione di anticorpi
IgM anti-VCA è il test sierologico più utile e specifico per la diagnosi di infezione acuta da EBV ed è generalmente sufficiente per
la conferma diagnostica.
TRATTAMENTO
Non esiste un trattamento specifico per la mononucleosi infettiva.
La terapia con dosi elevate di aciclovir, con o senza corticosteroidi,
riduce la replicazione virale e l’eliminazione orofaringea durante il
periodo di somministrazione, ma non riduce la severità o la durata
dei sintomi né altera l’eventuale esito. Riposo e terapie sintomatiche sono la pietra angolare del trattamento. Il riposo a letto è
necessario soltanto quando il paziente ha un’astenia debilitante.
Non appena si verifica un chiaro miglioramento sintomatico, il
paziente può riprendere le sue attività normali. Poiché un trauma
addominale chiuso può predisporre i pazienti alla rottura splenica,
è usuale e prudente consigliare ai pazienti di astenersi dagli sport
di contatto e dalle attività fisiche continuative nel corso delle prime
2-3 settimane di malattia o quando è presente splenomegalia.
Brevi cicli di corticosteroidi (<2 settimane) possono essere
utili per le complicanze della mononucleosi infettiva, ma questo
uso non è stato valutato criticamente. Alcune indicazioni appropriate comprendono un’ostruzione imminente delle vie respiratorie,
trombocitopenia con emorragie, anemia emolitica autoimmune,
convulsioni e meningite. Si raccomanda un ciclo di prednisone
1 mg/kg/die (dose massima 60 mg/die) o equivalenti per 7 giorni,
con riduzione progressiva della dose nei 7 giorni successivi. Non
esistono dati controllati che dimostrino l’efficacia dei corticosteroidi
in una qualsiasi di queste condizioni. In vista dei rischi potenziali
e sconosciuti dell’immunosoppressione in un’infezione virale con
complicanze oncogeniche, i corticosteroidi non devono essere usati
nei casi non complicati di mononucleosi infettiva.
COMPLICANZE
Pochissimi pazienti con mononucleosi infettiva presentano complicanze. La complicanza più temibile è l’emorragia splenica sottocapsulare o la rottura splenica, che si verifica più frequentemente
nel corso della 2ª settimana della malattia con un tasso <0,5%
negli adulti; il tasso nei bambini è sconosciuto, ma è probabilmente
molto più basso. La rottura è comunemente correlata a un trauma,
che spesso può essere lieve, ed è raramente fatale. La tumefazione
delle tonsille e del tessuto linfatico orofaringeo può essere molto
marcata, con possibile ostruzione delle vie aeree che si manifesta
con ipersalivazione, stridore e difficoltà respiratoria. Una compromissione delle vie aeree con sintomi progressivi si manifesta in
<5% dei casi ed è una comune indicazione all’ospedalizzazione per
la mononucleosi infettiva. Può essere trattata sollevando la testata
del letto e con l’idratazione endovenosa del paziente, l’umidificazione dell’aria e la somministrazione di corticosteroidi sistemici. Il
distress respiratorio con occlusione imminente o in atto delle vie
aeree deve essere trattato con un’adenotonsillectomia seguita da
intubazione endotracheale per 12-24 ore in unità intensiva.
È stata riportata un’associazione di molte condizioni neurologiche infrequenti e insolite con la mononucleosi infettiva da
EBV. È presente cefalea in quasi metà dei casi, con manifestazioni
neurologiche severe, come convulsioni e atassia, nell’1-5% dei casi.
Un sintomo di presentazione è costituito da distorsioni percettive di
dimensioni, forme e relazioni spaziali, note come sindrome di Alice
nel paese delle meraviglie (metamorfopsia). Può essere presente
meningite con rigidità nucale e presenza di cellule mononucleate nel
liquido cerebrospinale, paralisi del nervo faciale, mielite trasversa
1172 n Parte XVII Malattie infettive
ed encefalite. Tuttavia, la maggior parte dei pazienti con diagnosi
confermata di encefalite da EBV non presenta la sintomatologia
tipica della mononucleosi infettiva.
La sindrome di Guillain-Barré o la sindrome di Reye possono
far seguito alla malattia acuta. Un’anemia emolitica, spesso con
test di Coombs positivo e con la presenza di agglutinine fredde
specifiche per l’antigene eritrocitario, si verifica nel 3% dei casi.
L’esordio avviene caratteristicamente nelle prime 2 settimane di
malattia e dura <1 mese. L’anemia aplastica è una rara complicanza che di solito si presenta 3-4 settimane dopo l’esordio della
malattia, con guarigione in 4-8 giorni, ma alcuni casi richiedono il
trapianto di midollo osseo. Sono comuni una lieve trombocitopenia
e neutropenia, mentre una trombocitopenia severa (<20.000 piastrine/mL) o una neutropenia severa (<1.000 neutrofili/mL) sono
rare. Possono verificarsi miocardite o polmonite interstiziale, che
si risolvono entrambe in 3-4 settimane. Altre complicanze rare
comprendono pancreatite, parotite e orchite.
PROGNOSI
La prognosi per una guarigione completa è eccellente. I principali
sintomi durano caratteristicamente 2-4 settimane, seguiti da una
guarigione graduale. È stata dimostrata una seconda infezione
con un tipo differente di EBV (tipo 1 o tipo 2) nelle persone immunocompromesse, ma non sono stati documentati sintomi o un
2° attacco di mononucleosi infettiva causata da EBV. Un’astenia
prolungata e debilitante, malessere e un certo grado di disabilità,
che possono comparire e scomparire nel giro di un periodo variabile da diverse settimane a 6 mesi, sono disturbi comuni anche in
casi altrimenti senza particolari problemi. È ben nota la persistenza
occasionale di astenia per alcuni anni in seguito a mononucleosi
infettiva. Non vi sono prove convincenti che mettano in relazione
l’infezione da EBV o la riattivazione dell’EBV con la sindrome della
fatica cronica (Cap. 115).
PREVENZIONE
Pensare di poter prevenire l’infezione da EBV è poco realistico
perché il virus responsabile è ubiquitario e spesso trasmesso per
contatto orale nei primi anni di vita. È allo studio un vaccino ricombinante ad antigene purificato costituito dalla glicoproteina 350
(gp350) che, somministrato in 3 dosi, ha dato risultati promettenti
nella prevenzione della mononucleosi infettiva e, potenzialmente,
anche delle neoplasie maligne associate a EBV.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Capitolo 247
Cytomegalovirus
Sergio Stagno
Il cytomegalovirus umano (CMV) è un membro della famiglia delle
Herpesviridae ed è ampiamente distribuito. La maggior parte delle
infezioni da CMV è inapparente, ma il virus può causare diverse
malattie cliniche la cui severità varia da lieve a fatale. Il CMV è
la causa più comune di infezione congenita, che occasionalmente
causa la sindrome della malattia da inclusioni citomegaliche (epatosplenomegalia, ittero, petecchie, porpora e microcefalia) nei
neonati. Negli adulti immunocompetenti, l’infezione da CMV è
occasionalmente caratterizzata da una sindrome simil-mononucleosica. Nei soggetti immunosoppressi, compresi i trapiantati e
i pazienti con AIDS, sono comuni polmonite da CMV, retinite e
malattia gastrointestinale che possono essere fatali.
L’infezione primitiva si verifica nell’ospite suscettibile sieronegativo. L’infezione ricorrente rappresenta la riattivazione di un’infezione latente o la reinfezione di un ospite immune sieropositivo.
La malattia può derivare da un’infezione da CMV primitiva o
ricorrente, ma la prima è più comunemente associata a malattia
severa.
EZIOLOGIA
Il CMV è il più grande degli herpes virus e ha un diametro di 200 nm
con un genoma virale di DNA a doppio filamento di 240 kb in
un core di 64 nm racchiuso in un capside icosaedrico composto
di 162 capsomeri. Il core è assemblato nel nucleo della cellula
ospite. Il capside è circondato da un rivestimento amorfo poco
definito, a sua volta circondato da un involucro poco aderente
contenente lipidi. Il rivestimento contiene le proteine più immunogene del virione, compresi i bersagli della risposta T-linfocitaria
e anticorpale. L’involucro viene acquisito durante il processo di
gemmazione (espulsione) del virus attraverso la membrana nucleare in un vacuolo citoplasmatico, che contiene le componenti
proteiche dell’involucro. Le glicoproteine dell’involucro inducono
forti risposte anticorpali, ivi compresi gli anticorpi neutralizzanti
nell’ospite infettato. I virus maturi fuoriescono dalle cellule per lisi
cellulare (fibroblasti) o mediante processi di esocitosi poco definiti.
I test sierologici di routine non definiscono sierotipi specifici. Al
contrario, l’analisi del DNA del CMV mediante le endonucleasi
di restrizione evidenzia che i ceppi umani non sono geneticamente
identici a meno che non siano ottenuti da casi epidemiologicamente
correlati.
EPIDEMIOLOGIA
Le indagini sieroepidemiologiche dimostrano l’infezione da CMV
in ogni popolazione esaminata nel mondo. La prevalenza dell’infezione, che aumenta con l’età, è più elevata nei Paesi in via di
sviluppo e nelle classi socioeconomiche più basse delle popolazioni
più sviluppate.
Le fonti di trasmissione del CMV comprendono saliva, latte
materno, secrezioni cervicali e vaginali, urina, liquido seminale,
lacrime, sangue e tessuti o organi trapiantati. La diffusione del
CMV richiede un contatto molto stretto o intimo, in quanto è
molto labile. La trasmissione si verifica per contatto diretto da
persona a persona, ma anche la trasmissione indiretta è possibile
attraverso fomiti contaminati.
L’incidenza di infezione congenita da CMV varia dallo 0,2 al
2,4% (media 1%) di tutti i nati vivi, e i tassi più elevati si osservano
nelle popolazioni in condizioni economiche più disagiate. Il rischio
di infezione fetale è maggiore con l’infezione primitiva da CMV
materna (30%) e molto meno probabile con l’infezione ricorrente
(<1%). Negli Stati Uniti, l’1-4% delle donne gravide contrae l’infezione primitiva da CMV e almeno 8.000 neonati hanno sequele
neuroevolutive associate a infezione congenita da CMV.
La trasmissione perinatale è comune, con un’incidenza del 1060% nei primi 6 mesi di vita. Le più importanti fonti perinatali
del virus sono le secrezioni del tratto genitale al momento del
parto e il latte materno. Tra le madri sieropositive per il CMV, il
virus è identificabile nel latte materno nel 96% dei casi, con una
trasmissione postnatale che si verifica nel 38% circa dei neonati,
determinando un’infezione sintomatica in quasi metà dei neonati
di peso molto basso alla nascita. I neonati infetti eliminano il virus
per anni nella saliva e nelle urine.
Dopo il 1° anno di vita, la prevalenza dell’infezione dipende
dalla vita in comunità e il nido e la scuola materna, in particolare,
contribuiscono alla rapida diffusione del CMV nei bambini. Tassi
di infezione del 50-80% nel corso dell’infanzia sono comuni. Per
i bambini che non sono esposti ad altri bambini piccoli, il tasso di
infezione aumenta molto lentamente nel 1° decennio di vita. Un
2° picco si verifica nell’adolescenza in seguito alla trasmissione
sessuale. Gli operatori dei nidi e delle scuole materne sieronegativi
Capitolo 247 Cytomegalovirus n 1173
e i genitori dei bambini più piccoli che eliminano il CMV hanno
un rischio annuale del 10-20% di acquisire il CMV, rispetto a un
rischio dell’1-3% per anno per la popolazione generale.
Gli operatori sanitari non hanno un rischio aumentato di acquisire l’infezione da CMV dai pazienti. A seguito dell’implementazione delle precauzioni universali, si ritiene che il rischio di trasmissione nosocomiale del CMV agli operatori sanitari sia inferiore a
quello di acquisizione dell’infezione in ambiente comunitario.
L’infezione da CMV può essere trasmessa con gli organi trapiantati (rene, cuore, midollo osseo). Dopo il trapianto, molti pazienti
eliminano il CMV in seguito all’infezione acquisita dall’organo
del donatore o per la riattivazione di un’infezione latente causata
dall’immunosoppressione. I soggetti sieronegativi che ricevono
organi da donatori sieropositivi sono quelli a maggior rischio di
malattia severa.
L’infezione nosocomiale è un rischio legato alle trasfusioni di
sangue ed emoderivati. In una popolazione con una prevalenza
del 50% di infezione da CMV, il rischio è stato stimato nel 2,7%
per unità di sangue intero. Le trasfusioni di leucociti espongono a
un rischio molto più elevato. L’infezione è di solito asintomatica,
ma anche in bambini e adulti sani esiste un rischio di malattia
se il ricevente è sieronegativo e riceve diverse unità. I pazienti
immunocompromessi e i neonati prematuri sieronegativi hanno
un rischio molto più elevato (10-30%) di malattia.
PATOGENESI
La malattia clinica deriva generalmente da una combinazione di depressione dell’immunità cellulare, replicazione virale non controllata con aumento del carico virale, interessamento multiorganico
e malattia terminale di organo secondaria a effetti citopatici diretti
causati dal virus. Un aumento dei livelli di replicazione virale, come
accertato in base alle copie del genoma, è utile per identificare i pazienti a rischio di malattia invasiva e disseminazione dell’infezione.
La presenza di CMV in aree di infiammazione aumenta l’espressione di mediatori solubili come citochine e chemochine portando
al reclutamento di cellule infiammatorie. Le interazioni tra il virus e
la risposta infiammatoria dell’ospite sembrano indurre replicazione
virale persistente, espressione genica virale e disseminazione.
MANIFESTAZIONI CLINICHE
I segni e sintomi dell’infezione da CMV variano con età, via di
trasmissione e immunocompetenza del paziente. L’infezione è subclinica nella maggior parte dei pazienti. Nei lattanti e nei bambini
più piccoli, l’infezione primitiva da CMV occasionalmente causa
polmonite, epatomegalia, epatite e rash petecchiali. Nei bambini
più grandi, adolescenti e adulti, il CMV può causare una sindrome simile alla mononucleosi caratterizzata da astenia, malessere,
mialgie, cefalea, febbre, epatosplenomegalia, aumento degli enzimi
epatici e linfocitosi atipica. Il decorso della mononucleosi da CMV
è generalmente lieve e dura 2-3 settimane. Le presentazioni cliniche
possono comprendere occasionalmente febbre persistente, epatite
conclamata o un rash morbilliforme. Nell’ospite immunocompetente le infezioni ricorrenti sono asintomatiche.
Soggetti immunocompromessi
Il rischio di malattia da CMV è aumentato nei soggetti immunocompromessi, con infezione sia primitiva sia ricorrente (Cap.
171). La malattia da infezione primitiva comprende polmonite (più
comune), epatite, corioretinite, malattia gastrointestinale o febbre
con leucopenia, come entità isolate o come manifestazioni di una
malattia generalizzata che può essere fatale. Il rischio è maggiore
nei soggetti sottoposti a trapianto di midollo osseo e nei pazienti
con AIDS. Polmonite, retinite e interessamento del sistema nervoso
centrale e del tratto gastrointestinale sono di solito severi e progressivi. Ulcerazioni sottomucose possono comparire in qualunque
punto del tratto gastrointestinale e possono causare emorragia e
perforazione. Possono verificarsi anche pancreatite e colecistite.
Infezione congenita
L’infezione congenita sintomatica da CMV era in origine denominata malattia da inclusioni citomegaliche. Soltanto il 5% di tutti
i neonati con infezione congenita ha una malattia da inclusioni
citomegaliche severa, un altro 5% presenta un interessamento
lieve e il 90% nasce con un’infezione da CMV subclinica ma
ugualmente cronica. I segni e sintomi caratteristici delle infezioni
clinicamente manifeste comprendono scarsa crescita intrauterina,
prematurità, epatosplenomegalia e ittero, rash tipo “dolcetto al
mirtillo” (blueberry muffin), trombocitopenia e porpora, microcefalia e calcificazioni intracraniche. Altri problemi neurologici
comprendono corioretinite, ipoacusia neurosensoriale e un leggero
aumento delle proteine nel liquido cerebrospinale. I neonati sintomatici sono di solito facili da identificare. Le infezioni congenite
sintomatiche più severe e quelle che determinano sequele derivano
con maggiore probabilità da un’infezione primitiva piuttosto che
dalla riattivazione di un’infezione nella donna gravida. La reinfezione da un differente ceppo di CMV può causare un’infezione
congenita sintomatica. L’infezione congenita asintomatica da CMV
è probabilmente la causa principale di ipoacusia neurosensoriale e
si verifica nel 7-10% circa di tutti i neonati con infezione congenita
da CMV, sia sintomatica alla nascita sia non sintomatica.
Infezione perinatale
Le infezioni che derivano dall’esposizione al CMV nel tratto genitale materno al momento del parto o con il latte materno si verificano
nonostante la presenza di anticorpi di derivazione materna acquisiti
passivamente. Il 6-12% circa delle madri sieropositive trasmette il
CMV ai propri bambini con le secrezioni cervico-vaginali contaminate e il 40% con il latte materno; i neonati di solito rimangono
asintomatici e non esibiscono sequele. Occasionalmente, l’infezione
da CMV acquisita in epoca perinatale è associata a polmonite
e sindrome tipo sepsi. I neonati prematuri e a termine possono
avere sequele neurologiche e ritardo psicomotorio. Tuttavia, il rischio di ipoacusia, corioretinite e microcefalia non sembra essere
aumentato. I neonati di peso molto basso alla nascita con infezione
da CMV acquisita tramite una trasfusione o con il latte materno
hanno un rischio di morbilità molto maggiore.
DIAGNOSI
L’infezione attiva da CMV è confermata nel modo migliore mediante isolamento del virus da urine, saliva, liquido di lavaggio
broncoalveolare, latte materno, secrezioni cervicali, buffy coat e
tessuti ottenuti mediante biopsia. L’identificazione rapida entro
24 ore è disponibile di routine con il sistema colturale potenziato
mediante centrifugazione, basato sulla ricerca degli antigeni precoci
del CMV mediante l’uso di anticorpi monoclonali. Si utilizzano
diversi metodi per la ricerca quantitativa rapida degli antigeni del
CMV e sono disponibili anche tecniche PCR quantitative. La presenza di eliminazione virale e di infezione attiva non distingue tra
infezioni primitive e ricorrenti. Un’infezione primitiva è confermata
dalla sieroconversione o dall’identificazione simultanea delle IgM
e delle IgG con ridotta avidità funzionale. Un semplice aumento
dei titoli anticorpali in pazienti inizialmente sieropositivi deve
essere interpretato con cautela, perché ciò può essere osservato
occasionalmente anni dopo l’infezione primitiva. Gli anticorpi IgG
persistono per tutta la vita. Per le prime settimane dopo l’infezione
primitiva, l’avidità funzionale degli anticorpi di classe IgG è molto
ridotta e raggiunge il picco in 4-5 mesi. Le IgM possono essere
dimostrate transitoriamente sia nell’infezione sintomatica sia in
quella asintomatica a 4-16 settimane, durante la fase acuta della
malattia sintomatica. Con questi esami, le IgM sono occasionalmente riscontrate (0,2-1%) nei pazienti con infezione ricorrente.
L’infezione ricorrente è definita in base alla ricomparsa dell’eliminazione virale in un paziente noto per essere stato sieropositivo
in passato. La distinzione tra riattivazione di un virus endogeno e
reinfezione da parte di un ceppo differente di CMV richiede l’analisi con gli enzimi di restrizione del DNA virale o la determinazione
1174 n Parte XVII Malattie infettive
degli anticorpi contro epitopi specifici per i diversi ceppi di CMV,
come gli epitopi della glicoproteina H.
Nei soggetti immunocompromessi, sono frequenti l’escrezione
del CMV, l’aumento dei titoli delle IgG e anche la presenza di
anticorpi IgM, e questo confonde notevolmente la possibilità di
distinguere le infezioni primitive da quelle ricorrenti. La dimostrazione della viremia mediante coltura buffy coat, ricerca degli
antigeni del CMV o del DNA del CMV tramite PCR implica una
malattia cronica e una prognosi peggiore, indipendentemente dal
fatto che l’infezione sia di tipo primitivo, ricorrente o incerto.
Infezione congenita
Il metodo definitivo per la diagnosi di infezione congenita da CMV
è l’isolamento del virus o la PCR, che devono essere eseguiti durante le prime 2 settimane di vita perché in seguito l’escrezione
virale può rappresentare un’infezione contratta alla nascita o subito
dopo. Urine e saliva sono i migliori campioni per la coltura; saliva e
sangue del cordone ombelicale sono i migliori per la PCR. I lattanti
con infezione congenita da CMV possono eliminare il CMV nelle
urine per diversi anni. Un test anticorpale per le IgG è di scarso
valore diagnostico in quanto un risultato positivo riflette anche gli
anticorpi materni, anche se un risultato negativo esclude la diagnosi
di infezione congenita da CMV. La dimostrazione di titoli stabili
o in aumento in campioni seriati durante il 1° anno di vita non è
utile, perché l’infezione acquisita nei primi mesi di vita è comune.
I test per le IgM di solito mancano di sensibilità e specificità e sono
inaffidabili per la diagnosi di infezione congenita da CMV.
I test anticorpali per le IgM e la determinazione dell’avidità delle
IgG per CMV possono permettere l’identificazione delle donne
ad alto rischio per la trasmissione del CMV in utero. L’infezione
fetale può essere confermata con l’isolamento virale dal liquido
amniotico. La sensibilità di questo metodo è eccellente dopo la
22ª settimana di gestazione. L’identificazione del genoma virale con
la PCR nel liquido amniotico è ugualmente sensibile e specifica; la
PCR quantitativa che dimostra 105 equivalenti genomici per mL
di liquido amniotico è un fattore predittivo di infezione congenita
sintomatica.
TRATTAMENTO
Ganciclovir, foscarnet e cidofovir sono inibitori della DNA polimerasi virale di accertata efficacia nella malattia da CMV il cui utilizzo è stato approvato negli Stati Uniti. Il trattamento è raramente
indicato nei soggetti immunocompetenti, ma è raccomandato per
i soggetti immunocompromessi, e rimane controverso per i lattanti
con infezione congenita sintomatica.
Soggetti immunocompromessi
Più severa è l’immunosoppressione, come quella richiesta dopo un
trapianto di midollo osseo, maggiore è la severità della malattia
da CMV. Il ganciclovir associato a immunoglobuline, sia immunoglobuline ev standard (IVIG) sia CMV IVIG iperimmuni, è stato
utilizzato per il trattamento delle infezioni da CMV potenzialmente
fatali in ospiti immunocompromessi (soggetti sottoposti a trapianto
di midollo osseo, cuore e rene e pazienti con AIDS). Due schemi
terapeutici pubblicati sono ganciclovir (7,5 mg/kg/die suddivisi
ogni 8 ore ev per 14 giorni) con CMV IVIG (400 mg/kg nei giorni
1, 2 e 7, e 200 mg/kg in 14ª giornata), e ganciclovir (7,5 mg/kg/
die suddivisi ogni 8 ore ev per 20 giorni) con IVIG (500 mg/kg a
giorni alterni per 10 dosi).
La retinite da CMV e la malattia gastrointestinale sembrano
rispondere clinicamente alla terapia ma, come l’eliminazione virale,
spesso recidivano alla cessazione. La tossicità da ganciclovir è frequente e spesso severa e comprende neutropenia, trombocitopenia,
disfunzione epatica, riduzione della spermatogenesi e anomalie
gastrointestinali e renali. Il valganciclovir orale, un profarmaco del
ganciclovir biodisponibile per via orale, causa una minore tossicità
e sembra avere la stessa efficacia del ganciclovir ev. Il foscarnet è un
farmaco antivirale alternativo, anche se sono disponibili informa-
zioni limitate sul suo uso nei bambini. La profilassi del CMV con
ganciclovir o aciclovir riduce il rischio di morbilità nel trapianto di
organi solidi. Il trattamento profilattico con valaciclovir negli adulti
(900 mg per os 1 volta al giorno per 90 giorni) è un trattamento
sicuro ed efficace per la prevenzione della malattia da CMV nei
pazienti sottoposti a trapianto di rene e pancreas.
I pazienti con mononucleosi da CMV di solito guariscono
completamente, anche se alcuni presentano sintomi protratti.
Anche la maggior parte dei pazienti immunocompromessi guarisce senza problemi, molti presentano una polmonite severa
con un elevato tasso di mortalità se si sviluppa un’ipossiemia.
L’infezione e la malattia da CMV possono essere fatali negli
individui con aumentata suscettibilità alle infezioni, come i pazienti con AIDS.
Infezione congenita
Uno studio randomizzato e controllato con ganciclovir (6 mg/kg/
dose ogni 12 ore ev per le prime 6 settimane di vita) ha concluso
che il trattamento previene il deterioramento dell’udito, migliora o
mantiene una normale funzione uditiva a 6 mesi di età e può prevenire il deterioramento uditivo che si verifica dopo 1 anno di età.
La tossicità correlata ai farmaci era comune e il 63% dei pazienti
trattati con ganciclovir sviluppava una neutropenia significativa,
rispetto al 21% di quelli nel gruppo non trattato. Gli ostacoli logistici della terapia ev per le prime 6 settimane, gli esigui benefici
ottenuti e gli effetti avversi hanno limitato l’entusiasmo per questo
trattamento. Uno studio randomizzato sul valganciclovir orale è
attualmente in corso per determinare la diversa efficacia dopo 42
giorni di trattamento e dopo 6 mesi di trattamento.
PREVENZIONE
L’uso di emoderivati privi di CMV, specialmente per i neonati prematuri, e, quando possibile, l’uso di organi provenienti da donatori
liberi dal CMV rappresentano importanti misure per la prevenzione
dell’infezione e la malattia da CMV nei pazienti ad alto rischio.
Le donne gravide sieropositive per il CMV sono a basso rischio di partorire un neonato sintomatico. Se possibile, le donne
gravide devono essere sottoposte a un test sierologico per il CMV,
specialmente se si prendono cura di bambini piccoli che sono
potenziali eliminatori del CMV. Alle donne gravide sieronegative
per il CMV deve essere raccomandato di lavarsi adeguatamente le
mani, adottare altre misure igieniche ed evitare qualsiasi contatto
con le secrezioni orali di altri individui. Le donne con sospetta
infezione recente da CMV possono essere sottoposte a ulteriori
indagini diagnostiche per accertare la trasmissione in utero e la
malattia fetale. Uno studio non controllato ha evidenziato che la
somministrazione di globuline iperimmuni per il CMV a donne
gravide con infezione primitiva da CMV può ridurre il rischio di
trasmissione dell’infezione al nascituro e persino ridurre il rischio
di malattia nel feto infetto.
Immunoprofilassi passiva
L’uso di IVIG o CMV IVIG per la profilassi dell’infezione nei
pazienti sottoposti a trapianto di organi solidi e midollo osseo
riduce il rischio di malattia sintomatica ma non previene l’infezione. L’efficacia della profilassi è più rilevante quando il rischio di
un’infezione primitiva da CMV è maggiore, come nel trapianto di
midollo osseo. Non esiste un consenso per un trattamento profilattico uniforme per l’infezione da CMV. I trattamenti raccomandati comprendono sia le IVIG (1.000 mg/kg), sia le CMV IVIG
(500 mg/kg), somministrate come singola dose ev iniziando entro
72 ore dal trapianto e successivamente 1 volta alla settimana fino
a 90-120 giorni dopo il trapianto.
Vaccinazione attiva
Il ruolo benefico dell’immunità è fondamentale, come illustrato
dal fatto che nella maggior parte dei casi la malattia più severa
fa seguito all’infezione primitiva, specialmente con l’infezione
Capitolo 248 Roseola infantum (herpes virus umani 6 e 7) n 1175
congenita, l’infezione acquisita tramite trasfusione e l’infezione in
pazienti trapiantati. Il 1° vaccino sperimentato negli esseri umani
è stato sviluppato dal ceppo vivo attenuato di CMV di Towne, che
si è dimostrato immunogeno ma non ha protetto dall’infezione i
soggetti sottoposti a trapianto renale o le donne adulte normali.
Tuttavia, nei soggetti sottoposti a trapianto renale il vaccino ha
ridotto la virulenza dell’infezione primitiva. Risultati promettenti
sono stati ottenuti con un vaccino per CMV costituito dalla glicoproteina B (gB) ricombinante dell’involucro e dall’adiuvante MF59.
I risultati di uno studio in doppio cieco controllato con placebo
condotto su donne adulte sieronegative hanno evidenziato che,
in seguito alla somministrazione di 3 dosi, il vaccino induceva
la produzione di anticorpi anti-gB e anticorpi neutralizzanti e
l’immunità cellulo-mediata.
Uno studio successivo condotto su 464 donne assegnate in
modo casuale a ricevere questo vaccino ad antigene purificato a
base di gB oppure placebo ha mostrato che, nel 50% dei casi, il
vaccino era in grado di prevenire l’infezione materna, determinata
mediante test per la rilevazione di anticorpi contro proteine di
CMV diverse dalla glicoproteina B. Tra i bambini nati dalle donne
coinvolte nello studio, è stata osservata un’infezione congenita nel
gruppo vaccino e 3 nel gruppo placebo.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Capitolo 248
Roseola infantum
(herpes virus umani 6 e 7)
Mary T. Caserta
L’herpes virus umano 6 (HHV-6) e l’herpes virus umano 7 (HHV-7)
sono causa di diffuse infezioni fra i lattanti e nella prima infanzia.
L’HHV-6 è responsabile della maggior parte dei casi di roseola
infantum (exanthema subitum o sesta malattia) ed è stato associato ad altre malattie, compresa l’encefalite, soprattutto in
ospiti immunocompromessi. Una piccola percentuale di bambini
con roseola presenta un’infezione primitiva da HHV-7.
EZIOLOGIA
HHV-6 e HHV-7 sono gli unici membri del genere Roseolovirus nella sottofamiglia dei Betaherpesvirinae degli herpes virus
umani. Il cytomegalovirus umano (CMV), l’unico altro b-herpesvirus, condivide una limitata omologia di sequenza con HHV-6
e HHV-7. Dal punto di vista morfologico, tutti gli herpes virus
umani sono composti da un nucleocapside icosaedrico, un tegumento proteico e un involucro (envelope) lipidico. All’interno
del nucleocapside, sia l’HHV-6 che l’HHV-7 contengono grandi
genomi lineari di DNA a doppia elica che codificano >80 proteine uniche.
Sono stati riconosciuti due tipi distinti di HHV-6: la variante
A e la variante B. I genomi dell’HHV-6 A e B sono altamente
conservati, con un’identità di sequenza di circa il 90%, ma possono
essere distinti in base all’analisi della lunghezza dei polimorfismi
dei frammenti di restrizione, alla reattività con gli anticorpi monoclonali, alla crescita differenziale nelle linee cellulari di coltura
dei tessuti e all’epidemiologia. Di conseguenza, alcuni ricercatori
suggeriscono di considerarli virus separati. Sebbene la frequenza
dell’individuazione del DNA della variante A dell’HHV-6 differisca
nei vari studi, la variante B è il ceppo di gran lunga predominante
negli ospiti sia normali sia immunocompromessi, indifferentemente
in coltura e nella reazione a catena della polimerasi (PCR). L’in-
fezione primitiva da variante A dell’HHV-6 è stata individuata in
bambini in Africa. Non è chiaro se le differenze nell’individuazione
del DNA della variante A dell’HHV-6 e del DNA della variante
B siano correlati a un diverso tropismo dei tessuti, a differenze
nel modo o nell’età di acquisizione, a differenze nella capacità di
causare malattia nell’uomo o alla localizzazione geografica della
popolazione studiata.
EPIDEMIOLOGIA
L’infezione primitiva da HHV-6 è acquisita rapidamente da praticamente tutti i bambini in seguito alla perdita degli anticorpi
materni nei primi mesi di vita, e il 95% dei bambini viene infettato
dall’HHV-6 entro i 2 anni. L’età di picco dell’infezione primitiva
da HHV-6 è 6-9 mesi di vita, con infezioni sporadiche e senza
predilezione stagionale. Anche l’infezione da HHV-7 è diffusa,
ma si verifica più avanti nell’infanzia e con un tasso più lento;
entro i 3 anni di età, solo il 50% dei bambini presenta evidenze di
precedente infezione da HHV-7. La sieroprevalenza raggiunge il
75% a 3-6 anni di età. In un piccolo studio su bambini con infezione primitiva da HHV-7, l’età media dei pazienti era di 26 mesi,
significativamente maggiore di quella dei bambini con infezione
acuta da HHV-6.
Sebbene si supponga che i bambini acquisiscano l’infezione
primitiva da HHV-6 e HHV-7 dalla saliva di adulti asintomatici,
nell’1% dei neonati si verifica un’infezione congenita da HHV-6.
Sono stati identificati due meccanismi di trasmissione verticale
dell’HHV-6: l’infezione transplacentare e l’integrazione cromosomica (CI-HHV6). HHV-6 è unico fra gli herpes virus umani in
quanto è integrato nella terminazione telomerica dei cromosomi
umani con una frequenza del 0,2-2,2% della popolazione e viene
trasmesso da genitore a figlio attraverso la linea germinale. Il
principale meccanismo di trasmissione verticale dell’HHV-6 è stato
identificato nell’integrazione cromosomica, che spiega l’86% delle
infezioni congenite, un terzo delle quali è dovuto alla variante A. Le
conseguenze cliniche dell’integrazione cromosomica o dell’infezione transplacentare da HHV-6 non sono ancora state determinate.
In una serie di lattanti in cui è stata identificata infezione congenita
da HHV-6, nel primo periodo neonatale non erano presenti segni di
malattia. L’infezione congenita da HHV-7 non è stata dimostrata.
Nelle secrezioni cervicali di donne incinte è stato identificato il
DNA sia dell’HHV-6 che dell’HHV-7, il che suggerisce un ruolo
aggiuntivo della trasmissione sessuale o perinatale di questi virus.
Non sembra invece che il latte materno abbia un ruolo nella trasmissione dell’HHV-6 e dell’HHV-7.
PATOLOGIA/PATOGENESI
L’infezione primitiva da HHV-6 causa una viremia che può essere
dimostrata mediante co-cultura delle cellule mononucleate del
sangue periferico (PBMC, peripheral blood mononuclear cells)
del paziente con le cellule mononucleate ematiche del midollo
stimolate con mitogeni. L’HHV-6 ha un effetto citopatico riconoscibile, consistente nella comparsa di grandi cellule mononucleate
o multinucleate refrattili con inclusioni intracitoplasmatiche e/o
intranucleari. Le cellule infette mostrano di avere una vita leggermente prolungata nelle colture; tuttavia, predomina l’infezione
litica. L’infezione da HHV-6 induce anche apoptosi dei linfociti
e può portare a morte cellulare tramite perdita del potenziale di
membrana mitocondriale, oltre che tramite alterazione dei segnali
di morte cellulare indotta da interferone e acido retinoico. In
vitro, l’HHV-6 è in grado di infettare un’ampia gamma di tipi di
cellule, fra cui linfociti T primari, monociti, cellule natural killer
(NK), cellule dendritiche e astrociti. L’HHV-6 ha anche dimostrato di infettare linee cellulari megacariocitiche, endoteliali,
epiteliali e di linfociti B. Ex vivo, nell’uomo, sono stati infettati
dall’HHV-6 astrociti, oligodendrociti e cellule microgliali. L’ampio
tropismo dell’HHV-6 è coerente con il fatto che la CD46, una
proteina regolatrice del complemento presente sulla superficie di
1176 n Parte XVII Malattie infettive
tutte le cellule nucleate, è un recettore cellulare per l’HHV-6. La
molecola CD4 è stata identificata come recettore per l’HHV-7. È
stato dimostrato che l’HHV-7 riattiva l’HHV-6 dalla latenza in
vitro, ma non è ancora noto se questo fenomeno si verifichi anche
in vivo.
L’infezione primitiva da HHV-6 e HHV-7 è seguita dalla latenza
o persistenza del virus in varie sedi per tutta la vita. L’HHV-6 è
presente in un vero stato di latenza virale in monociti e macrofagi.
è stata descritta anche l’individuazione di HHV-6 in replicazione
in colture di cellule staminali CD34+ emopoietiche primarie, il
che suggerisce che la differenziazione cellulare è un trigger della
riattivazione virale. Questa osservazione potrebbe essere clinicamente significativa, a causa della possibilità che l’HHV-6 provochi
un’infezione primitiva o riattivata durante il trapianto delle cellule
staminali emopoietiche. Inoltre, l’infezione da HHV-6 e HHV-7
può essere persistente nelle ghiandole salivari e nella saliva sia
di adulti sia di bambini può essere normalmente identificato il
DNA sia dell’HHV-6 che del l’HHV-7. A differenza dell’HHV-6,
l’HHV-7 può essere isolato anche nelle colture tissutali da saliva. Il
DNA dell’HV-6 è stato identificato nel liquido cerebrospinale (CSF)
di bambini, sia durante sia successivamente all’infezione primitiva,
oltre che nel tessuto cerebrale di adulti immunocompetenti durante
autopsia, indicando in questo modo il ruolo dell sistema nervoso
centrale (SNC) come un’ulteriore sede importante di latenza o
persistenza virale. Il DNA dell’HHV-7 è stato rinvenuto inoltre nel
tessuto cerebrale di adulti, ma con una frequenza significativamente
inferiore.
MANIFESTAZIONI CLINICHE
La roseola infantum (exanthema subitum o sesta malattia) è una
malattia esantematica acuta e autolimitata dei lattanti e dei primissimi anni di vita. È caratterizzata dalla comparsa improvvisa di
febbre, talvolta accompagnata da irritabilità. La febbre si risolve
in genere all’improvviso dopo 72 ore (“crisi”) ma può scomparire
gradualmente nel giro di un giorno (“lisi”) in coincidenza con la
comparsa di un lieve rash morbilliforme di 2-3 mm sul tronco,
di colore rosa pallido, non pruriginoso (Fig. 248.1). Il rash dura
solitamente 1-3 giorni, ma è spesso descritto come evanescente e
può restare visibile solo per qualche ora, diffondendosi dal tronco
al viso e agli arti. L’eruzione cutanea, essendo variabile dal punto di
vista di aspetto, localizzazione e durata, non è caratteristica. I segni
associati sono scarsi, ma possono comprendere lieve infiammazione
della faringe, della congiuntiva palpebrale o delle membrane timpaniche, e lieve linfoadenopatia suboccipitale. Nei Paesi asiatici,
nei bambini con roseola sono spesso segnalate ulcere a livello della
giunzione uvulopalatoglossica (chiazze di Nagayama).
La febbre alta (in media 39,7 °C) è il reperto più costante associato all’infezione primitiva da HHV-6. Il rash individuato durante
la malattia o in seguito alla defervescenza è stato segnalato in circa
il 20% dei bambini infetti negli USA. Altri sintomi e segni sono
irritabilità, infiammazione delle membrane timpaniche, rinorrea
e congestione nasale, disturbi gastrointestinali ed encefalopatia. I
sintomi dell’interessamento delle vie aeree inferiori, come la tosse,
sono presenti con frequenza significativamente minore nei bambini
con infezione primitiva da HHV-6 rispetto ai bambini con altre
malattie febbrili. La durata media della malattia dovuta a infezione
primitiva da HHV-6 è di 6 giorni, con febbre presente per 6 o più
giorni nel 15% dei bambini. L’infezione primitiva da HHV-6 comporta un onere significativo per il sistema sanitario; da uno studio è
emerso che il 24% delle visite in pronto soccorso per i bambini di
6-9 mesi di età erano dovute a infezione primitiva da HHV-6. Uno
studio dell’infezione primitiva da HHV-6 basato sulla popolazione
ha confermato che il 93% dei bambini presentava sintomi e aveva
maggiori probabilità di vedere un medico dei bambini non infetti.
Nell’infezione da HHV-6 nei lattanti di età <6 mesi la febbre è
risultata meno frequente, mentre è significativamente più comune
nei lattanti più grandi e nei bambini.
Le manifestazioni cliniche dell’infezione da HHV-7 sono invece
molto meno note. L’infezione primitiva da HHV-7 è stata identificata in un piccolo numero di bambini con roseola nei quali la
malattia è indistinguibile da quella dovuta ad HHV-6. Sono stati
segnalati anche casi secondari di roseola dovuta a infezione da
HHV-7. Inoltre, l’infezione primitiva da HHV-7 potrebbe essere
asintomatica o causare una malattia febbrile non specifica che dura
all’incirca 3 giorni.
Figura 248.1 Roseola infantum. Macule
e papule eritematose che schiariscono alla
pressione (A) in un lattante che aveva presentato
febbre elevata per 3 giorni prima dell’eruzione
cutanea. A un esame più ravvicinato (B ), alcune
lesioni rivelano un lieve alone periferico
di vasocostrizione. (Da Paller AS, Mancinin AJ,
editors: Hurwitz clinical pediatric dermatology,
ed 3, Philadelphia, 2006, Elsevier, p 434.)
Capitolo 248 Roseola infantum (herpes virus umani 6 e 7) n 1177
REPERTI DI LABORATORIO
Il reperto di laboratorio più caratteristico riscontrato nei bambini
con infezione primitiva da HHV-6 è la riduzione del numero medio
di leucociti totali (8.900/mm3), linfociti (3.400/mm3) e neutrofili
(4.500/mm3), rispetto ai bambini febbricitanti ma senza infezione
primitiva da HHV-6. Reperti ematologici simili sono stati riportati
anche per l’infezione primitiva da HHV-7. Sporadicamente, nei
bambini con infezione primitiva da HHV-6 sono stati notati inoltre
trombocitopenia, transaminasi sieriche elevate e linfociti atipici.
Le analisi del CSF nei pazienti con encefalite la cui eziologia
fosse ritenuta l’HHV-6, sono risultate normali o hanno dimostrato
solo una lieve pleocitosi del CSF con minimi aumenti delle proteine.
Alla RM sono state individuate aree di segnale iperintenso nelle immagini T2-pesate e FLAIR (Fluid Attenuation Inversion Recovery)
di ippocampo, giro uncinato e amigdala, mentre la tomografia
a emissione di positroni (PET) ha evidenziato un aumento del
metabolismo all’interno dell’ippocampo.
DIAGNOSI
Sebbene la roseola sia generalmente una malattia esantematica
benigna e autolimitata, la sua diagnosi può escludere altre cause
più gravi di febbre ed eruzione cutanea. Una storia di 3 giorni di
febbre alta in un lattante di 10 mesi senza altri segni di tossicità,
con rash maculopapuloso sul tronco che schiarisce alla pressione
suggerisce la diagnosi di roseola. Analogamente, in genere non è
necessaria una specifica diagnosi dell’HHV-6, se non nelle situazioni in cui le manifestazioni dell’infezione sono gravi o insolite, e
potrebbero beneficiare della terapia antivirale.
La diagnosi di infezione primitiva da HHV-6 o HHV-7 è confermata dimostrando la presenza del virus che si replica attivamente
nel campione di sangue del paziente, associata a sieroconversione.
La coltura virale è il metodo principe per documentare la replicazione virale attiva. Purtroppo, la coltura è costosa, richiede tempo ed è
disponibile solo nei laboratori di ricerca. Due altri metodi usati per
identificare la replicazione attiva dell’HHV-6 sono l’individuazione
del DNA virale mediante PCR nei fluidi acellulari come il plasma,
e la transcrittasi inversa PCR (RT-PCR) sui campioni di PBMC,
progettata per individuare la trascrizione e la produzione di proteine del virus. Anche la PCR quantitativa per numero di copie del
genoma dell’HHV-6 su diversi campioni è riportata di frequente e
disponibile in commercio, ma il ruolo di questa metodologia non
è chiaro, in quanto non è stato determinato un valore specifico del
DNA che consenta di discriminare fra i pazienti con viremia e quelli
con coltura negativa. A complicare l’utilizzo dei test molecolari per
l’individuazione della replicazione attiva dell’HHV-6 vi è il fatto
che i soggetti con HHV-6 integrato a livello cromosomico hanno
cariche virali costantemente elevate del DNA dell’HHV-6 in plasma, PBMC e CSF anche in assenza di malattia e viremia.
Per la misurazione delle concentrazioni di anticorpi verso HHV6 e HHV-7 in siero o plasma, sono stati descritti, e sono disponibili
in commercio, metodi sierologici come i test dell’immunofluorescenza indiretta, i saggi di immunoassorbimento enzimatico (ELISA), i test di neutralizzazione e l’immunoblot. Sebbene gli anticorpi
IgM siano prodotti precocemente durante l’infezione da HHV-6, i
test progettati per misurare questa risposta non si sono dimostrati
utili nella diagnosi dell’infezione primitiva o riattivata. L’assenza di
anticorpi IgG in un lattante di età >6 mesi, combinata alla presenza
di virus in replicazione, è una prova importante di infezione primitiva da HHV-6 o HHV-7. In alternativa, anche la dimostrazione
della sieroconversione fra campioni in acuto e in convalescenza
conferma l’infezione primitiva, ma non è clinicamente utile per la
terapia in acuto. Purtroppo, i test sierologici non si sono dimostrati affidabili per individuare la riattivazione dell’HHV-6 e non
possono essere usati per distinguere l’infezione dovute alle varianti
A e B dell’HHV-6. Inoltre, fra HHV-6 e HHV-7 è stata dimostrata
una limitata reattività crociata, il che complica l’interpretazione dei
test sierologici, soprattutto se sono riportati titoli bassi.
Diagnosi differenziale
L’infezione primitiva da HHV-6 o HHV-7 causa in genere una
malattia febbrile indifferenziata che può essere molto difficile da
distinguere da altre comune infezioni virali dell’infanzia. Questa
difficoltà vale anche per i primi stadi della roseola, prima dello
sviluppo dell’esantema. Una volta presente il rash, la roseola può
essere confusa con altre malattie esantematiche dell’infanzia,
in particolare morbillo e rosolia. I bambini affetti da rosolia,
diversamente da quelli con roseola, hanno spesso un periodo
prodromico caratterizzato da lieve malessere con febbricola, mal
di gola, artralgia e disturbi gastrointestinali. All’esame obiettivo,
i linfonodi suboccipitali e retroauricolari sono ingrossati fino a
1 settimana prima che si manifesti il rash della rosolia, e persistono per tutta la fase esantematica. Inoltre, il rash della rosolia inizia
in genere sul viso e si diffonde al petto, come quello del morbillo.
I sintomi associati all’infezione virale del morbillo comprendono
tosse, coriza e congiuntivite, con febbre elevata in coincidenza
con lo sviluppo dell’esantema, diversamente da quanto accade
nella roseola.
La roseola potrebbe anche essere confusa con la scarlattina, per
quanto quest’ultima sia rara nei bambini di età <2 anni e causi
un caratteristico rash dall’aspetto a carta vetrata, contemporaneo alla febbre. La roseola può essere confusa con il malessere
dovuto alle infezioni da enterovirus, soprattutto nei mesi estivi e
autunnali. Anche le reazioni da ipersensibilità ai farmaci possono
essere difficili da distinguere dalla roseola. Spesso, ai bambini con
febbre dovuta a roseola vengono prescritti antibiotici prima della
comparsa dell’esantema; in questi casi, i bambini che manifestano
rash dopo la risoluzione della febbre possono essere erroneamente
etichettati come allergici al farmaco.
COMPLICANZE
Le convulsioni sono la complicanza più comune della roseola e
vengono riconosciute in un terzo dei pazienti. Le crisi convulsive
sono anche la complicanza più comune nei bambini con infezione
primitiva da HHV-6, e si verificano in circa il 15% dei casi, con
un picco a 12-15 mesi di età. Nei bambini con infezione primitiva
da HHV-6 è stata segnalata inoltre una maggior frequenza di
crisi parziali, crisi prolungate, paralisi postictale e crisi ripetute
rispetto ai bambini con crisi febbrili non associate ad HHV-6. In
uno studio limitato a bambini con infezione primitiva da HHV-6
e crisi convulsive, il 30% dei pazienti ha avuto crisi prolungate, il
29% crisi focali e il 38% crisi ripetute.
Da uno studio prospettico su bambini di 2-35 mesi di età con
sospetta encefalite o grave malattia con convulsioni e febbre è
emerso che il 17% aveva un’infezione primitiva da HHV-6 o
HHV-7, e la presentazione più comune era lo stato epilettico.
Nonostante la gravità segnalata delle crisi durante l’infezione
primitiva da HHV-6 e HHV-7, dati limitati suggeriscono che vi
possa essere una diminuzione del rischio di crisi ricorrenti dopo
infezione primitiva da HHV-6 rispetto a crisi di tipo febbrile
dovute ad altre cause.
Case report e piccole serie di pazienti hanno descritto ulteriori
complicanze nei bambini con infezione primitiva da HHV-6, incluse encefalite, demielinizzazione disseminata acuta, cerebellite
acuta, epatite e miocardite. Sequele a lungo termine a esordio
tardivo, fra cui disabilità dello sviluppo e caratteristiche di tipo
autistico, sono state riferite raramente in bambini con sintomi a
carico del SNC durante infezione primitiva da HHV-6.
È stata suggerita un’associazione fra crisi ricorrenti e infezione
riattivata o persistente del SNC da parte dell’HHV-6. Da studi
di valutazione di campioni di tessuto cerebrale è emerso il coinvolgimento dell’HHV-6 anche nel 35% dei pazienti con epilessia
del lobo temporale, con individuazione di elevate cariche virali
nell’ippocampo o nelle regioni del lobo temporale laterale. La
produzione di proteine dell’HHV-6 è stata identificata inoltre in un
piccolo numero di campioni di tessuto resecato. Gli astrociti primari ottenuti da questi campioni contenevano livelli non ­rilevabili
1178 n Parte XVII Malattie infettive
di un trasportatore del glutammato, il che suggerisce che la perdita
della capacità di controllare i livelli di glutammato sia un possibile
meccanismo per lo sviluppo di crisi ricorrenti.
La riattivazione dell’HHV-6 è stata segnalata in numerose popolazioni diverse con e senza malattia, con l’uso di vari metodi di
rilevamento. La riattivazione dell’HHV-6 è stata documentata molto bene soprattutto in ospiti immunocompromessi, in particolare
nei pazienti sottoposti a trapianto di cellule staminali emopoietiche
(Hematopoietic stem Cell Transplantation, HSCT).
Tale riattivazione si verifica in circa il 35-50% dei pazienti,
solitamente 2-4 settimane dopo il trapianto. Sono state associate
a riattivazione dell’HHV-6 molte delle complicanze cliniche viste
in seguito a HSCT, quali febbre, rash, ritardo dell’attecchimento
di piastrine o monociti e graft versus host disease, con gradi
variabili di sostegno in letteratura. La riattivazione dell’HHV-6
è stata segnalata anche come causa di encefalite in ospiti sia
normali che immunocompromessi. È stata descritta una sindrome distinta da encefalite limbica post-HSCT, caratterizzata
da disfunzione della memoria a breve termine, confusione e
insonnia con crisi notate clinicamente o al monitoraggio elettroencefalografico (EEG) prolungato. Nel CSF della maggior
parte di questi pazienti è stato identificato il DNA dell’HHV-6
DNA. Inoltre, in un campione post mortem sono state identificate
proteine dell’HHV-6 negli astrociti dell’ippocampo, che suggeriscono un’infezione da HHV-6 al momento del decesso. A causa
della variabilità della sensibilità dei metodi di PCR e dell’elevata
prevalenza del DNA dell’HHV-6 in varie sedi dell’organismo in
seguito a infezione primitiva, è molto difficile valutare la validità
di queste segnalazioni.
TRATTAMENTO
Per i bambini affetti da roseola, solitamente è necessaria solo una
terapia di supporto. Occorre consigliare ai genitori di mantenere
l’idratazione e di utilizzare antipiretici se il bambino è particolarmente disturbato dalla febbre. Per i casi di infezione primitiva da
HHV-6 o HHV-7 di routine non si raccomanda una terapia antivirale specifica. Possono beneficiare del trattamento manifestazioni
insolite o gravi di infezione da HHV-6 primitiva o presumibilmente
riattivata come l’encefalite, soprattutto nei pazienti immunocompromessi. Ganciclovir, foscarnet e cidofovir dimostrano attività inibitoria su HHV-6 in vitro, analoga alla loro attività contro CMV.
I case report suggeriscono che tutti e tre i farmaci, da soli o in
combinazione, possono ridurre la replicazione virale dell’HHV-6,
come dimostrato dalla diminuzioni delle cariche virali in plasma
e CSF, ma i dati clinici sull’efficacia sono scarsi e contraddittori,
e mancano studi randomizzati che ne guidino l’utilizzo. Inoltre è
stata descritta resistenza in vitro di HHV-6 a ganciclovir. Foscarnet
sembra essere il più attivo contro HHV-7 in base ai test in vitro,
ma non sono disponibili dati clinici.
PROGNOSI
La roseola è generalmente una malattia autolimitata associata a
guarigione completa. Anche la maggior parte dei bambini con
infezioni primitive da HHV-6 e HHV-7 guarisce tranquillamente
e senza sequele. Sebbene le crisi convulsive siano una complicanza
comune dell’infezione primitiva da HHV-6 e HHV-7, il rischio di
crisi ricorrenti non appare superiore a quello associato ad altre
cause di crisi febbrili.
PREVENZIONE
Le infezioni primitive da HHV-6 e HHV-7 sono diffuse in tutta
la popolazione umana, attualmente senza alcuna possibilità di
interrompere la trasmissione.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Capitolo 249
Herpes virus umano 8
Mary T. Caserta
L’herpes virus umano 8 (HHV-8) è stato identificato per la prima volta in campioni di tessuto da pazienti affetti da sarcoma di
Kaposi (KS) e per questo motivo è noto anche come herpes virus
associato al sarcoma di Kaposi (KSHV). Successivamente, l’HHV-8
è stato riconosciuto come agente eziologico di altre due malattie
linfoproliferative: linfoma a effusione primaria (PEL) e malattia
multicentrica di Castleman.
EZIOLOGIA
L’HHV-8 è un herpes virus g-2-umano geneticamente analogo
soprattutto al virus di Epstein-Barr, e contiene un ampio genoma
che codifica per 85-95 proteine uniche. L’infezione è seguita da stati
virali sia litici che latenti, con diversi gradi di replicazione virale
associata a distinte manifestazioni patologiche.
EPIDEMIOLOGIA
La prevalenza dell’infezione da HHV-8 varia sia geograficamente
che per popolazione e corrisponde all’incirca all’epidemiologia del
KS. L’HHV-8 è endemico in Africa e in alcune zone dell’America
Latina, con tassi di infezione che arrivano al 30-60% entro l’adolescenza. Anche in regioni confinanti con il Mediterraneo è stata
trovata una sieroprevalenza >20%. In America Settentrionale,
Europa centrale e Asia, invece, si riscontrano tassi di infezione
<5%. All’interno delle stesse regioni geografiche, però, la prevalenza dell’infezione varia in base ai comportamenti a rischio, e fra gli
uomini che fanno sesso con altri uomini in America Settentrionale
ed Europa l’incidenza è del 30-75%. Il DNA dell’HHV-8 può essere
rilevato nella saliva e nelle secrezioni genitali. Nel complesso, questi
reperti portano a riconoscere che nelle zone in cui l’infezione da
HHV-8 è endemica la trasmissione ai bambini avviene principalmente attraverso la saliva, mentre nelle zone a bassa prevalenza il
contatto sessuale è una fonte di infezione fra gli adulti. Altre vie
di trasmissione meno comuni dell’HHV-8 sono le trasfusioni di
sangue, il trapianto di midollo osseo e il trapianto di organi solidi.
La trasmissione verticale può avvenire in regioni in cui l’HHV-8 è
altamente endemico, ma il rischio appare basso.
PATOLOGIA E PATOGENESI
L’HHV-8 contiene geni multipli che hanno un impatto sulla regolazione del ciclo cellulare e sulla risposta immunitaria dell’ospite.
Le proteine virali interferiscono con la funzione di soppressori
tumorali delle molecole p53 e con la proteina del retinoblastoma,
inducono l’espressione di fattori proangiogenesi, del fattore di crescita endoteliale vascolare (VEGF) A e del recettore-2 del VEGF,
e conducono alla sovraregolazione della via umana del target di
rapamicina per i mammiferi (mTOR), fondamentale nel controllo
della crescita e del metabolismo cellulari. L’HHV-8 codifica anche
un omologo dell’interleuchina-6 (IL-6) umana in grado di legarsi
ai recettori per le citochine, attivandoli, e di fungere da fattore di
crescita autocrino della cellula ospite. Inoltre, alcune proteine virali
sono associate all’espressione costitutiva del fattore di trascrizione
nucleare (NF-kB). Tutte queste proteine sono bersagli potenziali
dell’intervento terapeutico.
MANIFESTAZIONI CLINICHE
Sebbene l’infezione subclinica sembri comune, l’infezione primitiva
sintomatica da HHV-8 è stata descritta anche in bambini immunocompetenti. Questi pazienti in genere avevano febbre e un rash
Capitolo 250 Virus dell’influenza n 1179
maculopapulare o una sindrome analoga alla mononucleosi, che
esitavano, di regola, con una completa guarigione.
Il KS ha varie forme cliniche diverse, ciascuna delle quali comprende lesioni angiogeniche multifocali derivanti dalle cellule
endoteliali vascolari infettate dall’HHV-8. Il KS classico è una
malattia non dolorosa che colpisce gli uomini anziani con limitato
coinvolgimento della pelle degli arti inferiori. Il KS endemico è più
aggressivo e colpisce bambini e giovani, soprattutto in Africa, e può
comprendere coinvolgimento dei visceri e lesioni cutanee diffuse
(chiazze, placche o noduli). Il KS post-trapianto e il KS correlato
all’AIDS sono le forme più gravi, con lesioni disseminate spesso
all’apparato digerente e ai polmoni, oltre che alla cute.
Il linfoma a effusione primaria è una malattia rara causata
dall’HHV-8 che si manifesta soprattutto nei soggetti infetti da HIV,
che comporta l’invasione linfomatosa delle superfici sierose della
pleura, del pericardio e del peritoneo.
Analogamente, la malattia multicentrica di Castleman è un
raro disturbo linfoproliferativo caratterizzato da anemia, trombocitopenia, linfoadenopatia generalizzata e sintomi costituzionali, e
associato di frequente all’infezione da HHV-8 e a un alto grado di
replicazione virale.
DIAGNOSI
I test sierologici quali immunofluorescenza, ELISA e Western blot,
sono i metodi principali di diagnosi dell’infezione da HHV-8. I
test hanno però sensibilità, specificità e riproducibilità limitate
e costituiscono soprattutto uno strumento di ricerca. Inoltre è
stata descritta la perdita di anticorpi nel tempo, la cosiddetta
sieroreversione, che complica ulteriormente la diagnosi sierologia.
Per l’individuazione del genoma dell’HHV-8 in campioni di tessuto
sono disponibili metodi immunoistochimici e molecolari.
TRATTAMENTO
Il trattamento di KS, PEL e malattia multicentrica di Castleman è
molteplice e comprende tentativi per controllare le proliferazioni
maligne con la radioterapia e i regimi chemioterapici tradizionali
nonché con agenti mirati a specifiche vie cellulari che sono bersaglio delle proteine dell’HHV-8.
Sono allo studio terapie come la rapamicina per bloccare la via
mTOR, inibitori del proteosoma tesi a ridurre l’attivazione dell’NF-kB e anticorpi monoclonali per bloccare il recettore dell’IL-6
o il CD20. Inoltre, nei pazienti con infezione da HIV, la terapia
antiretrovirale ad alta attività (HAART) è un caposaldo della
terapia della malattia correlata all’HHV-8. Il valganciclovir orale
diminuisce sia la quantità che la frequenza dell’individuazione
dell’HHV-8 nella saliva, il che suggerisce che una terapia antivirale
specifica possa svolgere un ruolo anche nel trattamento o nella
prevenzione delle malattie dovute all’HHV-8.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Capitolo 250
Virus dell’influenza
Peter F. Wright
Le infezioni da virus influenzali causano un’ampia varietà di malattie respiratorie responsabili ogni anno di una significativa morbilità
e mortalità nei bambini. L’influenza è in grado di causare pandemie
globali periodiche con una penetranza della malattia ancora più
elevata, come testimoniato dalla pandemia del 2009 dal nuovo
ceppo H1N1.
EZIOLOGIA
I virus influenzali sono membri della famiglia delle Orthomyxoviridae. Si tratta di virus di grandi dimensioni a RNA a filamento
singolo con genoma segmentato racchiuso in un involucro. Le
due principali proteine di superficie che determinano il sierotipo
dell’influenza, l’emoagglutinina (HA) e la neuraminidasi (NA), si
proiettano come punte attraverso l’involucro. I virus influenzali
si dividono in tre tipi: A, B e C. I tipi influenzali sono i principali
patogeni influenzali e causano la malattia epidemica. Il tipo influenzale C è una causa sporadica di una malattia prevalentemente
a carico delle vie respiratorie superiori. I tipi influenzali A e B
si dividono ulteriormente in ceppi sierotipicamente distinti che
circolano su base annuale nella popolazione.
EPIDEMIOLOGIA
I virus dell’influenza A presentano un’epidemiologia complessa che
coinvolge ospiti come uccelli e mammiferi che servono da serbatoio
dei diversi ceppi che hanno la capacità di infettare la popolazione
umana. La natura segmentata del genoma del virus dell’influenza
consente il riassortimento tra virus animali e umani in caso di coinfezione. Pertanto, potenzialmente tutte le 15 HA e le 9 NA presenti nei
serbatoi animali possono essere introdotte negli esseri umani; questi
virus dell’influenza A si comportano epidemiologicamente come se
fossero sierotipi immunologicamente distinti senza protezione crociata. Alterazioni minori all’interno di un sierotipo sono denominate
drift antigenico; alterazioni maggiori del sierotipo vengono definite
shift antigenico. Gli uccelli migratori possono diffondere la malattia,
come si è visto con l’attuale influenza aviaria da H5N1. L’introduzione di nuovi ceppi di HA si è verificata in Estremo Oriente con i
virus H5N1 e H9N2, in Olanda con il virus H7N7 e in Messico nel
2009 con il nuovo virus H1N1 di origine suina. Il virus altamente
virulento dell’influenza aviaria H5N1 è una potenziale minaccia
di una diffusione più ampia nella popolazione umana. Dalla metà
del 2009, sono stati documentati >400 casi. Ha dimostrato la sua
virulenza con una mortalità >50% negli esseri umani a diretto
contatto con pollame infetto, anche se non ha ancora acquisito la
capacità di diffondersi rapidamente da persona a persona.
Il nuovo virus H1N1 è emerso in Messico nella primavera del
2009 e si è diffuso così estesamente che nel giugno del 2009 è stata
dichiarata una pandemia globale. Nell’autunno del 2009 si è diffuso
attraverso tutti gli Stati Uniti, provocando di solito disturbi lievi, ma
occasionalmente anche morte, soprattutto nelle donne gravide e nei
pazienti con patologie sottostanti. Il virus dell’influenza B ha una
capacità molto minore di andare incontro a variazioni antigeniche
maggiori e non ha un serbatoio animale identificato.
L’epidemiologia mondiale dei virus influenzali dimostra una
diffusione annuale tra gli emisferi settentrionale e meridionale
e spesso l’origine di nuovi ceppi può essere ricondotta all’Asia.
Quando un virus identificato in base a una HA o a una NA nuove e sierologicamente distinte entra nella popolazione, esiste un
potenziale di pandemia influenzale con un eccesso di morbilità e
mortalità su scala globale in una popolazione in gran parte non
immune. La pandemia più drammatica della storia recente si è
verificata nel 1918, quando si stima che l’influenza abbia ucciso
>20 milioni di persone. Più frequente è la variazione quasi annuale
della composizione antigenica delle proteine di superficie, che
conferisce un vantaggio selettivo a un nuovo ceppo e determina
epidemie localizzate della malattia con tassi di ospedalizzazione
e mortalità più elevati nei bambini più piccoli, negli anziani e nei
soggetti con malattia cardiopolmonare. Il ceppo circolante ogni
anno è nuovo per i bambini più piccoli, in quanto essi non possiedono anticorpi preesistenti a eccezione di quelli trasferiti dalla
madre nei neonati.
1180 n Parte XVII Malattie infettive
Il tasso di attacco e la frequenza di isolamento dell’influenza
sono più elevati nei bambini più piccoli. In un anno tipico almeno il
30-50% dei bambini presenta un’evidenza sierologica di infezione.
L’influenza è causa di un aumento dell’assenteismo scolastico
e da un picco annuale delle visite per patologia dal pediatra. I
bambini sottoposti a esposizione primaria a un ceppo influenzale
presentano livelli più elevati e una maggiore eliminazione del virus
rispetto agli adulti, cosa che li rende trasmettitori estremamente
efficaci dell’infezione. L’influenza è una malattia dei mesi più freddi
dell’anno nei climi temperati. La diffusione sembra essere legata a
un aerosol di microparticelle e la trasmissione in una comunità è
rapida, con l’incidenza più elevata di malattia che si verifica entro
2-3 settimane dall’introduzione. L’influenza è stata implicata nella
diffusione ospedaliera dell’infezione e può complicare la malattia
originale che ha richiesto l’ospedalizzazione.
Su una base nazionale o globale, 1 o 2 ceppi predominanti si
diffondono per creare l’epidemia annuale. Fino al 2009, i ceppi
di influenza A con sierotipi H1N1 e H3N2 e i ceppi di tipo B
circolavano contemporaneamente e ognuno dei due tipi poteva
predominare in un certo anno, permettendo di predire sierotipo
e severità della prossima stagione influenzale. Non è chiaro se il
nuovo ceppo H1N1 altererà questo pattern.
I ceppi varianti sono identificati in base ai loro sierotipi HA e NA,
in base all’area geografica dalla quale sono stati isolati in origine,
dal loro numero di isolati e dall’anno di isolamento. Pertanto, il
vaccino antinfluenzale per il 2009-2010 era trivalente, contenente
gli antigeni dei ceppi identificati come A/Brisbane/59/2007 (H1N1),
A/Brisbane/10/2007 (H3N2) e B/Brisbane 60/2008.
PATOGENESI
Il virus aderisce ai residui di acido sialico delle cellule attraverso l’HA
e, per endocitosi, si introduce nei vacuoli dove, attraverso un’acidificazione progressiva, avviene la fusione con la membrana endosomiale e il rilascio dell’RNA virale nel citoplasma. L’RNA viene
trasportato nel nucleo e quindi trascritto. L’RNA sintetizzato
de novo ritorna nel citoplasma e quindi è tradotto in proteine,
trasportate alla membrana cellulare. Ciò è seguito dalla gemmazione del virus attraverso la membrana cellulare. L’assemblaggio
del virus incorpora i 10 segmenti del genoma in un modo non
ancora chiaro. Un clivaggio proteolitico mediato dalla cellula
ospite avviene in un determinato momento dell’assemblaggio o
del rilascio del virus, fatto essenziale per il successo della fusione,
il rilascio dall’endosoma e l’amplificazione del titolo virale. Negli
esseri umani, il ciclo di replicazione del virus influenzale è limitato
all’epitelio respiratorio. Con l’infezione primaria, la replicazione
virale continua per 10-14 giorni.
L’influenza causa un’infezione litica dell’epitelio respiratorio
con perdita della funzione ciliare, riduzione della produzione di
muco e desquamazione dello strato epiteliale. Tali alterazioni
permettono un’invasione batterica secondaria sia direttamente
attraverso l’epitelio sia, come nel caso nello spazio dell’orecchio
medio, attraverso l’ostruzione del normale drenaggio attraverso
la tuba di Eustachio. È stato riportato che i virus influenzali A e B
possono provocare miocardite, mentre il virus influenzale di tipo B
può causare miosite. Una sindrome di Reye può derivare dall’uso
di salicilati nel corso di un’influenza di tipo B (Cap. 353).
I precisi meccanismi immunologici coinvolti nella terminazione
dell’infezione primaria e nella protezione contro la reinfezione non
sono ben chiari ma possono corrispondere all’induzione di citochine che inibiscono la replicazione virale, come l’interferone e il
fattore di necrosi tumorale. Il periodo di incubazione dell’influenza
fino all’esordio della malattia può essere anche di sole 48-72 ore.
Il periodo di incubazione estremamente breve dell’influenza e la
crescita del virus sulla superficie delle mucose pongono particolari
problemi per invocare una risposta immunitaria di tipo adattativo.
La presentazione dell’antigene avviene primariamente a livello della
mucosa agendo attraverso il tessuto linfatico associato ai bronchi.
La risposta umorale più facilmente identificabile è quella diretta
contro l’HA. Il vaccino inattivato genera elevati titoli anticorpali
nel siero inibenti l’attività dell’HA e sono correlati alla protezione.
Si ritiene che le IgA prodotte a livello di mucosa siano la risposta
protettiva più efficace e immediata che venga generata durante l’infezione influenzale. Sfortunatamente, gli anticorpi IgA misurabili
contro l’influenza persistono per un periodo relativamente breve.
A causa di ciò e della variazione dei diversi ceppi, una reinfezione
sintomatica da virus influenzale può essere osservata a intervalli di
3-4 anni. Anche se può essere dimostrata un’immunità eterotipica
nel topo attraverso meccanismi immunitari cellulo-mediati diretti
contro proteine interne comuni, è stato più difficile dimostrare
un’immunità eterotipica negli esseri umani.
MANIFESTAZIONI CLINICHE
L’influenza di tipo A e di tipo B causa una malattia prevalentemente
respiratoria. L’esordio della malattia è improvviso e dominato
da febbre, mialgie, brividi, cefalea, malessere e anoressia; coriza,
faringite e tosse secca sono aspetti associati ma messi in ombra
dagli altri segni sistemici (Tab. 250.1). I sintomi predominanti possono essere localizzati ovunque nelle vie respiratorie, producendo
una malattia isolata delle vie respiratorie superiori, croup, bronchiolite o polmonite. Più che con ogni altro virus respiratorio, i
segni sistemici di temperatura elevata, mialgie, malessere e cefalea
accompagnano l’influenza. Molti di questi sintomi possono essere
mediati dalla produzione di citochine da parte dell’epitelio delle
vie respiratorie, in quanto non vi è una diffusione sistemica del
virus. La durata tipica della malattia febbrile è di 2-4 giorni. La
tosse può persistere per periodi di tempo più lunghi e spesso sono
presenti evidenze di disfunzione delle piccole vie aeree anche dopo
alcune settimane.
A causa dell’elevata trasmissibilità dell’influenza, altri membri
della famiglia o contatti stretti hanno spesso una malattia simile.
L’influenza ha caratteristiche meno distinte nei bambini più piccoli
e nei lattanti. Il lattante o il bambino più piccolo possono essere
altamente febbrili e avere un aspetto tossico, rendendo necessario
un iter diagnostico. Nonostante alcuni aspetti distintivi dell’influenza, la malattia è spesso indistinguibile da quella causata da
altri virus respiratori come il virus respiratorio sinciziale, il virus
della parainfluenza e l’adenovirus.
Tabella 250.1 FREQUENZA RELATIVA DI SEGNI E SINTOMI
NEL CORSO DI INFLUENZA CLASSICA NEI BAMBINI PIÙ GRANDI
E NEGLI ADOLESCENTI
VARIABILE
SINTOMI
Sensazione di freddo
Tosse
Cefalea
Faringodinia
Prostrazione
Occlusione nasale
Diarrea
Vertigini
Irritazione o dolore oculare
Vomito
Mialgie
SEGNI
Febbre
Faringite
Congiuntivite (lieve)
Rinite
Linfoadenopatia cervicale
Rantoli, ronchi o sibili espiratori a livello polmonare
++++, 76-100%; +++, 51-75%; ++, 26-50%; +, 1-25%.
PRESENZA
++++
+++
+++
+++
++
++
++
+
+
+
+
++++
+++
++
++
+
+
Capitolo 250 Virus dell’influenza n 1181
REPERTI DI LABORATORIO
Le anomalie cliniche di laboratorio associate all’influenza non
sono specifiche. Si osserva frequentemente una leucopenia relativa.
La radiografia toracica evidenzia un’atelettasia o un infiltrato nel
10% circa dei bambini.
DIAGNOSI E DIAGNOSI DIFFERENZIALE
La diagnosi di influenza dipende da considerazioni epidemiologiche,
cliniche e di laboratorio. Nel contesto di un’epidemia, la diagnosi
clinica di influenza in un bambino piccolo con febbre senza un
focolaio, malessere e sintomi respiratori può essere effettuata con
qualche certezza. La conferma di laboratorio dell’influenza può
essere posta in quattro modi:
• Se il paziente viene visitato precocemente, il virus può essere
isolato dal nasofaringe inoculando il campione in embrioni di
pollo o in un numero limitato di linee cellulari che supportano
la crescita del virus influenzale. La presenza del virus influenzale
nella coltura è confermata dall’emoadsorbimento che dipende
dalla capacità dell’HA di legare gli eritrociti.
• Sono disponibili test diagnostici rapidi e affidabili per l’influenza
A e B che fanno uso di varianti della tecnica della PCR per la
ricerca del genoma virale.
• L’identificazione rapida del virus può essere effettuata tramite
fluorescenza diretta su cellule esfoliate o il test di cattura dell’antigene ELISA.
• La diagnosi può essere confermata sierologicamente con sieri
della fase acuta e della convalescenza prelevati nel periodo della
malattia ed esaminati con la tecnica dell’inibizione dell’emoagglutinazione.
TERAPIA DI SUPPORTO
TRATTAMENTO
Due classi di farmaci antivirali sono efficaci nel trattamento dell’influenza. Le linee guida per l’uso degli inibitori della neuraminidasi zanamivir e oseltamivir contro il nuovo virus H1N1 sono
ammesse per l’uso nei bambini rispettivamente dai 7 anni e da 1
anno di età (Tab. 250.2). Questi farmaci sono somministrati in
forma inalatoria nel caso dello zanamivir o per via orale nel caso
Tabella 250.2 DOSAGGIO RACCOMANDATO DEI FARMACI ANTIVIRALI
PER TRATTAMENTO E CHEMIOPROFILASSI DELL’INFEZIONE DA H1N1
DEL 2009*
FARMACO
OSELTAMIVIR
Adulti
Bambini ≥12 mesi:
≤15 kg
>15-23 kg
>23-40 kg
>40 kg
ZANAMIVIR
Adulti
Bambini (≥7 anni di età
per il trattamento,
≥5 anni per la
chemioprofilassi)
dell’oseltamivir. La loro efficacia può dipendere dal ceppo virale,
come esemplificato dall’attuale virus stagionale H1N1, il quale è
resistente all’oseltamivir ma sensibile allo zanamivir. L’oseltamivir
non è approvato per l’utilizzo nei bambini al di sotto di 1 anno
di età. Gli scarsi dati sulla sicurezza del trattamento dell’influenza
stagionale con oseltamivir nei bambini al di sotto di 1 anno di
età suggeriscono che rari sono gli eventi avversi di natura severa.
L’oseltamivir è autorizzato dall’FDA per l’utilizzo in caso di emergenza nei bambini al di sotto di 1 anno di età (Tab. 250.3).
La seconda classe di farmaci, amantadina e rimantadina, può
essere utilizzata nelle epidemie di influenza di tipo A Questi due
antivirali non sono efficaci nell’influenza di tipo B e non sono approvati per l’uso nei bambini <1 anno di età. L’influenza aviaria
H5 è spesso resistente all’amantadina e alla rimantadina. Anche
il nuovo ceppo H1N1 e gli attuali virus stagionali H3N2 sono
resistenti. È importante esaminare le raccomandazioni annuali e
gli aggiornamenti pubblicati dai Centers for Disease Control and
Prevention (CDC) prima di prescrivere antivirali per l’influenza.
Ogni classe di farmaci deve essere somministrata entro le prime
48 ore dei sintomi per ridurre la severità e la durata dell’influenza.
In alcuni pazienti cui è stata somministrata amantadina sono state
osservate confusione e incapacità di concentrazione o di dormire.
Una resistenza farmacologica si sviluppa abbastanza rapidamente
durante un ciclo terapeutico con amantadina o rimantadina. Tutti
questi farmaci sono soltanto un’aggiunta a un forte programma
vaccinale. L’ambito familiare o la classe scolastica possono essere
luoghi appropriati per la prevenzione della malattia secondaria con
il trattamento farmacologico, particolarmente dove gli individui
presentano condizioni di base che li predispongono a un’infezione
influenzale severa o complicata.
TRATTAMENTO (5 GIORNI)
CHEMIOPROFILASSI
(10 GIORNI)
75 mg in capsule 2 volte
al giorno
75 mg in capsule 1 volta
al giorno
30 mg 2 volte al giorno
45 mg 2 volte al giorno
60 mg 2 volte al giorno
75 mg 2 volte al giorno
30 mg 1 volta al giorno
45 mg 1 volta al giorno
60 mg 1 volta al giorno
75 mg 1 volta al giorno
10 mg (2 inalazioni da
5 mg) 2 volte al giorno
10 mg (2 inalazioni da
5 mg) 2 volte al giorno
10 mg (2 inalazioni da
5 mg) 1 volta al giorno
10 mg (2 inalazioni da
5 mg) 1 volta al giorno
*Updated interim recommendations for the use of antiviral medications in the treatment
and prevention of influenza for the 2009-2010 season October 16, 2009; disponibile sul sito
www.cdc.gov/h1n1flu/recommendations.htm. Per i dettagli, consultare le raccomandazioni
aggiornate ogni anno dell’Advisory Committee on Immunization Practices of the Centers
for Disease Control and Prevention, sul sito internet www.cdc.gov/flu/.
L’assunzione di liquidi e un riposo adeguati sono importanti aspetti
del trattamento dell’influenza. Come antipiretici per il controllo
della febbre devono essere utilizzati paracetamolo o ibuprofene, ma
non i salicilati a causa del rischio di sindrome di Reye (Cap. 353).
Il problema più difficile per i genitori è il momento appropriato
per consultare un medico. Le sovrainfezioni batteriche sono relativamente comuni e in tal caso occorre somministrare una terapia
antibiotica. Le sovrainfezioni batteriche devono essere sospettate
in caso di recrudescenza della febbre, febbre prolungata o deterioramento delle condizioni cliniche. Nell’influenza non complicata, il
bambino dovrebbe sentirsi meglio dopo le prime 48-72 ore.
COMPLICANZE
Otite media e polmonite sono complicanze comuni dell’influenza nei bambini più piccoli. Un’otite media acuta può essere osservata anche nel 25% dei casi di influenza documentata. Una
Tabella 250.3 DOSAGGI RACCOMANDATO DI OSELTAMIVIR
PER IL TRATTAMENTO ANTIVIRALE O PER LA CHEMIOPROFILASSI
NEI BAMBINI <1 ANNO*
ETÀ
DOSE RACCOMANDATA PER
IL TRATTAMENTO PER 5 GIORNI
<3 mesi
12 mg 2 volte al giorno
3-5 mesi
6-11 mesi
20 mg 2 volte al giorno
25 mg 2 volte al giorno
DOSE RACCOMANDATA
PER LA PROFILASSI PER 10 GIORNI
Non raccomandato tranne che
in situazioni critiche, per la
presenza di dati limitati riguardo
l’uso in questo gruppo di età
20 mg 1 volta al giorno
25 mg 1 volta al giorno
*Updated interim recommendations for the use of antiviral medications in the treatment and
prevention of influenza for the 2009-2010 season October 16, 2009; disponibile sul sito internet
www.cdc.gov/h1n1flu/recommendations.htm. Per i dettagli, consultare le raccomandazioni
aggiornate ogni anno dell’Advisory Committee on Immunization Practices of the Centers for
Disease Control and Prevention, sul sito internet www.cdc.gov/flu/.
1182 n Parte XVII Malattie infettive
polmonite che accompagna l’influenza può essere un processo
virale primitivo. Una polmonite acuta emorragica può essere osservata nei casi più severi, come è avvenuto frequentemente con il
ceppo altamente virulento del 1918 e come è stato osservato nei
pazienti con l’attuale influenza aviaria H5. La causa più comune
di polmonite è probabilmente un’infezione batterica secondaria
attraverso lo strato epiteliale danneggiato. Manifestazioni cliniche
insolite dell’influenza comprendono la miosite acuta osservata
con l’influenza di tipo B, che fa seguito alla malattia respiratoria
acuta entro 5-7 giorni ed è marcata da perdita di forza muscolare
e dolore, particolarmente a livello dei muscoli del polpaccio, e
da mioglobinuria. Anche una miocardite può far seguito all’influenza e una sindrome dello shock settico può essere associata a
una colonizzazione da parte di stafilococchi produttori di tossine.
L’influenza è particolarmente severa nei bambini con malattia
cardiopolmonare di base, tra cui malattia valvolare congenita
e acquisita, cardiomiopatia, displasia broncopolmonare, asma,
fibrosi cistica e malattie neuromuscolari che interessano i muscoli
respiratori accessori. Le donne gravide sono a rischio particolare
di influenza severa. Il virus viene eliminato per periodi di tempo
più prolungati nei bambini trattati con chemioterapia per cancro
e nei bambini con immunodeficienza.
PROGNOSI
La prognosi per quanto riguarda la guarigione è eccellente, anche
se il pieno ritorno ai normali livelli di attività e la scomparsa della
tosse di solito richiedono settimane piuttosto che alcuni giorni.
Tabella 250.4 SOMMARIO DELLE RACCOMANDAZIONI
PER LA VACCINAZIONE INFLUENZALE STAGIONALE, 2009:
BAMBINI E ADOLESCENTI TRA 6 MESI-18 ANNI*
Tutti i bambini tra 6 mesi e i 18 anni devono essere vaccinati ogni anno.
I bambini e gli adolescenti a più alto rischio di complicanze da influenza devono
continuare ad essere l’obiettivo degli sforzi vaccinali così come i fornitori
e i programmi a passare alla vaccinazione routinaria di tutti i bambini
e gli adolescenti, inclusi quelli che:
• Hanno tra 6 mesi e 4 anni (59 mesi)
• Hanno patologie polmonari croniche (incluso asma), cardiovascolari (eccetto
ipertensione), renali, epatiche, cognitive, neurologiche/neuromuscolari,
ematologiche o metaboliche (incluso il diabete mellito)
• Sono immunodepressi (inclusa l’immunosoppressione causata da medicamenti
o da virus dell’immunodeficienza umana)
• Sono in terapia con acido acetilsalicilico a lungo termine a causa dell’aumentato
rischio di sindrome di Reye dopo l’infezione da virus influenzale
• Risiedono in una struttura di degenza a lungo termine
• Avranno una gravidanza durante la stagione influenzale.
*I bambini di età <6 mesi non possono ricevere la vaccinazione antinfluenzale. Devono essere
vaccinati i contatti domestici e gli altri contatti stretti (ad es. gli operatori di asili nido) di bambini
<6 mesi di età, inclusi i bambini più grandi e gli adolescenti.
di 2-4 anni di età che hanno asma. Gli studi clinici nei bambini
hanno evidenziato un’efficacia del 90%. La facilità di somministrazione, la risposta alla dose singola e l’elevata efficacia
di questi vaccini possono servire ad aumentare l’effetto della
vaccinazione antinfluenzale tra i bambini.
PREVENZIONE
CHEMIOPROFILASSI
La migliore misura preventiva nei confronti della malattia influenzale severa è la vaccinazione antinfluenzale per le popolazioni
a rischio. Le raccomandazioni per l’uso del vaccino antinfluenzale
sono divenute progressivamente più ampie in seguito alla valutazione dell’impatto dell’influenza in gruppi come le donne gravide e
i bambini più piccoli. La chemioprofilassi con i farmaci discussi nel
paragrafo “Trattamento” è un mezzo di prevenzione secondaria.
Amantadina, oseltamivir e zanamivir sono approvati per la profilassi dell’influenza A (si veda Tab. 250.2). Questi farmaci sono
raccomandati per la profilassi nei pazienti ad alto rischio vaccinati
e non vaccinati e nei relativi operatori nel corso di epidemie di
influenza A in ambiti chiusi, nelle persone e negli operatori sanitari
non vaccinati durante le epidemie di influenza A in comunità e
durante il periodo del picco di attività dell’influenza A, nei pazienti
con immunodeficienza e nei pazienti per cui è controindicata la
vaccinazione antinfluenzale.
Vaccini
Ogni estate è disponibile un vaccino antinfluenzale inattivato e
uno di virus vivi attenuati con ceppi H3, H1 e B, con cambiamenti
della formulazione che riflettono i ceppi che si prevede circoleranno
nell’inverno successivo. L’American Committee on Immunization
Practices pubblica ogni anno linee guida per l’uso dei vaccini quando questi vengono formulati e immessi sul mercato. Queste linee
guida sono ampiamente pubblicizzate ma inizialmente appaiono
sul Morbidity and Mortality Weekly Report pubblicate dai CDC.
Chiunque voglia ridurre le proprie possibilità di contrarre l’influenza
può vaccinarsi. Si raccomanda di vaccinare tutti i bambini che sono
a rischio di sviluppare l’influenza (Tab. 250.4). Nondimeno, bisogna
dare priorità ad alcuni gruppi ad alto rischio, in particolare quando
vi sono poche scorte di vaccino o quando viene prodotto in ritardo
in risposta a una epidemia emergente. Le linee guida sono sufficientemente complesse e differiscono abbastanza da anno ad anno tanto
che si possono dare solo le seguenti raccomandazioni generali:
• In aggiunta alle raccomandazioni universali per i pazienti pediatrici oltre i 6 mesi, gruppi bersaglio della vaccinazione sono i
contatti domestici e coloro che si prendono cura dei bambini tra
0-6 mesi di età al di fuori dell’ambiente domestico.
• A causa del ridotto potenziale di reazioni febbrili, soltanto il
vaccino con virus split è raccomandato nei bambini <12 anni
di età.
• Si raccomandano 2 dosi di vaccino (0,25 mL per 6-36 mesi di
età; 0,5 mL per 3-8 anni di età) ad almeno 1 mese di distanza
per la vaccinazione primaria dei bambini <9 anni di età.
• I vaccini vivi attenuati somministrati per via intranasale non
sono raccomandati per i bambini <2 anni di età o per i bambini
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Capitolo 251
Virus parainfluenzali
Angela Jean Peck Campbell e Peter F. Wright
I virus della famiglia della parainfluenza (PIV, parainfluenza virus) sono una causa comune di malattia respiratoria nei lattanti e
nei bambini più piccolo e sono secondi solo al virus respiratorio
sinciziale come importante causa virale di infezioni delle basse
vie respiratorie nei bambini piccoli e nei pazienti immunocompromessi. Questi virus causano uno spettro di malattie delle vie
respiratorie inferiori e superiori, ma sono associati soprattutto a
croup (laringotracheite o laringotracheobronchite), bronchiolite
e polmonite.
EZIOLOGIA
I PIV sono membri della famiglia delle Paramyxoviridae. Sono
4 virus del gruppo della parainfluenza, designati da 1 a 4, che
provocano malattia negli esseri umani, con manifestazioni variabili
dell’infezione. Il tipo 4 si divide in due sottogruppi antigenici, A
Capitolo 251 Virus parainfluenzali n 1183
Tabella 251.1 CARATTERISTICHE DELLE INFEZIONI DA VIRUS PARAINFLUENZALI (PIV) NEI BAMBINI
Stagionalità
Fasce di età
Sindromi cliniche (manifestazioni dei tipi
di virus, l’uno rispetto all’altro):
Raffreddore
Otite media acuta
Croup
Bronchiolite
Polmonite
Metodi diagnostici (affidabilità del metodo
per la diagnosi):
Coltura
Individuazione rapida/
immunofluorescenza
Reazione a catena della polimerasi
PIV-1
PIV-2
PIV-3
PIV-4
Epidemie autunnali ogni 2 anni,
spesso in alternanza
con il PIV-2
≈75% infettati entro i 5 anni,
picco di incidenza a 2-3 anni
Epidemie autunnali annuali,
spesso in alternanza
con il PIV-1
≈60% infettati entro i 5 anni,
picco di incidenza a 1-2 anni
Endemico per tutto l’anno, con picchi
in primavera (attività maggiore quando
diminuisce il PIV-1 circolante)
90-100% infettati entro i 5 anni, ≈50%
entro 1 a di età; bambini <6 m
ad alto rischio
Dati insufficienti
+++
++
++++
++
++
+++
++
+++
++
++
+++
+++
++
++++
++++
+++
+
+
+
+
++
++
++
++
++
+++
Non affidabile
+
++++
++++
++++
++++
≈50% infettati
anno
++++, 76-100%; +++, 51-75%; ++, 26-50%; +, 1-25%.
e B. I PIV hanno un genoma composto da RNA a filamento singolo non segmentato, con un involucro contenente lipidi derivato
dalla gemmazione attraverso la membrana cellulare. Le principali
componenti antigeniche sono le proteine HN ed F, che protrudono
dall’involucro e che manifestano rispettivamente emoagglutininaneuraminidasi e funzioni di fusione.
EPIDEMIOLOGIA
Entro i 5 anni di età, la maggior parte dei bambini ha un’infezione
primitiva causata dai PIV dei tipi 1, 2 e 3 (Tab. 251.1). Le infezioni
da PIV-3 colpiscono spesso nei primi 6 mesi di vita, mentre i PIV-1 e
PIV-2 sono più comuni dopo l’infanzia. Negli USA e nei climi temperati, PIV-1 e PIV-2 provocano epidemie ogni due anni in autunno,
solitamente alternando gli anni in cui i sierotipi sono prevalenti. Il
PIV-3 è endemico per tutto l’anno, ma caratteristicamente presenta
un picco in tarda primavera. Negli anni con minore attività del
PIV-1, la stagione del PIV-3 può prolungarsi maggiormente o avere
un secondo picco in autunno. L’epidemiologia del PIV-4 è meno
ben definita, in quanto il virus è difficile da coltivar nelle colture
di tessuti ed è spesso stato escluso dai primi studi.
I PIV si diffondono principalmente dalle vie aeree per inalazione
di goccioline respiratorie o contatto con secrezioni infette. È noto
che i PIV causano epidemie di infezioni respiratorie in reparti
ospedalieri, ambulatori, nursery neonatali e altri ambienti istituzionali. Il periodo di incubazione dal momento dell’esposizione
all’esordio dei sintomi è di 2-6 giorni. È probabile che i bambini
espellano il virus dall’orofaringe per 2-3 settimane, ma l’escrezione
può essere più prolungata perfino nei bambini immunocompetenti;
nei pazienti immunocompromessi, l’escrezione può persistere per
mesi. L’infezione primitiva non conferisce immunità permanente
e le reinfezioni sono comuni per tutta la vita, sebbene siano generalmente lievi e autolimitate.
PATOGENESI
I PIV si replicano nell’epitelio respiratorio. La tendenza a causare
malattia nelle vie aeree superiori di calibro maggiore è presumibilmente correlata alla maggiore replicazione in laringe, trachea
e bronchi rispetto ad altri virus. Alcuni PIV inducono fusione
intercellulare. Durante il processo di gemmazione, si perde l’integrità della membrana cellulare e i virus possono indurre morte
cellulare attraverso il processo di apoptosi. Nei bambini, la massima gravità della malattia coincide con il momento di eliminazione
massimale del virus, ma è probabile che la gravità della malattia
sia correlata tanto alla risposta infiammatoria quanto agli effetti
citopatici diretti del virus.
I livelli anticorpali di immunoglobulina (Ig) A specifica per il
virus sono correlati a protezione dall’infezione da PIV. È probabile
che anche gli anticorpi sierici circolanti svolgano un ruolo nella
protezione contro l’acquisizione di PIV e la progressione all’infezione grave. Nei pazienti con immunità cellulare compromessa
la malattia è grave e prolungata, il che suggerisce che i linfociti T
siano fondamentali per il controllo e la fine dell’infezione da PIV.
MANIFESTAZIONI CLINICHE
La maggior parte delle infezioni da virus della parainfluenza è
limitata alle vie respiratorie superiori (si veda Tab. 251.1). La malattia si manifesta comunemente con una combinazione di febbre
moderata, rinorrea, tosse, faringite e raucedine, e può associarsi
a vomito o diarrea. Raramente, i virus della parainfluenza sono
stati implicati nella parotite. La malattia di solito dura 4-5 giorni.
La natura relativamente benigna della malattia è contraddetta da
uno spettro di problemi più rari ma anche più seri che rendono
necessaria l’ospedalizzazione. I PIV sono responsabili del 50% dei
ricoveri per croup e del 15% dei casi di bronchiolite e polmonite.
Il PIV-1 e in misura minore il PIV-2 causano un maggior numero
di casi di croup, mentre il PIV-3 tende a infettare le vie aeree più
piccole e causare polmonite, bronchiolite o bronchite. Tutti i PIV
possono provocare malattia delle basse vie aeree, in particolare
durante l’infezione primitiva o nei pazienti immunosoppressi.
REPERTI DI LABORATORIO
La diagnosi tradizionale dell’infezione in laboratorio si ottiene
tramite isolamento dei PIV in colture di tessuti. Il test d’immunofluorescenza (IF) diretta è disponibile in alcuni centri per la diagnosi
rapida dell’antigene virale in secrezioni respiratorie. Molti laboratori eseguono l’esame basale del genoma mediante reazione a catena
della polimerasi (PCR), che aumenta notevolmente la sensibilità
dell’individuazione dei PIV (si veda Tab. 251.1). Per la coltura virale
o l’IF, l’aspirato o il lavaggio nasale forniscono i campioni migliori,
ma per la PCR sono adeguate anche i tamponi nasali.
1184 n Parte XVII Malattie infettive
DIAGNOSI E DIAGNOSI DIFFERENZIALE
La diagnosi di infezione da PIV nei bambini si basa di solito su
criteri clinici ed epidemiologici. La croup è una diagnosi clinica
e deve essere distinta da aspirazione di corpi estranei, epiglottite,
ascesso faringeo ed emangioma ipoglottico. Sebbene il “segno del
pinnacolo” (steeple sign) radiografico di progressivo restringimento
della regione ipoglottica sia caratteristico del croup, considerazioni
differenziali comprendono epiglottite acuta, lesioni da cause termine, angioedema e tracheite batterica. La manifestazione della
malattia da PIV delle vie aeree inferiori può somigliare a numerose
altre infezioni virali respiratorie; l’identificazione del virus per
alcune malattie gravi, come la polmonite nei bambini immunocompromessi, va pertanto effettuata in modo specifico mediante i mezzi
diagnostici più sensibili a disposizione.
TRATTAMENTO
Tranne che per la croup, non esistono trattamenti approvati per le
infezioni da PIV. Per la croup, la possibilità di una rapida compromissione respiratoria deve essere alla base dell’entità del trattamento
somministrato (Cap. 377). L’umidificazione dell’aria non è stata dimostrata efficace. Generalmente, una dose singola di desametasone
orale, intramuscolare o endovenoso (0,6 mg/kg) dovrebbe far parte
del trattamento della croup in ambulatorio o in pronto soccorso.
La dose può essere ripetuta, ma non esistono linee guida di confronto degli esiti di programmi terapeutici a dose singola e multipla. Anche l’adrenalina per aerosol (adrenalina racemica 2,25%,
0,5 mL in 2,5 mL di fisiologica, o l-adrenalina diluizione 1:1000
in 5 mL di fisiologica) può fornire un temporaneo miglioramento
dei sintomi. I bambini vanno tenuti sotto osservazione per almeno
2 ore dopo la somministrazione del trattamento con adrenalina,
in quanto possono presentare un rebound della costrizione delle
vie respiratorie. Trattamenti ripetuti possono ovviare al bisogno di
intibazione. Occorre somministrare ossigeno contro l’ipossia, e la
terapia di supporto con analgesici e antipiretici è ragionevole per la
febbre e il malessere associati alle infezioni da PIV. Le indicazioni
agli antibiotici sono limitate alle infezioni batteriche secondarie ben
documentate dell’orecchio medio o delle vie aeree inferiori.
La ribavirina esercita una certa attività antivirale nei confronti
dei PIV in vitro e in studi su animali e se ne deve considerare la
somministrazione per aerosol nel bambino immunocompromesso
con polmonite da PIV. Strategie promettenti di sviluppo di farmaci
comprendono gli inibitori dell’emoagglutinina-neuraminidasi e gli
RNA interferenti brevi sintetici.
COMPLICANZE
L’ostruzione delle trombe di Eustachio può portare a invasione batterica secondaria dello spazio dell’orecchio medio e a otite media
acuta nel 30-50% delle infezioni da PIV. Analogamente, l’ostruzione dei seni paranasali può provocare sinusite. La distruzione
cellulare nelle vie aeree superiori può portare a invasione batterica
secondaria con conseguente tracheite batterica, e un’antecedente
infezione da PIV delle vie aeree inferiori può predisporre a polmonite batterica. Le complicanze non respiratorie dei PIV sono rare,
ma comprendono meningite asettica, encefalite, encefalomielite
disseminata acuta, rabdomiolisi, miocardite e pericardite.
PROGNOSI
Nel bambino normale, la prognosi per una completa guarigione è
eccellente, senza sequele polmonari a lungo termine.
PREVENZIONE
Lo sviluppo di vaccini si concentra sui vaccini vivi intranasali del
PIV-3. I virus vivi candidati comprendono un virus adattato al
freddo di origine umana, un PIV-3 bovino attenuato, e un nuovo
ibrido ottenuto usando il vaccine PIV-3 bovino con l’inserimento
di geni HN ed F umani del PIV-3 e la proteina F dei virus respiratorio sinciziale. Sarà difficile valutare la misura della protezione
offerta dai vaccini a causa della possibilità di una reinfezione
sintomatica e del fatto che la frequenza di infezioni severe nella
popolazione generale è bassa. Tuttavia, è chiaro che la prevenzione
della malattia respiratoria acuta causata dai PIV, e in particolare le
infezioni delle vie aeree inferiori nei lattanti e nei bambini piccoli,
è un obiettivo desiderabile.
BIBLIOGRAFIA
Per la bibliografia completa, consultare il sito internet www.expertconsult.com.
Capitolo 252
Virus respiratorio sinciziale
James E. Crowe, Jr.
Il virus respiratorio sinciziale (Respiratory Syncytial Virus, RSV)
è la causa principale di bronchiolite (Cap. 383) e di polmonite
virale nei bambini <1 anno di età ed è il più importante patogeno
respiratorio della prima infanzia.
EZIOLOGIA
L’RSV è un virus a RNA di medie dimensioni dotato di membrana, con un genoma a singolo filamento negative che si replica
interamente nel citoplasma delle cellule infette e matura con gemmazione attraverso la superficie apicale della membrana cellulare.
Poiché questo virus ha un menoma non segmentato, non può
subire spostamento antigenico per riassorbimento come i virus
dell’influenza. Appartiene alla famiglia delle Paramyxoviridae
come i virus della parainfluenza e il virus del morbillo, ed è classificato nella sottofamiglia delle Pneumovirinae, che comprende
anche il metapneumovirus umano (Cap. 253). È l’unico membro
del genere Pneumovirus che infetta gli esseri umani. Esistono due
sottotipi antigenici di RSV, distinti primariamente in base a una
variazione di una delle due proteine di superficie, la glicoproteina
G responsabile dell’adesione. Tale variante antigenica, causata da
mutazioni puntiformi dovute a infedeltà della polimerasi dell’RNA
virale, può contribuire in qualche misura alla frequenza con la
quale l’RSV reinfetta i bambini e gli adulti.
L’RSV si replica in molte colture cellulari monostrato in vitro e
nelle cellule HeLa o HEp-2 produce una caratteristica citopatologia
sinciziale da cui deriva il nome. È interessante notare che ora si sa
che il virus non provoca grandi sincizi nelle cellule epiteliali polarizzate in vitro, e non è chiaro se la formazione di sincizi avvenga
in grado significativo in vivo.
EPIDEMIOLOGIA
L’RSV è distribuito in tutto il mondo e compare in epidemie annuali. Nei climi temperati, tali epidemie si verificano tutti gli inverni
per 4-5 mesi, mentre durante il resto dell’anno le infezioni sono
sporadiche e molto meno comuni. Nell’emisfero settentrionale,
le epidemie presentano di solito un picco in gennaio, febbraio o
marzo, ma sono stati osservati picchi anche a dicembre e fino a
giugno. In alcune zone degli USA, come la Florida, si segnala una
moderata incidenza per tutto l’anno. Nell’emisfero meridionale, le
epidemie si verificano anche durante i mesi invernali (giugno, luglio, agosto). Le epidemie di RSV spesso si sovrappongono a quelle
influenzali e di metapneumovirus umano, ma sono generalmente
più costanti da anno ad anno e determinano di solito una patologia
di maggiore entità, specialmente nei lattanti di età <6 mesi. Nei
Paesi tropicali, il pattern epidemico è meno chiaro. Il pattern di