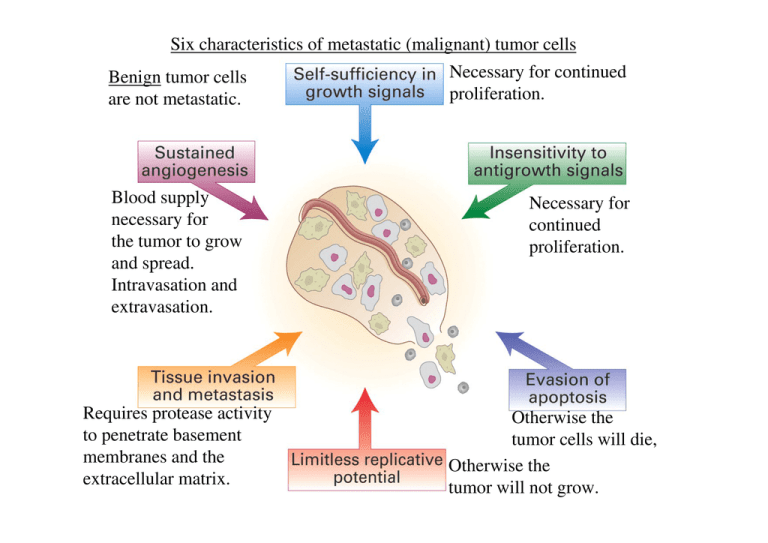
Six characteristics of metastatic (malignant) tumor cells
Benign tumor cells
are not metastatic.
Necessary for continued
proliferation.
Blood supply
necessary for
the tumor to grow
and spread.
Intravasation and
extravasation.
Necessary for
continued
proliferation.
Requires protease activity
to penetrate basement
membranes and the
extracellular matrix.
Otherwise the
tumor cells will die,
Otherwise the
tumor will not grow.
Nonostante ciò il cancro si sviluppa
a causa della
combinazione di due meccanismi:
• mutazioni che aumentano la proliferazione cellulare:
popolazione espansa di cellule in cui può verificarsi la
successiva mutazione
• mutazioni che diminuiscono la stabilità del genoma: aumento
del tasso di mutazione complessivo
Mantenimento del genoma e
riparazione del DNA
Fattori genetici
(MMR)
Quali cambiamenti sono necessari perché
si ottenga una cellula cancerosa?
•In una singola cellula si debbono
accumulare mutazioni in numerosi geni.
•Di solito si verificano mutazioni geniche
sia in oncogeni che in oncosoppressori.
•Sono solitamente necessari molti anni
perché si verifichino queste mutazioni.
• “Gatekeepers”: perdita ereditaria o sporadica di un gene
oncosoppressore -- p53, pRb, p16, NF-1, APC, etc.
• “Caretakers”: suscettibilità ereditaria a tumori; elevato
tasso di mutazioni dovuta a defetti nel meccanismo di
riparazione del DNA {HNPCC (hMSH2, hMLH1), A-T
(ATM), breast Ca (BRCA1/2)};
• Anomalie del meccanismo di controllo della Mitosi:
instabilità cromosomica (hBUB1, hMAD1, etc.)
Oncogeni (i precursori sono chiamati anche Proto-oncogeni)
• Controllo della divisione cellullare (stimolatori)
• Le mutazioni comportano un “guadagno di funzione”
• Fattori di crescita o recettori (ras, erb, src)
• Fattori di trascrizione (myc, jun, fox)
• Fenotipo dominante
• Sono attivati nelle cellule somatiche di numerosi tumori (carcinoma,
sarcoma, leucemia, limfoma).
• La maggior parte codificano per proteine coinvolte nella via
metabolica “fattore di crescita-recettore-risposta” di stimoli per la
crescita cellulare che vanno dalla superficie cellulare al nucleo e
culminano nella sintesi di DNA e nella trascrizione di specifici geni.
9 L’attivazione di un proto-oncogene può essere quantitativa e/o
qualitativa
9 Quasi sempre sono mutazioni somatiche (quelle germinali sono
per lo più letali)
9 Le modalità di attivazione sono:
• amplificazione, citogeneticamente evidenziabile come double
minute o HSR (Homogenously Staining Regions), es. Myc
• mutazioni puntiformi, es Ras
• traslocazioni cromosomiche che creano geni chimerici, es.
cromosoma Philadelphia
• trasposizione in un dominio di cromatina attiva, es. linfoma di
Burkitt
Geni chimerici prodotti da riarrangiamenti cromosomici
specifici di alcuni tumori
DA: GENETICA UMANA MOLECOLARE STRACHAN T. ET AL
CROMOSOMA PHILADELPHIA
LINFOMA DI BURKITT
DA: GENETICA UMANA MOLECOLARE STRACHAN T. ET AL
Geni Oncosoppressori
Descritti da Knudson nel retinoblastoma “Two-hit
hypothesis”
Le mutazioni comportano una perdita di funzione
Fenotipo recessivo
Entrambe le copie del gene debbono essere mutate
perché si abbia un effetto sulla divisione cellulare
Effetto negativo sulla regolazione della divisione
cellullare
Possono interagire con proto-oncogeni
- RB, APC, DCC, p53
Geni Oncosoppressori
• spesso sono già presenti come mutazioni germinali
• molti geni oncosoppresori sono silenziati con modalità
epigenetiche, ad esempio per metilazione del DNA nelle
zone/isole CpG: è stato dimostrato per CDKN2A, VHL, RB1 e
MLH1
Geni Oncosoppressori implicati in
Tumori Ereditari (I)
APC
FAP (Familial Adenomatous Polyposis)
VHL
Syndrome di Von Hippel-Lindau
WT1
Tumore di Wilms Ereditario
RB1
Retinoblastoma Ereditario
NF1
Neurofibromatosi 1
NF2
Neurofibromatosi 2
Geni Oncosoppressori implicati in
Tumori Ereditari (II)
P53
Sindrome di Li Fraumeni
P16/CDK4
Melanoma Ereditario
PTCH
Nevoid Basal Cell carcinoma syndrome
MEN1
MEN (Multiple Endocrine Neoplasia) tipo 1
BRCA1
Carcinoma Ereditario Mammella/Ovaio
BRCA2
Carcinoma Ereditario Mammella/Ovaio
L’ipotesi dei due colpi nei Tumori
Ereditari Negli individui che
2°
colpo
ereditano una
mutazione in un gene
oncosoppressore, il 1°
colpo viene ereditato
come mutazione
germinale e il 2° colpo
si verifica in una
cellula somatica
CANCRO
Geni di Risposta al danno del DNA
• Riparano i danni al DNA
• Il cancro è causato da mutazioni inattivanti
in entrambi gli alleli (considerati un
sottogruppo di Geni Oncosoppressori)
• La perdita della loro funzione determina
l’accumulo di mutazioni in altri geni cruciali
Geni di Risposta al danno del DNA
implicati in Tumori Ereditari
hMSH2
Carcinoma Colorettale senza poliposi
hMLH1
Carcinoma Colorettale senza poliposi
hPMS1
Carcinoma Colorettale senza poliposi
hPMS2
Carcinoma Colorettale senza poliposi
ATM
Atassia-Teleangiectasia
XPA,C,D,F
Xeroderma Pigmentosum
BLM
Bloom Syndrome
Gatekeepers and Caretakers
Caretaker pathway
G
S
S
S
S
S
G
S
S
S
S
S
CANCER
Gatekeeper pathway
HNPCC, BRCA
APC, p53, NF-1, Rb
Types of RNA
Expert Rev. Mol. Diagn. 2007, 7(5) 569-603
Expert Rev. Mol. Diagn. 2007, 7(5) 569-603
Expert Rev. Mol. Diagn. 2007, 7(5) 569-603
Lung cancer
RAS and let-7
miRNA
NEJM 2005. 325;23
Cell 2005;120:635-647
Block let-7 with siRNA
Lung ca,
mi155
and let-7
Cancer cell 2006,9;189-98
Lung
adenoca
Cancer cell 2006,9;189-98
Prostate cancer and
miRNA deregulation
Oncogene 2007. 1-6
miR125b target EIF4BP1
Breast cancer and microRNA10b
Nature 2007. 449;
682-89
MAtrigel invasion assay
Nature 2007. 449;682-89
Lung mets
Nature 2007. 449;682-89
P53 and miRNA
Nature 2007, 7;819-22
Nature 2007, 447;1130-4
Epigenetics and miRNA
CpG island
Nat Rev Genet 2006, 3:415-28
Ped Res 2007, 61;24R-29R
Ped Res 2007, 61;24R-29R
Normal prostate/bladder tissue, miR-127 is highly expressed, but
downregulated or silenced in the corresponding tumors.
Cancer Cell 2006, 9;435-43
Fig. 1. Correlation between FRAs and miRs
61 miRNAs are located at
FRAs
Suggests:
miRNAs are playing
important roles that may
be messed up in cancer
What else is messed up in
cancer?
Proto-oncogenes
Tumor suppressor genes
Common site of
HPV integration
Calin, George Adrian et al. (2004) Proc. Natl. Acad. Sci. USA 101, 2999-3004
Take home messages
• miRNAs are everywhere (even though we’ve only started looking
recently)
• miRNAs often act by repressing target mRNAs from being translated
into proteins
• miRNA expression is different in normal vs cancerous cells
• miRNAs are expressed in FRAs
• miRNAs can behave like:
– Proto-oncogenes
– Tumor suppressor genes
– Components of important regulatory pathways
What makes a stem cell a stem cell?
Stem cell
1.
Self-renewal - when a stem cell divides,
each daughter cell can either retain its
stem cell identity, or can become a
progenitor. Stem cells appear to retain
capacity for limitless division.
2.
Multipotency - progenitors (also called
transit amplifying cells) have limited
proliferative capacity and are committed
to terminally differentiate into multiple
lineages (multipotent). Often have high
proliferative rates in the short term,
whereas most stem cells divide rarely.
Progenitor cell
A
B
C
Different cell types…
D
Development of Hematopoietic Stem Cells
Stem
Cells
Multipotent
Progenitors
Oligolineage
Progenitors
Mature
Cells
Reya et al. 2001 Nature 414:105-111
The anatomy of the small intestinal epithelium
The epithelium is shaped into crypts and villi (left). The lineage scheme (right) depicts the stem cell, the
transit-amplifying cells, and the two differentiated branches. The right branch constitutes the enterocyte
lineage; the left is the secretory lineage. Relative positions along the crypt-villus axis correspond to the
schematic graph of the crypt in the center.
F. Radtke et al., Science 307, 1904 -1909 (2005)
Adult intestinal homeostasis
Schematic representation and section of the crypt-villus unit in the mature small intestine. Proliferative cells reside in the crypts,
while differentiated cells occupy the villus. Crypt progenitors migrate up (red arrow) the crypt-villus axis before shedding into the
lumen. The process of epithelial renewal takes 3-6 d and is ensured by a small number of asymmetrically dividing stem cells at the
bottom of the crypts. Wnt signaling in the adult intestine promotes proliferation of progenitor or transit-amplifying (TA) cells, as well
as commitment toward secretory lineages. Wnt signaling may also drive terminal differentiation of certain secretory lineages.
Although it is commonly believed that Wnt signaling may promote proliferation and/or differentiation of intestinal stem cells, there is
no evidence that formally proves this (see arrows with question marks). In panel A, black arrowheads indicate Ki67 positive transitamplifying cells, while white arrowheads indicate the Paneth cell compartment.
Alex Gregorieff et al. Genes Dev. 2005; 19: 877-890
Pathways involved in self-renewal that are deregulated in cancer cells
Wnt, Shh, and Notch pathways have been shown to contribute to the self-renewal of stem cells and/or progenitors in a variety
of organs, including the haematopoietic and nervous systems. When dysregulated, these pathways can contribute to
oncogenesis. Mutations of these pathways have been associated with a number of human tumours, including colon
carcinoma and epidermal tumours (Wnt), medulloblastoma and basal cell carcinoma (Shh), and T-cell leukaemias (Notch).
Normal stem cells
Rare cells within organs with the ability to selfrenew and give rise to all types of cells within the
organ to drive organogenesis
Cancer stem cells
Rare cells within tumors with the ability to selfrenew and give rise to the phenotypically diverse
tumor cell population to drive tumorigenesis
Properties shared by normal stem cells and
cancer stem cells
• Assymetric Division:
– Self renewal
• Tissue-specific normal stem cells must self-renew throughout the
lifetime of the animal to maintain specific organs
• Cancer stem cells undergo self-renewal to maintain tumor growth
– Differentiation into phenotypically diverse mature cell
types
• Give rise to a heterogeneous population of cells that compose the
organ or the tumor but lack the ability for unlimited proliferation
(hierarchical arrangement of cells)
• Regulated by similar pathways
– Pathways that regulate self-renewal in normal stem cells
are dys-regulated in cancer stem cells
Which cells in the hierarchy are cancer stem cells?
Hematopoietic and Progenitor Cell Lines
Passegue, Emmanuelle et al. (2003) Proc. Natl. Acad. Sci. USA 100, 11842-11849
Hematopoietic Cancer
Stem Cells
Acute myeloid leukemia
(AML) – CD34+ CD38-
Leukaemic Mouse Models:
chronic myelomonocytic leukaemia (CMML)
acute myeloid leukaemia (AML)
chronic myeloid leukaemia (CML)/Blast
acute promyelocytic leukaemia (APML)77
MRP8-BCL-2
MRP8-BCL2Xlpr/lpr
MRP8-PML-RARα
MRP8-BCRablXBCL-2
Stem Cells in the Nervous System
Metastasis
• Process by which a tumor cell leaves the primary tumor, travel
to a distant site via the circulatory system and then establishes
a secondary tumor.
• Final and most devastating step of a malignancy
• Leading cause of death in cancer patients
– Before mets tumors may be cured by surgery
Summary: The Metastatic Process
Metastasis is a multi-step process
Metastatic cell = “Decathlon champion”
• Vascularization of primary tumor
– Tumor grows through the synthesis and secretion of proangiogenic factors by the tumor and surrounding stroma
• Invasion of the organ stroma through enhanced
expression of enzymes (MMP9)
• Invasion of the lymphatic or vascular channels (may
grow in these places)
• Tumors cells enter circulation
– Must survive turbulence of circulation and evade both
immune and non-immune mechanisms
• Cells arrest in the capillary beds of distant
organs
• Extravasation into distant organ
• Survival and proliferation in target organ
– Depends on multiple interactions (“cross-talk”)
between tumor cell and organ microenvironment
Metastatic Cancer Cells = Migratory
Cancer Stem Cells
Genetic determinants for metastasis to the bone
Fattori che influenzano la penetranza
Geni
modificatori
Risposta al
danno del DNA
Carcinogeni
Fattori
ormonali/riproduttivi
Non tutti i portatori di un gene alterato sviluppano il cancro
Cancer Causes
2%
10%
33%
Radiation
Tobacco
Diet
UVA/B
Chemicals products
Industry
Unknown
Pollution
Virus
Peto, 1981
Heredity
Sexual factors
Alcool
4%
7%
1%
30%
2%
5%
4%
1%
1%
Tumori rari familiari:
DA: GENETICA UMANA MOLECOLARE STRACHAN T. ET AL
Caratteristiche dei Tumori Ereditari
9 Casi multipli nella famiglia
9 Più generazioni colpite
9 Associazione di specifici tipi di cancro
¾Nella stessa famiglia
¾Nello stesso individuo
9 Esordio ad un’età più giovane rispetto ai tumori
sporadici
9 Caratteristiche tipiche di sindromi specifiche
INSTABILITA GENICA/FAMILIARITA’
9 I tumori si possono suddividere in sporadici e familiari
9 Il 5% dei casi di tumore ha base familiare
9 L’eredità tumorale è su base multifattoriale
9 Eredità tumorale significa predisposizione allo sviluppo
PREDISPOSIZIONE AL CANCRO
• geni rari, ereditati nella linea germinale, sono responsabili
della comparsa di molteplici casi di tumore in una stessa
famiglia, vengono identificati per linkage genetico e clonaggio
posizionale:es. Rb e p53
• geni ad alta penetranza: es. APC, BRCA1 e BRCA2
COME SI SVILUPPA IL CANCRO?
• ipotesi di Knudson: comporta il coinvolgimento di un
unico gene deputato al controllo intracellulare della
proliferazione
• cancro come disordine poligenico: il bersaglio delle
mutazioni tumorali non è un solo gene, ma piuttosto la fitta
rete di segnali che una cellula invia e riceve in un tessuto e
nello stroma
L’accumulo di evidenze sperimentali e cliniche sembra
avvalorare sempre più l’ipotesi del cancro come disordine
poligenico: esemplare è il caso del cancro al seno.
STUDI DI POPOLAZIONE
Cancro al seno
Studi epidemiologici di popolazione hanno dimostrato che
soltanto il 15-20% dei casi di cancro al seno familiare presenta
mutazioni nei geni BRCA1 e BRCA2; il rimanente 80-85% dei
casi di rischio familiare ha sempre base genetica ma
multifattoriale, cioè sono coinvolti altri geni oltre a BRCA1/2
DA: NATURE GENETICS SUPPLEMENT 2003, 33:238-244
L’ipotesi di una predisposizione su base poligenica da sola
non è sufficiente per spiegare i dati di trasmissibilità
genetica del cancro al seno
DA: NATURE GENETICS SUPPLEMENT 2003, 33:238-244
Una caratteristica fondamentale di tutte le cellule tumorali è
l’instabilità genomica causata da:
• mutazioni ereditate che controllano l’integrità del genoma
• mutazioni somatiche acquisite durante lo sviluppo del
tumore
DA: NATURE GENETICS SUPPLEMENT 2003, 33:238-244
“MULTISTAGE MODEL” di sviluppo tumorale
Si assume che ogni evento mutageno importante conferisce
un vantaggio clonale selettivo alla cellula in cui avviene per
un successivo evento mutageno così via fino allo sviluppo di
un tumore maligno. Permane però poco spiegata la differenza
tra:
• Eventi mutazionali precoci e tardivi
• Ruolo dell’instabilità genomica nella progressione tumorale
DA: GENETICA UMANA MOLECOLARE STRACHAN T. ET AL
La suscettibilità/predisposizione allo sviluppo di un tumore
risulta essere più un gioco combinato di alleli ereditati di geni
che danno una debole predisposizione al tumore e mutazioni
somatiche responsabili della progressione tumorale.
DA: NATURE GENETICS SUPPLEMENT 2003, 33:238-244
Eventi genomici, genetici e epigenetici sono strettamente
collegati nella formazione del tumore, anche nei tumori che
sembrano
insorgere
spontaneamente
come
mutazioni
somatiche.
• Studi di popolazione di incidenza del cancro
• Studi genetici classici per la scoperta dei geni coinvolti e dei
loro meccanismi d’azione
ESEMPI DI TUMORI A “STORIA GENETICA” NOTA
• Cancro al seno
• Cancro all’ovaio
• Cancro al polmone
• Cancro al colon
• Tumori dell’infanzia
• Sindrome Li-Fraumeni
Fattori di rischio per i tumori della
mammella
Geografia
Età
Familiarità
Nord America Nord Europa
Fattori
riproduttivi
Gravidanza
Menarca
Menopausa
Obesità
Elevato consumo
di grassi
CANCRO AL SENO
9 Circa il 10% dei casi di tumore al seno si “raggruppa” in
famiglie: questi casi sono indicativi di mutazioni germinali con
alta penetranza in un piccolo numero di geni (es.BRCA1 e
BRCA2) che danno alto rischio di tumore
9 La maggior parte sono casi sporadici originati da mutazioni
multiple a bassa penetranza in un ampio gruppo di geni (es.p53,
PTEN,..)
9 Il 15-20% dei casi familiari hanno mutazioni nei geni BRCA1
(17q21) e BRCA2 (13q12):
• i loro prodotti sono coinvolti in processi di DNA repair,
ricombinazione, controllo del ciclo cellulare e trascrizione
• sono geni oncosoppressori
• hanno modalità di trasmissione autosomica-dominante, con
penetranza del 70-80%
BRCA1 and BRCA2 genes
BRCA2
BRCA1
BRCA1 E BRCA2
9 Sono note centinaia di mutazioni a carico dei due geni, sia nonsense sia frame-shift, che danno proteine tronche; frequentemente il
tipo di mutazione è specifico per famiglia/gruppo etnico
9 Mutazioni in BRCA1/2 sono presenti:
• 5.9-9.4% donne sotto i 35 anni
• 12-13.2% donne sotto i 45 anni con un familare affetto
• dopo la menopausa il rischio dimunuisce nelle donne con
mutazione in BRCA1 e aumenta nel caso di mutazione in
BRCA2
• tumori che hanno mutazioni in BRCA1/2 hanno comparsa
precoce prima dei 35 anni
GENETIC COUNSELLING
DA: CANCER TREATMENT
REVIEWS 2001, 27:295-304
Lo screening per mutazioni in BRCA1 e BRCA2 è consigliato
anche per soggetti sani indipendentemente dalla loro storia
familiare, in famiglie ad alto rischio spesso si pesenta anche il
fenomeno dell’anticipazione in cui il tumore si sviluppa sempre
più precocemente nelle generazione successive.
Geni BRCA e Carcinoma Mammario
Sporadico
Ereditario
BrCa2
Altri
BrCa1
Familiare
CANCRO ALL’OVAIO
Una storia familiare di cancro all’ovaio conferisce un
aumentato rischio di sviluppo di tumore.
DA: BEST PRACTICE & RESEARCH CLINICAL OBSTETRICS AND GYNAECOLOGY 2002, 16:449-468
9 Non sono stati ancora identificati geni che conferiscano da soli
un’aumentata suscettibilità al cancro all’ovaio
9 Famiglie con almeno 4 casi di cancro all’ovaio: per 2/3
mutazioni in BRCA1/2
9 Famiglie con 2 casi di cancro all’ovaio: per 1/5 mutazioni in
BRCA1/2
9 Linkage
con
cancro
al
seno,
HNPCC
(Hereditary
NonPoliposis Colonrectal Cancer), sindrome di Lynch: in genere
la suscettibilità allo sviluppo di questi tumori è data da difetti nel
sistema del “Mismatch Repair” (MMR)
9 Il “genetici counselling” è consigliato solo in casi di forte
familiarità per il cancro al seno
0VARIAN CANCER
In che proporzione i tumori della mammella e
dell’ovaio sono ereditari?
Carcinoma mammario
Carcinoma ovarico
15–20%
5–10%
5–10%
Sporadico
Raggruppamenti familiari
Ereditari
Caratteristiche del CM ereditario
9 Casi multipli di CM/CO nella famiglia
9 Diagnosi sia di CM che di CO
¾Nella stessa famiglia
¾Nella stessa donna
9Giovane età alla diagnosi di CM
9CM bilaterale
9CM maschile
9 Maggior frequenza negli Ebrei Ashkenazi
CANCRO AL POLMONE
E’ un tumore ad origine multigenica
DA:ONCOGENE 2002, 21:7421-7434
9 Particolarmente interessanti sono i geni p53 e FHIT:
entrambi presentano anomalie nel tumore al polmone
strettamente correlate con lo sviliuppo dell’iperplasia
9 Trascritti anomali di FHIT si riscontrano nel 80% dei casi
di SCLC (Small Cell Lung Cancer) e 42% di NSCLC (NonSmall Cell Lung Cancer)
9 FHIT è un target preferenziale di carcinogeni come il
tabacco si pensa a causa di una regione fragile all’interno del
gene stesso (FHIT=Fragile Histidine Triade)
DA: EUR.J.CANCER 2001, 37 SUPPL:S63-73
CANCRO AL COLON
9 Circa il 5% delle persone è destinato a sviluppare cancro al
colon-retto
9 Sono descritti tre diversi tipi:
• sporadico: circa il 70% dei casi
• ereditario: circa il 10% dei casi
• familiare: circa il 25% dei casi
DA: ANN INTERN MED 2002, 137:603-612
MODELLO DI VOGELSTEIN PER LO SVILUPPO DEL
CARCINOMA COLONRETTALE
Il Tumore è una
malattia genetica
Il sillogismo aristotelico nell’era del DNA
Socrate è un uomo.
Gli uomini sono mortali.
Socrate è mortale.
Socrate è mortale.
Il maiale è mortale.
Socrate è un maiale.
Il tumore è una malattia
genetica.
Le malattie ereditarie
sono malattie genetiche.
Il tumore è una malattia
ereditaria.
Il Tumore è sempre genetico
Talvolta il tumore è ereditario
Cellula
germinale
Tumore
Sporadico
Tumore
Ereditario
Cellula
Germinale
Tutte le cellule
dell’organismo
sono portatrici
della mutazione
Aumento
del rischio
di cancro
Goal: Classification
Assessment
Risk Classification
Average
Family Hx
Moderate
(“Familial”)
High/Genetic
Intervention
Standard prevention
recommendations
Personalized prevention
recommendations
Referral for genetic evaluation
with personalized prevention
recommendations