19/12/2011
CHEMIOTERAPIA ANTIMICROBICA
Waksman: “compounds produced by one organism which
inhibits the growth of or kills other organisms.”
natural compounds vs. synthetic
ANTIBIOTICO
(dal greco Anti, contro; bios, vita)
Sostanza chimica prodotta da varie specie di microrganismi (batteri, funghi,
attinomiceti), che sopprimono la crescita di altri microrganismi e che possono
alla fine distruggerli.
CHEMIOANTIBIOTICO
Farmaci antibatterici di sintesi, come ad esempio i SULFAMIDICI e i
CHINOLONICI, che non vengono prodotti da microbi e che sono comunque
dotati di attività antibatterica
Requisiti essenziali:
•Effetto massimo sulla cellula batterica
•Scarso o nessun effetto sulle cellule umane
Definizione di antibiotico
sostanze chimiche prodotte da varie specie di microrganismi (batteri,
funghi, actinomiceti) in grado di sopprimere la crescita di altri
microrganismi e che possono alla fine distruggerli
Basi razionali della chemioterapia
(Paul Erlich 1891-1914)
•
•
•
•
•
Tossicità selettiva
Recettore specifico dell’agente patogeno
Screening di prototipi naturali e semisintesi di analoghi
Ruolo dei modelli animali
Problema della chemioresistenza
Corpora non agunt nisi fixata (P. Erlich 13 giugno 1914)
Da un consiglio di Ehrlich pubblicato nel 1913
“Frapper fort et frapper vite”
Colpisci forte e colpisci in fretta
1
19/12/2011
TOSSICITA’ SELETTIVA
una sorta di “magico proiettile”
Capacità di risultare tossico esclusivamente nei confronti
dei microrganismi e non delle cellule eucariotiche
♦
Assenza nelle cellule eucariotiche di siti particolari che
rappresentano il bersaglio d’azione degli antibiotici (es. parete
batterica)
♦
Diversa capacità di penetrazione del farmaco nelle cellule
eucariotiche e procariotiche
♦ Diversa affinità del farmaco per strutture simili funzionalmente,
ma non strutturalemente (es antibiotici che bloccano la sintesi
proteica per la diversa struttura del ribosoma procariotico)
STRUTTURA DELLA CELLULA BATTERICA
(assenza di
nucleo)
(Peptoglicano)
Gram+
Gram-
Unico strato molto spesso costituito
da peptoglicano (o mureina) con molti
legami crociati
Strato doppio con poco peptoglicano (o
mureina) e pochi legami crociati
Sensibili al lisozima
Al di sopra membrana esterna ricca di
lipoproteine e lipopolisaccaridi
Resistenti al complemento
Resistenti all lisozima
Sensibili al complemento
2
19/12/2011
Eucarioti
Procarioti
Nucleo
Nucleo vero e proprio
limitato da membrana
Assenza membrane nucleari; corpo
nucleare non separato da citoplasma
Cromosomi
Diversi cromosomi, costituiti
da
DNA
e
proteine
(prevalenza istoni)
Cromosoma unico, costituito unicamente
da DNA (assenza di proteine)
Apparato
mitotico
Presenza di centrioli e fuso
Assenza di apparato mitotico; suo ruolo
assolto probabilmente da membrana
plasmatica
Presenza di steroli
Composizione
delle membrane
Parete cellulare Se presente (funghi, vegetali,
protozoi)
composto
da
materiali semplici organici e
inorganici
Assenza di steroli
Struttura complessa tipica;
peptidoglicano e aminoacidi "
presenza
Ribosomi
Sempre 80S, salvo quelli
mitocondri e cloroplasti (70S)
Unicamente 70S
Sistema
respiratorio
Localizzato
in
organuli
specializzati: i mitocndri
Localizzato su membrana plasmatica:
assenti i mitocondri
Altri organuli
citoplasmatici
Presenti
Assenti
Discovery of penicillin 1928
Alexander Fleming
6 August 1881 – 11 March 1955
Picture of Penicillium notatum
3
19/12/2011
1938 - Produzione e purificazione della penicillina
penicillin culture at the Sir William Dunn School of
Pathology Oxford, England, 1940
Presso l’università di Oxford, Howard Florey e Ernst Chain mettono a
punto una coltivazione su larga scala di un ceppo di Penicillium notatum
e ottengono delle piccole quantità di penicillina.
Sperimentazioni in vivo dimostrano che la penicillina permette di
salvare i topi infettati con streptococchi.
1941 – Prime sperimentazioni nell’uomo
Le prime sperimentazioni
nell’uomo danno risultati
spettacolari.
Penicillina acquisisce lo status di
"farmaco miracoloso“
A causa della guerra, i ricercatori
emigrano negli Stati Uniti
4
19/12/2011
1942-1945 – Produzione industriale della penicillina
Ricerca di nuove specie produttrice di penicillina
1943- Isolamento del
Penicillum chrysogenum
rispetto al notatum garantisce resa più eleva
Produzione industriale della penicillina
1944, Pfizer inaugura il suo primo impianto di produzione.
1945, la produzione diventa sufficiente, disponibile per tutti.
5
19/12/2011
A poster from World War Two
Discovery of penicillin 1928
Discovery of terapeutic effects of penicillin
1945 - Nobel Prize in Physiology or Medicine
“for the discovery of penicillin and
its therapeutic effects”
Alexander Fleming
6 August 1881 – 11 March 1955
Picture of Penicillium notatum
Sir Alexander Fleming
Sir Ernst Boris Chain
Baron Howard Walter Florey
Howard Walter Florey
(1898-1968)
Ernst Boris Chain
(1906-1979)
6
19/12/2011
GERHARD DOMAGK (1895-1964) (A)
(premio Nobel 1939 per “studi sugli effetti antibatterici dei sulfonamidici)
• Azione antibatterica della crisoidina
(colorante azoico: -N=N-)
• Sintesi della crisoidina sulfonamidica
(Prontosil rosso)
premio Nobel per la Medicina e la Fisiologia
Trasformazione in vivo
7
19/12/2011
CLASSIFICAZIONE DEGLI ANTIBIOTICI
IN BASE AL MECCANISMO D’AZIONE
IN BASE AL TIPO D’AZIONE
IN BASE ALLO SPETTRO D’AZIONE
IN BASE ALLA COMPOSIZIONE CHIMICA
IN BASE ALL’ORIGINE
IN BASE ALLE CARATTERISTICHE CHIMICO-FISICHE
Meccanismi
principali
dell’azione
degli
antibiotici
da P.R. Murray, K.S. Rosenthal, G.S. Kobayashi, M.A. Pfaller
Microbiologia
EDISES
8
19/12/2011
CLASSIFICAZIONE DEGLI ANTIBIOTICI
IN BASE AL TIPO DI AZIONE
BATTERICIDI
Uccidono i batteri e il numero totale di microrganismi vitali
diminuisce.
BATTERIOSTATICI
Arrestano la crescita e la replicazione dei batteri, limitano la
diffusione dell’infezione mentre il sistema immunitario
dell’ospite attacca ed elimina i batteri.
Per valutare se l’antibiotico è batteriostatico o battericida si determinano le
M.I.C. e le M.B.C.
M.I.C: minima concentrazione inibente (concentrazione minima di antibiotico
in grado di impedire lo sviluppo dei microrganismi)
M.B.C.: minima concentrazione battericida (concentrazione minima di
antibiotico in grado di portare a morte le cellule batteriche)
PRINCIPI BASE DEL “MIC TEST”
concentrazione minima inibente
Metodo quantitativo: metodo delle diluizioni seriali degli antibiotici
NESSUNA CRESCITA
CRESCITA
Brodo
+
inoculo
+
antibiotico
Concentrazione
antibiotico
(µg/ml)
64
32
16
8
4
2
1
0.5
0.25 Controllo
(no antibiotico)
MIC
Concentrazione minima battericida (MBC): concentrazione minima che sterilizza
l’ambiente di coltura o che provoca una diminuzione del numero dei batteri del 99.9%
9
19/12/2011
Principali antibiotici battericidi e batteriostatici
Battericidi
Batteriostatici
Note
Penicilline
Cefalosporine
Monobattami
Penemici
Carbapenemici
Aminoglucosidi
Chinoloni
Glicopeptidi
Rifamicine
Fosfomicina
Cotrimossazolo
Colistina
Metronidazolo
Quinp-dalfopristina
Daptomicina
Tetracicline
Cloramfenicolo
Macrolidi
Lincosamidi
Acido fusidico
Sulfamidici
Trimetoprim
Linezolid
Tigeciclina
Alcuni batteriostatici
possono essere battericidi in
vitro ad elevate concentrazioni
che sono però irraggiungibili in
vivo.
Il cotrimossazolo è battericida
anche se i suoi due
componenti (trimetoprim e
sulfametossazolo) impiegati
separatamente sono
batteriostatici
10
19/12/2011
CLASSIFICAZIONE DEGLI ANTIBIOTICI
IN BASE ALLO SPETTRO D’AZIONE
Le specie batteriche nei riguardi delle quali l’antibiotico è attivo
MOLTO AMPIO (Con azione sui Gram positivi e sui gram negativi)
Tetracicline, cloramfenicolo, cefalosporine di terza e quarta generazione,
fluorochinoloni
AMPIO
Aminoglicosidi, rifampicina, cefalosporine di prima e seconda generazione
MEDIO (Con azione predominante sui Gram positivi)
Penicilline, macrolidi
RISTRETTO
Polimixina-colistina
LIMITATO AI GRAM NEGATIVI
Chinoloni di prima generazione, aztreonam
LIMITATO AI COCCHI GRAM POSITIVI
Penicilline antistafilococciche, vancomicina, acido fusidico
CLASSIFICAZIONE DEGLI ANTIBIOTICI
IN BASE ALLA COMPOSIZIONE CHIMICA
Beta-lattamine (condensazione di un anello tiazolidinico con uno betalattamico)
Penicilline, benzilpenicilline, aminopenicilline, carbossipenicilline, clavami, penemi,
cefemi (cefalosporine), oxacefemi, monobactamici…
Derivati della naftacenecarbossamide policiclica
Tetracicline, glicilglicine…
Derivati di un aminoacido
Cloramfenicolo, tiamfenicolo, cicloserina…
Polipeptidi
Polimixina-colistina
Macrolidi (nucleo lattonico a 14 atomi di carbonio)
Eritromicina, claritromicina, roxitromicina…
Derivati da due o più aminozuccheri uniti con legami glicosidici ad un nucleo
esoso
Aminoglicosidi ed aminociclitoli
4-Chinoloni fluorurati
Norfloxacina, ciprofloxacina,…
11
19/12/2011
CLASSIFICAZIONE DEGLI ANTIBIOTICI
IN BASE ALL’ORIGINE
Estrazione
da batteri: bacitracina, polimixina-colistina, monobactami (oggi ottenuti per sintesi)
da funghi: penicillum:penicilline, griseofulvina
cefalosporium:cefalosporine
attinomiceti(streptomyces):cefamicine e tutti gli altri antibiotici
Semisintesi
A partire da una struttura di base ottenuta per estrazione (fermentazione), si
aggiungono delle catene laterali
Sintesi chimica totale
Cloramfenicolo, monobattamici, sulfamidici, trimethoprim, chinoloni, nitrofurani…
CLASSIFICAZIONE DEGLI ANTIBIOTICI
IN BASE ALLE CARATTERISTICHE CHIMICO-FISICHE
ANTIBIOTICI IDROFILI
ANTIBIOTICI LIPOFILI
Beta-lattamine
Macrolidi
Fluorochinoloni
Penicilline
Cefalosporine
Carbapenemi
Monobactami
Tetracicline
Cloramfenicolo
Glicopeptidi
Aminoglicosidi
Basso volume di distribuzione
Incapacità ad attraversare m. plasmatica
Inattivi su patogeni intracellulari
Eliminazione prevalentemente renale
Rifampicina
Alto volume di distribuzione
Attraversamento m. plasmatica
Attivi su patogeni intracellulari
ELiminazione dopo metabolismo epatico
12
19/12/2011
Due grandi famiglie di antibiotici
Picco/CMI
Tempo>CMI
Cmax
Concentrazione
AUC/CMI
area
sotto la
curva
CMI
tempo > CMI
tempo
ATTIVITA’ DEGLI ANTIBIOTICI
TEMPO-DIPENDENTE
•
•
•
•
CONCENTRAZIONE-DIPENDENTE
Betalattamine
Glicopeptidi
Lincosamidi
Macrolidi Naturali
•
•
•
•
•
Aminoglucosidi
Fluorochinoloni
Metronidazolo
Claritromicina
Azitromicina
PK-PD correlazione
T > MIC
AUC 24h/MIC
Cmax /MIC
Cmax
13
19/12/2011
Due grandi famiglie di antibiotici
efficacia concentrazione-dipendente
aminoglicosidi
fluorochinoloni
metronidazolo
Cmax/CMI
ASC 24h/CMI
Cmax
efficacia tempo-dipendente
betalattamici
glicopeptidi
clindamicina
macrolidi
T (% 24h) > CMI
PK-PD correlations
Cmax/MIC
Concentration (mg/L)
40
Aminoglycosides
Fluoroquinolones
30
AUC/MIC
20
Azithromycin
Clarithromycin
Ketolides
MIC
10
T > MIC
Betalactams
Oxazolidinones
0
0
0,5
PAE
Vancomycin
Teicoplanin
8
10
16
24
Hours
JM Hyatt et al., 1995
14
19/12/2011
la scoperta degli antibiotici
1935 sulfonamidi
1940 β-Lattamici
1945 tetracicline
macrolidi
glicopeptidi
streptogramini
chinoloni
1950 cloramfenicolo
1955 aminoglicosidi
1960
rifampicina
1965
1970
1975
1963-1997 : 34 anni
senza la scoperta di
una nuova classe !
1980
1985
1990
1995
2000
2005
oxazolidoni
lipopeptidi
... Resistenza, malattie nosocomiali
Il diffuso e spesso ingiustificato
impiego di antibiotici, accanto alla non
sempre perfetta osservanza delle
norme igieniche negli ospedali, ha
contribuito e contribuisce in modo
significativo
alla
diffusione
del
fenomeno della resistenza, agendo
soprattutto quale fattore di selezione in
grado
di mantenere
e favorire
nell’ambiente lo sviluppo di germi
divenuti resistenti.
15
19/12/2011
RESISTENZA NATURALE
Insensibilità costituzionale di in microrganismo verso un
determinato antibiotico
♦ Immutabile nel tempo, geneticamente determinata
♦ Si manifesta in tutti i ceppi di una stessa specie
Dipende:
caratteristiche dell’antibiotico
strutture del microrganismo
mancata penetrazione del farmaco attraverso le strutture
esterne del microrganismo (es. insensibilità degli
enterobatteri per la penicillicna o dei batteri gram negativi
per i glicopeptidi)
LA RESISTENZA ACQUISITA
Comparsa di ceppi che, nell’ambito di una specie microbica originariamente sensibile ad un
chemioterapico, hanno perduto la sensibilità verso concentrazioni del farmaco terapeuticamente
raggiungibili in vivo.
1. Resistenza endogena (10-15% di tutte le resistenze acquisite )
mutazione spontanea dell’informazione genetica cromosomica
Si trasmette verticalmente tramite la discendenza
Multi-step: es. beta-lattamine, macrolidi, cloramfenicolo
One-step: es. rifamicine, chinoloni
2. Resistenza esogena (90% di tutte le resistenze )
E’ dovuta a geni presenti su plasmidi o trasposomi
Acquisizione di nuova informazione genetica mediante:
•coniugazione
• trasduzione
• trasformazione
trasmissione orizzontale
16
19/12/2011
MECCANISMI DELL’ANTIBIOTICO RESISTENZA
1. Ridotta permeabilità cellulare
Alterazione delle porine
* resistenza beta-lattamici
* fluorochinoloni
* aminoglicosidi
2. Aumentato efflusso
(A)pompa a efflusso nei batteri
Gram positivi e
Tetracicline
cloramfenicolo
macrolidi
alcuni beta-lattamici
fluorochinoloni
(B)Gram negativi.
MECCANISMI DELL’ANTIBIOTICO RESISTENZA
Alterazione del bersaglio
Ridotta affinità per il bersaglio
Iperproduzione del bersaglio
Sostituzione del bersaglio
Modificazione enzimatica del bersaglio
proteina alternativa (PBP2a) prodotta da Staphylococcus
aureus insieme alla proteina normale legante la penicillina
resistenza ai sulfamidici per sintesi di una nuova diidrofolate-sintetasi e quella del
trimetoprim per la produzione di una diidrofolato reduttasi supplementare
Produzione di enzimi inattivanti
L’antibiotico viene inattivato da enzimi specifici:
Beta-lattamasi : antibiotici beta-lattamici
acetiltrasferasi : aminoglicosidi o cloramfenicolo
fosfotrasferasi : aminoglicosidi
adeniltrasferasi : aminoglicosidi
17
19/12/2011
MECCANISMI DI RESISTENZA BATTERICA
• Alterata permeabilità involucri batterici
(β-lattamine, aminoglicosidi)
• ↑ estrusione antibiotico
(tetracicline)
• Inattivazione enzimatica
(β-lattamine, CAF, aminoglicosidi)
• Alterazione del sito di legame sui ribosomi
(macrolidi, tetracicline, aminoglicosidi)
• ↑ antimetabolita
(sulfamidici)
Accorgimenti per prevenire le
resistenze batteriche
In generale
rispetto e/o miglioramento delle pratiche igieniche negli
ospedali, al fine di ridurre il passaggio, tra un batterio e
l’altro, di materiale genetico;
monitoraggio e controllo dei “trend” di resistenza riscontrati
nel pool degli antibiogrammi di provenienza ospedaliera e
territoriale;
sviluppo di appropriate linee di condotta standardizzate e
condivise nelle prescrizioni per le patologie infettive
attenzione all’uso di antibiotici in zootecnia e nella
conservazione degli alimenti
18
19/12/2011
Accorgimenti per prevenire le
resistenze batteriche
In corso di terapia antibiotica
attenta considerazione per i fenomeni di resistenza batterica,
sia negli ospedalizzati sia tra la popolazione generale;
concreta e tempestiva disponibilità dei risultati di laboratorio
sulla sensibilità batterica, per modificare in modo
appropriato, se necessario, la terapia antibiotica;
scelta, in caso di terapia ragionata/empirica, di antibiotici che
non inducano e, al limite, neanche aumentino la probabilità
di resistenza;
impiego degli antibiotici in posologia e durata adeguate;
impiego di efficaci combinazioni di antibiotici, quando
strettamente indicato ed appropriato.
Schema per una scelta corretta dell’antibiotico
(terapia mirata)
mirata)
DATI CLINICO-STRUMENTALI DEL PAZIENTE
relativi alla patologia infettiva in atto
DATI MICROBIOLOGICI E DI LABORATORIO
Es.: E. Coli sensibile all’antibiotico X
RAGIONAMENTO RELATIVO AL SOGGETTO
Normale
Ins. Renale
Insuff. epatica
19
19/12/2011
FATTORI RESPONSABILI DELL’INSUCCESSO
DI UNA TERAPIA ANTIBIOTICA
•
•
•
•
•
•
•
Antibiotico non attivo vs organismo infettante o errata dx
Inadeguate difese dell’ospite
Durata terapia insufficiente o dosaggio insufficiente
Sviluppo resistenza
Superinfezione
Mancata compliance
Impossibilità a raggiungere sito infezione in q.tà adeguata
• Scarsa diffusibilità
• Inadeguato schema posologico
• Insufficiente esposizione
• Anomalie cinetiche
ANTIBIOTICI β-LATTAMICI
(penicilline, cefalosporine, carbapenemi e monobattami)
Gruppo più numeroso
Inibitori della sintesi parete cellulare
Stesso meccanismo d’azione
Reazioni allergiche spesso crociate
Possibile inattivazione ad opera enzimi (β-lattamasi)
Farmacocinetica
farmacodinamica
Struttura
nuclei attivi dei derivati
penicillinici e
cefalosporinici
20
19/12/2011
IL PEPTIDOGLICANO è un componente fondamentale della parete
cellulare batterica
aminozuccheri
Inibitori della sintesi parete cellulare
21
19/12/2011
sintesi dei peptidoglicani
Disaccaride+ peptide
Ponti di pentaglicina
PBP
(proteine leganti la penicillina)
L-Alanina
D-Glutammato
L-Lisina
NAMA
Transpeptidasi
Glicina
D-Alanina
D-Alanina
D-Alanina
NAMA= Acido N-acetilmuramico
22
19/12/2011
differenze strutturali
Parete Gram +
Parete Gram -
Hans Joachim Christian Gram
Meccanismo d’azione
Peptide
(D-alanine)
transpeptidasi
glycopeptide
penicilline
23
19/12/2011
MECCANISMO D’AZIONE
1. INIBIZIONE DELLA SINTESI DELLA PARETE CELLULARE: inibizione
covalente della transpeptidasi
2. ATTIVAZIONE DI AUTOLISINE: il legame con penicilline e cefalosporine oltre
a bloccare l’attività transpeptidasica determina l’attivazione di mureinidrolasi e
endopeptidasi con conseguente blocco della sintesi ed autolisi
Meccanismi di
resistenza agli
antibiotici betalattamici
1. Impermeabilizzazione
2. Alterazione delle PBP
3. Beta-lattamasi
da P.R. Murray, K.S. Rosenthal, G.S. Kobayashi, M.A. Pfaller
Microbiologia
EDISES
24
19/12/2011
inibitori betalattamasici in uso clinico
• Composti caratterizzati da scarsa
attività antibatterica
• substrati suicidi
• possono essere associati ad una
penicillina semisintetica
Amoxicillina+ Ac.clavulanico (Augmentin, Clavulin)
Ampicillina/sulbactam (Bethacil, Loricin, Unasyn)
Piperacillina-tazobactam (Tazocin)
Ticarcillina+ Ac.clavulanico (Timentin, Clavucar)
Classificazione
PENICILLINE NATURALI:
Penicillina G o benzil-penicillina
Penicillina V o fenossimetil penicillina
Penicillina F fentenil penicillina
• Forme retard:
• Benzatine-penicilline (Wycillina A.P. flac. 600000 e 1200000 U)
• Procaine- penicilline,
25
19/12/2011
Classificazione
PENICILLINE NATURALI:
Penicillina G o benzil-penicillina
Penicillina V o fenossimetil penicillina
Penicillina F fentenil penicillina
PENICILLINE BETA-LATTAMASI RESISTENTI
Meticillina (staficyn )
Isoxazolil penicilline: (oxacillina, dicloxacillina, cloxacillina, flucloxacillina)
solo cloxacillina,
dicloxacillina e
flucloxacilline sono
assorbite per via enterale
Classificazione
PENICILLINE NATURALI:
Penicillina G o benzil-penicillina
Penicillina V o fenossimetil penicillina
Penicillina F fentenil penicillina
PENICILLINE BETA-LATTAMASI RESISTENTI
Meticillina
Isoxazolil penicilline: (oxacillina, dicloxacillina, cloxacillina, flucloxacillina)
PENICILLINE AD AMPIO SPETTRO
AMINOPENICILLINE:
Ampicillina (Amplital)
Amoxicillina (Mopen, Velamox, Zimox)
Profarmaci dell’ampicillina
(Pivampicillina, Bacampicillina, Talampicillina)
gruppo aminico su catena laterale
26
19/12/2011
Classificazione
PENICILLINE NATURALI:
Penicillina G o benzil-penicillina
Penicillina V o fenossimetil penicillina
Penicillina F fentenil penicillina
PENICILLINE BETA-LATTAMASI RESISTENTI
Meticillina
Isoxazolil penicilline: (oxacillina, dicloxacillina, cloxacillina, flucloxacillina)
PENICILLINE AD AMPIO SPETTRO
AMINOPENICILLINE:
Ampicillina
Amoxicillina
Profarmaci dell’ampicillina
(Pivampicillina, Bacampicillina, Talampicillina)
CARBOSSIPENICILLINE:
carbenicillina, ticarcillina, temocillina
carindacillina e carfecillina
SULFOSSIPENICILLINE:
Sulbenicillina
UREIDOPENICILLINE:
piperacillina (Avocin ),
azlocillina,
mezlocillina,
apalcillina
Parametri farmacocinetici delle principali penicilline
Pénicilline
Assorbimento
orale (%)
Legame alle
proteine (%)
Metabolizzazione
epatica
Emivita
(h)
Penicillina G
20
60
No
0.5
Penicillina V
60
80
No
1
1. Benzilpenicilline
2. Penicilline resistanti alla β-lattamasi
Meticillina
-
35
No
0.5
Cloxacillina
50
94
Si
0.5
Dicloxacillina
50
97
Si
0.5
Flucloxacillina
50
96
Si
0.5
3. Aminopenicilline (ampio spettro)
Ampicillina
40
20
No
1
Amoxycillina
80
20
No
1
1
4. Carboxipenicilline e aciluréidopenicilline (spettro esteso)
Ticarcillina
-
50
Si
Piperacillina
-
50
Si
1
Azlocillina
-
50
Si
1
Mezlocillina
-
50
Si
1
27
19/12/2011
la quantità somministrata?
Cos'è più importante
la frequenza delle somministrazioni?
In altre parole sono
antibiotici dose o
tempo dipendente?
Due grandi famiglie di antibiotici
concentrazione-dipendente
aminoglicosidi
fluorochinoloni
metronidazolo
Cmax/CMI
ASC 24h/CMI
Cmax
tempo-dipendente
betalattamici
glicopeptidi
clindamicina
macrolidi
T (% 24h) > CMI
[c]
Peak
AUC
CMI
Time > CMI
Time
28
19/12/2011
EFFETTI COLLATERALI
Alto IT
Gli antibiotici sono responsabili del maggior numero (40%) delle reazioni allergiche
Determinante maggiore: residuo penicilloico
Determinanti minori: la molecola intera stessa, il penicilloato
Formazione in vivo di metaboliti della penicillina.
LE REAZIONI AVVERSE AGLI ANTIBIOTICI
I tre antibiotici più segnalati sono:
amoxicillina + ac. Clavulanico con 1423 reazioni, di cui 501 gravi e 8 decessi,
levofloxacina con 859 reazioni, di cui 289 gravi e 5 decessi, e
ceftriaxone con 626 reazioni, di cui 352 gravi e 22 decessi.
29
19/12/2011
SEVERITÀ DELLE REAZIONI AVVERSE AGLI ANTIBIOTICI
Il maggior numero di ADR gravi: 870 (32,7% del totale delle gravi per tutti i farmaci) i betalattamici e penicilline; 642 (24,1%) gli altri beta-lattamici ; 629 (23,6%) i chinolonici con il
23,6%, 245 (9,2%) i macrolidi e le lincosamidi.
Le ADR gravi hanno interessato: 50,8% la fascia d’età tra i 18 e i 64 anni
39,1% la fascia sopra i 65 anni.
Penicilline e reazioni allergiche
1. Reazioni
immediate
- reazioni di tipo anafilattiche
- manifestazioni: eritema, orticaria, rinite,
broncospasmo, ipotensione, shock
2. Reazioni
accelerate
- Producono effetti dello stesso tipo delle reazioni
precoci, ma non portano allo shock
- Possono manifestarsi con angioedema
3. Reazioni
tardive
- Manifestazioni: frequentemente eruzione cutanea
morbilliforme; raramente nefrite interstiziale
gravi le sindromi di Lyell o "necrolisi epidermica tossica“; la sindrome di
Stevens-Johnson o "eritema multiforme; epatite; necrosi cutanea e colite
pseudomembranosa
Test cutanei
Prick test
Patch test
Esami di laboratorio
30
19/12/2011
ALTRI EFFETTI COLLATERALI
• intolleranza locale; si può verificare dolore nel punto d’inoculo
• neurotossicità: convulsioni
• alterazioni elettrolitiche, i sali sodici, a dosi elevate possono causare
squilibri elettrolitici
• disturbi della coagulazione (soggetti anziani)
• colite pseudomembranosa
• infezioni opportunistiche (candidosi)
Reazioni allergiche crociate con gli altri beta-lattamici
I pazienti allergici alle penicilline devono essere considerati come
allergici a tutte penicilline semi-sintetiche.
- Le cefalosporine di prima generazione non devono essere
somministrati in caso di allergia alla penicillina, in quanto sono
stati descritti casi di allergie crociati. Il rischio di allergie crociate
con le cefalosporine di II e III generazione è più basso.
- L'aztreonam può essere somministrato ai pazienti allergici alle
penicilline.
- L'imipenem e il meropenem non possono essere usati in caso
di allergia alle penicilline a causa di allergie crociate.
-
Spettro d'azione delle diverse penicilline (Adattato da Schorderet 1998 e Armstrong et Cohen
1999)
Batteri
Benzilpenicilline
Penicillinasi
resistenti
Aminopenicilline
Carbossi-, ureidopenicilline
Amidinopenicilline
Streptococchi
++
++
++
+
-
Stafilococchi
penicillinasi +
-
+
-
-
-
Neisseria
+
-
+/-
+
-
+/-
-
+
+/-
-
Enterobatteri Gram
(-)*
-
-
+
+
+
Pseudomonas
aeruginosa
-
-
-
++
-
Anaerobi
+
+/-
+
+
-
Enterococchi
* Essenzialmente: E. coli, K. pneumoniae, Enterobacter spp, P. mirabilis
ALCUNE INDICAZIONI CLINICHE:
angina streptococcica: penicillina G o V
polmonite pneumococcica: penicillina o preferibilmente cefalosporine di III° generazione
infezioni otorinolaringoiatriche: amoxicillina + ac. clavulanico per la frequente produzione di
betalattamasi da parte di Haemophilus e Moraxella
meningite dell’adulto: aminopenicillina EV
infezioni urinarie: aminopenicilline, carbossipenicilline, ureidopenicilline a seconda dell’agente
eziologico
difterite e tetano: penicillina in associazione con la sieroterapia
31
19/12/2011
CEFALOSPORINE
ANELLO β-LATTAMICO
ANELLO DIIDROTIAZINICO
COOH
ACIDO 7-AMINOCEFALOSPORANICO
Tutte le cefalosporine derivano dal nucleo 7-aminocefalosporanico (anello betalattamico + anello diidrotiazinico) ottenuto dalla cefalosporina C (cefalosporina
estrattiva proveniente dal micete Cefalosporium acremonium)
CEFALOSPORINE
CLASSIFICAZIONE:
Via di somministrazione (orale o parenterale)
Resistenza alle beta-lattamasi (totale o parziale)
Immissione in commercio (generazioni I - II – III – IV)
MECCANISMO D’AZIONE
Hanno lo stesso meccanismo d’azione delle penicilline:
interferiscono con la formazione dei legami crociati del
peptoglicano
RESISTENZA
Idrolisi da parte delle beta-lattamasi
Ridotta penetrazione del farmaco nel batterio dovuta ad
alterazioni di proteine della membrana esterna nei batteri
gram-
mutazioni subite dalle proteine leganti l’antibiotico
32
19/12/2011
CEFALOSPORINE
Attività vs
Gram + Gram -
I GENERAZIONE
Resistenza alle
β-lattamasi
(es. cefalotina, cefazolina, cefalexina)
II GENERAZIONE
(es. cefamandolo, cefoxitina, cefuroxima)
III GENERAZIONE
(es. cefotaxime, ceftazidime, cefoperazone)
IV GENERAZIONE
(es. cefepime, cefpirome)
Varie generazioni di cefalosporine
Prima
cefadroxil, cefaloridina, cefalotina, cefapirina, cefazolina,
cefradina, cefalexina
attività antibatterica simile per tutte le molecole nell’antibiogramma si usa cefalotina
generalmente sensibili alle beta-lattamasi
Seconda
cefamandolo, cefotiam, cefoxitina, cefuroxina, cefaclor,
cefatrizina, ceforamide, cefotetan
spettro antibatterico variabile ricorso all’antibiogramma
maggior stabilità all’idrolisi da parte delle beta-lattamasi
Terza
Cefotaxime,
ceftriaxone,
ceftazidime
(+
cefoperazone,
latamoxef e cefsulodine)
Spettro d’azione ampio, alta stabilità nei riguardi delle betalattamasi plasmidiche
Favorevoli caratteristiche farmacocinetiche: lunga emivita (>7h
ceftriaxone), alta diffusione presso liquor, picchi sierici elevati
Quarta
cefepime, cefpirome
presentano carica elettrica bipolare migliore penetrazione
nei Gram+ e Gramampio spettro d’azione (incluso Proteus e Pseudomonas), alta
affinità per il bersaglio,
elevata resistenza all’azione idrolitica da parte delle betalattamasi
33
19/12/2011
Le cefalosporine di 1°° generazione costituiscono la prima scelta nella
profilassi chirurgica.
Le cefalosporine di 2°° generazione sono utilizzati in molte infezioni,
soprattutto respiratorie, urinarie, osteoarticolari.
Le cefalosporine di 3°° e 4°° generazione sono usate nella terapia delle
infezioni gravi da Gram-, compreso lo speudomonas.
Indicazioni cliniche
• infezioni gravi da bacilli Gram- (sepsi, endocarditi e meningiti)
• meningiti dell'età infantile (ceftriaxone)
• infezioni urinarie da enterobatteri multiresistenti (ceftazidime)
• infezioni respiratorie nosocomiali o comunitarie (cefalosporine di III°)
• trattamento di attacco di infezioni gravi (prima dell'isolamento dell'agente
eziologico) cefalosporina + aminoglicoside
34
19/12/2011
Antibiotici attivi sulla sintesi proteica
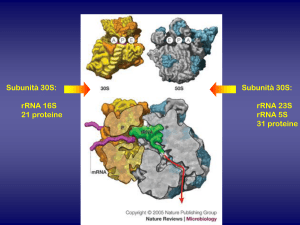
ANTIBIOTICI ATTIVI SUI RIBOSOMI
1) ANTIBIOTICI CHE LEGANO LA SUBUNITÀ 30S
• Aminoglicosidi
• Tetracicline
2)
•
•
•
•
•
•
ANTIBIOTICI CHE LEGANO LA SUBUNITÀ 50S
Cloramfenicolo
Macrolidi
Lincosamidi
Streptogramine
Pleuromutiline
Oxazolidinoni
AMINOGLICOSID
I
Classificazione: Secondo l’origine
ESTRATTIVA
SEMISINTETICA
GENTAMICINA
AMIKACINA
STREPTOMICINA
NETILMICINA
KANAMICINA
DIBEKACINA
TOBRAMICINA
ISEPAMICINA
NEOMICINA
Nel 1944 Salmon Waxman isolò, da alcune colture di microrganismi del
genere Streptomyces ( fam. Attinomiceti), il capostipite della classe degli
aminoglicosidi: la Streptomicina.
The Nobel Prize for Medicine to Selman Waksman for the discovery of
streptomycin in 1952
35
19/12/2011
In base alla struttura chimica …
Sono costituiti da due o
più aminozuccheri uniti
attraverso un legame
glicosidico ad un nucleo
esoso (aminociclitoli).
2-Desossistreptamina
Streptidina
Kanamicina
Neomicina
Gentamicina
Streptomicina
Tobramicina
Netilmicina
Paromomicina
Amikacina
Isepamicina
Gli aminozuccheri più importanti:
streptosio; ribosio; glucosamina;
Gli aminociclitoli invece sono principalmente due :
-streptidina, per la streptomicina e la diidrostreptomicina,
-2 - desossistreptamina, per gli altri aminoglicosidi
CARATTERISTICHE DEGLI ANTIBIOTICI AMINOGLICOSIDICI
Composti policationici altamente polari e, pertanto, non sono in
grado di attraversare la membrana plasmatica per diffusione passiva,
Sono scarsamente assorbiti nel tratto gastrointestinale e vengono
rapidamente escreti per via renale.
Gli effetti tossici sono correlati alla concentrazione ematica e
sembrano dovuti alla particolare affinità degli aminoglicosidi per le
cellule renali e per quelle dell’orecchio interno.
Possono verificarsi gravi manifestazioni tossiche a carico dei reni
(necrosi tubulare) e della funzione uditiva e vestibolare; la
diidrostreptomicina, ad esempio, per quanto con minore frequenza, può
determinare danni all’apparato vestibolare così gravi da indurre sordità
permanente. Per tale motivo viene, quindi, usata molto raramente.
36
19/12/2011
MECCANISMO D’AZIONE AMINOGLICOSIDI
Entrano nella cellula batterica mediante legame ad un carrier ⇒TRAPORTO
ATTIVO O2 DIPENDENTE ⇒ ⇒ ⇒legame subunità 30S del ribosoma RAPIDA
ATTIVITA’
1) BLOCCO DELLA SINTESI PROTEICA A LIVELLO RIBOSOMIALE (RNAr)
2) SOVVERTIMENTO STRUTTURALE E FUNZIONALE
DELLA MEMBRANA CITOPLASMATICA (multipolarità cationica)
3) INDUZIONE DI ERRORI NELLA TRADUZIONE DELCODICE (RNAm)
Ipotesi sull’azione battericida degli aminoglicosidi
The Davis model of aminoglycoside action
The effect is irreversible, perhaps because of trapping of drug inside the cell (“caging”). The
membrane damage cannot be repaired because new proteins cannot be synthesized, and cell death
ensues.
37
19/12/2011
AMINOGLICOSID
I
SPETTRO ANTIBATTERICO
Microrganismi Aerobi GRAM –
Enterobatteri, brucelle, yersinie, pseudomonas, acinetocbacter,
stafilococchi
Sono resistenti:
Streptococchi, enterococchi anaerobi e i batteri a localizzazione
intracellulare (Spirochete, Clamydia, Mycoplasma, Ureaplasma)
Gli aminoglicosidi attraversano la membrana batterica con un
processo attivo che richiede ossigeno, quindi i microrganismi
anaerobi risultano resistenti
Meccanismi di resistenza agli aminoglicosidi
1- Alterazioni del trasporto di membrana
2 – Alterazione dei siti di legame ribosomiali
3 – Inattivazione enzimatica
Sono stati isolati 3 tipi di
enzimi:
* Adeniltransferasi
* Fosfotransferasi
* Acetiltransferari
38
19/12/2011
FARMACOCINETICA AMINOGLICOSIDI
•mancato assorbimento gastroenterico dopo somministrazione orale
•livelli ematici variabili e dipendenti da fattori quali: l’età, la funzionalità renale,
l’obesità
•fissazione debole alle proteine plasmatiche
•diffusione tissutale debole (tassi tissutali inferiori ai tassi sierici ad eccezione della
corteccia renale)
•debole diffusione nel liquor e nel pus, nella prostata, nel tessuto osseo e nelle
secrezioni bronchiali
•emivita di circa 2-2,30 ore
•eliminazione renale rapida per filtrazione glomerulare
la quantità somministrata?
Cos'è più importante
la frequenza delle somministrazioni?
In altre parole sono
antibiotici dose o
tempo dipendente?
39
19/12/2011
Due grandi famiglie di antibiotici
concentrazione-dipendente
aminoglicosidi
fluorochinoloni
metronidazolo
Cmax/CMI
ASC 24h/CMI
Cmax
tempo-dipendente
betalattamici
glicopeptidi
clindamicina
macrolidi
T (% 24h) > CMI
Peak
[c]
AUC
Time > CMI
CMI
Time
EFFETTI INDESIDERATI
OTOTOSSICITA’
•Danno cocleare (neomicina, amikacina,
kanamicina)
suoni ad alta frequenza
suoni a bassa frequenza
•Danno vestibolare (streptomicina, gentamicina)
Fase acuta (1-2 sett) cefalea, nausea
vomito, vertigini
Labirintite cronica (1-2 mesi) atassia
Fase compensatoria (1-2 anni)
40
19/12/2011
EFFETTI INDESIDERATI
NEFROTOSSICITA’ (neomicina,
tobramicina, gentamicina)
tubulo prossimale
==> necrosi tubulare acuta
SEQUENZA DEGLI EVENTI
Incorporazione degli AG (mediante pinocitosi) da parte delle cellule
epiteliali del tubulo prossimale
Trasporto e accumulo degli AG nei lisosomi, e sviluppo di fosfolipidosi
lisosomiale
Rottura (?) dei lisosomi, necrosi cellulare e fosfolipiduria
Necrosi tubulare/rigenerazione tubulare
Necrosi tubulare acuta
Insufficienza renale
EFFETTI INDESIDERATI
NEFROTOSSICITA’ (neomicina,
tobramicina, gentamicina)
tubulo prossimale
==> necrosi tubulare acuta
PARALISI MUSCOLARE
placca neuromuscolare:
- Inibizione pre-sinaptica della liberazione di
ACh
-Blocco del recettore post-sinaptico per
l'acetilcolina
Ipersensibilità
41
19/12/2011
Aminoglucosidi
Indicazioni
Infezioni respiratorie (da batteri Gram-negativi)
Infezioni urinarie
Sepsi da batteri Gram-negativi
Infezioni intraddominali
Complicanze infettive secondarie ad intervento
chirurgico
Infezioni dei vari organi e apparati da batteri
Gram-negativi
GENTALYN
Monitoragio: terapia > 7 giorni
categorie a rischio (anziani, IR,
neonati, altre terapia, alt. udito)
NEBICINA, TOBREX
PRECAUZIONI
Adattare la posologia in caso di insufficienza renale
Monitorare la funzione uditiva
Evitare il trattamento prolungato
Evitare la somministrazione in gravidanza
42
19/12/2011
Struttura delle tetracicline
I GENERAZIONE
II GENERAZIONE
Meccanismo d’azione delle tetracicline
Legame con la subunità
ribosomiale batterica 30S
blocco
del
legame
dell’aminoacil-tRNA sul sito
accettore del complesso mRNAribosoma
Tossicità selettiva delle tetracicline: da elettiva concentrazione nella cellula
batterica (trasporto attivo)
43
19/12/2011
Meccanismi di resistenza alle tetracicline
1. Diminuzione dei livelli intracellulari di TC
Ingresso
Acquisizione di sistemi di estrusione
2. Diminuzione dell’accesso delle TC ai siti di legame
ribosomiali
3. Inattivazione delle TC
SPETTRO ANTIBATTERICO
Originariamente molto ampio, ora ristretto per
l’espansione delle resistenze
Cocchi GRAM + (stafilococchi 70% resistenze)
Cocchi GRAM - (neisserie)
neisserie)
Bacilli GRAM +
Enterobatteri e altri bacilli gram –
Effetti collaterali delle tetracicline
Effetti GI
• Irritazione GI
• Superinfezioni
colite pseudomembranosa da C. difficile
44
19/12/2011
Effetti collaterali delle tetracicline
Fotosensibilizzazione
Effetti GI
Epatotossicità
Nefrotossicità
•
•
•
sintesi proteica ed effetto catabolico
Diabete insipido nefrogenico da demeclociclina
Effetto tossico diretto da TC parzialmente
degradate
Effetti collaterali delle tetracicline
Fotosensibilizzazione
Effetti GI
Epatotossicità
Effetto in
gestazione
Nefrotossicità
Effetto sui denti
45
19/12/2011
MACROLIDI - Struttura
Anello lattonico macrociclico + 1 o 2 zuccheri
O
H 3C
CH3
OH
O
OH
H3 C
H3C
CH3
OH
CH3
HO
OH
OH
H3C
H 3C
O
O
amminozuccheri
H3C
O
O
N(CH3)2
HO
O
O
CH3
CH3
H3C
O
CH3
O
metil-desossi-esosi (L)
CH3
OCH3
CH3
O
CH 3
O
OH
CH3
Eritromicina A
H3 C
H3C
HO
N
CH3
OH
OH
H3C
H3 C
CH3
H3C
O
O
O
N(CH3)2
HO
O
O
CH3
OCH3
CH3
CH3
O
Azitromicina
OH
CH3
46
19/12/2011
MACROLIDI
MACROLIDI – Meccanismo d’azione
Inibizione reversibile della sintesi
proteica (subunità 50S)
Legame con la
subunità 50S
del ribosoma
(rRNA 23S).
E PA
Inibizione della
traslocazione della
catena in formazione dal
sito A al sito P.
Hanno attività sia BATTERICIDA che
BATTERIOSTATICA a seconda delle [C] e
del tipo di microrganismo
E PA
47
19/12/2011
Meccanismi di resistenza ai macrolidi
1.
Estrusione attraverso meccanismi attivi di pompa
2.
Produzione di metilasi che modifica il bersaglio ribosomiale (geni Erm fenotipo MLSB)
3.
Alterazioni cromosomiche modificazioni proteine ribosomiali
4.
Inattivazione per idrolisi
48
19/12/2011
MACROLIDI – Effetti collaterali
Generalmente ben tolerati
•Disturbi gastrointestinali:
talvolta la somministrazione per via orale è
accompagnata da anoressia, nausea, vomito
e diarrea.
•Epatotossicità:
in particolare l’Eritromicina estolato, e in
minor misura l’etilsuccinato e lo stearato
possono causare epatite colestatica acuta con
febbre, ittero e alterazione della funzionalità
epatica.
Claritromicina KLACID
Azitromicina ZITROMAX
49
19/12/2011
50