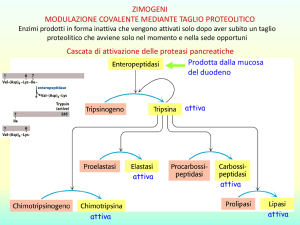
Enzimi
Con l’eccezione di piccoli gruppi di molecole di RNA
catalitico tutti gli enzimi sono proteine
Molti enzimi per poter funzionare richiedono la presenza di
cofattori.
apoenzima + cofattore = oloenzima
I cofattori che sono piccole molecole organiche sono detti
coenzimi
Gli enzimi sono classificati in base alle reazioni che catalizzzano
Classificazione internazionale degli enzimi
N. Classe
1. Ossidoreduttasi
Tipo di reazione catalizzata
Trasferimento di elettroni
A- +B
2. Transferasi
A + B-
Trasferimento di gruppi
A-B + C
A + B-C
Classificazione internazionale degli enzimi
N. Classe
3. Idrolasi
Tipo di reazione catalizzata
Reazioni di idrolisi
(Trasferimento di gruppi funzionali all’acqua)
A-B + H2O
4. Liasi
A-H + B-OH
Addizione di gruppi a doppi legami o
formazione di doppi legami mediante
rimozione di gruppi
X
Y
A
B
A = B + X-Y
Classificazione internazionale degli enzimi
N. Classe
5. Isomerasi
6. Ligasi
Tipo di reazione catalizzata
Trasferimento di gruppi all’interno
della molecola con la formazione di
isomeri
X
Y
Y
X
A
B
A
B
Formazione di legami C-C, C-S, C-O,
e C-N mediante reazioni di
condensazione accoppiate alla
scissione di ATP.
A+B
A-B
I legge della termodinamica
L’energia totale di un sistema e del suo ambiente è costante
ΔE = EB - EA = Q + W
EA = Energia del sistema all’inizio del processo
EB = Energia del sistema alla fine del processo
Q = Calore assorbito dal sistema
W = Lavoro svolto
La prima legge della termodinamica non può essere usata per
predire se una reazione avviene spontaneamente
Bisogna introdurre il concetto di Entropia:
Entropia (S) = grado di disordine del sistema
II legge della termodinamica
Un processo può avvenire spontaneamente soltanto se la somma
delle entropie del sistema e dell’ambiente aumenta.
In un processo spontaneo
(ΔSsistema + ΔSambiente) > 0
Nel 1878 J. W. Gibbs introdusse la funzione “energia libera” (G)
combinando la I e la II legge della termodinamica:
Δ G = Δ H - TΔ S
ΔG = Variazione di energia libera di un sistema a pressione (P) e temperatura
(T) costanti
ΔH = Variazione di entalpia
ΔS = Variazione di entropia
Δ H = Δ E + PΔV
ΔE = Variazione dell’energia interna del sistema.
Poiché nelle reazioni biochimiche la variazione di volume (ΔV) è
molto piccola:
Δ H ≅ ΔE
quindi
Δ G ≅ Δ E - TΔ S
Il ΔG di una reazione dipende sia dalla variazione di energia
interna che dal cambio di entropia del sistema
La variazione di energia libera (ΔG) può essere utilizzata per
stabilire se un processo avviene in modo spontaneo:
•Una reazione può avvenire spontaneamente se il ΔG è negativo
•Un sistema è all’equilibrio quando il ΔG = 0
•Una reazione non può procedere spontaneamente se il il ΔG > 0.
In tal caso sarà necessario fornire energia libera alla reazione
Il ΔG di una reazione è indipendente dalla via seguita dalla
trasformazione
Il ΔG non fornisce informazioni sulla velocità della reazione
Un ΔG negativo indica che una reazione può avvenire
spontaneamente, ma non significa che essa proceda ad una
velocità apprezzabile
L’enzima è un catalizzatore
La funzione di un catalizzatore è quella di aumentare la
velocità di una reazione
I catalizzatori non modificano l’equilibrio di una reazione
Gli enzimi accelerano il raggiungimento dell’equilibrio
ma non modificano la sua posizione
Diagramma della coordinata di reazione di una reazione chimica
Nella reazione S Æ P il substrato S passa attraverso lo stato di
transizione che possiede più energia libera di S e P.
L’energia libera di attivazione di Gibbs (ΔG‡) indica la differenza
tra l’energia dello stato di transizione e quella del substrato
Gli enzimi accellerano le reazioni abbassando
l’energia di attivazione
L’enzima non viene consumato durante la reazione.
Il punto di equilibrio rimane inalterato.
La reazione raggiunge l’equilibrio più rapidamente.
V = k [S]
(legge della velocità)
Dalla teoria dello strato di transizione si può ricavare
l’equazione :
kT − ΔG ‡ /RT
k=
e
h
k = costante di Boltzman
h = costante di Plank
La relazione tra la costante di velocità (k) e l’energia di
attivazione (ΔG‡) è inversa ed esponenziale.
Più bassa è l’energia di attivazione più alta è la velocità della
reazione.
La formazione di un complesso enzima-substrato è
la prima tappa nella catalisi enzimatica.
Quali sono le evidenze dell’esistenza di un complesso
enzima-substrato?
Una reazione catalizzata ha una velocità massima.
Velocità della reazione
Per molti enzimi:
A concentrazione costante di enzima, la velocità della reazione
aumenta in modo proporzionale all’aumento della concentrazione
del substrato finchè non viene raggiunta una velocità massima.
Velocità massima
[ ] del substrato
Le reazioni non catalizzate non presentano questo effetto di saturazione
I complessi enzima-substrato possono essere
visualizzati direttamente al microscopio elettronico
Fotografia al microscopio elettronico di molecole di DNA polimerasi I
(sfere bianche) legate ad uno stampo di DNA sintetico (Dr. Iack Griffith)
L’enzima chimotripsina con un substrato legato (in rosso)
I substrati si legano ad una specifica regione
dell’enzima, chiamato sito attivo.
- Il sito attivo occupa una parte relativamente piccola del volume
totale della molecola
- Il sito attivo è formato da gruppi che derivano da parti diverse
della sequenza amminoacidica lineare.
- L’interazione enzima-substrato è mediata dalle stesse forze che
stabilizzano la struttura delle proteine (legami idrogeno,
interazioni idrofobiche, forze di van der Waals, legami ionici)
Il substrato ha una forma complementare al sito attivo dell’enzima
Enzima diidrofolato reduttasi insieme al suo substrato NADP+
Il substrato ha una forma complementare al sito attivo dell’enzima
Enzima diidrofolato reduttasi insieme al suo substrato NADP+
Il sito attivo può essere formato da residui distanti nella sequenza primaria
Lisozima
L’energia che si libera dalle interazioni enzima-substrato viene
detta energia di legame.
L’ energia di legame è la fonte principale di energia libera usata
dall’enzima per abbassare l’energia di attivazione della reazione.
I siti attivi sono cavità da cui l’acqua è normalmente esclusa a
meno che non sia un reagente.
Il carattere non polare favorisce l’interazione con il substrato.
Possono essere presenti residui polari coinvolti nell’interazione
enzima-substarto.
Le interazioni fra molecole polari risultano fortemente indebolite in un mezzo
acquoso.
I sistemi biologici hanno risolto questo problema creando dei microambienti
privi di acqua (idrofobici) dove le interazioni polari sono molto forti
Enzima
-
Sacca idrofobica
+
Substrato
Un enzima che lega un substrato carico positivamento (+) spesso ha un amminoacido
con catena laterale carica negativamente (-) in corrispondenza del sito di
riconoscimento
La specificità del legame enzima-substrato dipende dalla precisa disposizione
degli atomi del sito attivo.
Vi è perfetta complementarietà tra il substrato ed il sito attivo.
Modello “chiave - serratura” per l’interazione enzima-substrato proposto da
Emil Fisher nel 1890.
Modello di “adattamento indotto” per l’interazione enzima-substrato proposto
da Daniel E. Korshland nel 1958.
- L’enzima cambia forma in seguito al legame del substrato.
- Il sito attivo ha una forma complementare al substrato solo dopo che questo si è legato.
Adattamento indotto dell’esochinasi
In rosso il glucosio
L’aumento della velocità prodotto da alcuni
enzimi
Un enzima immaginario (“metallasi) che catalizza la rottura di
una barretta di metallo
Per poter catalizzare una reazione, un enzima deve essere
complementare allo stato di transizione
Le interazioni deboli tra enzima e substrato sono ottimali nello stato di
transizione.
Le interazioni deboli di legame tra enzima e substrato sono la principale forza
trainante della catalisi
ΔGB = Energia di legame
Per comprendere come funzionano gli enzimi abbiamo
bisogno di una descrizione cinetica della loro attività
La velocità di una reazione, definita come il numero di moli
di prodotto formate nell’unità di tempo, dipende dalla
concentrazione del reagente e da una costante di velocità (k)
Per la reazione S Æ P
V = k [S]
(legge della velocità)
V = k [S]
(legge della velocità)
Dalla teoria dello strato di transizione si può ricavare
l’equazione :
kT − ΔG ‡ /RT
k=
e
h
k = costante di Boltzman
h = costante di Plank
La relazione tra la costante di velocità (k) e l’energia di
attivazione (ΔG‡) è inversa ed esponenziale.
Più bassa è l’energia di attivazione più alta è la velocità della
reazione.
Velocità della reazione
Per molti enzimi:
A concentrazione costante di enzima, la velocità della reazione
aumenta in modo proporzionale all’aumento della concentrazione
del substrato finchè non viene raggiunta una velocità massima.
Velocità massima
[ ] del substrato
Le reazioni non catalizzate non presentano questo effetto di saturazione
La concentrazione del substrato modifica la velocità delle
reazioni catalizzate dagli enzimi
- Studiando gli effetti della concentrazione del substrato sulla velocità delle
reazioni bisogna tener presente che la [S] varia durante il corso della reazione
perché il substrato viene convertito in prodotto.
- Per semplificare l’analisi degli esperimenti di cinetica enzimatica, si può
valutare la velocità iniziale (V0), quando la [S] è in genere molto più grande
della concentrazione dell’enzima. E’ possibile in queste condizioni ignorare la
reazione P Æ S.
- Se l’analisi è rapida la variazione di [S] può essere trascurata e la [S] può
essere considerata costante.
Per molti enzimi:
ad una concentrazione fissa di enzima la velocità della reazione (V) è
linearmente proporzionale alla concentrazione del substrato [S] quando [S] è
bassa;
ad elevate [S] V risulta indipendente da [S]
La formazione del complesso ES è la chiave per comprendere il
comportamento cinetico degli enzimi.
Nel 1913 Leonor Michaelis e Maud Menten, elaborando una
teoria generale sull’azione degli enzimi, hanno proposto un
modello e trovato l’equazione che spiega l’andamento della
velocità di una reazione enzimatica in funzione della [S].
Modello di Michealis e Menten (a)
L’enzima prima si combina con il substrato in una tappa veloce
e reversibile:
k1
E+S
ES
k2
Modello di Michealis e Menten (b)
Il complesso ES si decompone poi in una seconda tappa più lenta
in E + P
k3
ES
E+P
k4
X
Nei primi tempi della reazione la concentrazione di prodotto,
[P], è molto bassa e quindi si può assumere che il prodotto non si
converta in substrato e quindi la k4 può essere ignorata.
Modello di Michealis e Menten (c)
I ricercatori Michaelis e Menten hanno trovato l’equazione che spiega
l’andamento della velocità di una reazione enzimatica in funzione della
concentrazione del substrato partendo dall’ipotesi che la trasformazione del
complesso ES in E + P è la tappa limitante della reazione, quindi:
k3
ES
E+P
Tappa limitante della reazione
La velocità complessiva della reazione, che è definita dalla velocità della tappa
più lenta è:
V0 = k3 [ES]
Il termine [ES] non è facilmente misurabile.
Bisogna pertanto esprimere [ES] in termini noti.
Esprimiamo [ES] in termini noti…..
k3
k1
E+P
E+S
ES
k2
Velocità di formazione di ES = k1 [E] [S]
Velocità di scissione di ES = k2 [ES] + k3 [ES] = (k2 +k3) [ES]
Quando l’enzima viene mescolato con un grande eccesso di substrato la reazione
raggiunge rapidamente lo stato stazionario in cui la [ES] resta costante nel
tempo.
Allo stato stazionario, la concentrazione dell’intermedio di reazione, nel caso di
una reazione catalizzata [ES], rimane la stessa anche se le concentrazioni dei
substrati di partenza e dei prodotti cambiano.
Velocità di formazione di ES = k1 [E] [S]
è uguale alla
Velocità di scissione di ES = k2 [ES] + k3 [ES] = (k2 +k3) [ES]
Esprimiamo [ES] in termini noti…..
k3
k1
E+P
E+S
ES
k2
Velocità di formazione di ES = k1 [E] [S]
Velocità di scissione di ES = k2 [ES] + k3 [ES] = (k2 +k3) [ES]
Quando l’enzima viene mescolato con un grande eccesso di substrato la reazione
raggiunge rapidamente lo stato stazionario in cui la [ES] resta costante nel
tempo.
La V0 che misuriamo è la V0 dello stato stazionario, dove:
k1 [E] [S] = (k2 +k3) [ES]
Esprimiamo [ES] in termini noti…..
allo stato stazionario: k1 [E] [S] = (k2 +k3) [ES]
da cui:
[E ][S]
[ES ] = (k
2
+ k 3)
k1
k2 + k 3
= KM
k1
KM = costante di Michaelis
quindi:
[ES ] =
[E ][S]
KM
Esprimiamo [ES] in termini noti…..
[ES ] =
[E ][S]
KM
La concentrazione del substrato non combinato con l’enzima,
[S], è molto vicina alla concentrazione totale di substrato quando
[E] << [S].
La concentrazione di enzima libero, [E] è:
[E] = [Et] - [ES]
Esprimiamo [ES] in termini noti…..
Sostituendo [E] = [Et] - [ES] in:
[ES ] =
([E t ] − [ES ])[S]
abbiamo: [ES ] =
KM
KM [ES] = [Et][S] - [ES][S]
KM [ES] + [ES] [S] = [Et][S]
[ES] (KM + [S]) = [Et][S]
[E ][S]
KM
=
[E t ][S] − [ES][S]
KM
Esprimiamo [ES] in termini noti…..
[ES] (KM + [S]) = [Et][S]
=
[E t ][S]
[ES ] =
K M + [S]
V0 = k3 [ES]
quindi:
[E t ][S]
[ES ] =
K M + [S]
[E t ][S]
V0 = k 3
K M + [S ]
Poiché la velocità massima viene raggiunta quando l’enzima è
stato completamente saturato con il substrato e cioè [ES] = [Et]:
Vmax = k3 [Et]
Vmax [S]
V0 =
KM + [S]
Vmax [S]
V0 =
KM + [S]
Equazione di Michaelis - Menten
Questa equazione è in accordo con i dati cinetici sperimentali:
Quando [S] è molto bassa ([S] << KM)
Vmax
V0 =
[S]
KM
cioè V0 è direttamente proporzionale a [S]
Quando [S] è molto alta ([S] >> KM)
cioè V0 è indipendente da [S]
V0 = Vmax
Vmax [S]
V0 =
KM + [S]
Quando [S] = KM
Equazione di Michaelis - Menten
Vmax [S]
V0 =
2[S]
semplificando:
Vmax
V0 =
2
KM = concentrazione del substrato che determina metà
della velocità massima.
Vmax [S]
V0 =
KM + [S]
Equazione di Michaelis - Menten
Descrive il comportamento cinetico di molti enzimi.
Tutti gli enzimi che presentano una relazione di tipo iperbolico tra
la velocità della reazione catalizzata e la concentrazione del
substrato seguono la cinetica di Michaelis - Menten
KM = [S] quando V = 1/2 Vmax
Molti enzimi che seguono la cinetica di Michaelis - Menten hanno
meccanismi di reazione diversi dal semplice meccanismo a 2 tappe
originariamente proposto da Michaelis e Menten:
E+S
k1
k2
ES
k3
E+P
Se un enzima reagisce secondo un meccanismo a 2 tappe (modello di MichaelisMenten):
E+S
k1
ES
k3
E+P
k2
Vmax = k3 [Et]
e
k3 = costante che limita la V0
Se un enzima reagisce secondo lo schema seguente:
E+S
k1
k2
ES
k3
EP
k5
E+P
k4
in cui il rilascio del prodotto (EP Æ E + P) diventa la tappa limitante,
Vmax = k5 [Et]
Significato dei valori di KM e di Vmax
Si definisce Kcat la costante di velocità della tappa limitante.
Vmax = kcat [Et]
L’equazione di Michaelis- Menten:
Vmax [S]
V0 =
KM + [S]
può essere riscritta:
k cat [E t ][S ]
V0 =
KM + [S ]
Significato dei valori di KM e di Vmax
Kcat = numero di turnover
Il numero di turnover di un enzima = il numero di molecole di substrato che viene
convertito in prodotto nell’unità di tempo
da una singola molecola di enzima quando
l’enzima è completamente saturato con il
substrato.
Il valore di Vmax
La Vmax può essere utilizzata per determinare il numero di turnover di un
enzima se si conosce la concentrazione dei siti attivi (= [Et]) in quanto:
Vmax = kcat [Et]
Esempio:
Una soluzione 10-6 M di anidrasi carbonica catalizza la formazione di 0,6 moli
di H2CO3 per secondo quando è completamente saturata con il substrato.
kcat
Vmax 0,6Ms−1
5 −1
=
=
=
6x10
s
−6
[E t ] 10 M
Vmax e KM sono parametri calcolabili sperimentalmente
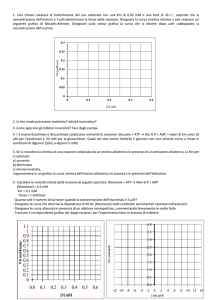
Un metodo grafico molto semplice per ottenere il valore di KM e di Vmax:
il grafico dei doppi reciproci.
La costante di Michaelis-Menten (KM), e la velocità masima (Vmax) possono essere
facilmente derivate dalla velocità di catalisi misurata a diverse concentrazioni di
substrato se l’enzima segue la cinetica di Michaelis-Menten
L’equazione:
Vmax [S]
V0 =
KM + [S]
può essere trasformata algebricamente in una forma più utile per analizzare i
dati sperimentali:
1 KM
1
1
=
x
+
V0 Vmax [S] Vmax
…la trasformazione algebrica….
Vmax [S]
V0 =
KM + [S]
=
1 KM + [S]
=
V0 Vmax [S]
=
KM
1
[S]
=
+
V0 Vmax [S] Vmax [S]
semplificando…..
1 KM
1
1
=
x
+
V0 Vmax [S] Vmax
1 KM
1
1
=
x
+
V0 Vmax [S] Vmax
Equazione di Lineweaver-Burk
Per enzimi che obbediscono alla relazione di Michaelis - Menten mettendo in
grafico i valori di
1
in funzione di
V0
otteniamo una linea retta.
1
[S ]
(grafico dei doppi reciproci)
pendenza
= intercetta sull’asse delle Y
= intercetta sull’asse delle X
Significato del valore di KM
KM = concentrazione del substrato che determina metà della velocità massima
(metà dei siti attivi sono occupati)
KM ci fornisce una indicazione sulla concentrazione di substrato necessaria
perché la catalisi avvenga in modo significativo
E+S
k1
ES
k3
k2
Se k2 >> k3
KM ≅
E+P
KM
k 2 + k3
=
k1
k2 [E ][S]
=
k1
[ES]
Cioè: KM è uguale alla costante di dissociazione del complesso ES quando k3 è
molto più piccola di k2.
-in queste condizioni (k2>> k3) KM misura la forza del complesso ES
(valori alti di KM = legame debole)
Significato dei valori di KM e di kcat
Per confrontare l’efficienza catalitica di enzimi diversi è necessario disporre di
un parametro adeguato
Il numero di turnover non è molto soddisfacente!
Enzimi che catalizzano reazioni diverse possono avere lo stesso valore del
numero di turnover, mentre le velocità delle reazioni non catalizzate possono
essere diverse e quindi non si ha un’idea dell’incremento della velocità dovuto
all’enzima.
Il numero di turnover riflette una situazione in cui l’enzima è saturato con il
substrato.
E’ meno utile quando [S] è bassa!
Anche KM non è sempre un parametro adeguato!
-KM deve avere una relazione con la [S] a cui l’enzima lavora
Un enzima che agisce su un substrato presente in una cellula a concentrazioni
molto basse tende ad avere una KM più bassa.
Significato dei valori di KM e di Vmax
Abbiamo visto che quando la concentrazione del substrato è molto più grande
di KM , tutto l’enzima è legato al substrato e la velocità della catalisi è uguale a
Vmax = kcat [Et]
In condizioni fisologiche il rapporto [S]/KM generalmente varia da 0.01 a 1.
Per paragonare le efficienze catalitiche è necessario usare un parametro che
comprenda sia kcat che KM
Quando, come spesso accade in condizioni fisiologiche, [S] << KM
l’equazione
k cat [E t ][S ]
V0 =
KM + [S ]
può essere scritta:
k cat
V0 =
[E t ][S ]
KM
V0 quindi dipende da [Et], da [S] e dalla costante
kcat
KM
Per paragonare le efficienze catalitiche è necessario usare un parametro che
comprenda sia kcat che KM
Quando [S] << KM, pertanto, kcat/KM è la costante di velocità
dell’interazione di S con E e può essere utilizzato per misurare l’efficienza
catalitica di un enzima.
Il fattore
kcat
KM
è il migliore parametro cinetico per confrontare l’efficienza catalitica
Utilizzando il rapporto kcat/KM, è possibile paragonare la preferenza di un
enzima per diversi substrati
Quanto può essere efficiente un enzima?
E+S
k1
ES
k3
E+P
k2
Ricordando che…..
kcat
KM
k 2 + k3
KM =
k1
e
k3 = kcat
k cat
kcat
=
=
k1
k2 + k cat k2 + k cat
k1
In condizioni in cui la velocità di formazione del prodotto (kcat) è molto più veloce
della velocità di dissociazione del complesso ES (k2), cioè kcat >> k2, il valore di
kcat/KM è dato da k1, la velocità di formazione del complesso ES.
Quanto può essere efficiente un enzima?
La velocità di formazione del complesso ES (k1) non può essere più veloce della
velocità di incontro per diffusione del substrato e dell’enzima in soluzione
Il limite superiore del rapporto
kcat
KM
è imposto dalla velocità con cui i due
reagenti diffondono l’uno verso l’altro nelle soluzioni acquose
Il valore limite di
kcat
KM
è compreso tra 108 e 109 M-1s-1
Alcuni enzimi hanno valori di
kcat
KM
vicini a questo limite
Con un enzima ideale la velocità di una reazione è limitata
soltanto dalla velocità con cui l’enzima e il substrato si incontrano
nella soluzione.
Nei complessi multienzimatici i limiti imposti dalla velocità di
diffusione possono essere superati!
Il prodotto di un enzima rapidamenta “trova” l’enzima
successivo quando i substrati ed i prodotti vengono confinati nel
piccolo volume di un complesso multienzimatico
Molti enzimi catalizzano reazioni a due o più substrati
Le reazioni con substrati multipli possono essere divise in due classi:
a spostamento sequenziale
a doppio spostamento (o reazioni ping-pong)
Nelle reazioni con meccanismo sequenziale tutti i substrati si devono legare
all’enzima prima che vengano rilasciati i prodotti.
Nel caso di una reazione a due substrati pertanto l’enzima formerà un
complesso ternario con i due substrati
Nelle reazioni con meccanismo a doppio spostamento (o ping-pong) uno o più
prodotti vengono rilasciati prima che tutti i substrati si siano legati all’enzima.
Le reazioni con meccanismo sequenziale possono essere di due tipi:
ordinate, in cui i substrati si legano all’enzima in una sequenza definita.
(il substrato 1 deve legarsi per primo in modo che il substrato 2 possa legarsi
produttivamente)
casuali,
casuali in cui i substrati possono legarsi in qualsiasi ordine.
Nelle reazioni a doppio spostamento (o reazioni ping-pong) si forma un
complesso enzima-substrato e il primo prodotto esce dal complesso; l’enzima
modificato forma un secondo complesso con una molecola di substrato 2 e si
genera il secondo prodotto mentre l’enzima ritorna libero
Esempio di reazione con meccanismo a spostamento sequenziale di tipo ordinato,
la reazione catalizzata dalla lattato deidrogenasi.
Molti enzimi che utilizzano il NAD+ o il NADH come substrati hanno un meccanismo
sequenziale ordinato
Esempio di reazione con meccanismo a spostamento sequenziale di tipo casuale,
la reazione catalizzata dalla creatin chinasi.
Esempio di reazione con meccanismo a spostamento doppio,
la reazione catalizzata dalla aspartato aminotransferasi.
L’enzima è
temporaneamente modificato
Le proprietà cinetiche di alcuni enzimi non possono essere spiegate
dal modello di Michaelis-Menten.
Gli enzimi allosterici spesso
mostrano una curva della velocità
catalitica in funzione della
concentrazione del substrato con
andamenro sigmoidale invece che
iperbolico.
Gli enzimi allosterici sono costituiti
da più subunità e presentano più siti
attivi
Negli enzimi allosterici il legame del
substrato ad un sito attivo può
modificare le proprietà di altri siti
attivi nella stessa molecola
(enzimi omotropici).
E’ possibile così un legame di tipo
cooperativo.