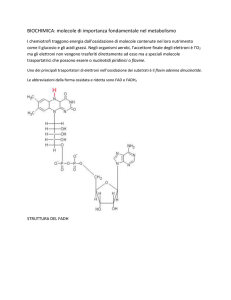
La tecnica "Redox
TRATTATO SULLA IONIZZAZIONE DELL'ACQUA
E L'EFFETTO NEL CORPO UMANO
L'acqua rappresenta il prodotto chimico più essenziale della vita. Ogni vita dipende
dall'acqua.
Il corpo di ogni essere vivente è composto per il 70/90% da acqua.
Tutte le reazioni chimiche in piante ed animali hanno luogo con l'aiuto dell'acqua.
L'acqua non fornisc soltanto il mezzo nel quale le reazioni avvengono, ma gioca anche
un ruolo importante nello svolgimento delle stesse.
Una molecola d'acqua, con la sua formula chimica H2O, contiene 2 atomi di idrogeno e
1 atomo di ossigeno.
Considerato a se stante, l'atomo di idrogeno contiene un protone nel nucleo atomico
ed un elettrone nella nube elettronica, il quale gira attorno al nucleo.
L'ossigeno contiene 8 protoni e 8 neutroni nel nucleo, e 8 elettroni che ruotano intorno
al nucleo, ma su orbite di raggi differenti. Sullo strato interno si trovano 2 elettroni,
mentre i restanti 6 ruotano sull'orbita esterna; questi ultimi sono anche denominati
"elettroni esterni" o "elettroni di valenza".
Gli elettroni di valenza determinano la capacità di legami chimici dell'atomo
d'ossigeno.
L'ossigeno raggiunge la sua massima stabilità se possiede uno strato esterno occupato
con 8 elettroni. Quando si lega a due atomi di idrogeno può raggiungere questo stato.
Durante questo processo, l'ossigeno utilizza i due elettroni dei due atomi di idrogeno
(portando la sua valenza a 8) mentre i due atomi di idrogeno utilizzano ognuno un
elettrone dell'ossigeno. Le coppie di elettroni utilizzati insieme rappresentano il legame
chimico. Per dissolvere questo legame ci vuole energia.
Grazie alla posizione particolare della coppia di elettroni, si forma una molecola
asimmetrica, nella quale queste coppie di elettroni leganti formano un angolo di 104°.
La polarità delle molecole d'acqua è fondamentale.
Dato che l'ossigeno ha una elettronegatività maggiore, il vertice della molecola ospita
una parziale carica elettrica negativa (δ-), mentre le estremità recano una parziale
carica elettrica positiva (δ-).
Una molecola che presenta questo squilibrio di cariche elettriche viene definita
undipolo elettrico.
Dato che la differenza di elettronegatività è molto alta nella molecola d'acqua,
quest'ultima è un forte dipolo ed un solvente fortemente polare.
La dipolarità elettrica ha un influenza decisiva sulle caratteristiche dell'acqua.
Le molecole dell'acqua formano legami intermolecolari (legami a idrogeno) con le
molecole confinanti, creando forze d'attrazione tra l'estremità negativa di una
molecola e l'estremità positiva della molecola confinante. I legami a idrogenonon
sono così forti come le forze leganti all'interno della molecola e possono dunque
essere costruiti e dissolti facilmente.
I legami a idrogeno sono la causa della tensione superficiale dell'acqua e ne
determinano il punto di ebollizione a 100 gradi.
Il comportamento di solvente dell'acqua è determinato dalla polarità della sua
molecola: quando un composto ionico o polare viene disciolto in acqua, viene
circondato dalle molecole di acqua, le quali si inseriscono tra uno ione e l'altro, o tra
una molecola e l'altra, di soluto (grazie alle loro piccole dimensioni), orientandosi in
modo da presentare ad ogni ione (o estremità polare) del soluto la parte di sé che
reca la carica opposta; questo indebolisce l'attrazione tra gli ioni (o tra le molecole
polari) e rompe la struttura cristallina; ogni ione (o ogni molecola polare) si ritrova
quindi solvatato (o idratato), cioè circondato completamente da molecole d'acqua che
interagiscono con esso.
Un esempio di soluto ionico è il comune sale da cucina (cloruro di sodio); un esempio
di soluto molecolare polare è lo zucchero.
In generale, le sostanze ioniche polari (quali acidi, alcoli e sali) sono abbastanza
solubili in acqua, mentre non lo sono le sostanze non polari (quali grassi ed oli).
Così i cristalli duri del cloruro di sodio si sciolgono facilmente nel solvente "acqua".
Come si vede da quest'ultimo esempio, i legami deboli di singole molecole d'acqua
sono in grado di dissolvere legami relativamente forti per mezzo di questo processo.
Ed è per questo motivo che chiamiamo l'acqua solvente universale.
E' un solvente naturale capace di rompere legami forti e complessi.
REAZIONI DI OSSIDAZIONE E DI RIDUZIONE
(reazioni REDOX)
Questo processo occupa una posizione centrale nei sistemi biologici.
Nella chimica si definisce l'ossidazione come un'emissione di elettroni e
lariduzione come un assorbimento di elettroni.
Ossidazione = emissione di elettroni
Riduzione = assorbimento di elettroni
Non esiste ossidazione senza simultanea riduzione.
Il nome per questa combinazione simultanea di tipi di reazioni viene
definitaREAZIONE REDOX, rappresentata dalla seguente formula chimica:
Ae-
+
→
B
A
+
Be-
dona
elettroni
elettrone)
riceve
elettroni
ossida
(-1 elettrone)
riduce
(+1
Anche nei sistemi biologici avvengono spesso tali reazioni REDOX all'interno del
metabolismo (fotosintesi, ciclo dell'acido citrico).
ACIDO e ALCALINO (o BASICO) : il valore pH
Un altro tipo di reazione importante è la reazione ACIDO - BASE.
Auto-protolisi: una molecola d'acqua dona uno ione d'idrogeno (protone o ione H+);
e un'altra molecola d'acqua assorbe questo protone.
Nella chimica tale processo viene definito come segue:
Ogni materia che dona protoni si chiama ACIDO
Ogni materia che riceve protoni si chiama BASE
Schema dell'Auto-protolisi:
H2O
+
H20
acido
=
H3O+
base
+
OH-
Possiamo anche dire che: distinguiamo le molecole presenti in natura in virtù delle
loro caratteristiche. Le sostanze che, poste in acqua, si dissociano rilasciando ioni
H+ liberi sono definite acide, mentre le sostanze che si dissociano rilasciando ioni
OH- sono definite basiche .
Se si determina la concentrazione degli ioni H3O+ in acqua normale neutra si ottiene
una concentrazione di 10-7 mol/l.
Si può influenzare questo valore aggiungendo Acidi, aumentando così la
concentrazione di ioni H3O+ (per esempio: 10-3 mol/l), oppure aggiungendo Basi ed
abbassando la concentrazione di ioni H3O+ (per esempio: 10-9 mol/l).
Chimicamante, con il valore pH si determina la concentrazione di ioni idrogeno(H+).
Il valore pH è il logaritmo negativo decimale della concentrazione degli ioni idrogeno.
Concentrazione ioni idrogeno (mol/l)
10-9
10-7
10-3
Valore pH
9
7
3
Caratteristica della soluzione
Alcalina
Neutra
Acida
Una scala dei valori pH ha di conseguenza la seguente divisione (per le cellule umane
il margine ottimale si trova entro 6,8 e 7,2).
Dato che le indicazioni della concentrazione avvengono in modo logaritmico, il salto da
pH 3 a pH 2 significa un duplicarsi della concentrazione di Acidi.