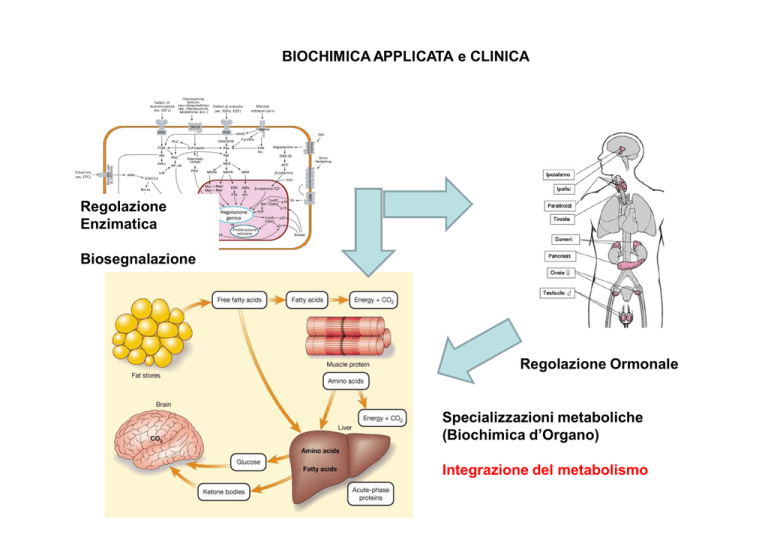
BIOCHIMICA APPLICATA e CLINICA
Regolazione
Enzimatica
Biosegnalazione
Regolazione Ormonale
Specializzazioni metaboliche
(Biochimica d’Organo)
Integrazione del metabolismo
BIOCHIMICA APPLICATA e CLINICA
Password Moodle: BACfarma
Regolazione enzimatica, Biosegnalazione, Regolazione delle vie metaboliche, Integrazione
metabolica
Nelson DL e Cox MM - I PRINCIPI DI BIOCHIMICA DI LEHNINGER , (V edizione) Zanichelli 2010
Cap. 6, 12, 14, 15, 16,17, 19, 21, 23
Ormoni
Levy MN, Koeppen, BM, Stanton, BA – PRINCIPI DI FISIOLOGIA di Berne & Levy, (IV edizione)
Elsevier Masson 2007 Capitoli 41-48
in alternativa
Carbone E, Cicirata F e Aicardi G – FISIOLOGIA dalle molecole ai sistemi integrati (I edizione)
EdiSES 2008 Capitoli 20-25, 28
Biochimica d’organo
Caldarera CM – BIOCHIMICA SISTEMATICA UMANA, (II edizione), CLUEB Economica, 2007 (.pdf
allegato)
REGOLAZIONE ENZIMATICA
Cap. 6, 15 Lehninger
L’attività degli enzimi è regolata :
•CONTROLLO DA SUBSTRATO
Legge di Michaelis-Menten
•CONTROLLO GENICO
Viene regolata la quantità dell’enzima
•CONTROLLO ALLOSTERICO
• INTERAZIONE CON ALTRE PROTEINE (Partners)
•MODIFICAZIONI COVALENTI REVERSIBILI
Fosforilazione
•MODIFICAZIONI COVALENTI IRREVERSIBILI
taglio proteolitico della catena enzimatica
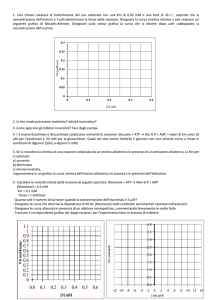
Cinetica secondo Michaelis e Menten
Il valore di KM è una misura
di quanto strettamente il
substrato sia legato
all’enzima (affinità)
Tanto maggiore sarà il
valore di KM tanto più
debole sarà l’interazione tra
substrato ed enzima
CONFRONTO TRA KM
È la prima reazione di modificazione del glucosio una volta trasportato all’interno della
cellula:
TAPPA FONDAMENTALE PER ogni suo impiego (in senso catabolico o anabolico)
Fosforilazione del glucosio a glucosio-6-fosfato
La fosforilazione del glucosio è catalizzata da una famiglia di enzimi diversi:
ESOCHINASI (I, II, e III) e GLUCOCHINASI (Esochinasi IV)
ESOCHINASI e GLUCOCHINASI hanno una diversa KM
KM ESOCHINASI (I,II,III) = 20-150 mM (0.02- 0.15 mM)
KM GLUCOCHINASI = 10 mM
Il legame del glucosio alla
glucochinasi è da 66 a 500 volte
più debole di quello all’esochinasi
KM ESOCHINASI = 150 mM
Vmax
V
A [glucosio] > 0.7 mM l’enzima è saturo:
concentrazioni ancora maggiori non
alterano la velocità.
½ Vmax
0
(0.15 mM)
0.15
0.5
1.0
1.5
[glucosio] mM
Con questo intervallo di [glucosio] come sarà la curva per la glucochinasi (KM= 10 mM)?
Per ottenere la curva della glucochinasi bisogna usare concentrazioni di glucosio maggiori
KM GLUCOCHINASI = 10 mM
V
Vmax
Per saturare l’enzima bisogna
arrivare a 30mM glucosio
½ Vmax
00.15
10
20
30
[glucosio] mM
Con questo intervallo di [glucosio] come sarà la curva per l’ esochinasi?
Che senso ha avere enzimi che catalizzano la stessa reazione, ma con KM così
diverse?
KM ESOCHINASI (I, II, III) = 20 – 150 μM
È espressa in tutti i tessuti
KM GLUCOCHINASI (ESOCHINASI IV) = 10 mM
È espressa solo nel FEGATO
e nelle cellule b del pancreas
La concentrazione di glucosio nel sangue (glicemia) varia da 4mM
a digiuno a circa 10 mM dopo un pasto (nel circolo entero-epatico)
Vmax
V
½ Vmax
0.15
0
10
20
30
[glucosio] mM
Vmax
V
½ Vmax
0.15
0
10
KM ESOCHINASI =0.02- 0.15 mM
20
30
[glucosio] mM
È espressa in tutti i tessuti
A digiuno l’enzima lavora alla sua Vmax (saturo): aumenti di glucosio non alterano la
velocità della reazione. I tessuti vengono EGUALMENTE riforniti di G6P
INDIPENDENTEMENTE dallo stato nutrizionale
KM GLUCOCHINASI = 10 mM
È espressa solo nel FEGATO
Dopo un pasto, l’aumento della [glucosio] fa aumentare la velocità della reazione
catalizzata dalla glucochinasi ð nel FEGATO, (ma NON negli altri tessuti) aumenta la
fosforilazione del glucosio.
REGOLAZIONE ENZIMATICA
L’attività degli enzimi è regolata :
•CONTROLLO DA SUBSTRATO
•CONTROLLO GENICO (+/-)
Viene regolata la quantità dell’enzima
REGOLAZIONE ENZIMATICA
CONTROLLO GENICO (+/-)
Viene regolata l’ ESPRESSIONE (quantità) dell’enzima a livello di trascrizione e
traduzione del gene
Tempo: decine di min - ore
E’ REVERSIBILE
interruttore trascrizionale:
Attivazione (o inattivazione) di Fattori di Trascrizione
su specifici Promotori
Vmax è funzione della quantità di enzima presente
Kcat è chiamata numero di turnover: pari
al numero di molecole di substrato
convertite in prodotto nell’unità di tempo
(sec) per ciascuna molecola di enzima.
Dimensioni = sec -1
Vmax 20 E
Glucosio 6-P mmol/min
V
KM GLUCOCHINASI = 10 mM
l’insulina ne stimola la
trascrizione di circa 20
volte in 30 min.
Vmax E
0
10
20
30
40
50
[glucosio] mM
REGOLAZIONE ENZIMATICA
L’attività degli enzimi è regolata :
•CONTROLLO DA SUBSTRATO
•CONTROLLO GENICO (+)
Viene regolata la quantità dell’enzima
•CONTROLLO ALLOSTERICO (+/-)
deriva da una molecola che si lega ad un sito diverso dal sito di legame
Regolazione allosterica.
•Gli enzimi allosterici hanno siti di
legame per gli attivatori o inibitori
(EFFETTORI o MODULATORI)
diversi dal sito attivo del substrato
effettore +
enzima allosterico è in generale
una proteina oligomerica che può
esistere in due conformazioni (T e
R) caratterizzate da bassa (T) o
elevata (R) attività catalitica
Enzima inattivo
T
effettore -
Enzima attivo
R
Il legame con l’effettore ha la conseguenza di
stabilizzare una delle due conformazioni
Effettori allosterici sono soprattutto METABOLITI INTRACELLULARI
Tra i principali modulatori allosterici ci sono gli
“indicatori dello stato energetico”
ATP/ADP/AMP
NAD/NADH
Citrato & acetil CoA
E’ la CONCENTRAZIONE dei modulatori allosterici a determinare l’effetto
La costante di dissociazione definisce l’affinità di un
modulatore allosterico per il suo sito di legame
sull’enzima, ed ha le dimensioni di una
concentrazione
E+M
EM
[E] [M]
[EM]
=
Kd
REGOLAZIONE ENZIMATICA
L’attività degli enzimi è regolata :
•CONTROLLO DA SUBSTRATO
•CONTROLLO GENICO (+/-)
•CONTROLLO ALLOSTERICO (+/-) da metaboliti
Per INTERAZIONE CON ALTRE PROTEINE (Partners; +/-)
STIMOLAZIONE O INIBIZIONE DA PARTE DI
PROTEINE DI CONTROLLO
INTERAZIONE PROTEINA-PROTEINA
Partner attivatore
Enzima inattivo
Transizione conformazionale
substrati
prodotti
Attivazione di
altre copie
dell’enzima
Enzima attivo
REGOLAZIONE ENZIMATICA
L’attività degli enzimi è regolata :
•CONTROLLO DA SUBSTRATO
•CONTROLLO GENICO (+/-)
l’enzima è prodotto solo quando serve . Viene regolata la quantità
dell’enzima
•CONTROLLO ALLOSTERICO (+/-) da metaboliti
Per INTERAZIONE CON ALTRE PROTEINE (Partners; +/-)
•MODIFICAZIONI COVALENTI REVERSIBILI (+/-)
Fosforilazione
Lo stato di fosforilazione di molti enzimi ne regola DIRETTAMENTE l’attività
Protein chinasi
I substrati sono proteine
Chinasi: fosforilazione
Protein fosfatasi
H2O
Per poter avere un significato biologico la fosforilazione deve poter essere REVERSIBILE
DEFOSFORILAZIONE: idrolisi del legame fosfo-estere
REGOLAZIONE ENZIMATICA
L’attività degli enzimi è regolata :
•CONTROLLO DA SUBSTRATO
Tutti
•CONTROLLO GENICO
•CONTROLLO ALLOSTERICO
metaboliti o partners proteici
•MODIFICAZIONI COVALENTI REVERSIBILI
Fosforilazione
ENZIMI REGOLATORI
Catalizzano la reazione più
lenta di una via metabolica e
quindi controllano la velocità
complessiva della via stessa.
In generale sono enzimi
allosterici e vengono controllati
anche mediante fosforilazione e
controllo genico (non tutti)
COORDINAMENTO dell’ATTIVITA’ METABOLICA