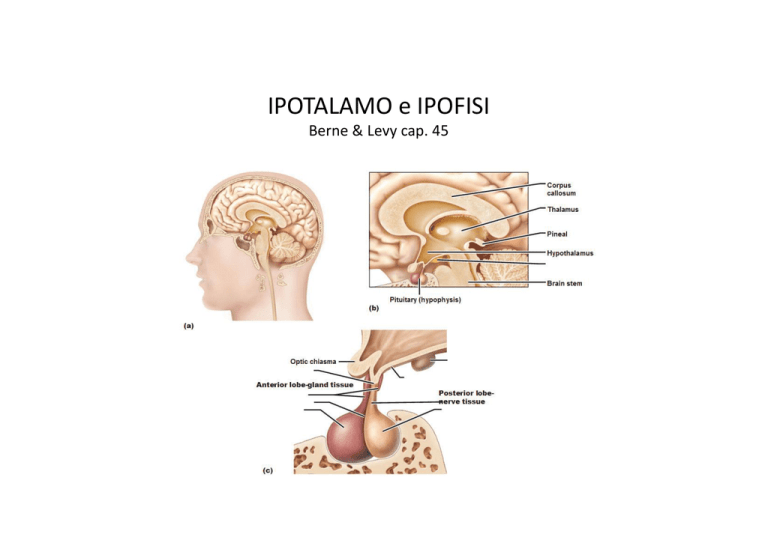
IPOTALAMO e IPOFISI
Berne & Levy cap. 45
Ipotalamo
E’ parte del Sistema Nervoso Centrale, dove,
alla base dell’encefalo, forma il pavimento del
terzo ventricolo.
Connette e integra le risposte del sistema
nervoso autonomo e del sistema endocrino
con il comportamento, specialmente per
quanto riguarda le risposte essenziali per il
mantenimento dell’omeostasi.
FUNZIONI dell’IPOTALAMO - controllo di:
pressione arteriosa e battito cardiaco,
composizione degli elettroliti,
Temperatura corporea,
metabolismo,
riproduzione,
risposta allo stress.
L’ipotalamo possiede anche neuroni sensoriali interni: es. possiede termorecettori in
grado di segnalare la temperatura locale, la concentrazione di glucosio, la
concentrazione di Na+.
Per svolgere il suo ruolo di controllo su queste variabili l’ipotalamo ha bisogno di
informazioni sul valore delle variabili da controllare (es. temperatura esterna),
valori di riferimento con cui paragonarli (valore di riferimento 37 °C) e uscite
adatte a controbilanciarne le variazioni.
I neuroni ipotalamici si associano in NUCLEI, che costituiscono altrettanti CENTRI
INTEGRATIVI.
Le informazioni vengono fornite da fibre sensoriali afferenti.
I nuclei più anteriori dell’ipotalamo
controllano i ritmi circadiani, l’attività
riproduttiva, la pressione arteriosa e la
temperatura corporea;
i nuclei più mediali controllano la
secrezione ormonale
dell’ipofisi anteriore
e contengono le cellule
neuroendocrine i cui assoni si
proiettano all’ipofisi posteriore.
L’ ipofisi (ghiandola pituitaria) ha un ruolo fondamentale nella regolazione
ormonale di molti processi ed è a sua volta regolata dall’ipotalamo.
• 3 lobi: anteriore, intermedio (rudimentale) e posteriore
– Lobo anteriore: ipofisi anteriore o adenoipofisi; autentiche cellule
endocrine
– Lobo posteriore: ipofisi posteriore o neuroipofisi; estensione del sistema
nervoso; assoni delle cellule neuroendocrine ipotalamiche
Ipofisi posteriore
• Gli ormoni vengono
rilasciati in modo
neuroendocrino.
I neuroni magnocellulari dei nuclei sopraottico (SON) e paraventricolare
(PVH) hanno lunghi assoni che terminano nella ipofisi posteriore.
• Secernono gli ormoni ossitocina e antidiuretico (ADH).
Ormone antidiuretico (ADH) o vasopressina:
- Peptide di 9 aminoacidi secreto dall’ ipofisi posteriore
- Aumenta il recupero d’acqua da parte del rene (organo bersaglio).
- In presenza di gravi emorragie, agisce da vasocostrittore (vasopressina)
Meccanismo attivante il rilascio:
1) Aumento osmolarita’ (conc. totale di soluti) del fluido extracellulare ipotalamico
2) osmocettori -> cellule dei nuclei sopraottico -> rilascio di ADH nell’ ipofisi
posteriore
3) Bersaglio -> rene – diminuzione del volume urinario e aumento del volume fluido
extracellulare – l’osmolarità diminuisce
RENE: cellule epiteliali
del dotto collettore
Le molecole d’acqua diffondono molto lentamente attraverso le membrane
• I movimenti di acqua associati alla regolazione del volume richiedono la presenza
di aquaporine (canali per l’acqua)
le quali aumentano enormemente la permeabilità osmotica delle cellule
permettendo un veloce riequilibrio
Vescicole intracellulari contenenti diverse
copie di acquaporina sono presenti nelle
cellule epiteliali renali, a livello del dotto
collettore
Meccanismo d’azione di ADH delle cellule del dotto collettore del rene
Diabete insipido
“Urine senza sapore”. Questo è il significato letterale del termine diabete insipido, una
patologia in cui il meccanismo che concentra le urine è inadeguato o assente.
Il diabete insipido è causato da un deficit di vasopressina o dall’incapacità del nefrone di
rispondere alla vasopressina.
Il diabete insipido dovuto alla mancanza di vasopressina (diabete insipido centrale)
può essere causato da traumi cranici, da vari farmaci o da lesioni che danneggiano
l’ipofisi o l’ipotalamo.
Nell’altra forma di diabete insipido, detto diabete insipido nefrogeno, le cellule del
dotto collettore non sono in grado di accrescere la loro permeabilità all’acqua in risposta
alla vasopressina.
Gli OSMORECETTORI
rilevano un’aumento
della
pressione osmotica
I BARORECETTORI
(dell’arco aorticoADH
e del
seno carotideo)
rilevano una
diminuzione della
pressione arteriosa
Neurone ipotalamico
Ipofisi Posteriore
Aumentato
riassorbimento
d’acqua
Vaso sanguigno
Vasocostrizione
Rene
ADH
Aumento del volume di sangue
Aumento della pressione sanguigna
Ossitocina
- peptide di 9 aminoacidi molto simile all’ ADH
- Induce contrazione della muscolatura liscia dell’utero e secrezione della ghiandola
mammaria
Il rilascio di ossitocina è stimolato dalla
distensione della cervice uterina a termine della
gravidanza e dalla contrazione dell’utero
durante il parto.
I segnali sono trasmessi dai nuclei
paraventricolare (PVN) e sopraottico (SON)
dell’ipotalamo, ove inducono un feedback
positivo di regolazione del rilascio di ossitocina.
L’aumento del numero di recettori per
l’ossitocina, nelle cellule muscolari lisce,
aumenta la contrazione del muscolo uterino
stimolando la fase espulsiva e la involuzione
dell’utero dopo il parto.
La suzione del capezzolo stimola il rilascio di
ossitocina che induce contrazione delle cellule
mioepiteliali presenti nel dotto galattoforo,
inducendo la escrezione di latte.
L’Ipotalamo è
funzionalmente ed
anatomicamente legato alla
ipofisi anteriore grazie al
supporto ematico fornito dal
sistema portale locale.
Asse IPOTALAMO – IPOFISI
I neuroni ipotalamici parvicellulari
secernono i neuroormoni definiti
ORMONI TROFICI o
TROPINE IPOTALAMICHE
conosciuti anche come
Releasing Hormones (RH)
Inhibiting Hormones (IH)
Sono segnali peptidici (3-44 AA) che
vengono rilasciati nel sistema portale e
da qui raggiungono le loro cellule
bersaglio.
i loro recettori si localizzano sulla
membrana delle cellule dell’ipofisi
anteriore (endocrine).
Stimolano il rilascio endocrino degli
ormoni ipofisari.
L’ipofisi anteriore contiene 6 differenti tipi di cellule secretorie (endocrine)
Somatotrope (secernono l’ormone della crescita Growth Hormone, GH)
Corticotrope (ACTH)
Tireotrope (TSH)
Gonadotrope (LH)
Gonadotrope (FSH)
Lattotrope (prolattina)
Secernono ormoni proteici le cui cellule bersaglio
sono distanti dal sito di rilascio
gonadotrope
corticotrope
somatotrope
L’ipofisi anteriore contiene 6 differenti tipi di cellule secretorie (endocrine)
Somatotrope (secernono l’ormone della crescita Growth Hormone, GH)
Corticotrope (ACTH)
Tireotrope (TSH)
Gonadotrope (LH)
Gonadotrope (FSH)
Lattotrope (prolattina)
ACTH
TSH
Tropine Ipotalamiche
RH = Releasing Hormone
IPOTALAMO
Thyrotropin RH
Gonadotropin RH
ADENOIPOFISI
Thyroid Stimulating Hormone
GnRH
Follicle Stimulating Hormone
Lutenizing Hormone
Corticotropin RH
Adrenocorticotropic Hormone
Growth Hormone RH
Growth Hormone
Prolactin
RIFLESSI ENDOCRINI DELL’ASSE IPOTALAMO-IPOFISI-GHIANDOLA
GROWTH HORMONE (GH)
ORMONE DELLA CRESCITA
Fattori che influenzano la crescita
a) Fattori genetici
b) Condizioni nutrizionali
c) Ormoni
Crescita:
1) Allungamento lineare
2) Sviluppo degli organi
3) Aumento delle dimensioni
• Ormone della crescita
• Ormoni tiroidei
• Ormoni sessuali
• Insulina
• Ormoni glucocorticoidi (inibizione)
degradazione
sintesi
ADULTO
PROTEINE
PROTEINE
Il GH stimola l'accrescimento e lo
sviluppo somatico post-natale
Ormoni Tiroidei
Ormone della
Crescita
Ormoni Sessuali
0
2
4
6
8
10
12
Età (anni)
14
16
18
20
ORMONE della CRESCITA (GH)
• Peptide di 191 aminoacidi. Promuove
principalmente la crescita scheletrica e
l’ aumento di massa corporea
• Il suo rilascio dalle cellule somatotrope è
stimolato dal GHRH ipotalamico e inibito
dalla somatostatina ipotalamica.
Somatotrope: 35-45% delle cellule
adenoipofisarie
• Ha effetti diretti sul muscolo, sul fegato e
sul tessuto adiposo
• Ha effetti indiretti dovuti all’azione di peptidi
epatici la cui sintesi è stimolata da GH
Tali peptidi, chiamati somatomedine o
Insulin-like Growth Factor (IGF)
stimolano la crescita ossea e dei tessuti
EFFETTI DIRETTI DEL GH
EFFETTI INDIRETTI
A) la sua carenza nei bambini
determina:
1) riduzione velocità di accrescimento
2) ritardo maturazione sessuale
3) riduzione massa corporea magra
4) aumento della massa grassa.
carenza negli adulti produce
solo lievi alterazioni;
B) eccessivi livelli determinano:
1) nei bambini gigantismo;
2) negli adulti iperaccrescimento dei tessuti
molli, ossa e facies vistosamente alterata
(acromegalia), diabete mellito