I FARMACI ANTIMICROBICI:
C.d.L. in Tecniche di Fisiopatologia
Cardiocircolatoria e Perfusione Cardiovascolare
Università “G. d‟Annunzio” di Chieti-Pescara
Dott.ssa Arianna POMPILIO
Anno Accademico 2011-2012
La storia degli antibiotici ha inizio nel 1928,
quando Fleming, studiando varianti dello
stafilococco, osservò che una muffa che
contaminava una delle sue culture
aveva
inibito intorno a sé la crescita dello
stafilococco.
Inoltre, Fleming potè osservare che il brodo di coltura in cui
erano cresciuti i funghi possedeva un potente effetto inibitorio
nei confronti di molti microrganismi.
Poiché la muffa apparteneva al genere Penicillum, Fleming chiamò
questa sostanza antibatterica PENICILLINA
AGENTE
ANTIBATTERICO
ANTIBIOTICO
CHEMIOTERAPICO
Composto in grado di interferire con la crescita e la
moltiplicazione batterica;
contrariamente al disinfettante, è attivo solo verso
batteri metabolicamente attivi.
Molecola naturale a basso P.M., prodotta dal
metabolismo di un microrganismo: Actinomiceti
(Streptomyces), Miceti (Penicillium, Cephalosporium),
in grado di inibire la crescita di altri microrganismi
e/o causarne la distruzione.
Farmaco ad attività antibatterica prodotto per
sintesi chimica (analogo strutturale di un antibiotico)
ADEGUATA ATTIVITA’ ANTIMICROBICA
SCARSA o NULLA ATTIVITA’ sulla FLORA COMMENSALE e sui
MECCANISMI di DIFESA dell’OSPITE
TOSSICITA’ SELETTIVA
ATTIVO a BASSE CONCENTRAZIONI
STABILE, ECONOMICO, facilmente SOMMINISTRABILE
RAGGIUNGE ADEGUATE CONCENTRAZIONI TISSUTALI
ASSENZA di EFFETTI COLLATERALI e/o SISTEMICI
ASSENZA di RESISTENZE nella POPOLAZIONE MICROBICA
Paul Ehrlich
La chemioterapia
antibatterica si basa sul
principio della
TOSSICITÀ SELETTIVA,
formulato per la prima
volta da Paul Ehrlich, in
base al quale una sostanza
può essere utilizzata nella
terapia di una malattia
infettiva solo se è nociva
per il microrganismo e
relativamente innocua per
le cellule dell‟ospite.
ANTIBIOTICI
SELETTIVI
ANTIBIOTICI non
SELETTIVI
Agiscono solo su
strutture e vie
metaboliche peculiari dei
batteri (es: parete
cellulare, DNA girasi e
topoisomerasi IV)
Agiscono con
meccanismi diversi verso
strutture e meccanismi
non esclusivi dei batteri
Impossibili gli effetti sulle Potenziali effetti dannosi
cellule dell’ospite
Penicilline,
Cefalosporine,
Monobattami, Penemici,
Carbapenemici.
Fosfomicina,
Glicopeptidi,
Daptomicina.
Aminoglucosidi,
Macrolidi, Lincosamidi,
Linezolid, Tetracicline,
Cloramfenicolo,
Metronidazolo,
Rifamicine,Sulfamidici,Tri
metoprimTigeciclina
Esistono diversi sistemi di classificazione degli antibiotici, in
considerazione del notevole numero di molecole utilizzate nella
pratica clinica. In particolare, la classificazione può essere fatta:
1. In FAMIGLIE
Molecole che presentano caratteristiche simili (es. PENICILLINE,
CEFALOSPORINE,AMINOGLICOSIDI, TETRACICLINE, ecc)
2. Secondo l‟ORIGINE
ESTRATTIVA: da batteri e funghi (Penicillium, Cephalosporium, Streptomyces)
SEMISINTETICA: partendo da una struttura base, ottenuta per
fermentazione ed aggiungendo catene di sintesi.
SINTESI CHIMICA: molti composti si ottengono per sintesi chimica
(chinoloni, monobattami,cloramfenicolo, ecc)
3. Secondo lo SPETTRO d’AZIONE
Per spettro d‟azione si intende il ventaglio delle specie batteriche nei
riguardi delle quali l‟antibiotico mostra attività
•
AMPIO SPETTRO: Gram-positivi e Gram-negativi (es. tetracicline)
•
SPETTRO RISTRETTO: attivo soltanto su una limitata varietà di
microrganismi (es. penicillina)
4. Secondo il TIPO d’AZIONE (natura dell‟inibizione)
F. BATTERIOSTATICO: inibisce la crescita del microrganismo,
consentendo lo sviluppo della risposta immunitaria anticorpale
F. BATTERICIDA: provoca la morte dell‟agente infettivo
5. In base al MECCANISMO d’AZIONE
1. INIBIZIONE della SINTESI della PARETE CELLULARE
2. ALTERAZIONE della MEMBRANA CITOPLASMATICA
3. INIBIZIONE della SINTESI PROTEICA
4. INIBIZIONE della SINTESI degli ACIDI NUCLEICI
5. ANTIMETABOLITI
1. INIBIZIONE della SINTESI della PARETE CELLULARE
Agiscono bloccando gli enzimi che regolano la sintesi di peptidoglicano con
conseguente lisi cellulare. BATTERICIDI, l‟inibizione si può verificare:
• nella 1° FASE di SINTESI (es: FOSFOMICINA inibisce la fosfoenolpiruvato
transferasi o CICLOSERINA per mancata utilizzazione della alanina)
• nella 2° FASE di SINTESI (es: BACITACINA agisce mediante trasferimento e
polimerizzazione del mucopeptide parietale)
• A LIVELLO TERMINALE (es: VANCOMICINA, PENICILLINE e
CEFALOSPORINE agiscono nella fase di transpeptidazione)
2. ALTERAZIONE della MEMBRANA CITOPLASMATICA
Si tratta di farmaci BATTERICIDI.
Provocano alterazioni della membrana citoplasmatica con perdita della
permeabilità con meccanismo d‟azione poco selettivo . Ciò spiega la tossicità di
questi farmaci e l‟uso limitato (es: POLIMIXINA, COLISTINA, DAPTOMICINA)
3. INIBIZIONE della SINTESI PROTEICA
Agiscono a livello ribosomiale e l‟inibizione si può verificare:
• A livello della SUBUNITA’ RIBOSOMIALE 30S (es: AMINOGLICOSIDI,
TETRACICLINE)
• A livello della SUBUNITA’ RIBOSOMIALE 50S
MACROLIDI)
(es: CLORAMFENICOLO,
• Attività BATTERICIDA, azione selettiva dovuta al fatto che i ribosomi
delle cellule eucariote sono costituiti da subunità 60S e 40S. Per agire
devono penetrare nella cellula.
4. INIBIZIONE della SINTESI degli ACIDI NUCLEICI
Si tratta di farmaci BATTERICIDI. Agiscono inattivando gli enzimi con un
meccanismo d‟azione non selettivo eccetto per i chinoloni:
• INIBIZIONE della RNA-polimerasi (es: RIFAMICINE)
• INIBIZIONE della DNA-girasi o topoisomerasi (es: CHINOLONI)
5. ANTIMETABOLITI
Si tratta di farmaci BATTERIOSTATICI.
• Agiscono inibendo la sintesi dell‟ ACIDO
FOLICO
• (es: SULFAMIDICI, TRIMETHOPRIM)
BATTERICIDI
BATTERIOSTATICI
Penicilline
Tetracicline
Cefalosporine
Cloramfenicolo
Monobattami
Macrolidi
Penemici
Lincosamidi
Carbapenemici
Acido fusidico
Aminoglucosidi
Sulfamidici
Chinoloni
Trimetoprim
Glicopeptidi
Linezolid
Rifamicine
Tigeciclina
Fosfomicina
Cotrimossazolo
Colistina
Metronidazolo
Daptomicina
NOTE
Alcuni batteriostatici
possono essere
battericidi in vitro ad
elevate concentrazioni
che sono però
irraggiungibili in vivo.
COTRIMOSSAZOLO è
battericida anche se
trimethoprim e
sulfametossazolo
impiegati
separatamente sono
batteriostatici
BERSAGLI DEGLI ANTIBIOTICI
SINTESI
PARETE
CICLOSERINE
FOSFOMICINA
GLICOPEPTIDI
BACITRACINA
PENICILLINE
CEFALOSPORINE
MONOBATTAMI
CARBAPENEMI
METABOLISMO
ACIDO FOLICO
SULFAMIDICI
TRIMETOPRIM
DNA GIRASI
TOPOISOMERASI
CHINOLONI
DNA POLIMERASI
NOVOBIOCINA
RNA POLIMERASI
RIFAMPICINA
THF
DNA
DHF
mRNA
50
30
50
30
50
30
PABA
MEMBRANA
POLIMIXINE
SINTESI PROTEICA
tRNA
MUPIROCINA
PUROMICINA
SINTESI PROTEICA
Inibitori 50S
MACROLIDI
CLORAMFENICOLO
LINCOSAMIDI
SINTESI PROTEICA
Inibitori 30S
TETRACICLINE
SPECTINOMICINA
STREPTOMICINA
AMINOGLICOSIDI
NITROFURANI
Poiché il peptidoglicano della parete cellulare batterica non è presente nelle
cellule umane, esso rappresenta un bersaglio ideale per l‟antibiotico terapia.
La sintesi del peptidoglicano può essere suddivisa in 3 tappe:
SINTESI DEI PRECURSORI NEL CITOPLASMA
•
D-cicloserina
•
Fosfomicina
TRASPORTO DEI PRECURSORI ATTRAVERSO LA MEMBRANA
CITOPLASMATICA
•
Bacitracina
INSERIMENTO DEI PRECURSORI NELLA PARETE CELLULARE
•
Vancomicina, ristocetina
•
Antibiotici β-lattamici
La prima tappa avviene nel citoplasma, dove vengono sintetizzate le unità
fondamentali della struttura portante del peptidoglicano NAG e NAM.
La D-CICLOSERINA è un analogo
strutturale della D-alanina. Essa inibisce
in maniera competitiva due enzimi
coinvolti nella formazione del dipeptide
D-alanil-D-alanina: la racemasi che
converte
la
L-alanina
nel
suo
stereoisomero D, e la sintetasi che
catalizza la formazione del legame
peptidico tra le due molecole D-alanina
La FOSFOMICINA è un analogo strutturale del
fosfo-enolpiruvato. Impedisce la sintesi dell‟acido Nacetil-muramico, legandosi covalentemente al sito
attivo dell‟enzima piruvato-UDP-NAG trasferasi.
fosfomicina
La cicloserina è una molecola ciclica
La stabile struttura dell‟anello
favorisce il legame alla racemasi e
alla sintetasi, preferenzialmente
rispetto ai substrati naturali.
Ciò risulta in una inibizione
competitiva di questi enzimi.
La cicloserina è neurotossica e non
viene usata clinicamente, eccetto
per il trattamento delle infezioni
da Mycobacterium tuberculosis
resistenti agli altri farmaci.
Struttura chimica della
D-cicloserina e dell’analogo
D-alanina
La reazione di condensazione
tra UDP-N-acetilglucosamina
e
fosfoenolpiruvato
negli
stadi iniziali della sintesi del
peptidoglicano rappresenta il
target
d‟azione
della
fosfomicina.
La rapida insorgenza di
resistenza
la
rendono
praticamente inutile in clinica.
Struttura chimica della
fosfomicina
La seconda tappa della sintesi del peptidoglicano avviene sulla superficie
interna della membrana citoplasmatica dove l‟ N-acetilmuramilpeptide
viene legato da un trasportatore lipidico che trasloca la subunità
completa all‟esterno della membrana citoplasmatica
La
BACITRACINA
inibisce
la
defosforilazione
del
trasportatore
lipidico legandosi al bactoprenolodifosfato e bloccando la rigenerazione
del bactoprenolo-monofosfato. E‟ un
polipeptide ciclico tossico per l‟uso
clinico umano. Viene usato per
trattamenti topici e come additivo
alimentare per ruminanti al fine di
ridurre la produzione di metanolo nel
rumine.
La terza tappa avviene nel contesto del peptidoglicano e nello spazio
periplasmico (Gram-), dove l‟unità basale, liberata dal legame del
trasportatore lipidico, si unisce all‟ estremità in accrescimento di una
catena di peptidoglicano (transpeptidazione). Molti antibiotici agiscono
su questa tappa.
La VANCOMICINA e la
RISTOCETINA sono
glicopeptidi che si legano
all‟estremità D-alanina-Dalanina del pentapeptide
legato al bactoprenolo ed
impediscono l‟azione della
transpeptidasi
sequestrandone il
substrato.
Gli antimicrobici più comuni sono i -lattamici, accomunati dalla
presenza di un anello tetratomico azetidinico -lattamico:
PENICILLINE
CEFALOSPORINE
ALTRI -LATTAMICI:
• Acido clavulanico, tienamicina, sulbactam
• Moxalactam
• Monobattamici (aztreonam)
Gli antibiotici β-lattamici sono analoghi strutturali del dipeptide D-alaninaD-alanina che devono la loro azione antibatterica proprio alla capacità di
legarsi ad una serie di enzimi che catalizzano le operazioni terminali di
polimerizzazione, transpeptidazione ed inserimento delle unità
peptidoglicaniche nella parete cellulare, inibendo quindi la sintesi del
peptidoglicano stesso.
L‟evento finale dell‟azione degli antibiotici β-lattamici è la lisi della
cellula batterica.
Target principale: PARETE CELLULARE BATTERICA (tox selettiva)
ATTIVITÀ BATTERICIDA SU CELLULE IN ATTIVA DIVISIONE
INIBISCONO LA FASE FINALE DI POLIMERIZZAZIONE
• Arresto della crescita
FORMAZIONE dello SFEROPLASTO e LISI CELLULARE:
• Produzione di peptidoglicano “lasso”
• Induzione di enzimi endogeni batterici (mureina-idrolasi)
Interazione con proteine enzimatiche responsabili del processamento terminale
del peptidoglicano (transpeptidasi, endopeptidasi e carbossipeptidasi) dette
“PENICILLIN BINDING PROTEINS” PBP a livello della m. citoplasmatica
PORINA
PBP
Spazio Periplasmico
GRAM +
GRAM -
LPS
Prodotte da Penicillium chrysogenum
Nucleo fondamentale: acido 6-amino-penicillanico
Possono essere classificate in:
NATURALI
•Benzil-penicillina (penicillina G)
• attiva verso cocchi Gram+ e Gram-
SEMI-SINTETICHE
•Meticillina/oxacillina
• resistenti a β-lattamasi
• Ampicillina/amoxicillina (ad ampio spettro)
• Carbenicillina/ticarcillina/piperacillina
(attive su specie resistenti alle altre penicilline)
Si differenziano dalle penicilline per uno spettro d‟azione esteso ai
Gram-negativi (capacità di penetrare la m. esterna) e per la resistenza
nei confronti di alcune -lattamasi
Possono essere classificate in:
NATURALI
• Cefalosporina C (prodotta dal fungo
marino Cephalosporium achremonium)
SEMI-SINTETICHE
•I GENERAZIONE (cefazolina): attive vs Gram+
•II GENERAZIONE (cefuroxime): attive vs Gram•III GENERAZIONE (cefotaxime): ampio spettro (Gram+ e Gram-)
•IV GENERAZIONE (cefepime): ampio spettro
CEFAMICINE
Naturali: prodotte da streptomiceti, esteso spettro
d‟azione (soprattutto vs anaerobi)
PENICILLINE
CEFALOSPORINE
a. 6-aminopenicillanico
S CH3
CH3
H2N
O
S
N
• Batteriemia, setticemia, faringite,
otite media (S. aureus ed epidermidis)
•
H2N
Meningite, polmonite (S. pneumoniae)
• Attive su alcuni Gram -:
• UTI ( Proteus, E. coli)
• Gastroenteriti (Salmonella, Shigella)
CH2O
O
COOH
• Generalmente attive su Gram +
aerobi ed anaerobi:
a. 7-aminocefalosporanico
CO
CH3
COOH
• Spettro esteso anche ai Gram -:
• Meningiti (Haemophilus influenzae
tipo B, S. pneumoniae, Neisseria
meningitidis)
• Resistenza alle β-lattamasi attive
sulle penicilline
•
Maggiore penetrazione attraverso
la membrana esterna
Le β-lattamasi sono enzimi in grado di DEGRADARE gli
antibiotici β-lattamici
La loro produzione, ampiamente diffusa nel mondo
microbico, rappresenta il principale meccanismo con
HC
CH
cui i batteri si difendono da questi antibiotici.
L‟inattivazione dei -lattamici da parte delle N
C
lattamasi è dovuta all’idrolisi dell’anello -lattamico
O
(il legame CO=N è spezzato dall‟enzima con
conseguente produzione di A. penicilloico inattivo).
Le -lattamasi sono enzimi secreti che svolgono la
anello -lattamico
loro funzione all‟esterno della membrana plasmatica.
La produzione di -lattamasi è in alcuni casi costitutiva mentre in
altri risulta indotta in presenza di certi substrati -lattamici.
La specificità di substrato di alcuni di questi enzimi è relativamente
ristretta, per questo motivo alcuni di questi enzimi sono spesso definiti
penicillinasi o cefalosporinasi.
Alcune molecole sono in grado di legarsi alle β-lattamasi inattivandole
e prevenendo, così la distruzione degli antibiotici β-lattamici.
ACIDO CLAVULANICO, SULBACTAM
• Derivato strutturale dell‟acido 6-aminopenicillanico (sostituzione dello S con O).
• Modesta azione antibatterica ma notevole
potere inibente su numerose -lattamasi
• Azione protettiva nei confronti delle lattamasi (in combinazione con penicilline)
MONOBATTAMICI (aztreonam)
• Antibiotici monociclici prodotti da
sulbactam
R-CO-NH
Chromobacterium violaceum.
• Rilevante attività vs Gram-negativi
(anaerobi esclusi), spiccata resistenza alle
-lattamasi.
O
R2
N
SO2H
MONOBATTAMI (solo Gram-)
POLIMIXINE
(Polimixina B, Colistina)
• Gruppo di antibiotici formati da polipeptidi ciclici , legati ad un polipeptide
lineare terminante con un acido grasso. Prodotti da Bacillus polymyxa.
• Attivi solo nei confronti dei Gram- alla cui m. esterna si legano
specificamente (fosfolipidi) distruggendone le proprietà osmotiche ,
alterandone la permeabilità e provocando la fuoriuscita di metaboliti
intracellulari.
MECCANISMO D’AZIONE:
• Sono detergenti cationici, agiscono in maniera analoga ai disinfettanti,
rimpiazzando competitivamente gli ioni Mg2+ e Ca2+ dei gruppi fosfato
delle m. lipidiche provocando la distruzione delle membrane.
• Sono attive anche nei confronti di batteri non metabolizzanti.
• Sono tossiche anche per le cellule eucariotiche (trattamenti topici).
La selettività dell‟azione di questi antibiotici risiede nelle sostanziali
differenze esistenti tra i ribosomi procariotici ed eucariotici e nel
processo di sintesi proteica
Poiché i ribosomi batterici sono
significativamente diversi dai ribosomi delle
cellule eucariotiche, tutti gli antibiotici che
interagiscono con le subunità ribosomiali sono
abbastanza selettivi per poter essere
impiegati nella terapia antibatterica.
Prodotte da Streptomyces, Micromonospora
Possono essere classificate in:
NATURALI
Streptomicina, Neomicina, Kanamicina,
Gentamicina, Tobramicina, Sisomicina
SEMI-SINTETICI
•Amikacina, netilmicina
Streptomicina
SPETTRO d’AZIONE ESTESO:
• Inattivi nei confronti degli anaerobi Gram+ e Gram- (infezioni gravi da
P. aeruginosa, Enterobacter spp)
TOSSICITA’:
• Nefrotossicità
• Ototossicità
• Blocco neuromuscolare
2. Parte della proteina “anomala”
viene inserita a membrana
generando dei pori che favoriscono
l’ingresso di ulteriori quantità di
antibiotico
1. Penetrazione dell’ANTIBIOTICO nella
cellula dove si lega irreversibilmente
alla subunità 30S, con formazione di un
prodotto proteico “anomalo” (non
funzionale)
AAA
AAA
mRNA
UNA PICCOLA %
ENTRA NELLA CELLULA
50
30
BLOCCO DELLA SINTESI
PROTEICA E BATTERICIDIA
50 50
30 30
3. Elevate concentrazioni
dell’antibiotico impediscono il
legame all’m-RNA di tutti i
ribosomi, causando il blocco
di sintesi proteica
4. Induzione di errori nella
lettura dei codoni di RNA-m
PROTEINE ALTERATE NELLA
MEMBRANA CAUSANO AUMENTATO
AFFLUSSO DELL’ANTIBIOTICO
Gruppo di antibiotici prodotti da Streptomyces spp, caratterizzati
da una struttura molecolare tetraciclica.
MECCANISMO d’AZIONE
Attività batteriostatica
• Blocco della sintesi proteica in una fase molto iniziale: si legano
reversibilmente alla subunità 30S inibendo l‟attacco dell‟aminoacil-tRNA a
livello del codone di inizio e bloccando la formazione del polisoma.
SPETTRO d’AZIONE ESTESO:
• Gram+ (acne), Gram- (infezioni vie aeree)
R4 R3 R2 R1
OH
• Ricketsie (trattamento di elezione)
• Clamidie (trattamento di elezione)
• Spirochete ed alcuni protozoi
OH
O
OH
OH O
CONH2
=
• Superinfezioni (eliminazione flora commensale)
• Colorazione dei denti in via di sviluppo
=
TOSSICITA’:
N(CH3)2
Struttura base delle Tetracicline
MACROLIDI
(Eritromicina, Claritromicina, roxitromicina, azitomicina..)
• Gruppo di antibiotici caratterizzati da un nucleo lattonico macrociclico,
prodotti da Streptomyces.
MECCANISMO D’AZIONE: attività batteriostatica
• Inibiscono la sintesi proteica legandosi reversibilmente alla subunità 50S
ed inibendo la traslocazione
SPETTRO d’AZIONE:
• Poco più ampio di quello delle penicilline
(include anche alcuni gram-)
• Infezioni da patogeni intracellulari:
• Chlamydia
• Campylobacter
• Mycobacterium spp.
• Polmonite da Mycoplasma pneumoniae
• Legionellosi
Eritomicina
CLORAMFENICOLO
• Prodotto da Streptomyces venezuelae.
MECCANISMO D’AZIONE: attività batteriostatica
• Blocca la reazione di transpeptidazione e di allungamento
della catena polipeptidica (impedisce il legame tra
l‟aminoacil-tRNA e il ribosoma). Conseguentemente, si
assiste al blocco della sintesi proteica.
SPETTRO d’AZIONE ESTESO:
• Gram+ e Gram- (da utilizzare solo in infezioni gravi)
TOSSICITA’
Cloramfenicolo
• Effetti secondari negativi a livello del sistema ematopoietico
LINCOSAMIDI
• clindamicina
• lincomicina
Antibiotici batteriostatici con un meccanismo e
spettro d‟azione simile ai macrolidi, pur avendo una
struttura chimica diversa. Clindamicina è
particolarmente attiva vs gli anaerobi obbligati.
Il gruppo più importante di antibiotici che agiscono bloccando la
sintesi del DNA è quello dei chinoloni.
CHINOLONI
(a. nalidixico, ofloxacina,
ciprofloxacina, levofloxacina, a. pipemidico…)
Chinoloni
• Composti di sintesi aventi come struttura base la 4-oxo-1,4 diidrochinolina
MECCANISMO D’AZIONE: attività battericida
• Agiscono bloccando la subunità A della DNA-girasi (enzima responsabile
della despiralizzazione del DNA, necessaria per la sua replicazione e
trascrizione). L‟inattivazione dell‟enzima è seguita dal blocco della neosintesi
del DNA e morte del batterio.
SPETTRO d’AZIONE ESTESO:
• Cocchi Gram+ ed infezioni delle vie urinarie
TOSSICITA’ SELETTIVA
• Differente struttura enzimatica tra procarioti ed eucarioti
Le rifamicine sono un gruppo di antibiotici isolati in Italia, dalle
colture di Nocardia mediterranea
RIFAMPICINA
Rifampicina
• Derivato semi-sintetico
MECCANISMO D’AZIONE:
• Agisce legandosi direttamente alla subunità β dell‟RNA polimerasi batterica
che rende non funzionale.
SPETTRO d’AZIONE: attività battericida
• Gram+ e Gram- ed in particolare nei confronti del micobatterio tubercolare
per le cui infezioni rappresenta uno dei farmaci di elezione.
TOSSICITA’ SELETTIVA
• differenze nella struttura della RNA-polimerasi batterica rispetto a quella
eucariotica
Prodotti chimici di sintesi strutturalmente simili a metaboliti essenziali
dei batteri : una volta assorbiti bloccano importanti processi biosintetici.
I sulfamidici sono stati i primi chemioterapici usati per inibire la
crescita batterica. Il sulfamidico più semplice è la sulfanilamide ma
vi sono numerosi derivati sintetici ottenuti mediante sostituzioni
SULFAMIDICI
Sulfanilamide
MECCANISMO D’AZIONE:
• Agiscono come analoghi strutturali dell‟acido p-aminobenzoico (PABA).
Competono con il PABA legandosi al sito attivo dell‟enzima DHPS
(diidropteroatosintetasi) bloccando la sintesi dell‟acido folico (coenzima
essenziale per la moltiplicazione batterica), precursore degli a. nucleici.
SPETTRO d’AZIONE ESTESO: attività batteriostatica
• Gram+ e Gram-; usati primariamente nelle UTI e nelle infezioni da Nocardia
TOSSICITA’ SELETTIVA
• via biosintetica dei folati presente nei soli batteri che sono in grado di
sintetizzare acido folico, ma non contro gli organismi superiori, che devono
procurarselo con la dieta.
TRIMETHOPRIM
Trimethoprim
• Analogo dell‟ acido diidrofolico
MECCANISMO D’AZIONE:
• Agisce legandosi all‟enzima diidrofolato riduttasi (DHFR), catalizzante la
reazione che trasforma il diidrofolato in tetraidrofolato, cofattore
richiesto per la sintesi delle purine, della timina, e di alcuni aminoacidi.
SPETTRO d’AZIONE ESTESO: attività batteriostatica
• Gram+ e Gram-; usati primariamente nelle UTI e nelle infezioni da Nocardia
TOSSICITA’ SELETTIVA
• Via metabolica comune sia ai procarioti che eucarioti, tuttavia l‟enzima
batterico mostra maggiore affinità per il trimethoprim.
TERAPIA COMBINATORIA (Trimethoprim-sulfametossazolo)
• Usato in combinazione con il sulfametossazolo inibisce due fasi metaboliche
sequenziali della sintesi di acido tetraidrofolico: il sulfametossazolo si
sostituisce al PABA nell‟acido folico, il trimethoprim impedisce la formazione
di acido tetraidrofolico, prevenendo l‟emergenza di ceppi resistenti.
LA VALUTAZIONE
DELL’ANTIBIOTICO-RESISTENZA:
C.d.L. in Tecniche di Fisiopatologia
Cardiocircolatoria e Perfusione Cardiovascolare
Università “G. d‟Annunzio” di Chieti-Pescara
Dott.ssa Arianna POMPILIO
Anno Accademico 2011-2012
Uno stipite batterico è resistente ad un farmaco quando:
è in grado di moltiplicarsi in presenza di concentrazioni
di farmaco che risultano inibitorie per la massima parte
degli stipiti della stessa specie
è in grado di moltiplicarsi in presenza di concentrazioni
del farmaco pari a quelle massime raggiungibili nel
corso dell‟impiego terapeutico.
L‟antibiotico resistenza è una proprietà geneticamente
trasmissibile del microrganismo. Essa può essere:
NATURALE o
INTRINSECA
ACQUISITA
Condizione di generale insensibilità
ad un farmaco che si estende a tutti
gli stipiti di una data specie.
Al microrganismo può mancare la
struttura su cui agisce
l‟antibiotico (es: Gram – vs
Generalmente selezionata da una
precedente esposizione del
patogeno all'antibiotico.
Si attua secondo diversi meccanismi
di cui i principali sono:
modifica del target batterico
produzione da parte del
batterio di enzimi inattivanti
l’antibiotico
ridotta permeabilità
all'antibiotico
efflusso dell'antibiotico dalla
cellula grazie ad un sistema di
pompe attive (che richiedono E).
penicilline; Clamidie e Micoplasmi sono
privi della parete cellulare e quindi
insensibili ai β-lattamici)
La struttura della parete
cellulare o la membrana
citoplasmatica di un
microrganismo possono essere
impermeabili ad un antibiotico.
Significato “clinico” della resistenza
I ceppi resistenti sopravvivono in presenza di concentrazioni
raggiunte in vivo a livello sierico dall‟antibiotico in seguito a
somministrazione di normali dosi terapeutiche.
La resistenza predice il possibile fallimento della terapia
antibiotica.
Antibiotico-resistenza: il “problema” medico
Meticillino-resistenza negli stafilococchi (100.000 decessi/anno
negli USA)
Circa il 50% delle infezioni nosocomiali è resistente ad almeno
1 antibiotico
Esito infausto per il 90% dei pazienti affetti da tubercolosi
multi-resistente
L‟abuso (uso non corretto) ha aumentato l‟incidenza e la
selezione delle mutazioni inducenti resistenza:
Profilassi in chirurgia
Uso empirico (agente eziologico ignoto)
Aumentato uso di antibiotici a spettro esteso
Antibiotici (probiotici) nei mangimi animali
Uso pediatrico per infezioni virali
Scarsa compliance del paziente
L‟esame batteriologico consente l‟identificazione
dell‟agente etiologico, così permettendo la scelta del
farmaco antibatterico adatto.
Ogni antibiotico o chemioterapico possiede uno
spettro d‟azione antibatterico in base al quale è
possibile prevedere in quali infezioni il suo impiego può
essere efficace.
Questa previsione, naturalmente, è possibile
automaticamente solo nel caso di infezioni sostenute
da batteri uniformemente e costantemente sensibili a
determinati antibiotici (Haemophilus influenzae,
Salmonella, spirochete…)
Quando invece l‟esame batteriologico mette in
evidenza la presenza di:
specie batteriche che sappiamo costituite da
stipiti diversamente sensibili ai vari medicamenti
(Pseudomonas, streptococchi viridanti, enterococchi,
enterobatteri del gruppo dei coliformi o dei Proteus)
specie che facilmente danno luogo alla comparsa
di MUTANTI antibiotico-resistenti (stafilococchi,
micobatteri)
è necessario completare l‟identificazione dei
batteri presenti in un dato materiale con lo studio
della loro SENSIBILITA’ ai diversi antibiotici.
L’ANTIBIOGRAMMA è il test impiegato per
determinare l’efficacia antimicrobica di un
farmaco nei confronti di specifici patogeni.
E‟ uno dei test più importanti che viene
comunemente eseguito nel laboratorio di
microbiologia clinica a causa delle sue
implicazioni terapeutiche immediate.
Nella pratica clinica questo tipo di test, essenziale
per una corretta terapia, permette di:
1) evidenziare quali siano i farmaci più efficaci nei
confronti di un certo microrganismo patogeno
2) fornisce una stima della dose terapeutica più
opportuna per la cura della malattia infettiva.
• Vengono effettuati in vitro, e misurano la risposta (crescita) di
un microrganismo isolato nei confronti di uno o più antibiotici.
• Sono eseguiti in condizioni standardizzate (la realizzazione
tecnica deve rispondere a criteri perfettamente standardizzati
periodicamente aggiornati da diversi comitati Nazionali, CLSI
ecc.) per garantirne la riproducibilità dei risultati.
• I risultati di questi tests debbono essere usati per guidare la
scelta dell‟antibiotico da adottare, alla quale contribuiscono
anche le informazioni cliniche e l‟esperienza professionale.
Obiettivo dei tests per la
determinazione della antibiotico-S è:
predire il successo od il fallimento in
vivo della terapia antibiotica.
ISOLARE il
MICRORGANISMO
RESPONSABILE
dell’INFEZIONE
IDENTIFICARE IL
MICRORGANISMO a
LIVELLO di SPECIE
ESPRIMERE la
SENSIBILITA’
BATTERICA secondo i
CRITERI ORIENTATI
alla TERAPIA
SELEZIONARE
un’APPROPRIATA
BATTERIA di
ANTIBIOTICI da
SAGGIARE
Un antibiogramma è INUTILE
• Quando il microrganismo isolato non può essere
ragionevolmente considerato responsabile di una infezione nel
sito in cui il campione è stato prelevato (FLORA COMMENSALE o
CONTAMINANTE: Streptococchi orali o H. parainfluenzae isolati da
secrezioni bronchiali) o quando il n° di CFU/ml è inferiore alla
soglia significativa (nelle urine o nelle secrezioni bronchiali).
• Quando il patogeno isolato appartiene ad una specie che è
costantemente SENSIBILE ad un trattamento standard, o
per la quale non esiste una correlazione fra l‟attività in vitro
ed in vivo.
• In quelle infezioni cutanee dove è indicato un trattamento
topico o chirurgico.
Un antibiogramma è UTILE
• EMOCOLTURA: l‟antibiogramma deve essere eseguito
tempestivamente nei campioni positivi
• LIQUOR
• TRATTO RESPIRATORIO SUPERIORE ed INFERIORE:
espettorato, lavaggio bronco-alveolare (BAL)
• CAMPIONI da OSSA o ARTICOLAZIONI, URINA da
CATETERE, FLUIDI da PUNTURA: quando si sospetti
un‟eziologia batterica
• INFEZIONI OSPEDALIERE ACCERTATE: anche per
obiettivi epidemiologici
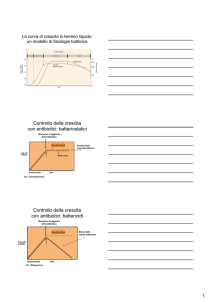
Il metodo più corretto per determinare
l‟efficacia di un antibiotico nei confronti di
un microrganismo consiste nello stabilire,
per ogni farmaco antibatterico:
la concentrazione minima inibente (MIC)
la concentrazione minima battericida (MBC).
Questo metodo permette di stabilire una
scala di attività dell’antibiotico per
diverse specie batteriche.
MIC
(Minimal Inhibitory Concentration): è una misura
quantitativa dell‟attività di un antibiotico verso un
determinato batterio. Definita come la più bassa
concentrazione di antibiotico in grado di inibire la crescita
batterica visibile.
(Minimal Bactericidal Concentration): è definita come la più
MBC
CLSI
bassa concentrazione di antibiotico in grado di inibire la
crescita batterica di almeno il 99,9% (1 germe su 1.000 elude
l‟azione antibiotica) della popolazione iniziale.
(Clinical and Laboratory Standard Institute): pubblica i
criteri per l‟interpretazione dei risultati dei tests
di sensibilità (categorie interpretative).
Le categorie interpretative (Sensibilità, Sensibilità
Intermedia e Resistenza) sono individuate da valori
di MIC detti BREAKPOINTS (soglia, limite).
I valori standard di sensibilità variano per ciascun
microrganismo e sono basati sulla concentrazione
plasmatica di farmaco che può essere raggiunta
senza la comparsa di effetti tossici.
I BREAKPOINTS consentono di classificare il microrganismo in:
“S”
• quando l„infezione causata da quel ceppo può essere adeguatamente
trattata con il dosaggio di un agente antimicrobico comunemente
raccomandato per quel tipo di infezione.
“I”
• quando la crescita batterica è inibita solo al dosaggio massimo
raccomandato; gli isolati batterici mostrano MIC corrispondenti a livelli
sierici e tessutali di antibiotico per i quali l‟efficacia potrebbe essere più
bassa di quella registrata per gli isolati sensibili.
“R”
• questa categoria predice il possibile fallimento dell‟antibiotico testato.
L'antibiotico dovrebbe essere utilizzato a dosaggi che risulterebbero
tossici nell'organismo in quanto i ceppi non sono inibiti alle concentrazioni
sistemiche di antimicrobico raggiungibili di solito con i normali dosaggi.
I breakpoints per la categorizzazione
(S, I, R) vengono individuati dalla CLSI
(già NCCLS) e determinati sulla base della:
• FARMACOCINETICA e FARMACODINAMICA
degli ANTIBIOTICI (livelli raggiunti in vivo nel
sangue e tessuti dall‟antibiotico)
• ATTIVITA’ CLINICA mediante correlazione
tra risultati in vitro (MIC) e risultati in vivo
(risoluzione del caso clinico).
1. BRODO DILUIZIONE (micro- e macrometodo)
2. DIFFUSIONE IN AGAR (Kirby-Bauer)
Metodi per diffusione
Antibiogramma
Metodi per diluizione
Str
Determinazione della MIC
Tet
8
4
2
1
k
MIC = MINIMA CONCENTRAZIONE INIBENTE
Ery
Chl
Amp
Nei test di antibiotico-sensibilità mediante diluizione la
sensibilità del microrganismo viene valutata in base alla sua
crescita o meno in un terreno di coltura (solido o liquido)
contenente diverse concentrazioni dell'antibiotico.
VANTAGGI
SVANTAGGI
Metodo quantitativo (consente di
determinare accuratamente oltre
alla MIC anche la MBC).
Costoso
Laborioso (allestimento pannelli
antibiotizzati), per cui l'impiego è
limitato a pochi casi:
Metodo valido e preciso
(RIPRODUCIBILE)
trattamenti di affezioni molto
serie in cui sia necessario valutare
la MBC (endocarditi batteriche o
osteomieliti);
valutazione sensibilità di
microrganismi a lenta crescita
(micobatteri e actinomiceti)
Preparare una serie di provette
contenenti terreno con diverse
concentrazioni di antibiotico, ed
inocularle con quantità convenzionali
(5 x 105 cfu/ml) dell‟organismo da
testare.
Incubare le provette (37°C, 16-20h)
La MIC è data dalla concentrazione più
bassa di antibiotico che porta ad assenza
di crescita dopo 16-20 ore di
incubazione.
E‟ invece possibile calcolare la
MBC se le provette che non
presentano crescita sono
sottoposte a subcultura in
terreno fresco privo di
antibiotico: la concentrazione
più bassa di antibiotico alla
quale il microrganismo non è in
grado di crescere quando viene
trasferito in terreno fresco
equivale alla MBC.
Il micrometodo in pozzetti
è sostanzialmente identico
al metodo delle diluizioni in
provetta.
Le MIC vengono determinate in microtiter 96/wells
fondo ad “U” valutando l‟intorbidimento del brodo o la
formazione di sedimento sul fondo dei pozzetti.
ANTIBIOTICO
S
I
R
PIPERACILLINA
≤ 16
32-64
≥ 128
CEFAZOLINA
≤ 8
16
≥ 32
CEFOTAXIME
≤ 8
16-32
≥ 64
CEFPODOXIME
≤ 2
4
≥ 8
IMIPENEM
≤ 4
8
≥ 16
VANCOMICINA
≤ 4
8-16
≥ 32
GENTAMICINA
≤ 4
8-16
≥ 32
S = Sensibilità, I = Sensibilità Intermedia, R = Resistenza
È un metodo quali-quantitativo, semplice, rapido ed economico, valido
per microrganismi aerobi a crescita rapida.
Attualmente il test di diffusione su dischetto più utilizzato è il
metodo di Kirby-Bauer, sviluppato agli inizi degli anni ‟60.
VANTAGGI
Tecnica standardizzata (CLSI)
Flessibilità nella scelta degli
antibiotici
Facilità di esecuzione
Economicità
Correlazione tra risultati in vitro
(antibiogramma) e risoluzione
clinica (risultati in vivo)
SVANTAGGI
Impossibilità di totale
automatizzazione
Produce risultati qualitativi
(categorie di sensibilità)
1. Allestimento brodocoltura da coltura pura
Si effettua applicando sulla
superficie della piastra in cui è
stata precedentemente seminata
una brodocoltura batterica dei
dischetti di carta da filtro sterili
2. Semina brodocoltura
perfettamente aderenti contenenti
una concentrazione nota e standard
di antibiotico. L‟ antibiotico
presente sul disco diffonde in
rapporto alla diffusibilità in terreno
di coltura
3. Apposizione dischetti
antibiotizzati
4. Incubazione
(37°C, 18-24h)
5. Misurazione diametro
alone di inibizione
1.
Allestire piastre con idoneo terreno solido le quali
vengono successivamente inoculate con una quantità di
batteri sufficiente a dare uno sviluppo confluente
generando una patina uniforme sul terreno
2. Deporre sulla superficie della piastra, con l‟aiuto di una
pinzetta sterile, una serie di dischetti di carta assorbente
imbevuti con adatte concentrazioni degli antibiotici che si
desidera testare.
3. Incubare le piastre a 37°C per 18-24 ore.
4. Misurare il diametro degli aloni di inibizione formatisi
per ogni antibiotico.
Secondo i criteri stabiliti dalla
CLSI (Clinical and Laboratory
Clinical Institute) il diametro
dell‟alone di inibizione deve
rispondere a determinati valori
al di sotto dei quali il
microrganismo viene considerato
Resistente, ed al di sopra dei
quali viene considerato
Sensibile.
Esiste inoltre una zona definita
Intermedia in cui si deve
stabilire se il microrganismo è
sensibile o resistente.
MICRORGANISMO SENSIBILE
MICRORGANISMO
con RESISTENZA
L'E-test o epsilon test dalla forma dell'alone di inibizione,
è un metodo quantitativo per la determinazione della MIC.
E-test è costituito da strisce di plastica di
5 x 50 mm contenenti un gradiente
corrispondente a 15 concentrazioni a
raddoppio di antibiotico (in mg/ml).
Queste sono variabili a seconda dei diversi
antibiotici utilizzati:
0.00025 – 4
0.002 – 32
0.016 – 256
0.032 – 512
0.064 – 1024
La tecnica di semina a tutta piastra è analoga a quella
dell‟antibiogramma per diffusione secondo Kirby-Bauer.
Deposizione delle strisce antibiotizzate sulla superficie
della piastra inoculata
Incubazione a 37°C per 18-24 ore.
La lettura della MIC si effettua dove la crescita batterica
interseca la striscia.