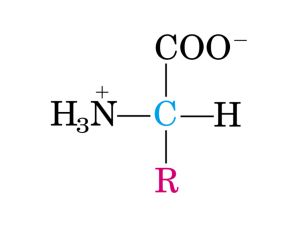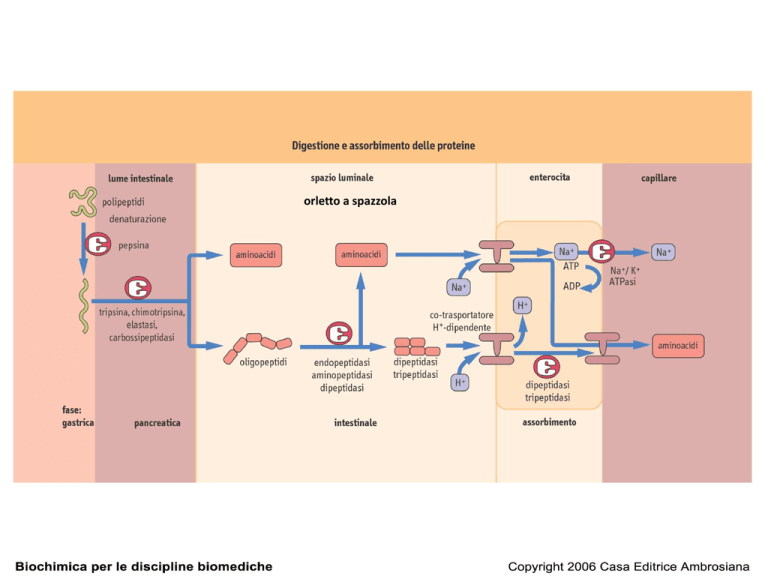
orletto a spazzola
Digestione delle proteine: 6 fasi
1. Idrolisi gastrica del legame peptidico
2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel
lume dell’intestino tenue
3. Idrolisi degli oligopeptidi operata da peptidasi dell’orletto a spazzola
degli enterociti
4. Ulteriore digestione dei di- e tri-peptidi da peptidasicitoplasmatiche
nell’enterocita
5. Metabolismo degli AA negli enterociti
6. Trasporto degli AA attraverso la membrana basolaterale e invio al
sangue portale e quindi al fegato
Origine
Zimogeno/ Enzima
Attivazione
Substrato
Prodotto
finale
Stomaco
Pepsinogeno/pepsina
pH 1-2,
autoattivazione
Proteine
Peptidi
Pancreas
Tripsinogeno/tripsina
Enteropeptidasi
Proteine,
peptidi
Peptidi,
dipeptidi
Tripsina
Proteine,
peptidi
Peptidi,
dipeptidi
Tripsina
Proteine,
peptidi
Peptidi,
dipeptidi
Estremità Cterminale
polipeptidi
Peptidi,
aminoacidi
Estremità Nterminale di
oligopeptidi
Peptidi,
aminoacidi
(membrana enterociti
duodenali)
Chimotripsinogeno/
chimotripsina
Pro-elastasi/elastasi
Pro-carbossipeptidasi
Intestino
tenue
(membrana e
citoplasma)
Aminopeptidasi
Tripsina
Assente
Specificità di taglio delle proteasi dell’apparato gastrointestinale
tripsina – amminoacidi basici (arginina, lisina), versante -COOchimotripsina - amminoacidi aromatici (Phe, Tyr) ,versante -COO-
elastasi – glicina, versante -COOcarbossipeptidasi a - amminoacidi aromatici
carbossipeptidasi b - amminoacidi basici
ASSORBIMENTO degli AMINOACIDI
presenza di proteine trasportatrici sulle membrane apicali e basolaterali degli enterociti
Ogni sistema trasporta aminoacidi o dipeptidi con proprietà strutturali diverse
Alcuni sfruttano un sistema di trasporto attivo, mediante co-trasporto con Na+ o H+
Destino delle proteine (amminoacidi) della dieta
durante la fase di assorbimento (circa 2 ore)
Sintesi proteica
Glucosio (7-9 g)
10 g
4g
Intestino
(Glutammina)
12 g
Amminoacidi
30g
Fegato
Urea
CO2
4g
(Amminoacidi ramificati)
Muscolo e rene
ATP
Funzioni degli amminoacidi
•Substrati per la sintesi proteica (20 +1), suscettibili di
modificazioni post-traduzionali (es. idrossiprolina, idrossilisina,
acido γ-carbossiglutammico)
•Intermedi metabolici (es. ornitina)
•Fonte energetica (glucogenici, chetogenici)
•Trasporto di gruppi amminici (glutammina, alanina)
ALTRI DESTINI METABOLICI DEGLI AMMINOACIDI
Tirosina
Triptofano
Glicina
Arginina
Aspartato
Glutammato
Istidina
Glutammina
Lisina
Metionina
Cisteina
→
→
→
→
→
→
→
→
→
→
→
melanina , catecolammine, ormoni tiroidei
niacina (NAD+, NADP+), serotonina
purine, eme, acido glicocolico, creatina, creatinina
creatina, creatinina, ossido nitrico (NO)
purine
gamma-aminobutirrato (GABA)
istamina
purine
carnitina
carnitina, creatina
taurina
Biosintesi di alcuni neurotrasmettitori
da amminoacidi
Notare il ruolo delle decarbossilasi
Fosfocreatina
composto fosforilato di
riserva del muscolo
(concentrazione
muscolare circa 30 mM)
Sintesi a partire da
glicina, arginina e
metionina
La CREATININA è il
prodotto di
degradazione della
fosfocreatina muscolare
Sintesi delle purine: gli atomi di azoto derivano
dagli amminoacidi aspartato, glicina e glutammina
Sintesi del glutatione:
glutammato, cisteina, glicina
Sintesi dell’ossido nitrico (NO) a partire dal gruppo guanidinico dell’arginina
(ossido nitrico sintasi)
L’ossido nitrico è un importante mediatore di processi fisiologici
(controllo della pressione sanguigna, trasmissione nervosa, coagulazione del sangue)
Sulla base delle vie cataboliche energetiche dello scheletro
carbonioso gli amminoacidi possono essere suddivisi in due
gruppi
Glucogenici
degradati a piruvato, alfa-chetoglutarato, succinil-CoA, fumarato, o ossalacetato
(produrranno glucosio tramite gluconeogenesi)
Chetogenici degradati ad acetil-CoA o acetoacetato (produrranno acidi grassi
o corpi chetonici)
Alcuni amminoacidi appartengono ad entrambi i gruppi
Leucina e lisina (producono solo acetoacetato o acetilCoA) sono
esclusivamente chetogenici
In ROSSO solo glucogenici; in AZZURRO solo chetogenici; in VERDE
entrambi
Alanina, glicina, cisteina, serina, treonina piruvato (glucogenici)
Treonina anche acetilCoA (anche chetogenico)
Asparagina, aspartato ossalacetato (glucogenici)
Arginina, glutammato, glutammina, istidina, prolina alfachetoglutarato (glucogenici)
Isoleucina, metionina, treonina, valina succinil-CoA, tramite propionilCoA (glucogenici)
Isoleucina anche acetil-CoA (anche chetogenico)
Leucina e lisina acetilCoA e/o acetoacetato (SOLO chetogenici)
Triptofano alanina piruvato)
acetoacetilCoA (sia glucogenico che chetogenico)
Fenilalanina e tirosina fumarato
acetoacetato ( sia glucogenici che chetogenici)
Schema del catabolismo degli amminoacidi
Esclusivamente chetogenici
ALCUNE RIFLESSIONI
•Il catabolismo dello scheletro carbonioso degli amminoacidi produce
energia attraverso l’interazione con la via glucogenetica ed il ciclo di
Krebs
•Il catabolismo dei carboidrati e quello delle proteine sono in stretta
correlazione
•L’efficienza del catabolismo delle proteine (molecole di ATP prodotte) è
inferiore rispetto a quello dei carboidrati e lipidi
- non tutto lo scheletro carbonioso degli amminoacidi è soggetto ad
ossidazione
-la formazione di urea richiede il consumo di 3 molecole di ATP
•Molte malattie genetiche dell’uomo sono inerenti al catabolismo degli
amminoacidi
Malattia
Processo difettoso
Enzima difettoso
Sintomi ed effetti
Albinismo
Sintesi melanina da
Tyr
Tirosinasi
Mancanza di
pigmentazione
Alcaptonuria
Degradazione Tyr
Omogentisato
diossigenasi
Pigmentazione
scura dell’urina,
artriti
Argininemia
Ciclo dell’urea
Arginasi
Ritardo mentale
Omocistinuria
Degradazione Met
Cistationina beta
sintasi
Alterazione viluppo
osseo, ritardo
mentale
Malattie urine
a sciroppo
d’acero
Degradazione aa
ramificati
Complesso alfachetoacido
deidrogenasi a
catena ramificata
Vomito, ritardo
mentale, morte
precoce
Acidemia
metilmalonica
Conversione
propionilCoA a
succinilCoA
MetilmalonilCoA
mutasi
Vomito, ritardo
mentale, morte
precoce
Fenilalanina
idrossilasi
Vomito neonatale,
ritardo mentale
Fenilchetonuria Conversione Phe a
(più frequente) Tyr
Classificazione in base alla struttura
presentano una diversa percentuale di azoto
Classificazione nutrizionale
Essenziali
Non essenziali
Essenziali
in certe condizioni
(condizionatamente)
Valina
Alanina
Arginina
Leucina
Glutammato
Glicina
Isoleucina
Aspartato
Prolina
Lisina
Asparagina
Glutammina
Istidina
Serina
Triptofano
Cisteina
Fenilalanina
Tirosina
Metionina
Treonina
•Tirosina e Cisteina diventano essenziali se mancano fenilalanina e metionina, da cui
derivano (semi-indispensabili)
•La Tirosina è essenziale nel cervello, dove la sua sintesi dalla fenilalanina non avviene
•L’Arginina è essenziale nell’infanzia e nello sviluppo
•La sintesi dei non essenziali può essere compromessa per scarso apporto dei carboidrati
•L’essenzialità dell’istidina è controversa
Biosintesi degli amminoacidi non essenziali
o dei condizionatamente essenziali nell’uomo
piruvato → alanina
ossalacetato → aspartato (+ glutammina) → asparagina
α-chetoglutarato → glutammato + NH3→ glutammina
glutammato → prolina, arginina
3-fosfoglicerato → serina → glicina
fenilalanina → tirosina
metionina → cisteina
La velocità di sintesi può non essere sufficiente ai bisogni
in alcune condizioni
(malati, stress, neonati prematuri o sottopeso, ustionati)
Biosintesi della serina dal 3- fosfo glicerato
e conversione della serina in glicina
Metionina
Biosintesi della Cys
dalla Hcys +Ser
Contenuto in proteine di un UOMO ADULTO: circa 12 kg/70 kg
peso
actina, miosina, collagene ed emoglobina costituiscono circa la metà di tutte le
proteine
40% nel muscolo: possono diventare fonte di amminoacidi in condizioni di
stress, a discapito però di proteine funzionali
10% tessuti viscerali (fegato, intestino): scarsamente mobilizzate in
condizioni di stress
30% nella pelle e nel sangue: diventano fonte di amminoacidi in deficit di
proteine alimentari