Chimica Organica
Studio dei
composti del
CARBONIO
1
Contengono C, H
e possono contenere
N, O, S
Carbonio legato
covalentemente ad
un metallo
Tutti gli elementi
possibili
Composti organici
2
Perché si formano gli ibridi?
1. La repulsione fra gli elettroni diminuisce
2. Si formano legami più forti
3. Gli orbitali ibridi sono meglio orientati per formare
legami
4. Grazie alla “promozione” di elettroni si possono
formare più legami
PERCHE’
PERCHE’ NON FUNZIONANO GLI ORBITALI ATOMICI ?
2s
2px,2py,2pz
sp,sp
2py,2pz
Orbitali
atomici
Orbitali
ibridi
ibridazione
σ, π,n
legame
Orbitali
molecolari
IPOTETICO MODO DI FORMAZIONE DI UN LEGAME
3
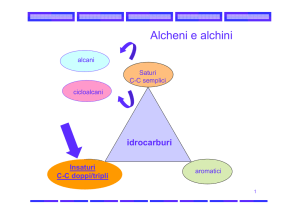
Idrocarburi
¾ Sono una famiglia di composti che
contengono nella molecola solo atomi di
carbonio e di idrogeno
saturi
alifatici
Idrocarburi
alcani
alcheni
insaturi alchini
dieni
aromatici (benzene)
Alcani
¾ Sono idrocarburi di formula generale:
CnH2n+2
¾ L’alcano più semplice è il metano, CH4
4
sp3
IBRIDAZIONE TETRAEDRICA
4 elettroni di valenza
(non si formano doppi o tripli legami)
Ibridazione sp3
5
Formazione di orbitali sp3
sp3(1)
2p
109o28’
2s
O
Elettroni di valenza
Ibridazione
sp3(3)
sp3(4)
sp3(2)
(1)
Geometria TETRAEDRICA
(2)
(3)
(4)
Orbitali ibridi sp3
Perché sp3?
IBRIDAZIONE
2s
2p
(1)
(2)
(3)
(4)
4 orbitali ibridi sp3
Ogni nuovo orbitale sarà:
1/4 s + 3/4 p (25% s, 75% p)
S1P3 = SP3
6
Origine della forma dell’orbitale sp3
Esempio: Metano
7
Esempio: Etano
Legame sigma (σ)
Legame sigma (σ)
Rotazione intorno al legame σ
Legame sigma (σ)
8
Conformazioni
¾ Ci sono infinite rotazioni possibili, e quindi
anche infinite conformazioni
Conformazioni ed Energia
9
Alcani: esempi
metano
etano
propano
butano
Proprietà
¾ Poiché
i processi di fusione e di
ebollizione richiedono la rottura delle
forze inter - molecolari, le temperatura di
fusione ed ebollizione crescono con il
Peso Molecolare.
¾ Sono molecole scarsamente reattive in
quanto la forza del legame C - C è alta.
¾ Viene richiesta un alta energia di
attivazione per spezzare i legami.
10
Proprietà
¾ In
generale gli alcani sono non polari, si
hanno soltanto interazioni di Van der
Walls, che aumentano con l’aumentare
della catena.
¾ I primi 4 composti sono gassosi a
temperatura ambiente
¾ Sono liquidi gli alcani dal pentano
all’eptadecano (C17H36)
¾ Solidi quelli a peso molecolare più alto
Isomeri costituzionali
¾ Alcani più complessi del propano possono
avere concatenazioni di atomi di carbonio
lineari o ramificate.
¾ Ci sono composti che hanno lo stesso
numero di atomi di carbonio e idrogeno
ma concatenati in modo diverso, sono
questi isomeri COSTITUZIONALI
11
Isomeri costituzionali
¾
Aumentando il numero degli atomi di C
aumentano gli isomeri di catena:
¾
Metano
Etano
Propano
Butano
Pentano
Esano
Eptano
Ottano
¾
¾
¾
¾
¾
¾
¾
1 isomero
1 isomero
1 isomero
2 isomeri (n-butano e iso butano)
3 isomeri
5 isomeri
9 isomeri
18 isomeri
Carbonio I°, II°, III° e IV°
¾ Un
atomo di C può trovarsi legato ad
altri atomi di C:
¾ A un solo atomo di C (C primario)
¾ A due Atomi di C
(C secondario)
¾ A tre atomi di C
(C terziario)
¾ A 4 atomi di C
(C quaternario)
12
Esempio
CH3
C terziario
CH3
CH CH2
CH2
C
C primario
CH CH3
rio
nda
o
c
se
CH3
Esempi
13
Nomenclatura
1. Si individua la catena più lunga: ESANO
CH3
CH3 CH
CH2 CH
CH3
CH2
CH3
Nomenclatura
2. Si individuano tutti i sostituenti attaccati alla catena più lunga
CH3
CH3 CH
CH2 CH
CH3
CH2
CH3
In questo caso due gruppi METILICI (CH3)
14
Sostituenti. Cosa sono?
¾ I Gruppi CH3
hanno formalmente
“sostituito” un atomo di idrogeno (H)
nell’alcano corrispondente:
CH3
(H) CH3 CH
CH2 CH
(H)
CH3
CH2
CH3
Sostituenti. Cosa sono?
¾
Come si ottengono questi sostituenti? A loro volta
dall’
dall’alcano corrispondente, infatti:
z
Se dalla molecola di un alcano si sottrae un atomo di H si
ottiene un:
Gruppo (o radicale) alchilico
¾
I gruppi alchilici vengono denominati sostituendo
alla desinenza ano dell’
dell’alcano il suffisso: ile
metano
metile
metano (CH4)
metile – CH3
etano
etile
- C2H5
etano (C2H6)
etile
propano
propile
propano (C3H8)
propile – C3H7
15
Nomenclatura
3. Se due o più sostituenti sono uguali, se ne indica il numero
facendo precedere il nome del gruppo dal prefisso: di, tri, tetra…
CH3
CH3 CH
CH2 CH
CH3
CH2
CH3
In questo caso due gruppi METILICI (CH3), quindi dimetil
Nomenclatura
4. Si numera la catena in modo da avere i sostituenti in posizioni
con il minor numero possibile
CH3
CH3
4
CH
CH2 CH
3
2
CH3
1
5 CH2
6 CH3
In questo caso: 2,4-dimetilesano
16
Cicloalcani
¾
I cicloalcani hanno la formula generale:
CnH2n
e sono alcani a struttura ciclica.
¾
La denominazione deriva dal nome dell’alcano
con il prefisso ciclo
Cicloesano:
conformazioni
a barca (instabile, alta energia)
a sedia (stabile, bassa energia)
17
Cicloesano:
conformazioni ed energia
Alcheni
¾
¾
¾
¾
Contengono 1 o più
doppi legami
Caso più semplice:
ETILENE C2H4
I doppi legami
hanno geometria
planare
Formula generale:
CnH2n
sp2
18
FORMAZIONE DI ORBITALI IBRIDI sp2
3 coppie
orbitale 2p
non occupato
Non utilizzato
sp2(2)
2p
2s
B
2p
3 orbitali
occupati
ibridazione
x
120o
sp2(1)
2p
Trigonale
planare
sp2(3)
z
(1)
(2)
(3)
Orbitali ibridi sp2
Legame π negli alcheni
19
Orbitali ibridi negli alcheni
Esempi
sp2
sp2
propano
propene
propino
20
Alcheni
¾
La formula molecolare generale è:
CnH2n
Contengono nella loro molecola almeno un
doppio legame
I composti sostituiscono alla desinenza ano
quelle ene
Etano
etene (o etilene)
Propano
propene
butano
butene
Rotazione impedita lungo il legame π
¾
Per ruotare attorno al legame π devo ROMPERE
il legame
Il legame π si rompe
¾
Posso quindi avere isomeri che differiscono solo
per la geometria del doppio legame
21
Alcheni: isomeria cis-trans
(isomeri GEOMETRICI o STERICI)
Z
E
ATTENZIONE!!
In questi casi non esistono isomeri cis e trans dei composti perché
perché i due sostituenti sullo stesso carbonio sp2 sono identici
Perché ci sia isomeria geometrica, i sostituenti devono essere DIVERSI!
22
Proprietà chimiche degli alcheni
¾
¾
Gli alcheni danno reazioni di addizione
elettrofila sul doppio legame (che è ricco di
elettroni e attira quindi elettrofili)
Esempio: addizione di HBr
Attacco dell’elettrofilo
23
Idrocarburi AROMATICI
¾ Gli idrocarburi aromatici sono una classe
particolare degli idrocarburi insaturi ciclici
¾ Sono:
z
z
z
CICLICI
PLANARI
HANNO 4n+2 ELETTRONI p
Benzene (C6H6)
24
Risonanza e strutture di Kekulè
Ibrido di risonanza
Struttura del benzene
25
¾
¾
¾
¾
Alchini
Contengono 1 o più
tripli legami
Caso più semplice:
ACETILENE C2H2
I tripli legami hanno
geometria lineare
La formula
molecolare
generale è:
CnH2n2n-2
sp
FORMATION OF LINEAR HYBRID ORBITALS
2 coppie
Orbitali 2p
“Vuoti”
2p
y
2s
sp(1)
C
vuoti
2 orbitals
filled
ibridazione
x
sp(2)
2p
(1)
LINEARE
2p
(2)
Orbitali ibridi sp
z
26
Legami negli alchini
Nell’acetilene i 2 atomi di carbonio sono legati da
1 legame σ e 2 legami π
Alcoli, Fenoli, Eteri
27
Alcoli
¾
¾
Gli alcoli sono composti caratterizzati dal
gruppo funzionale –OH (ossidrile)
Il gruppo ossidrile è legato a un atomo di
carbonio sp3
H
C OH
H
alcol benzilico
Alcoli, orbitali
Come nella molecola d’acqua, anche negli alcoli l’ossigeno
ha un’ibridazione di tipo sp3
28
Alcoli primari, secondari, terziari
H
R
R'
OH
H
primario
R
R'
OH
R
H
secondario
OH
R"
terziario
R= una catena di atomi di carbonio
Fenoli
¾
Sono composti dove il
gruppo ossidrilico è
legato direttamente
ad un anello
aromatico
OH
fenolo
29
Eteri
¾
¾
Sono composti con
un atomo di ossigeno
a ponte fra due
radicali alchilici e/o
arilici
Esempio:
R
O
R'
O
etere (di)etilico
o
dietil etere
eteri corona
Eteri, orbitali e legami
¾ Ancora una volta l’ossigeno è sp3
30
Legami a ponte d’idrogeno
Tioalcoli, tiofenoli e tioeteri
¾
Sono composti analoghi degli alcoli, ma
con lo zolfo al posto dell’ossigeno
SH
R SH
tioalcoli
R
tiofenoli
S
R'
tioeteri
31
Ammine
¾
Sono derivati organici dell’ammoniaca per
sostituzione di uno o più atomi di idrogeno con
gruppi alchilici o arilici:
Ammoniaca
Ammina primaria
Ammina secondaria
Ammina terziaria
Ammine, orbitali
L’azoto è di tipo sp3
32
Legami a ponte di idrogeno
nelle ammine
Ammine cicliche e aromatiche
Piperidina
Piridina
33
Aldeidi e Chetoni
¾
Aldeidi e chetoni sono caratterizzati dallo
stesso gruppo funzionale detto carbonilico:
O
¾
Differenza:
Aldeide
Chetone
Legami presenti nel carbonile
¾
Carbonio e ossigeno si legano a formare un
doppio legame (1 legame σ e 1 legame π)
34
Modello 3D
acetaldeide
acetone
Acidi Carbossilici
¾
Sono caratterizzati dal gruppo funzionale
carbossilico (gruppo carbonilico legato ad un
gruppo ossidrilico)
O
R
OH
35
Esempio:
acido acetico (CH3COOH)
O
H3C
OH
Acidi Grassi
¾
¾
Sono acidi carbossilici alifatici a lunga catena
(in generale da 10 a 26 atomi di C)
Nei LIPIDI sono presenti solo a numeri pari di
atomi di carbonio
36
Derivati degli acidi carbossilici
¾
Si ottengono dagli acidi per sostituzione
dell’ossidrile
O
R
W = OR (esteri)
= Cl, Br, F, I (alogenuri degli acidi)
= NR2 (ammidi)
= RCOO (anidridi)
W
Esteri
¾
Si possono ottenere da un acido carbossilico e
da un alcol:
O
R
O
OH
+
R' OH
R
OR'
+ H2 O
37
Aspirina
Aspirina (acido acetilsalicilico)
Alogenuri degli acidi
¾
Si possono ottenere dagli acidi carbossilici per
sostituzione dell’ossidrile con un alogenuro
O
R
O
OH
R
X
X = Cl, Br, F, I
38
Ammidi
¾
Si possono ottenere da un alogenuro di un
acido e da un’ammina:
O
R
O
X
+
R
R' NH2
NHR'
Peptidi
39
Amminoacidi
¾
Sono acidi carbossilici con in posizione α (cioè
sul carbonio legato a quello dell’acido) un
ammina
acido
ammina
Alanina
un aminoacido
Proteine
¾
Sono formate da catene polipeptidiche complesse
40
Struttura 3D di una proteina
Anidridi
¾
Si ottengono da due acidi carbossilici legati fra
loro:
O
R
O
O
R'
41
Ossidazioni e riduzioni
H
R C OH
H
Alcol primario
H
R C OH
R'
Alcol secondario
R"
R C OH
R'
Alcol terziario
ossidaizone
riduzione
ossidaizone
riduzione
O
R
H
Aldeide
O
R
ossidaizone
riduzione
O
R
OH
Acido carbossilico
ossidaizone
R'
Chetone
ossidaizone
Chimica delle Biomolecole:
CARBOIDRATI
42
Carboidrati
¾ I carboidrati sono poliidrossialdeidi o
poliidrossichetoni
¾ Hanno formula generale:
Cn(H2O)n
Monosaccaridi
¾
Sono gli zuccheri più semplici, non possono
essere idrolizzati in carboidrati più semplici
Serie “D” unica che si trova in natura
43
Aldosi (poliidrossialdeidi)
Chetosi (poliidrossichetoni)
44
Molecole chirali
¾
Sono per definizione
molecole NON
sovrapponibili alla
propria immagine
speculare
Oggetti chirali e achirali
mano sinistra
mano destra
CHIRALI
ACHIRALE
45
Carbonio stereogenico
¾
Quando un atomo di carbonio è legato a quattro
gruppi diversi si chiama STEREOGENICO
perché PUO’ generare stereoisomeri
Un atomo di carbonio stereogenico
Molecole chirali e achirali
molecola
chirale
molecola
chirale
(immagine speculare
non sovrapponiblie)
molecola
achirale
molecola identica
Coppia di ENANTIOMERI
46
Molecole chirali
¾ Le molecole chirali RUOTANO il piano
della luce polarizzata. Quelle achirali no!
Molecola chirale
¾ Un enantiomero ruota in un senso,
l’immagine speculare nel senso opposto
Importanza della stereochimica
Solo uno dei due enantiomeri potrà essere riconosciuto dal recettore
47
Proiezioni di Fischer delle molecole
Schiaccia la molecola
Proiezione di
Fischer
Esempio
Proiezione di Fischer
48
Glucosio e forme anomeriche
Emiacetale
(Aldeide+alcol)
Forme anomeriche α e β
49
Fruttosio e forme anomeriche
Galattosio e forme anomeriche
50
Legame glicosidico e disaccaridi
¾
¾
¾
¾
¾
I polisaccaridi si
formano per unione di
2 monosaccaridi
Possono avere
legame α o β
L’uomo è in grado di
idrolizzare solo i
legami di tipo α (es.
amido vs. cellulosa)
L’amilosio è contenuto
nell’
nell’amido (per il 20%) è
un’
un’importante fonte
alimentare contenuta nel
grano, riso, patate, etc.
La cellulosa è formata
dalle stesse unità
unità
dell’
dell’amilosio ma legate β,
non può essere digerita
dall’
dall’uomo
51
LIPIDI
¾
¾
Sono una classe
vasta ed eterogenea
di biomolecole
Hanno come
costituenti essenziali
uno o due residui
carbossilici (RCOO)
di acidi grassi
Acidi grassi
52
Oli e grassi
Un grasso
Un olio
La presenza di doppi legami cis impedisce
Alle molecole di impaccarsi come nei grassi
Saponi e micelle
53
Famiglie di lipidi
La Struttura dei Lipidi
54
Trigliceridi
¾
Sono esteri del glicerolo con 3 acidi grassi
FINE
55