DOTTORATO DI RICERCA IN MEDICINA SPERIMENTALE XXIX CICLO
Dottoranda: Monica Nanni
La Dott.ssa Monica Nanni ha svolto le sue attività di ricerca sotto la direzione della Prof.ssa Maria
Rosaria Torrisi e con la supervisione della Dott.ssa Francesca Belleudi presso il laboratorio di
Diagnostica Cellulare dell’Azienda Ospedaliera Sant’Andrea, Dipartimento di Medicina Clinica e
Molecolare, Sapienza Università di Roma.
Nel corso del 1° anno di Dottorato il progetto di ricerca è stato rivolto allo studio degli effetti
dell’espressione della proteina E5 del virus HPV16 (16E5) sul processo autofagico in cheratinociti
umani.
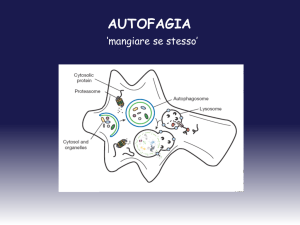
L’autofagia è un processo di auto-digestione finemente regolato (Rubinsztein et al., 2011) che può
essere innescato a seguito di stress cellulare come la deprivazione di nutrienti o l’ipossia (Yang et
al., 2010). Recentemente è stato osservato un forte interplay fra autofagia e infezione da virus
oncogeni. Infatti, mentre la cellula ospite infettata utilizza l’autofagia per eliminare i virus, molti di
questi hanno evoluto varie strategie per evadere il processo autofagico o per sfruttarlo allo scopo di
favorire la loro stessa replicazione (Mack et al., 2012; Silva and Jung, 2013). Recenti studi hanno
mostrato che l’infezione da papillomavirus umano di tipo 16 (HPV16) induce autofagia nei
cheratinociti infettati (Griffin et al., 2013) ed evidenze ottenute mediante esperimenti di deplezione
suggeriscono che le proteine precoci del virus potrebbero svolgere un importante ruolo di
interferenza con questo processo (Hanning et al., 2013). La proteina oncogenica 16E5 coopera con
le proteine 16E6 e 16E7 per promuovere la cancerogenesi tumorale indotta da HPV16 (Moody and
Laimnins, 2010; Venuti et al., 2011; DiMaio and Petti, 2013), ed è stato osservato che la sua
espressione è in grado di down-modulare sia a livello trascrizionale che traduzionale il Keratinocyte
Growth Factor Receptor (KGFR) (Belleudi et al., 2011; Purpura et al., 2013), l’isoforma epiteliale
dell’FGFR2 in grado di indurre autofagia nei cheratinociti umani (Belleudi et al., 2014).
Sulla base di queste premesse, la Dott.ssa Nanni si è proposta di definire gli effetti dell’espressione
di 16E5 sull’autofagia nei cheratinociti umani.
Inizialmente sono stati valutati gli effetti dell’espressione della proteina virale 16E5 sull’autofagia
indotta dall’attivazione ligando specifica del KGFR utilizzando la linea di cheratinociti umani
HaCaT trasfettata transientemente con un costrutto pCI-neo contenente la proteina virale 16E5
(HaCaT E5) o con il solo vettore vuoto (HaCaT pCI-neo). Per valutare i livelli di autofagia, le
cellule sono state trattate con il KGF per 24h a 37°C, condizione già testata come ottimale per
ottenere un’efficiente induzione del processo (Belleudi et al., 2014). I livelli di autofagia sono stati
valutati mediante western blot analizzando l’espressione proteica di LC3-II, un marker specifico
della formazione di autofagosomi, e quella di SQSTM1, un substrato selettivamente degradato
mediante il processo autofagico. I risultati hanno dimostrato che l’espressione della proteina E5 è in
grado di contrastare l’aumento dei livelli di LC3-II e la degradazione di SQSTM1 indotta dal KGF.
Il ruolo inibitorio di 16E5 sull’autofagia indotta da KGF è stato confermato successivamente
mediante approcci di immunofluorescenza. Le cellule HaCaT sono state cotrasfettate
transientemente con il costrutto pEGFP-C2-LC3 e con pCI-neo E5-HA (HaCaT EGFP-LC3/E5) o
con pCI-neo vuoto (HaCaT EGFP-LC3), come controllo, e l’anticorpo anti-HA è stato utilizzato per
visualizzare le cellule esprimenti 16E5. I risultati hanno dimostrato che, dopo trattamento con KGF,
la presenza della proteina virale riduce il numero di dots LC3-positivi corrispondenti agli
autofagosomi.
In seguito, per verificare se la capacità inibitoria della proteina E5 sull’autofagia indotta da KGF
fosse correlata alla sua capacità di down-regolare il KGFR, sono stati studiati gli effetti della forzata
modulazione di questo recettore. L’analisi biochimica dei livelli proteici di LC3-II e SQSTM1
hanno dimostrato che la deplezione del recettore, indotta mediante specifico siRNA, e l’espressione
forzata di 16E5 inducono un confrontabile effetto inibitorio sull’autofagia. Al contrario, la forzata
over-espressione del KGFRwt, ma non quella del suo mutante KGFRkin-, in cellule esprimenti
16E5 è risultata in grado di contrastare l’effetto inibitorio della proteina virale sull’autofagia.
Infine, per verificare se la proteina 16E5 potesse ricoprire un più generico ruolo sull’inibizione
dell’autofagia, sono stati studiati i possibili effetti della sua espressione su cellule HaCaT soggette
alla privazione di siero, stimolo autofagico nel quale il contributo del signaling del KGFR è escluso.
L’analisi biochimica dei marker dell’autofagia e approcci d’immunofluorescenza quantitativa hanno
evidenziato che l’espressione della proteina E5 è in grado di contrastare anche l’autofagia indotta
dalla privazione di siero.
Nell’insieme i dati ottenuti durante il 1° anno di dottorato indicano che: i) 16E5 inibisce l’autofagia
indotta dal KGF; ii) l’impatto negativo di 16E5 sull’autofagia KGF-dipendente è dovuto, almeno in
parte, alla sua capacita di down-regolare il KGFR; iii) indipendentemente dal tipo di stimolo che lo
innesca, 16E5 gioca un ruolo generale di interferenza sul processo autofagico.
Roma 24/09/2014
Dottoranda
Dott.ssa Monica Nanni
Docente responsabile della ricerca
Dott.ssa Francesca Belleudi