CHIMICA INORGANICA: nozioni sui principali
elementi del sistema periodico
L’atomo di idrogeno ha un solo orbitale di valenza (1s) occupato
da un solo elettrone e per questo motivo è sistemato nel primo
gruppo come i metalli alcalini con i quali, tuttavia, non ha
alcuna caratteristica comune
Le sue principali caratteristiche sono:
Numero atomico
1
Configurazione elettronica esterna
1s
Numero di ossidazione
1
Energia di ionizzazione
313 kcal mol-1
Affinità elettronica
- 17 kcal mol-1
Elettronegatività
2,2
Energia di dissociazione della molecola
104 kcal mol-1
IDROGENO
In base alle caratteristiche prima elencate possiamo dedurre
che:
- L’elevata energia di ionizzazione indica che l’idrogeno,
mettendo in compartecipazione l’elettrone, forma
principalmente un legame covalente con un altro atomo
oppure acquistando un elettrone (ione idruro H-) può
interagire in modo elettrostatico con ioni di carica positiva
- esiste come molecola H2
- l’elevata energia di dissociazione spiega l’inerzia chimica a
temperatura ambiente
- Il protone libero H+ possiede un rapporto carica/massa
elevato per cui non esiste libero ed in soluzione dà luogo allo
ione idronio (H3O+) formando un legame dativo con l’acqua
- L’affinità elettronica negativa indica che l’idrogeno ha una
certa tendenza ad acquistare elettroni poco legati (ad
esempio con i metalli) formando gli IDRURI nei quali ha n.o. =
-1
IDROGENO
Gli idruri si suddividono in base al legame in:
- IDRURI IONICI
- IDRURI MOLECOLARI
- IDRURI POLIMERI CON ATOMI DI IDROGENO A PONTE
- IDRURI DEGLI ELEMENTI DI TRANSIZIONE
Gli idruri ionici sono quelli con i metalli alcalini e con Ca, Sr e Ba
e sono allo stato SOLIDO
IDROGENO
Gli idruri degli elementi dal gruppo 14 al gruppo 17 sono tutti
costituiti da legami molecolari e sono gassosi ad eccezione
dell’H2O e HF che sono liquidi a T ambiente per le forti
interazioni a ponte di idrogeno
Gli idruri dei gruppi 14 e 15 hanno proprietà acido/base fatta
eccezione dell’NH3 che è una base debole in acqua
L’NH3 è un acido debolissimo ma più forte del CH4 e può cedere
uno ione H+ ad una base molto forte:
NH3 + NaH NH2- + H2
Gli idruri con gli alogeni sono polari e reagiscono con l’acqua
HCl, HBr e HI si sciolgono in acqua ed agiscono da acidi molto
forti
IDROGENO
Nel caso dell’idruro di boro B2H6 si ha la formazione di un
composto particolare
Infatti il B ha configurazione elettronica 1s2,2s2,2p1 e dopo aver
promosso un elettrone dal livello 2s al livello 2p presenta 3
elettroni spaiati e quindi può formare la molecola BH3
Questa molecola tuttavia non rispetta la regola dell’ottetto
essendo elettron-deficiente in quanto il boro ha intorno a sé sei
elettroni e tende a dimerizzare dando luogo al diborano B2H6
che ha una struttura a ponte in cui ciascun atomo di boro è
legato a due atomi di idrogeno detti atomi di idrogeno
terminali; i rimanenti due atomi di idrogeno si trovano a ponte
tra i due atomi di boro:
IDROGENO
Il boro forma molti composti chiamati nel loro insieme BORANI
che presentano un numero variabile di atomi di B e di H ed
hanno struttura molecolare con legame tricentrico ovvero
legami covalenti in cui il doppietto elettronico è esteso su tre
atomi anziché su due
Sono solidi mentre il diborano o idruro di boro è gassoso
Sono polimeri e quindi non molto reattivi ma mantengono
proprietà basiche e riducenti
IDROGENO
Il legame dell’H con Be, Mg, Al e Ga è di natura covalente polare
con l’idrogeno che si pone a ponte tra due atomi in modo
analogo al boro e forma composti covalenti polimeri
Essendo polimeri sono meno reattivi dei
precedenti ma hanno proprietà basiche e
riducenti
IDROGENO
Il legame dell’H con i metalli di transizione porta a composti non
stechiometrici cioè composti chimici la cui composizione
elementale non rispetta le normali leggi stechiometriche quali
la legge delle proporzioni definite e quella delle proporzioni
multiple, quindi la loro formula chimica non può essere
rappresentata in termini di rapporti tra numeri naturali
IDROGENO
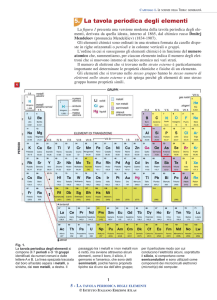
GAS NOBILI
Elemento
He
Ne
Ar
Kr
Xe
Rn
2
10
18
36
54
86
Configurazione
elettronica
esterna
2s2
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
Potenziale di
ionizzazione
(kcal mol-1)
564
497
363
323
280
248
Temperatura
di ebollizione
-268,9
-246,0
-185,7
-152,3
-108,0
-61,8
Temperatura
di fusione
-272,2
-248,7
-189,2
-156,6
-111,9
-71,0
Numero
atomico
Elio e Neon hanno una configurazione che li rende MOLTO
STABILI e gli altri una stabilità discreta ragione per cui si
conoscono pochissimi composti dei gas nobili
GAS NOBILI
Questo è evidenziato dai valori elevati di potenziale di
ionizzazione
GAS NOBILI
METALLI ALCALINI
Elemento
Li
Na
K
Rb
Cs
Fr
Numero
atomico
3
11
19
37
55
87
2s1
3s1
4s1
5s1
6s1
7s1
124,3
118,5
100,1
96,3
89,7
-
Elettronegativi
tà
1
0,9
0,8
0,8
0,7
0,7
Temperatura
di ebollizione
1347
882,9
774
688
678,4
667
Temperatura
di fusione
180,5
97,81
63,65
38,89
28,40
27
Configurazione
elettronica
esterna
Potenziale di
ionizzazione
(kcal mol-1)
METALLI ALCALINI
Rappresentano un gruppo compatto con caratteristiche molto
simili
Il nome deriva dall’arabo «al gali» (potassa)
Hanno configurazione ns1 per cui potenziale di ionizzazione
molto basso e bassa elettronegatività ed elevato potenziale di
seconda ionizzazione
La mobilità elettronica è imputabile esclusivamente ad un
elettrone e ciò determina anche formazione di un legame
metallico molto debole (temperatura di fusione molto bassa)
Cs e Fr sono comunemente allo stato liquido, gli altri solidi ma
molto teneri
Sono forti agenti riducenti in quanto hanno un potenziale
elettrico standard basso e quindi generalmente si ossidano
Ciò determina che si trovino in natura solo sotto forma di
composti
METALLI ALCALINI
I metalli cristallini tendono infatti a reagire con l’umidità
dell’aria a dare idrossidi alcalini molto forti ed ottimi elettroliti
I cationi che si formano in soluzione acquosa sono incolori
sempre per la configurazione elettronica
Reattività e composti
Sono specie chimiche molto reattive e quindi si trovano sulla
terra essenzialmente sotto forma dei loro Sali
Il più diffuso è il cloruro di sodio NaCl
Essi reagiscono con l’acqua per dare idrossidi e idrogeno
gassoso; gli idrossidi sono solidi e si sciolgono completamente in
acqua
METALLI ALCALINI
Si legano all’idrogeno (con n.o. = -1) per dare gli IDRURI (vedi
prima)sono composti solidi, ionici e forti agenti riducenti
Per reazione diretta con l’acqua danno gli idrossidi, che,
tuttavia, si generano anche per reazione dei loro ossidi con
l’acqua
METALLI ALCALINI
Reagiscono facilmente anche con l’ossigeno ma danno composti
diversi a seconda del volume atomico dell’elemento
Il litio si lega all’ossigeno con n.o. +1 e forma Li2O (legame
covalente)
Il sodio forma il perossido Na2O2 (legame ionico)
Potassio, Rubidio e Cesio formano il superossido (in cui
l’ossigeno ha n.o. =-0,5) KO2, RbO2 e CsO2 (legame ionico)
Importanti sono i CARBONATI DI SODIO:
Bicarbonato di sodio (NaHCO3) = utilizzato in medicina
Carbonato di sodio o soda Solvaly (Na2CO3)
METALLI ALCALINI
METALLI ALCALINO-TERROSI
Elemento
Be
Mg
Ca
Sr
Ba
Ra
4
12
20
38
56
88
2s2
3s2
4s2
5s2
6s2
7s2
214,9
176,18
140,9
131,2
120,1
119,2
Elettronegativi
tà
1,5
1,2
1,0
1,0
0,9
0,9
Temperatura
di ebollizione
2970
1090
1484
1384
1640
1700
Temperatura
di fusione
1280
648
840
769
725
700
Numero
atomico
Configurazione
elettronica
esterna
Potenziale di
ionizzazione
(kcal mol-1)
METALLI ALCALINO-TERROSI
Si chiamano alcalino-terrosi perché stanno tra il I (alcalini) ed il
III gruppo (terrosi)
Presentano proprietà compatte dal calcio al bario, affine è il
magnesio, mentre molto diversi sono il berillio ed il radio (che +
addirittura radioattivo)
Il berillio deve le sue caratteristiche alle sue piccole dimensioni
Sono elementi metallici come i precedenti, ma la presenza di
due elettroni di valenza ne accentua l’aspetto metallico (più duri
con temperature di fusione ed ebollizione più elevate)
Anch’essi perdono facilmente un elettrone come gli alcalini, ma
con poco dispendio energetico perdono anche il secondo
elettrone che è di valenza
Come i precedenti i cationi bivalenti sono incolori in soluzione
METALLI ALCALINO-TERROSI
Presentano potenziali redox molto negativi quindi hanno
carattere riducente
Reattività e principali composti
Molti dei composti sono insolubili e meno solubili dei metalli
alcalini
La solubilità aumenta solo con le dimensioni del catione
I composti più comuni sono gli ALOGENURI, i SOLFATI, i NITRATI
ed i CARBONATI degli alcalino-terrosi
Berillio:
Sorosilicato che dà origine, a seconda delle impurezze, allo
smeraldo (cromo e vanadio) e all’acqua marina (Fe2+)
METALLI ALCALINO-TERROSI
Magnesio:
Dolomite (Ca, Mg)CO3
Silicati come il talco Mg3(OH)2(Si2O5)2
Calcio:
Calcite CaCO3
Apatite 3Ca3(PO4)2xCa(F, Cl, OH)2
Gesso CaSO4x2H2O
Silicati
METALLI ALCALINO-TERROSI
Composti più importanti sono:
OSSIDI: tipo MeO
PEROSSIDI: li formano tutti ad eccezione del Be
IDROSSIDI: tipo Me(OH)2
ALOGENURI: tipo MeX2 (dove X=alogeno). Si combinano
direttamente con gli alogeni con legame ionico (ad eccezione
del berillio che forma un legame covalente).
METALLI ALCALINO-TERROSI
METALLI TERROSI
Elemento
B
Al
Ga
In
Ti
Numero
atomico
5
13
31
49
81
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
Potenziale di
ionizzazione
(kcal mol-1)
191
138
138
133
138
Elettronegativi
tà
2,0
1,6
1,6
1,5
1,4
Temperatura
di ebollizione
2550
2467
2400
2000
1460
Temperatura
di fusione
2300
660,2
29,78
156,6
303,5
Configurazione
elettronica
esterna
METALLI TERROSI
Presentano cariche nucleari superiori ai precedenti quindi
hanno dimensioni inferiori ed elettroni di valenza legati molto
più fortemente al nucleo, che determina un carattere metallico
meno spiccato
Addirittura il boro non è neppure un metallo con potenziale di
ionizzazione grande ed elettronegatività molto elevata (simile a
quella dell’idrogeno)
Per questo motivo l’acido borico B(OH)3 è un acido monoprotico
ed il boro non forma composti ionici nemmeno con l’elemento
più elettronegativo come il fluoro
Gli elementi terrosi sono abbastanza reattivi per cui si trovano
in natura sotto forma di composti
L’alluminio metallico è il principale composto della litosfera
Gallio, indio e tallio sono poco abbondanti e hanno scarsa
importanza
METALLI TERROSI
Come prima visto formano idruri con l’idrogeno o polimeri
come nel caso del boro e dell’alluminio, che formano molecole
elettrondeficienti
ESEMPIO: idruro di boro BH3
Il boro ha 6 elettroni di valenza e si ibrida sp2
L’idruro ha forma trigonale ed il boro non
completa l’ottetto (vedi idrogeno)
METALLI TERROSI
BORO
Si trova in natura come borati come la borace (Na2B4O7)
Allo stato standard il boro è un solido covalente molto duro,
lucente come un metallo ma cattivo conduttore
di elettricità
Nell’acido borico B(OH)3, il boro è legato al
gruppo OH-; infatti per le sue dimensioni ridotte
il boro attrae a sé la nuvola elettronica
dell’ossigeno, impedendo agli ioni ossidrile di
passare in soluzione; addirittura la reazione dell’acido borico
con l’acqua è la seguente:
B(OH)3 + H2O B(OH)4- + H+
Si comporta come un acido di Lewis e l’acqua rappresenta la
base
METALLI TERROSI
ALLUMINIO
Si trova in natura come silicati complessi dai quali non è
economico estrarre l’alluminio
L’alluminio è un metallo argenteo, leggero, tenero e buon
conduttore di elettricità e calore
METALLI TERROSI
IL GRUPPO DEL CARBONIO
Elemento
C
Si
Ge
Sn
Pb
Numero
atomico
6
14
32
50
82
Configurazione
elettronica
esterna
2s2p2
3s2p2
4s2p2
5s2p2
6s2p2
Potenziale di
ionizzazione
(kcal mol-1)
259,6
187,9
182,1
169,3
170,9
Elettronegativi
tà
2,6
1,9
1,9
1,8
1,8
Temperatura
di ebollizione
-
2355
2830
2270
1740
Temperatura
di fusione
3800
1410
937,4
231,9
327,5
GRUPPO DEL CARBONIO
Gli elementi più importanti del gruppo 14 sono il carbonio ed il
silicio
Il primo è il principale costituente dei composti organici alla
base degli organismi viventi mentre il silicio è l’elemento più
abbondante (dopo l’ossigeno) nella litosfera
Questi elementi presentano 4 elettroni di valenza, un graduale
aumento del volume atomico all’aumentare del peso atomico,
ed una graduale riduzione del potenziale di ionizzazione
Per questi motivi sono nettamente non metallici, il germanio è
un semimetallo e lo stagno e il piombo sono metalli
GRUPPO DEL CARBONIO
CARBONIO
Si presenta in tre forme allotropiche diverse: grafite, diamante e
fullerene (si ottengono per riscaldamento in elio della grafite)
Composti molto stabili
GRUPPO DEL CARBONIO
Nel diamante ciascun atomo di carbonio è legato ad altri 4
atomi con legami covalenti con ibridazione sp3
Struttura molto compatta con atomi molto legati tra loro ed
elettroni localizzati in coppie fisse
Il diamante è molto duro e fonde a T
molto alte ma conduce bene calore
e suono per la vibrazione degli
atomi rispetto alle posizioni
di equilibrio
GRUPPO DEL CARBONIO
Nella grafite invece ogni atomo di carbonio è ibridato sp2 e si
lega quindi con un legame di tipo ad altre 3 atomi di carbonio
Si utilizzano quindi solo 3 degli elettroni di valenza e l’elettrone
residuo si trova sull’orbitale pz, che possono sovrapporsi per
formare un ulteriore legame
si formano anelli esagonali ai cui vertici si
trovano atomi di carbonio e sopra e sotto
il piano le nuvole elettroniche delocalizzate
degli orbitali pz sovrapposti
GRUPPO DEL CARBONIO
La struttura risultante nella grafite
è a piani con i diversi strati legati tra
loro attraverso forze di Van der
Walls
La grafite è una sostanza leggera, tenera e sfaldabile anche se
altofondente
Buon conduttore di elettricità per l’elettrone mobile anche se
solo nei sensi dei piani del carbonio
I minerali in cui è presente una notevole quantità di carbonio
sono: la torba (circa 50% di C), la lignite e l’antracite
GRUPPO DEL CARBONIO
COMPOSTI DEL CARBONIO E DEL SILICIO
Il carbonio forma con l’ossigeno il monossido (CO) ed il biossido
(CO2)
Il primo è un gas incolore ed inodore molto velenoso e si genera
per combustione del carbonio e sostanze organiche in difetto di
ossigeno
Il biossido è un gas incolore, di odore e sapore leggermente
frizzanti, moderatamente solubile in acqua
L’ossido di silico (SiO2) cioè la sabbia è solida allo stato standard
in quanto il silicio non è in grado di stabilire legami a causa
delle sue dimensioni ragion per cui il legame nella silice è
singolo
Da ciò ne deriva che sull’ossigeno si localizzano ben 3 doppietti
solitari mentre sul silicio rimangono due orbitali vuoti
GRUPPO DEL CARBONIO
La silice è quindi costituita da un reticolo indefinito tenuto
assieme da legami dativi tra l’ossigeno di una molecola
(donatore del doppietto) ed il silicio di un’altra
Ciò è la spiegazione della natura solida della silice rispetto a
quella del biossido di carbonio
GRUPPO DEL CARBONIO
IL GRUPPO DELL’AZOTO
Elemento
N
P
As
Sb
Bi
Numero
atomico
7
15
33
51
83
Configurazione
elettronica
esterna
2s2p3
3s2p3
4s2p3
5s2p3
6s2p3
Potenziale di
ionizzazione
(kcal mol-1)
335,1
241,8
226,2
199,2
168,3
Elettronegativi
tà
3,05
2,75
2,0
1,9
1,8
Temperatura
di ebollizione
-195,8
280
613
1750
1560
Temperatura
di fusione
-209,86
44,1
814,5
630,7
271,3
GRUPPO DELL’AZOTO
Gli elementi del gruppo 15 sono caratterizzati da una riduzione
dell’elettronegatività all’aumentare del numero atomico e
quindi il loro carattere varia dal non metallico al metallico
Infatti, l’azoto è un non metallo gassoso, il fosforo è un non
metallo solido, l’arsenico e l’antimonio sono semimetalli ed il
bismuto può essere considerato un metallo
Hanno tutti 5 elettroni di valenza con i n.o. che variano da -3 a
+5
Tutti, ad eccezione dell’azoto, possono espandere l’ottetto
avendo a disposizione gli orbitali nd liberi
L’azoto può ibridarsi a sp3 formando al massimo 3 legami, ma, a
differenza degli altri, per le sue dimensioni ridotte, può formare
anche legami doppi e tripli (come l’azoto molecolare N2)
GRUPPO DELL’AZOTO
Il fosforo si trova più comunemente in forme tetramere P4
(fosforo bianco) in cui ciascun fosforo è
legato ad altri 3atomi di fosforo ed ha
un doppietto libero
Le molecole di fosforo risultano legate da
Interazioni di Van der Walls, per cui
È bassofondente e molto reattivo
Un’altra forma allotropica del fosforo (non esistente in natura)
è il fosforo rosso, costituito da catene polimeriche Px
La forma più stabile è il fosforo nero
formato da strati di atomi di fosforo
uniti secondo legami covalenti
semplici in anelli esagonali
(fosforo ibridato sp3)
GRUPPO DELL’AZOTO
Composti
Azoto e fosforo che presentano elettronegatività elevata
reagiscono ad alte T con alcalini e alcalino-terrosi per dare
nitruri e fosfuri ionici, mentre con il boro formano composti
covalenti
Con l’idrogeno formano gli idruri:
NH3 = ammoniaca
PH3 = fosfina
AsH3 = arsina
SbH3 = stibina
BiH3 bismutina
Sono sostanze gassose covalenti in cui ciascun legame è singolo
Avendo tutte un doppietto libero si comportano da basi di Lewis
GRUPPO DELL’AZOTO
L’azoto si lega anche all’ossigeno con i numeri di ossidazione
positivi per dare:
N2O = protossido di azoto (n.o.=+1)
NO = ossido di azoto (n.o.=+2) (radicale in quanto l’azoto non
completa l’ottetto)
N2O3 = anidride nitrosa o triossido di azoto (n.o.=+3)
NO2 = biossido di azoto o ipoazotide (n.o.=+4)
N2O5 = anidride nitrica (n.o.=+5)
Il composto più importante è l’acido nitrico HNO3
GRUPPO DELL’AZOTO
Il fosforo si lega anche all’ossigeno con i numeri di ossidazione
positivi per dare:
P2O3 = anidride fosforosa (n.o.=+3)
P2O5 = anidride fosforica (n.o.=+5)
Le anidridi danno luogo ad acidi reagendo con una, due o tre
molecole di acqua
L’acido più importante è l’acido fosforoso H3PO3
GRUPPO DELL’AZOTO
IL GRUPPO DEI CALCOGENI
Elemento
O
S
Se
Te
Po
Numero
atomico
8
16
34
52
84
Configurazione
elettronica
esterna
2s2p4
3s2p4
4s2p4
5s2p4
6s2p4
Potenziale di
ionizzazione
(kcal mol-1)
314,0
238,8
224,8
207,7
194,2
Elettronegativi
tà
3,5
2,6
2,5
2,0
1,8
Temperatura
di ebollizione
-182,96
444,7
684
1390
962
Temperatura
di fusione
-218,4
112,8
217
450
254
GRUPPO DEI CALCOGENI
Nell’ambito degli elementi del gruppo 16 (calcogeni oramai in
disuso) si differenzia molto l’ossigeno ed è l’elemento più
diffuso sulla crosta terrestre (50% in peso)
Lo zolfo è 1000 volte meno abbondante mentre selenio e
tellurio sono molto scarsi
Hanno 6 elettroni di valenza per cui possono formare legami
acquistando 2 elettroni
Ad eccezione dell’ossigeno, hanno n.o. 2, 4 e 6
Hanno elevata elettronegatività per cui non sono metallici
(anche se Se e Te hanno aspetto metallico)
GRUPPO DEI CALCOGENI
OSSIGENO
E’ un gas incolore ed insapore
Nella maggior parte dei composti ha n.o. -2 e per completare
l’ottetto può acquistare 2 elettroni
I composti binari si definiscono OSSIDI che se legati a elementi
non metallici si definiscono anche ANIDRIDI che reagendo con
l’acqua danno origine agli OSSIACIDI
Gli ossidi con i metalli in acqua originano gli IDROSSIDI
PEROSSIDI sono i composti caratterizzati da due atomi di
ossigeno legati tra loro(l’ossigeno ha n.o. = -1)
Il composto più importante dell’ossigeno è indubbiamente
l’acqua, solvente per eccellenza negli organismi viventi
Infine un’altra forma allotropica dell’ossigeno è l’ozono (O3)
GRUPPO DEI CALCOGENI
ZOLFO
Esiste in varie forme allotropiche (circa 30) ed è presente nella
pirite (FeS2), nella galena (PbS), come solfato di calcio o
magnesio anche se i suoi composti più importanti sono l’acido
solforico e sulfidrico
Reagisce anche con l’ossigeno con cui forma il biossido (SO2) ed
il triossido (SO3) di zolfo
GRUPPO DEI CALCOGENI
GLI ALOGENI
Elemento
F
Cl
Br
I
At
Numero
atomico
9
17
35
53
85
Configurazione
elettronica
esterna
2s2p5
3s2p5
4s2p5
5s2p5
6s2p5
Potenziale di
ionizzazione
(kcal mol-1)
401,7
299,0
272,4
240,9
207,5
Elettronegativi
tà
4
3,15
2,85
2,65
2,20
Temperatura
di ebollizione
-188,14
-34,01
59,47
184,35
337
Temperatura
di fusione
-219,62
-100,98
-7,2
113,5
302
ALOGENI
Gli elementi del gruppo 17 hanno 7 elettroni di valenza e
tendono ad acquistare un elettrone per raggiungere l’ottetto
Affinità elettronica elevata e quindi carattere non metallico che
compaiono solo nello iodio per l’elevato volume atomico
Formano legami ionici (acquistando un elettrone) oppure
formare legami covalenti singoli (formano molecole biatomiche)
Possono legarsi anche ai non metalli (esempio CCl4)
Il fluoro (elemento più elettronegativo) può formare solo
composti con n.o. = -1, gli altri alogeni oltre a n.o. = -1 hanno
anche n.o. = 1, 3, 5 e 7
Si trovano in natura solo come alogenuri
ALOGENI