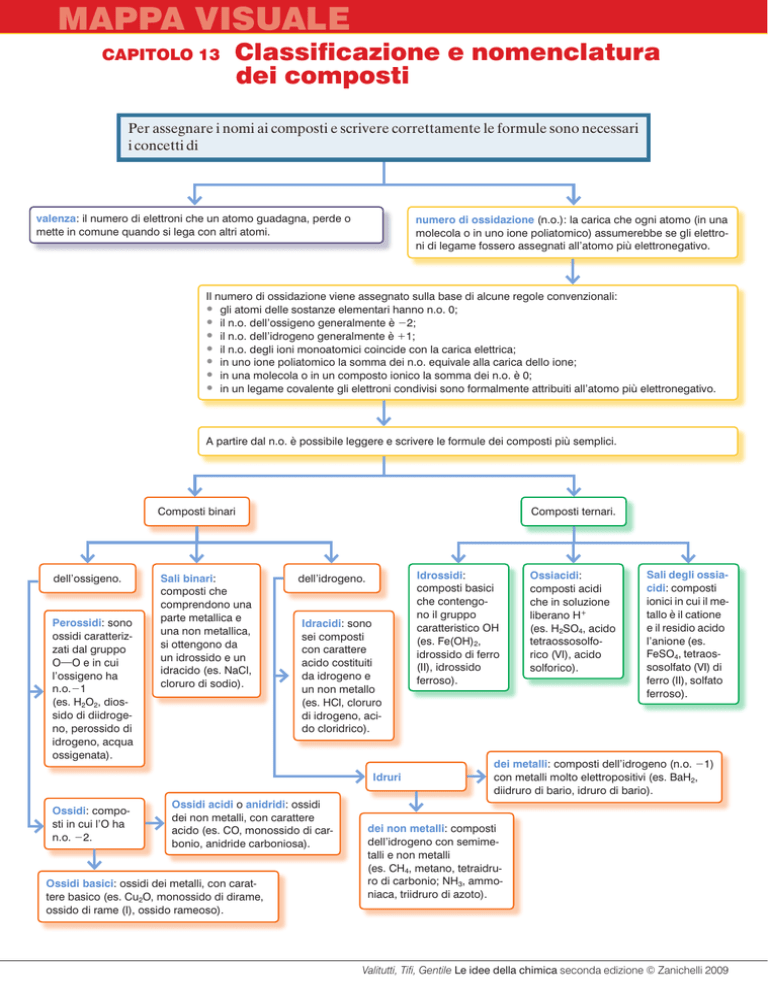
Mappa visuale
Capitolo 13
Classificazione
e nomenclatura
dei composti
Per assegnare i nomi ai composti e scrivere correttamente le formule sono necessari
i concetti di
valenza: il numero di elettroni che un atomo guadagna, perde o
mette in comune quando si lega con altri atomi.
numero di ossidazione (n.o.): la carica che ogni atomo (in una
molecola o in uno ione poliatomico) assumerebbe se gli elettroni di legame fossero assegnati all’atomo più elettronegativo.
Il numero di ossidazione viene assegnato sulla base di alcune regole convenzionali:
• gli atomi delle sostanze elementari hanno n.o. 0;
• il n.o. dell’ossigeno generalmente è 22;
• il n.o. dell’idrogeno generalmente è 11;
• il n.o. degli ioni monoatomici coincide con la carica elettrica;
• in uno ione poliatomico la somma dei n.o. equivale alla carica dello ione;
• in una molecola o in un composto ionico la somma dei n.o. è 0;
• in un legame covalente gli elettroni condivisi sono formalmente attribuiti all’atomo più elettronegativo.
A partire dal n.o. è possibile leggere e scrivere le formule dei composti più semplici.
Composti binari
dell’ossigeno.
Perossidi: sono
ossidi caratterizzati dal gruppo
O9O e in cui
l’ossigeno ha
n.o.21
(es. H2O2, diossido di diidrogeno, perossido di
idrogeno, acqua
ossigenata).
Sali binari:
composti che
comprendono una
parte metallica e
una non metallica,
si ottengono da
un idrossido e un
idracido (es. NaCl,
cloruro di sodio).
Composti ternari.
dell’idrogeno.
Idracidi: sono
sei composti
con carattere
acido costituiti
da idrogeno e
un non metallo
(es. HCl, cloruro
di idrogeno, acido cloridrico).
Idruri
Ossidi: composti in cui l’O ha
n.o. 22.
Ossidi acidi o anidridi: ossidi
dei non metalli, con carattere
acido (es. CO, monossido di carbonio, anidride carboniosa).
Ossidi basici: ossidi dei metalli, con carattere basico (es. Cu2O, monossido di dirame,
ossido di rame (I), ossido rameoso).
Idrossidi:
composti basici
che contengono il gruppo
caratteristico OH
(es. Fe(OH)2,
idrossido di ferro
(II), idrossido
ferroso).
Ossiacidi:
composti acidi
che in soluzione
liberano H+
(es. H2SO4, acido
tetraossosolforico (VI), acido
solforico).
Sali degli ossiacidi: composti
ionici in cui il metallo è il catione
e il residio acido
l’anione (es.
FeSO4, tetraossosolfato (VI) di
ferro (II), solfato
ferroso).
dei metalli: composti dell’idrogeno (n.o. 21)
con metalli molto elettropositivi (es. BaH2,
diidruro di bario, idruro di bario).
dei non metalli: composti
dell’idrogeno con semimetalli e non metalli
(es. CH4, metano, tetraidruro di carbonio; NH3, ammoniaca, triidruro di azoto).
Valitutti, Tifi, Gentile Le idee della chimica seconda edizione © Zanichelli 2009












