METABOLISMO LIPIDICO
I LIPIDI
FUNZIONI GENERALI DEI LIPIDI
Ø Funzione energetica: forniscono 9 Kcal/gr
Ø Funzione ormonale (ormoni steroidei) e di messaggeri intracellulari
Ø Funzione termica: mantenimento della temperatura corporea costante
attraverso isolamento termico svolto dal tessuto adiposo sottocutaneo
Ø Funzione meccanica: protezione degli organi interni
Ø Funzione strutturale: costituzione e mantenimento delle membrane cellulari e
subcellulari
Funzione dei lipidi alimentari
Ø Funzione di veicolo: le vitamine liposolubili (funzione coenzimatica e funzione
regolatrice) possono essere assorbite ed utilizzate solo in presenza di lipidi
Ø Apporto di acidi grassi essenziali che altrimenti non potrebbero essere
sintetizzati dall’organismo
Ø Producono senso di sazietà in quanto la loro digestione richiede un certo tempo
Metabolismo lipidico ---à Funzione energetica
La struttura delle classi
più comuni di lipidi
CH3 – (CH2)n – COO-
Gli acidi grassi
insaturi
In un uomo di 70 Kg
~15 Kg (~20% del peso) sono sotto forma di TRIGLICERIDI
15 Kg TRIGLICERIDI
~ 140000 Kcal (~ 9 Kcal/gr )
se il fabbisogno energetico è di ~ 2000 Kcal/die
140000Kcal
~ 70 giorni
N.B.
• I grassi sono ANIDRI essendo estremamente APOLARI, mentre il
glicogeno lega ~2gr H2O/gr
• gli atomi di carbonio hanno un livello maggiore di riduzione rispetto
a quelli presenti nei carboidrati o negli aminoacidi.
Gli acidi grassi derivano da tre fonti
principali:
(1) l’ alimentazione (60-150gr lipidi/die,
rappresentano circa il 30-35% dell’apporto
calorico)
(2) la biosintesi ex-novo
(3) la mobilizzazione dai trigliceridi
accumulati negli adipociti
L’ alimentazione (60-150gr
lipidi/die, rappresentano
circa il 30-35% dell’apporto
calorico)
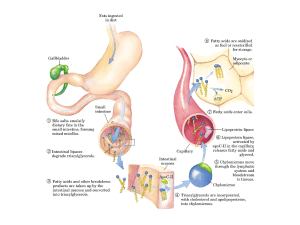
Chilomicroni contengono il
98% di lipidi, trasportano
triacilgliceroli e colesterolo
di origine alimentare
dall’intestino ai tessuti
periferici
LIPOTROTEINE PLASMATICHE
Differiscono per la composizione
lipidica e proteica, per le
dimensioni e per la densità ed
hanno la funzione di mantenere i
lipidi in una forma solubile
durante il trasporto nel sangue e
di offrire un meccanismo di
trasporto efficiente del loro
contenuto lipidico da un tessuto
ad un altro
N.B. Gli acidi grassi a catena
carboniosa non superiore a
8-10C non vengono riesterificati
ma direttamente riversati nel
torrente sanguigno e veicolati
dall’ ALBUMINA al fegato
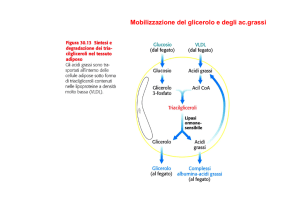
La mobilizzazione dai
trigliceridi accumulati negli
adipociti
Regolazione ormonale della
degradazione dei
triacilgliceroli (TAG) al
livello del TESSUTO
ADIPOSO (LIPOLISI)
Controllo ormonale:
Favorita da glucagone
(digiuno), epinefrina,
ACTH (attività fisica),
metilxantina (caffè);
Inibita da insulina e alti
livelli di glicemia
STRYER
ADIPOCITA
glucagone, adrenalina
albumina-acidi grassi
lipasi ormone-sensibile
Û glucagone
Ü insulina
Gli acidi grassi nel metabolismo umano
• Vengono generati dai grassi introdotti con la dieta ad opera di enzimi
denominati LIPASI
• Nei mitocondri sono ossidati (BETA OSSIDAZIONE) a CO2 e H2O,
con demolizione della catena alchilica accorciata di due atomi di C per
volta.
• Possono essere sintetizzati dall’organismo a partire dall’unità basilare
(acido acetico)
1. Trasporto all’interno delle cellule mediante molecole trasportatrici
2. Nella cellula sono presenti delle proteine che legano gli acidi grassi
3.
Acido Grasso + ATP + CoA
acil ∼ SCoA + AMP + PPi
Acil-CoA SINTETASI o LIGASI
• presente nel R.E. e sul lato esterno della M.M.E
• forme isoenzimatiche per acidi grassi a corta, media o lunga catena
• la formazione degli acil-CoA è resa favorevole dall’idrolisi di due legami
ad alta energia dell’ATP
CATABOLISMO degli ACIDI GRASSI
ATTIVAZIONE (citoplasma)
richiede
- ATP
- Coenzima A (CoASH) (vitamina: acido pantotenico)
palmitato + ATP g palmitil ~ AMP + CoASH g palmitil~CoA
TRASPORTO NEL MITOCONDRIO
carnitina
CH3
OH
esteri di acidi grassi
acil~carnitina
CH3 – N+ – CH2 – CH – CH2 – COO–
CH3
β-OSSIDAZIONE
(matrice mitocondriale)
Da lisina, metionina
4. Ingresso degli acidi grassi nei mitocondri attraverso il
trasportatore acil-carnitina/carnitina
CAT II
CAT I
Malonil-CoA
CoA citosolico
CoA mitocondriale
Funzione energetica: Metabolismo lipidico
coinvolge flavoproteine
ETF flavoproteina di
trasferimento degli
elettroni
GLUCOSIO
i
2 PIRUVATO
i
2 ACETIL-CoA
2 x
1 ciclo di Krebs
3 NADH + H+
1 FADH2
1 GTP
2 NADH
2 ATP
5 ATP
2 NADH
5 ATP
10
2 x
7,5 ATP
1,5 ATP
1
ATP
PALMITATO
i
8 ACETIL-CoA
i
8 cicli di Krebs
i
80 ATP
ATP
20 ATP
TOT 32 ATP
attivazione
7 FADH
7 NADH
x 1,5 ATP = 10,5
x 2,5 ATP = 17,5
+ 8 Ciclo di Krebs
-2 ATP
tot = 28
80 ATP
TOT 106 ATP
N.B. Una volta che gli acidi grassi sono entrati nel
mitocondrio il processo di β-ossidazione è controllata
principalmente da:
-
Alta [AcetilCoA]
• attività della catena respiratoria
• disponibilità di CoA
Alto [NADH]/[NAD+]
L’adattamento dell’organismo al
digiuno costituisce uno degli esempi più
tipici di adattamento metabolico.
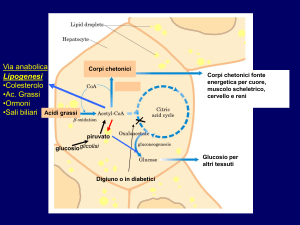
CORPI
CHETONICI
Ü glucosio Ù DIGIUNO
Ü insulina
PIRUVATO
produzione di NADH e ATP
β ossid. ACIDI
GRASSI
PIRUVATO
mitocondrio
CICLO DI
KREBS
CH3CO~SCoA
-
+
CORPI
CHETONICI
-
utilizzo di NADPH e ATP
Biosintesi COLESTEROLO
Biosintesi ACIDI GRASSI
CHETOGENESIeCORPICHETONICI
-compos(acidi(pK~4)
- metaboli(idrosolubilidegliacidigrassi(nonnecessitanodi
trasportatoriema(ci)
- captazioneindipendentedall’insulina
ACETOACETATO
CH3-CO-CH2-COO-
β-IDROSSIBUTIRRATO
CH3-CHOH-CH2-COO-
maggiorcomponente
Interconver/biliadoperadideidrogenasi decarbossilazionelentaespontaneaACETONE CH3-CO-CH3
Sintesi dei CORPI CHETONICI,
processo esclusivamente
EPATICO (matrice mitocondriale)
Reazione di condensazione favorita
dalla elevata concentrazione di
AcetilCoA
tiolasi
Avviene ogni volta che c’è una
extra produzione di acetil-CoA
(principalmente dovuto ad un
aumento della β-ossidazione)
rispetto alla capacità operativa del
ciclo citrico (minore disponibilità di
ossalacetato utilizzato nella
gluconeogenesi)
Ruolo della
CHETOGENESI:
• la sintesi dei corpi chetonici
consente al FEGATO di
liberare CoA (consentendo di
continuare l’ossidazione degli
acidi grassi)
• sintesi di substrati solubili,
ricchi di energia
trasportabili nel plasma a
tessuti extraepatici
KM molto alta
Spontanea
o
Associato alla m.m.i.
Il rapporto tra
idrossibutirrato e
acetoacetato dipende dal
rapporto NADH/NAD+
presente nei mitocondri
Utilizzo dei CORPI CHETONICI nei
TESSUTI PERIFERICI (metabolismo
mitocondriale):
• Muscolo (cardiaco e scheletrico)
• Intestino
• Corteccia renale
• Testicoli
• Cervello (nel digiuno prolungato)
Assente nel fegato *
N.B. L’attività degli enzimi del ciclo
citrico nel miocardio è estremamente
più elevata di quelli epatici
CICLO DI KREBS
Formazione dei corpi chetonici
Ø DIGIUNO PROLUNGATO
Ø DIETA RICCA IN PROTEINE E/O GRASSI E PRIVA
DI CARBOIDRATI (DIETA CHETOGENICA)
Ø ESERCIZIO PROLUNGATO
STATO PATOLOGICO per Carenza di insulina
Chetosi diabetica - diabete insulino-dipendente
FORMAZIONE EPATICA (matrice mitocondriale)
velocità di formazione direttamente proporzionale alla velocità
della β-ossidazione
UTILIZZO soltanto EXTRAEPATICO: ossidati a CO2 e H2O
- sistema nervoso centrale
- muscolo cardiaco
- muscolo scheletrico
il fegato manca dell’enzima
succinil~CoA 3chetoacido transferasi
per l’attivazione dell’acetoacetato ad acetoacetilCoA
Formazione ed esportazione dei corpi chetonici
Le condizioni che
determinano un aumento
della gluconeogenesi,
(diabete non controllato,
diete troppo rigide e digiuno)
rallentano il flusso dei
metaboliti nel ciclo citrico ed
esaltano la conversione di
acetil-CoA in acetoacetato.
LIVELLI EMATICI
glucosio
5,5 mM a digiuno notturno
3,5 mM nel digiuno prolungato
corpi chetonici
0,01 mM stato di alimentazione
0,1 mM dopo il digiuno notturno
2 mM dopo tre giorni di digiuno
5 mM digiuno prolungato
acidi grassi-albumina
0,5 mM
2 mM nel digiuno
Gli adattamenti metabolici al digiuno sono continui ma si possono
schematicamente suddividere in diversi periodi in base al tipo di
substrato energetico maggiormente usato
Digiuno fisiologico notturno
Digiuno prolungato
Prima fase inizia 10-12 ore dall’ultimo pasto ed occupa le due
giornate dall’ultimo pasto
Seconda fase dura circa 3 settimane
Terza fase che si protrae fino ad esaurimento delle scorte
lipidiche
Fasi del digiuno in base alle modalità di approvvigionamento di glucosio
FASEDI
ADATTAMENTO
ALDIGIUNO
SINTESI DEI CORPI CHETONICI
A seguito del processo di beta ossidazione nel fegato
possono formarsi quantità di acetil-CoA in eccesso rispetto
alle capacità di smaltimento del ciclo di Krebs:
in queste condizioni l'acetil-CoA viene utilizzato nel
mitocondrio per la sintesi dei corpi chetonici
(acetoacetato, beta-idrossibutirato ed acetone).
ASPETTI CLINICI
Pochi corpi chetonici sono prodotti in condizioni di normale dieta.
Se la dieta è povera di carboidrati, il fegato produce corpi
chetonici utilizzando l'acetil-CoA derivato dalla ossidazione degli
acidi grassi.
Livelli maggiori di corpi chetonici sono prodotti durante il digiuno
prolungato.
Chetoacidosi diabetica. Nel soggetto diabetico la bassa
concentrazione di glucosio nelle cellule dovuta ai bassi livelli di
insulina in circolo fa si che il fegato produca molti corpi chetonici
-------> acidosi.
Biosintesi “ex novo” degli acidi grassi
La sintesi degli acidi grassi
avviene prevalentemente nel
FEGATO (formazione di
trigliceridi e fosfolipidi-----à
VLDL), nella GHIANDOLA
MAMMARIA durante la
lattazione e, in misura minore,
nel TESSUTO ADIPOSO
Processo che si attua in
condizioni ipercaloriche,
abbondanza di nutrienti
(carboidrati e proteine),
condizione caratterizzata da un
alto rapporto insulina/glucagone.
Il vantaggio di questa via
anabolica consiste nella
possibilità di depositare energia
metabolica ogni qual volta i livelli
energetici intracellulari sono
elevati
Acil-Coenzima A ----à β-ossidazione
Coenzima A
ACP
Acil-ACP ----à sintesi acidi grassi
La sintesi degli acidi grassi avviene nel CITOSOL
8 acetyl-CoA + 7 ATP + 14 NADPH + 14H+---- à palmitate + 14 NADP+ + 8 CoA + 7 ADP + 7 Pi
Sistema di trasporto dei gruppi
acetili dai mitocondri al citosol
•
•
•
•
L’acetil CoA mitocondriale si forma in
seguito a :
Ossidazione del piruvato glicolitico
Catabolismo degli acidi grassi
Catabolismo dei corpi chetonici
Catabolismo degli aminoacidi
chetogenici
Il citrato trasporta dai
mitocondri al citosol i gruppi
acetile che vengono usati per
la sintesi degli acidi grassi
Inibizione
Attivazione
REGOLAZIONE DEL
CICLO DI KREBS
Destino del citrato a livello citosolico
Aminoacidi
(in eccesso della dieta)
KM per il citrato = 2-3mM
ATP Citrate Liasi:
Citrato + ATP + CoA --à
OAA + AcetilCoA + ADP + Pi
Citrato sintasi
Malato
deidrogenasi
Piruvato
carbossilasi
Enzima malico
CO2
BIOSINTESI acidi Grassi
“Ex novo”
Tu ora ti trovi qui…..
…..nel citosol
Acetil-CoA Carbossilasi
Acetil-CoA + HCO3- + ATP à malonil-CoA + ADP + Pi
• Reazione irreversibile
• Tappa limitante
• Tappa di regolazione
L’acido grasso sintasi
• In E. Coli è un complesso
multienzimatico costituito da ACP e sei
enzimi
• Negli animali, è costituita da due
subunità ciascuna multifunzione
Gruppo -SH della fosfopanteteina, gruppo
prostetico legato covalentemente al gruppo
ossidrilico di un residuo di Serina dell’ACP
Gruppo -SH di un residuo di
cisteina della
β-chetoacil-ACP
sintasi (enzima condensante)
β-chetoacilACP sintasi
β-chetobutirril-ACP
(Acetoacetil-ACP)
β-mercaptoetilammina
β-chetoacil-ACP
reduttasi
β-idrossiacil-ACP
deidratasi
enoil-ACP
reduttasi
D-β-idrossibutirril-ACP
trans-Δ2-Butenil-ACP
Butirril-ACP
Acetiltransferasi
Malonil-transferasi
Alla fine del processo biosintetico il palmitato viene staccato dall’
ACP per azione di una attività idrolitica presente nel complesso
della sintasi
β-chetoacilACP sintasi
Regolazione del metabolismo dei lipidi