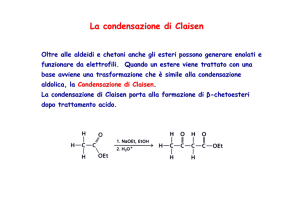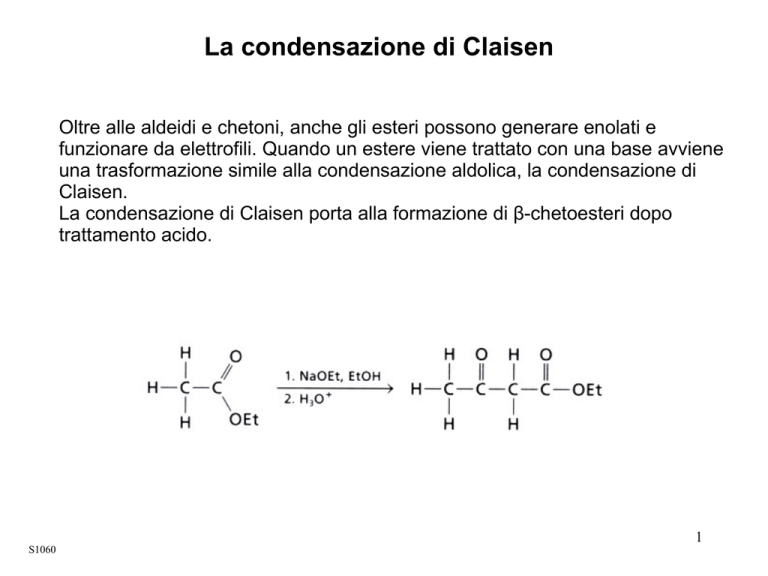
La condensazione di Claisen
Oltre alle aldeidi e chetoni, anche gli esteri possono generare enolati e
funzionare da elettrofili. Quando un estere viene trattato con una base avviene
una trasformazione simile alla condensazione aldolica, la condensazione di
Claisen.
La condensazione di Claisen porta alla formazione di β-chetoesteri dopo
trattamento acido.
S1060
1
La condensazione di Claisen
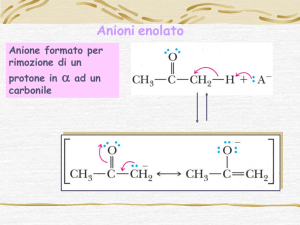
Il meccanismo è simile a quello delle condensazioni aldoliche, ma vi
sono alcune differenze:
Bassa concentrazione dell’enolato (pKa ≈ 24)
L’enolato reagisce con un’altra molecola di estere portando ad un intermedio
tetraedrico
S1060
2
La condensazione di Claisen
La funzione carbonilica viene rigenerata con l’uscita di un gruppo etilato
La reazione sembrerebbe fermarsi qui. Invece, poiché il composto che si è
formato ha un metilene attivato, nelle condizioni di reazione la base è in grado
di deprotonarlo nuovamente generando un nuovo enolato, altamente
stabilizzato.
Perchè questa reazione avvenga deve essere presente almeno 1 eq di base.
Questa è un’altra differenza rispetto alla condensazione aldolica, per la quale è
richiesta solamente una quantità catalitica di base.
S1060
3
La condensazione di Claisen
Dopo trattamento acido si ottiene il β-chetoestere:
Se il reagente è l’acetato di etile, questa reazione viene chiamata
condensazione acetoacetica o sintesi acetoacetica
Nella condensazione di Claisen, la formazione dell’enolato stabilizzato
per risonanza permette di spostare l’equilibrio di reazione a destra
S1061
4
Meccanismo della condensazione di Claisen
La deprotonazione dell’intermedio C
in ambiente basico è irreversibile e
quindi porta alla conversione
completa in D. Solo in ambiente
acido si riesce ad ottenere C come
prodotto finale
5
Condensazione di Claisen: Retro Claisen
Tutti i passaggi della condensazione di Claisen sono processi di equilibrio; la
formazione di un dicarbonil enolato porta la reazione a completamento. Se
questo processo non può avvenire, allora l’equilibrio favorisce i reagenti.
Etile isobutirrato vs. etile acetato
S1061-2
6
Retro Claisen
In presenza di ioni EtO- si ha un ulteriore attacco nucleofilo al centro
carbonilico anzichè deprotonazione e la reazione torna indietro, oppure si ha la
formazione di un enolato e la reazione procede verso i prodotti
S1062
7
Evitare la retro Claisen
Un metodo per prevenire la retro Claisen è l’utilizzo di basi forti per la
generazione dell’enolato
L’enolato viene quindi trattato con un equivalente di estere o, ancor meglio,
l’acil cloruro corrispondente.
S1062-3
8
Esercizio. Quale sarà il prodotto principale delle seguenti reazioni?
O
H٣ C
CH٣
C
COOEt
CH٣
S1063
9
Ciclizzazione di Dieckmann
Condensazione di Claisen intramolecolare
Il meccanismo è del tutto analogo a quello della condensazione di Claisen:
generazione dell’enolato, formazione dell’intermedio tetraedrico, espulsione del
gruppo uscente, formazione del carbanione stabilizzato per risonanza
S1063
10
Ciclizzazione di Dieckmann
Un trattamento acquoso acido consente di ottenere il prodotto neutro,
nel quale la funzione carbonilica è all’interno dell’anello
S1064
11
Ciclizzazione di Dieckmann
Poiché i β-chetoesteri possono essere facilmente decarbossilati, questa è
una strategia sintetica per ottenere cicloalcanoni
S1064
12
Esercizio: scrivere il meccanismo delle reazioni coinvolte nel seguente
processo
EtO- /EtOH
EtOOC
O
COOEt
COOEt
OEt
COOEt
COOEt
COOEt
COOEt
-O
O
EtO
S1064
O
+ EtO-
H3O+
O
13
Condensazione di Claisen mista
Analogamente alla condensazione aldolica, anche nella condensazione di
Claisen possono essere usati due esteri diversi. La reazione dà risultati
migliori se uno degli esteri non ha idrogeni in α al carbonile
S1064
14
Condensazione di Claisen mista
S1065
15
Condensazione di Claisen mista
Esempi di condensazione di Claisen mista appaiono anche nella ciclizzazione
di Dieckmann, quando una delle funzioni esteree non ha protoni in posizione
α. Questo consente la formazione di un unico prodotto.
Si può ottenere un singolo prodotto anche in presenza di due funzioni esteree
enolizzabili se la reazione è reversibile
S1065
Unico prodotto
16
Condensazione di Claisen mista
Uno dei due prodotti non ha protoni enolizzabili, per cui la retro-Claisen è favorita.
L’equilibrio si sposta verso la formazione del regioisomero 2,6-disostituito.
S1066
17
Condensazione di Claisen mista con chetoni
Nella condensazione di Claisen mista possiamo anche utilizzare un chetone
come partner enolizzabile. I chetoni sono circa 4 ordini di grandezza più acidi
degli esteri, per cui formano l’enolato in modo preferenziale.
Si preferisce utilizzare un estere non enolizzabile, anche se i chetoni
forniscono la reazione di autocondensazione lentamente.
Un’applicazione comune di questa reazione è l’idrossimetilenazione dei
chetoni con etile formiato:
S1067
18
Idrossimetilenazione dei chetoni
Il trattamento acido
fornisce il prodotto, che
esiste principalmente in
forma enolica
S1067-8
19
Esercizio: spiegare i seguenti processi
O
O
O
H
H
- EtOO-
O
OEt
O
HCOOEt
O
O
O
H
H
H
H
H
-O
OEt
H
O
S1068
O
O
H
O
O
20
Condensazione di Claisen mista: carbossilazione
Gli enolati, essendo nucleofili, sono in grado di reagire con CO2. Però,
poiché i composti β-carbossicarbonilici decarbossilano, la reazione è
completamente reversibile
Ci sono diversi modi per superare il problema. Il più semplice è quello di
preparare un estere piuttosto che l’acido stesso, utilizzando l’etile
cloroformiato o il dietil carbonato invece che la CO2.
S1068
21
Condensazione di Claisen mista: carbossilazione
L’idrolisi controllata può portare all’acido, ma la reazione di
decarbossilazione è sempre possibile
S1069
22
Reazione di Knoevenagel
Una variante della condensazione aldolica nella quale il nucleofilo è la
base coniugata di un composto con metileni attivi
Il prodotto è un alchene che contiene due gruppi accettori geminali
La reazione avviene in condizioni debolmente basiche (basi
organiche quali la piperidina) o neutre (acetato di piperidinio)
S1091 (es. 21.27)
23
Reazione di Knoevenagel: meccanismo
24
Reazione di Knoevenagel: prodotti di reazione
25
Reazione di Henry
Una variante della condensazione aldolica nella quale il nucleofilo è la
base coniugata di un nitroalcano (pKa < 10)
Meccanismo
S1091 (es. 21.26)
26
Reazione di Perkin
Una condensazione aldolica mista tra un’aldeide e un’anidride di un acido
carbossilico in presenza di una base debole, per esempio la base coniugata
dell’acido carbossilico corrispondente. Porta ad un acido α,β-insaturo
L’enolato dell’anidride reagisce con l’aldeide. La presenza del gruppo
carbonilico dell’anidride a 6 atomi di distanza dall’alcolato porta a una reazione
di acilazione intramolecolare
S1094 (es. 21.36); C705
27
Reazione di Perkin
Acilazione
intramolecolare
Il carbossilato è il miglior gruppo uscente
La perdita di acido acetico porta alla formazione del derivato α,β-insaturo
C705
28
Reazione di Darzens
La reazione di Darzens è una condensazione aldolica mista tra un’aldeide e
l’enolato di un estere di un acido α-alocarbossilico, seguita da una reazione
SN2 intramolecolare. Porta alla formazione di epossidi.
Proporre un meccanismo.
CHO
OH
COOEt
EtOCl
CH2
Cl
COOEt
CH
COOEt
H
Cl
H
O
COOEt
H
S1094 (es. 21.37)
29
Riepilogo
Condensazione di Claisen: 2 mol. estere β-chetoestere
Bassa concentrazione di enolato, 1 equiv. di base
EtONa/EtOH
2
H3C
COOEt
O
O
H3C
C
CH
H3C
COOEt
C
CH2
COOEt
Reaz. reversibile: equilibrio spostato a dx per deprotonazione, altrimenti retro
Claisen
CH3
EtONa/EtOH
2
H
C
O
CH3
C
C
C
COOEt
H
CH3
CH3
CH3
COOEt
CH3
Per effettuare la condensazione in tali casi, usare base forte per generare
l’enolato con estere o alogenuro acilico
Ciclizzazione di Dieckmann: variante intramolecolare (β-chetoestere ciclico)
30
Riepilogo
Condensazione di Claisen mista: per regioselettività usare un
componente non enolizzabile
Chetone + HCOOEt idrossimetilenazione
O
O
O
H
HCOOEt
CHOH
CHO
Carbossilazione degli enolati: chetone β-chetoacido
con CO2 reazione reversibile
Possibile con equivalenti come ClCOOEt o CO(OEt)2
31
Riepilogo
Reazione di Knoevenagel: variante della cond. aldolica
Aldeide + metilene attivato alchene con 2 gruppi accettori geminali
CHO
COOEt
+ CH2(COOEt)2
COOEt
Reazione di Henry
Aldeide + nitroalcano nitroalchene
CHO
NO2
+ CH3NO2
32
Riepilogo
Reazione di Perkin
Aldeide + anidride acido α,β-insaturo
Reazione di Darzens
Aldeide + α-alocarbossilato epossido
33