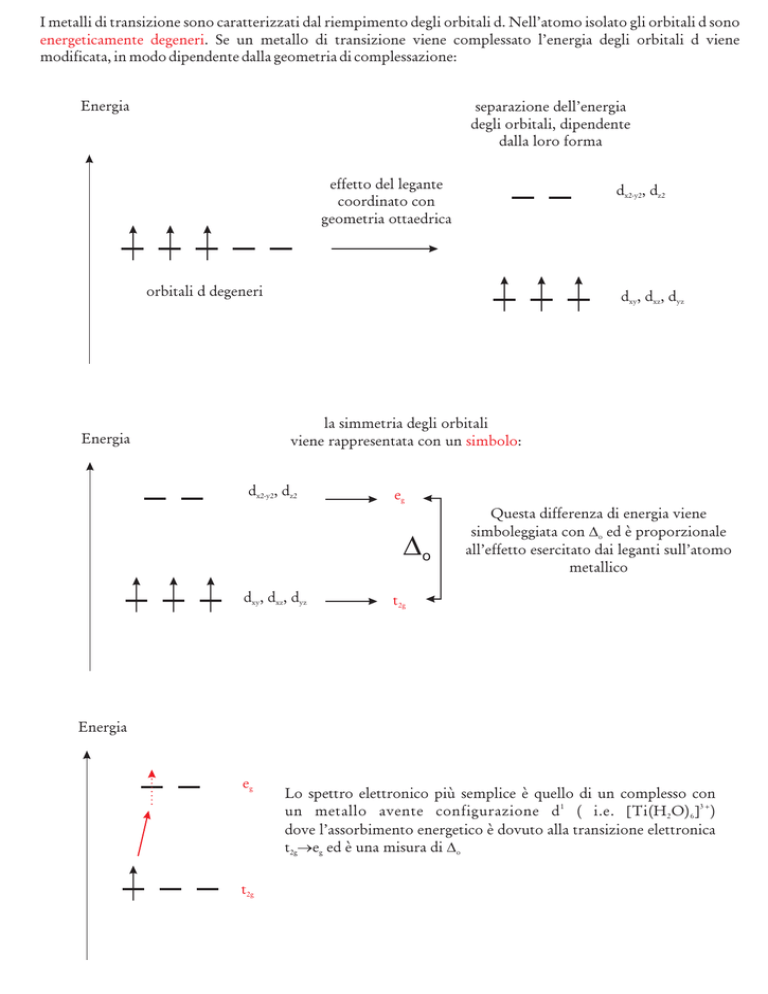
I metalli di transizione sono caratterizzati dal riempimento degli orbitali d. Nell’atomo isolato gli orbitali d sono
energeticamente degeneri. Se un metallo di transizione viene complessato l’energia degli orbitali d viene
modificata, in modo dipendente dalla geometria di complessazione:
Energia
separazione dell’energia
degli orbitali, dipendente
dalla loro forma
effetto del legante
coordinato con
geometria ottaedrica
dx2-y2, dz2
orbitali d degeneri
dxy, dxz, dyz
la simmetria degli orbitali
viene rappresentata con un simbolo:
Energia
dx2-y2, dz2
eg
Questa differenza di energia viene
simboleggiata con D
o ed è proporzionale
all’effetto esercitato dai leganti sull’atomo
metallico
D
o
dxy, dxz, dyz
t2g
Energia
eg
t2g
Lo spettro elettronico più semplice è quello di un complesso con
un metallo avente configurazione d 1 ( i.e. [Ti(H 2 O) 6 ] 3+ )
dove l’assorbimento energetico è dovuto alla transizione elettronica
t2g®
eg ed è una misura di D
o
1
In questa configurazione elettronica (d ) l’elettrone ha cinque
or bi tali a di spos izione e due stati di spi n: tut to ciò ene rgeticament e
viene riassunto nel concetto di termine elettronico, che viene rappresentato
con un simbolo che contiene le informazioni circa la degenerazione orbitalica
2
e lo stato di spin: in questo caso D, dove l’apice 2 a sinistra indica la molteplicità di spin
e la lettera D indica la degenerazione quintupla.
2
D
2
Eg
2
D
M
2
T2g
La separazione degli orbitali
provocata dai leganti con geometria
ottaedrica scinde
il termine energetico 2D in due
termini 2T2g e 2Eg, uno triplamente
degenere e uno doppiamente
degenere
In un atomo polielettronico la situazione è più complessa, a causa della repulsione inter-elettronica. Si definisce un momento angolare orbitale totale degli elettroni L e un
momento angolare di spin totale S. I possibili valori che possono assumere S e L danno origine
a termini elettronici differenti. Quello di minima energia è detto termine fondamentale.
3
4
Per la configurazione d il termine fondamentale è F, cioè un termine con degenerazione orbitalica settupla (L=3) e degenerazione di spin quadrupla (S=4).
2x(1/2+1/2+1/2)+1=4
S
L
+2 +1
6
0
-1
-2
2+1+0=3
3+
5
Per la configurazione d ( i.e. quella dei complessi di Co ) il termine fondamentale è D, avente degenerazione
orbitalica quintupla (L=2) e degenerazione di spin quintupla (S=5):
2x(1/2-1/2+1/2+1/2+1/2+1/2)+1=5
S
L
+2 +1
0
-1
-2
2+2+1+0 -1 -2 = 2
4
Per effetto dei leganti coordinati con geometria ottaedrica il termine F viene separato in tre
termini :
4
4
4
4
F®
A2g + T1g + T2g
La molteplicità di spin viene conservata, mentre cambia la molteplicità orbitalica per ogni termine:
A è singola, T è tripla.
4
T1g
4
4
F
T2g
D
o
4
A2g
Il diagramma di Tanabe-Sugano riporta
schematizzati i termini per ogni
configurazione elettronica, la loro
separazione per effetto della coordinazione
(ottaedrica in questo caso) permette di
calcolare il valore di D
o utilizzando gli
spettri elettronici. Le transizioni
elettroniche permesse sono quelle che
conservano la molteplicità di spin.
3
Per un sistema d sono permesse le seguenti
transizioni elettroniche:
4
4
n
A2g = D
1= T2g¬
o
4
4
n
=
T
¬
A
2
1g
2g
4
4
n
=
T
¬
A
3
1g
2g
Il valore di D
o permette di misurare l’energia
di interazione fra il metallo e il legante nel
complesso. La transizione a energia
maggiore potrbbe non essere osservabile in
un normale spettro UV-VIS, poiché
potrebbe trovarsi nel NIR.
3+
3+
Esercizio: confrontare gli spettri elettronici di [Cr(H2O)6] , Cr(acac)3 e [Cr(ox)3] e calcolare D
o in modo da
valutare le differenti energie di interazione dei leganti.












