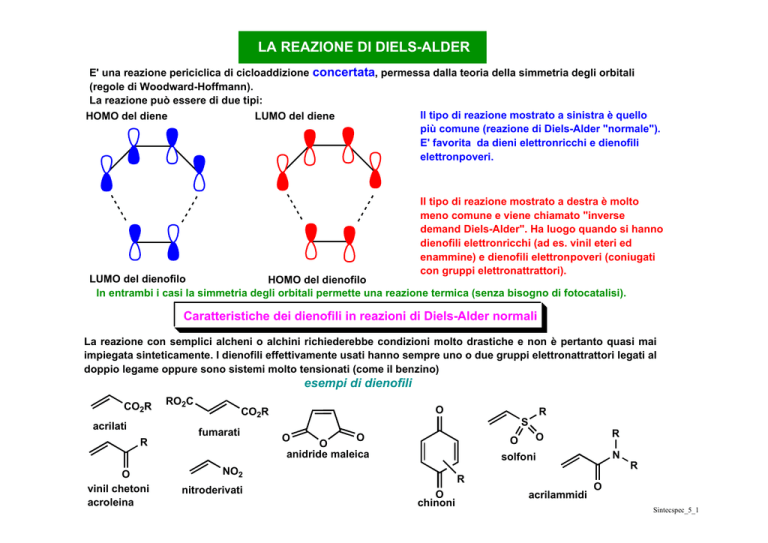
LA REAZIONE DI DIELS-ALDER
E' una reazione periciclica di cicloaddizione concertata, permessa dalla teoria della simmetria degli orbitali
(regole di Woodward-Hoffmann).
La reazione può essere di due tipi:
Il tipo di reazione mostrato a sinistra è quello
HOMO del diene
LUMO del diene
più comune (reazione di Diels-Alder "normale").
E' favorita da dieni elettronricchi e dienofili
elettronpoveri.
Il tipo di reazione mostrato a destra è molto
meno comune e viene chiamato "inverse
demand Diels-Alder". Ha luogo quando si hanno
dienofili elettronricchi (ad es. vinil eteri ed
enammine) e dienofili elettronpoveri (coniugati
con gruppi elettronattrattori).
LUMO del dienofilo
HOMO del dienofilo
In entrambi i casi la simmetria degli orbitali permette una reazione termica (senza bisogno di fotocatalisi).
Caratteristiche dei dienofili in reazioni di Diels-Alder normali
La reazione con semplici alcheni o alchini richiederebbe condizioni molto drastiche e non è pertanto quasi mai
impiegata sinteticamente. I dienofili effettivamente usati hanno sempre uno o due gruppi elettronattrattori legati al
doppio legame oppure sono sistemi molto tensionati (come il benzino)
esempi di dienofili
CO2R
acrilati
R
O
vinil chetoni
acroleina
RO2C
O
CO2R
fumarati
O
O
anidride maleica
O
O
R
O
N
solfoni
NO2
nitroderivati
R
S
R
O
chinoni
acrilammidi
R
O
Sintecspec_5_1
Caratteristiche dei dieni in reazioni di Diels-Alder normali
A differenza di quello che avviene con i dienofili, anche dieni non funzionalizzati sono sufficientemente reattivi
nella Diels-Alder. Due fattori incidono sulla reattività:
La presenza di sostituenti elettrondonatori fa aumentare la reattività
Una maggiore percentuale di conformero s-cis fa aumentare la reattività
s-cis
s-trans
Esempi di dieni più reattivi del comune
OCH3
O
Me3SiO
diene di Danishefsky
(reattivo grazie ai gruppi
elettrondonatori + R)
ciclopentadiene
(reattivo perché
bloccato nella conf. s-cis)
furano
(molto reattivo perché
bloccato nella conf. s-cis e
per la presenza dell'ossigeno
elettrondonatore)
calore
orto-chinondimetano
(reattivo perchè la Diels-Alder
ripristina l'aromaticità e perché bloccato nella conf. s-cis)
O
isobenzofurano
(estremamente reattivo perché
combina le proprietà del furano
con quelle dell' orto-chinondimetano)
Sintecspec_5_2
ASPETTI REGIO E STEREOCHIMICI
In principio, una reazione di Diels-Alder potrebbe portare fino a 32 composti diversi (16 coppie di enantiomeri)
R1
R1
R3
*
+
*
R4
R1
R3
*
*
*
+
*
R4
R2
R2
R4
*
*
R3
R2
In realtà molto spesso il controllo regio e stereochimico è tale da portare a soli 2 prodotti (una coppia di
enantiomeri) o addirittura ad un solo prodotto (nel caso di Diels-Alder asimmetriche con catalizzatori o ausiliari
chirali).
La reazione di Diels-Alder è quasi sempre un processo irreversibile e quindi il controllo è cinetico (fanno
eccezione le reazioni con dieni aromatici quali il furano o l'antracene, che tendono ad essere reversibili)
A
REGIOSELETTIVITA'
Il problema si pone quando sia il diene che il dienofilo non sono simmetrici.
In questi casi il fattore dominante è quello elettronico. Si uniranno i carboni che hanno i più grandi coefficienti
degli orbitali di frontiera interessati.
coefficienti
del' HOMO
coefficienti
del LUMO
coefficienti
del' HOMO
min.
magg.
min.
magg.
ERG
min.
EWG
magg.
ERG
ERG
EWG
EWG
ERG
ERG
ERG
Sintecspec_5_3
Quindi:
EWG
EWG
+
+
EWG
EWG
ERG
ERG
ERG
ERG
prodotto "tipo para"
prodotto "tipo orto"
Gruppi alchilici piccoli sul diene hanno effetto elettrondonatore (+I) e quindi aumentano la velocità e indirizzano la
reazione secondo quanto detto sopra.
Quando i gruppi sono ingombrati si può però avere una diminuzione di velocità
R
R
H
CH3
tBu
vel. relativa
1
4.2
< 0.05
+
O
O
O
L'effetto sterico è ancora più gravoso quando il sostituente è in cis:
H
R
H
B
STEREOSPECIFICITA'
H
H
H
R
H
Dato che la Diels-Alder è un processo concertato, la configurazione relativa di R1 ed R2 e di R3 e R4 è decisa dalla
configurazione dei 3 doppi legami. Degli 8 diastereoisomeri teoricamente possibili se ne formano solo 2. Ad
esempio
E
R1
R1
R3
+
R3
Z
R2
R3
E
R1
E
R1
R3
R2
R3
+
3
R R
R3
Z
H
R1
R3
2
R3
R2
R3
+
+
R3
E
R1
R2
R3
R2
Sintecspec_5_4
C
DIASTEREOSELETTIVITA'
Negli esempi visti prima abbiamo visto che la stereochimica degli alcheni di partenza controlla le configurazioni
relative tra R1 ed R2 e tra i due R3, ma non la configurazione relativa tra R1 ed R3 (e quindi tra R2 ed R3): si
possono in principio formare due diastereoisomeri endo ed eso.
R1
R1
R1
E
Normalmente (sotto controllo cinetico) si ha una netta
R3
R3
R3
prevalenza dell'isomero endo, anche se esso è meno
Z
+
+
stabile, quando almeno uno dei gruppi R3 è
elettronattrattore ed il dienofilo è Z o terminale
R3
R3
R3
E
Con dienofili E (se i gruppi R3 sono diversi) la situazione è
2
2
R2
R
R
ovviamente più complessa. Tende comunque a stare in endo il
eso
endo
gruppo più elettronattrattore 2
H
R
R3
3
R
R3
R3
H
2
R3
2
R
H
R
2
attacco endo
R
1 H
R
3
R
R3 H
R3
H
R1
R1
H
H
1
R
R3
R3
3
R
R2
attacco eso
R3
H
H
H
R2
H
2
R
3
HR
R4 H
R3
R1
H
D
R2
1
R
H
R3
R3
R1
STEREOSELEZIONE π-FACCIALE
Le due facce π del diene e dell'alchene possono essere omotopiche (e allora il problema non sussiste) o
enantiotopiche o diastereotopiche. Per discriminare due facce enantiotopiche occorrono catalizzatori chirali
Sintecspec_5_5
O
ESEMPI
140°C
+
O
90%
OAc
se il diene è attivato da sost. elettrondonatori, la
reazione è più facile
OMe
+
Con dienofili monoattivati e semplici
dieni la reazione richiede in genere
temperature tra i 100 ed i 200°C. Ove
necessario
si
possono
usare
recipienti chiusi a tenuta di pressione
AcO
90°C
AcO
H
H
OAc
CO2Me
O
75%
AcO
OAc
prodotto endo
CO2Me
Si forma un unico diastereoisomero (racemo) tra i 4 possibili grazie:
a) alla configurazione relativa cis dei due acetossi, decisa dalla configurazione del diene
b) alla diastereoselettività di tipo endo.
I dieni ciclici sono particolarmente reattivi grazie al fatto che la conformazione s-cis è presente al 100% all'equilibrio
O
L'attacco è esclusivamente endo.
40°C
+
O
97%
O
O
O
O
O
T amb.
O
+
O
O
O
O
Con il furano le reazioni sono molto
veloci, ma anche reversibili. Il controllo
diventa termodinamico ed il prodotto
principale è l'eso.
Sintecspec_5_6
I nitroalcheni sono ottimi dienofili. Grazie al fatto che il nitrogruppo risultante può subire diverse trasformazioni,
questa reazione è particolarmente utile sinteticamente:
1) NaOMe, MeOH
2) TiCl3, NH4OAc,
BnO
BnO
Et2O, 25°C
OBn
T amb., 16h
+
NO2
64%
O
NO2
Aspetto stereochimico: le due facce del diene sono diastereotopiche e quella meno ingombrata viene attaccata di
preferenza. Le due facce del dienofilo sono invece enantiotopiche e non c'è discriminazione. Pertanto si ottiene una
miscela racemica
Aspetto sintetico: il nitroetilene è di fatto un equivalente sintetico del chetene, che è un pessimo dienofilo. Il
meccanismo della riduzione dovrebbe essere il seguente:
R1
H
O
R1
+ MeO
+ 2 TiCl3
N
2
R
OH
R1
+ H3O
R
O
anione nitronato
H
R1
TiCl3
N
R
NH4OAc serve a tamponare HCl
O
R2
+ 5 HCl
2
R1
N
R2
+ 2 TiO2 + Cl
N
2
NO2
OH
R1
R2
I nitroalcheni sono utili anche grazie al fatto che permettono un maggior controllo regio- e stereo-chimico
MeO2C
CO2Me
T amb.
CO2Me
base
+
NO2
NO2
NHBoc
NHBoc
NHBoc
NO2
Grazie all'eliminazione:
eq. sint. di
MeO2C
CO2Me
Sia la regioselettività che la
diastereoselettività endo sono
controllate dal nitro gruppo e
non dall'estere.
ma con il propiolato si
otterrebe l'isomero di tipo
"orto"
Sintecspec_5_7
CO2Et
CO2Et
CO2Et
2
A : B = 83:17
NO2
A
NO2
H
CO2Et
MeO2C
B
base
unico prodotto
CO2Et
nBu3SnH, AIBN
Quest'ultima trasformazione mostra come i nitroalcheni possano essere considerati equivalenti sintetici di alcheni
OMe
massimo
coeffic. LUMO
OMe
50-100°C
+
Me3SiO
CHO
CHO
H2O, H3O
CHO
Me3SiO
massimo
coeffic. HOMO
O
Il diene di Danishefsky è un diene piuttosto reattivo. I suoi addotti possono essere facilmente trasformati in chetoni
α,β
β-insaturi. Si noti la regioselettività. Entrambi i sostituenti del diene innalzano il coefficiente dell'HOMO dello
stesso carbonio.
DIELS-ALDER CATALIZZATA DA ACIDI DI LEWIS
Acidi di Lewis quali AlCl3, Et2AlCl,
ZnCl2, etc. accelerano la reazione di
Diels-Alder, rendendo più elettrofilo
il dienofilo. Il meccanismo rimane
comunque concertato e la reazione
rimane stereospecifica. Si nota però
un aumento di regioselettività
CO2Me
+
+
CO2Me
non cat.
cat. da AlCl3
CO2Me
temp.
120°C
20°C
rapporto
70 : 30
95
:
5
Sintecspec_5_8
DIELS-ALDER INTRAMOLECOLARE
La Diels-Alder intramolecolare consente la trasformazione in un solo passaggio di un composto aciclico in un
composto biciclico. Inoltre essa richiede condizioni più blande, sfruttando il vantaggio entropico e può avvenire
anche con dienofili non attivati. Le IMDA procedono con elevata regioselettività. La diastereoselettività non è
invece facilmente prevedibile con le regole endo-eso e dipende da una combinazione di effetti sterici ed elettronici.
Vi sono due tipi di D.A. intramolecolare
portano a sistemi fusi
IMDA di tipo I
n
n
n
n deve essere ≥ 1
Le reazioni più frequenti hanno n = 1 o 2 e
portano quindi a idrindani e decaline
giunzione trans
giunzione cis
Per n = 1, 2 o 3 la reazione è sempre completamente regioselettiva indipendentemente dagli effetti elettronici dei
sostituenti. Per esempio:
IMDA di tipo II
n deve essere ≥ 1
Le reazioni più frequenti hanno n = 1, 2 o 3 e sono
completamente regioselettive. Anche per n = 3 il modo
di attacco alternativo porterebbe ad un doppio legame
anti-Bredt:
portano a sistemi a ponte
n
n
Sintecspec_5_9
Diastereoselettività nelle IMDA di tipo I
L'aspetto fondamentale è la formazione di addotti con giunzione cis o trans
n
n
giunzione cis
n
giunzione trans
Il rapporto tra i due prodotti dipende da vari fattori
•
•
•
•
La configurazione del doppio legame "interno" del diene
La presenza di un gruppo attivante sul dienofilo e la sua posizione (esterna E, esterna Z, interna)
Le condizioni di reazione (reazione termica o catalizzata da acidi di Lewis)
L'effetto sterico di eventuali sostituenti "interni" sul diene
Primo fattore: Quando la configurazione del doppio legame "interno" del diene è Z, la reazione è in generale più
difficile e si possono formare solo gli addotti cis
H
H
H
H
Quando la configurazione è E, in assenza di altri effetti, la reazione sembra favorire la giunzione cis, anche se la
diastereoselettività non è elevata:
160°C
+
76
:
24
190°C
+
53
:
47
Sintecspec_5_10
La diastereoselettività dipende dal grado di formazione dei due nuovi legami nello S.d.T. (e quindi dal tipo di
asincronicità della cicloaddizione):
quando è più formato il legame rosso, in assenza di altri effetti, è più stabile (anche se di poco) lo
stato di transizione che porta alla giunzione cis
quando è più formato il legame azzurro, in assenza di altri effetti, è più stabile lo stato di
transizione che porta alla giunzione trans
I sostituenti aggiuntivi possono quindi incidere sul decorso in due modi:
stabilizzando o destabilizzando i due S.d.T. con interazioni steriche o elettroniche
spostando l'asincronicità della reazione verso l'uno o l'altro dei due casi limite
Secondo fattore: Quando è presente un sostituente attivante in posizione "esterna" ed E, aumenta la percentuale
di isomero con giunzione trans.
OHC
CHO
CHO
150°C
+
25
CHO
OHC
:
75
CHO
110°C
La reazione è in generale
più selettiva per gli
idrindani che per le
decaline
+
8
:
92
Sintecspec_5_11
Come è stata razionalizzata questa aumentata preferenza nei confronti della giunzione trans ?
a) L'aumentata elettrofilia del dienofilo aumenta
b) La regola endo favorisce la giunzione trans
l'asincronicità della reazione
questo legame
è più formato a livello
di S.d.T.
H
OHC
il gruppo CHO è in endo
H
OHC
Quando invece il sostituente attivante è in posizione "esterna", ma in Z, l'effetto è trascurabile
NO2
NO2
O2N
+
47
:
53
In questo caso i due fattori sopra citati sono in conflitto e si annullano a vicenda
NO2
NO2 in eso
NO2 in endo
NO2
NO2
NO2
Infine quando il sostituente attivante è in posizione "interna" si forma esclusivamente la giunzione cis
O
O
inoltre C=O è in endo
O
cis : trans : 97:3
questo legame
è più formato a livello
di S.d.T.
Sintecspec_5_12
Terzo fattore: Quando è presente un sostituente attivante in posizione "esterna" ed E, l'uso della catalisi (acido di
Lewis)
fa
aumentare
notevolmente
la
percentuale
Tale aumento non si verifica se il sostituente attivante è in Z.
OMe
ZnCl2, T amb.
CH2Cl2
OHC
di
isomero
con
giunzione
trans.
CHO
L'acido di Lewis aumenta l'asincronicità della
reazione ed aumenta anche l'effetto endo
O
O
unico prodotto
Quarto fattore: un sostituente sul diene può destabilizzare lo S.d.T. che porta alla giunzione cis, incrementando
la selettività a favore del trans nei casi problematici.
R
cis
trans
H
R
CO2Me
HO
interazione
destabilizzante
CO2Me
HO
SiMe3
> 95:5
SiMe3
Senza Me3Si la diastereoselettività è molto scarsa. Il gruppo Me3Si può poi essere rimosso e rappresenta quindi
un "removable steric directing group"
Sintecspec_5_13
DIELS-ALDER TRANSANNULARE
Nella Diels-Alder transannulare il diene ed il dienofilo sono congiunti da catene di collegamento (tethers) su
entrambi i lati. Si passa quindi da un sistema macrociclico ad un sistema triciclico. I fattori sterici ed entropici
sono in questo caso decisivi nell'indirizzare la regiochimica e la stereochimica del processo.
OPh
O
N
OPh
OH
OH
Py-BOP
O
N
O
Et3N
O
OMe
O
OMe
T amb.
Quando non ci sono tensioni steriche che impediscono la
cicloaddizione, la Diels-Alder transannulare è fortemente
agevolata entropicamente ed ha luogo in condizioni
estremamente blande. La corrispondente reazione
intramolecolare non avviene facilmente e a 180°C si
decompone tutto.
Esistono due gradi di libertà: la diastereoselezione interna
(endo-eso) e la diastereoselezione relativa (rispetto
al centro preesistente). Entrambe sono controllate al 100%
grazie alla rigidità del sistema.
conf. rel.
decisa da conf. diene
conf. rel.
obbligatoria
per la struttura
del sistema
OPh
O
*
N
O
*
H
*
*
O
conf. rel.
decisa da conf. alchene
conf. rel.
OMe obbligatoria
per la struttura
del sistema
Sintecspec_5_14
TRASPOSIZIONI SIGMATROPICHE
Le trasposizioni sigmatropiche coinvolgono una riorganizzazione concertata di elettroni, durante la quale un
legame σ migra su un sistema π adiacente con contemporaneo spostamento di elettroni π
Le trasposizioni sigmatropiche principali sono di due tipi, dette [3,3] e [3,2]
La classificazione delle reazioni sigmatropiche segue questa regola: si contano(sui due lati) gli atomi interposti
tra il legame σ che si rompe ed il legame σ che si forma.
2
1
3
X
X
X
Y
Y
Y
1
3
2
2
1
1
[3,3]
X
3
Y
Z
[2,3]
Z
2
Le reazioni del tipo [3,3] sono le più importanti. Sono reazioni permesse dalla regola di simmetria degli orbitali. Lo
stato di transizione può essere visto come l'accoppiamento di due radicali allilici:
X
Y
X
Y
X
orbitali di
un radicale allilico
Y
Nell'interazione di due radicali allilici il LUMO e l'HOMO sono lo stesso
orbitale. L'interazione è permessa
Lo stato di transizione può essere in questo
caso sia a barca che a sedia. Normalmente
prevale lo S.d.T. a sedia
Sintecspec_5_15
1
2
3
X
Y
1
Quando X è un atomo di ossigeno e Y un carbonio, le trasposizioni [3,3]
vengono chiamate trasposizioni di Claisen
X
Y
3
I substrati più classici delle trasposizioni di Claisen sono
gli allil vinil eteri, di solito preparati in situ dagli alcoli allilici
[3,3]
2
CHO
195°C
+
O
OH
O
In principio le trasposizioni sigmatropiche [3,3] sono reazioni di equilibrio. Le Claisen sono però generalmente
spostate verso destra (ed irreversibili) grazie all'alta energia del legame C=O
Altri tipici substrati sono i fenil allil eteri
O
O
OH
L'ultima tautomeria sposta
a destra l'equilibrio
Un'utile variante è la trasposizione di Claisen degli ortoesteri
+
OH
OEt
− EtOH
OEt
OEt
trietil
ortoacetato
In pratica si aggiunge un'unità di acetato
anziché un'unità di acetaldeide
O
EtO
O
OEt
OEt
O
OEt
Sintecspec_5_16
Aspetti stereochimici
Le trasposizioni [3,3] di substrati chirali sono stereospecifiche (solo 2 dei 4 possibili prodotti si formano) e
stereoselettive (uno dei due prodotti prevale).
(Z)
HO
H
H
(E)
CO2Et
(R)
(S)
+
CO2Et
H
maggiore
H OEt
minore
OEt
H
CO2Et
O
O
Se
il
doppio
legame
si
forma
E
il carbonio stereogenico deve per forza essere (R)
S.d.T. favorito
O
O
CO2Et
H
EtO
Se
il
doppio
legame
si
forma
Z
il carbonio stereogenico deve per forza essere (S)
EtO
S.d.T. sfavorito
La configurazione del nuovo centro stereogenico è quindi decisa: a) dalla configurazione del vecchio stereocentro;
b) dalla configurazione del doppio legame di partenza; c) da quale delle due sedie è favorita
In ogni caso i prodotti che si formano hanno lo stesso e.e. del substrato.
La stereospecificità della Claisen è molto utile sinteticamente. Consente infatti di trasferire la chiralità da un alcool
secondario (facile da ottenere stereoselettivamente ad es. per risoluzione enzimatica, riduzione enantioselettiva
etc.) ad un carbonio stereogenico non funzionalizzato (difficile da ottenere direttamente in modo enantioselettivo)
Gli stessi prodotti della Claisen con ortoesteri possono essere ottenuti utilizzando enolati di esteri o silil chetene
acetali. La reazione con questi ultimi (detta Ireland-Claisen) è la più usata.
O
R2
R2
O
O
R1
1
chetene acetali OEt
(da ortoesteri)
R
silil chetene acetali
OSiMe3
enolati di esteri
OM
Sintecspec_5_17
Quando l'enolato o il silil chetene acetale derivano da un acido diverso dall'acido acetico esistono due possibili
configurazioni al doppio legame ed esse incidono sul decorso stereochimico della reazione:
OSiMe3
OSiMe3
2
R
R2
Me3SiO2C
R2
O
O
1
R1
R
R1
silil chetene acetale (E)
doppio legame (E)
OSiMe3
OSiMe3
2
R
R2
R1
O
R1
O
Me3SiO2C
R2
R1
silil chetene acetale (Z)
doppio legame (E)
anti
sin
Lo stesso vale per gli enolati
La formazione di enolati (E) o (Z) può essere controllata giocando sulle condizioni di enolizzazione:
LDA
THF
O
2
R
O
2
R
O
enolato (E)
O
R1
LDA
THF-HMPA
O
2
R
R1
O
enolato (Z)
I silil chetene acetali sono quindi preparati dagli
enolati per semplice trattamento con Me3SiCl
Me3SiCl
Me3SiCl
OSiMe3
R2
O
OSiMe3
2
R1
R1
R
O
R1
Sintecspec_5_18
Esempi di applicazioni sintetiche:
O
Br
Li
Br
O
MeO
OMe
1) KN(SiMe3)2
−78°C
2) Me3SiCl
O
1)
OSiMe3
O
O
Br
O
O
2) (EtCO)2O
MeO
MeO
OMe
OMe
enolato (E)
1 solo diastereoisomero
HO2C
*
(S)
i trimetilsilil
esteri
si
idrolizzano
facilmente
nel work-up
CO2H
(S)
(E)
sono possibili in teoria
8 diversi stereoisomeri
si forma
solo questo
Br
O
*
Br
O
anti
MeO
OMe
MeO
OMe
Br
O
MeO
Br
OMe
CO2H
OSiMe3
(R)
(R)
MeO
OSiMe3
MeO
favorito
O
O
anti
(Z)
Br
O
sfavorito
O
MeO
OMe
Sintecspec_5_19
La reazione di Claisen dei silil chetene acetali può servire a costruire stereoselettivamente un substrato per una
RCM:
O
1) KN(SiMe3)2
−78°C
HO2C
OH
DCC
2) Me3SiCl
BnO
O
+
O
O
DMAP
BnO
OBn
OBn
a
Cat. Grubbs 1 gen.
CO2Me CH2Cl2, riflusso
1) 0°C
CO2Me 2) CH2N2
87%
79%
O
Me3SiO
O
O
BnO
O
sin
enolato (Z)
La presenza dell'ossigeno favorisce
l'enolato (Z) per chelazione del potassio
OSiMe3
OSiMe3
BnO
O
R
R
O
BnO
O
OBn
CO2H
O
OR
Si noti che i due frammenti sono stati uniti mediante un legame C−
−O, che è poi divenuto un legame C−
−C in base alla
trasposizione
Una trasposizione simile alla Claisen è il passaggio chiave della sintesi degli indoli di Fischer
H
N
O
NH2
+
H+
R
R
N
H
H
N
NH
R
Sintecspec_5_20
Trasposizione di Cope
La trasposizione di Cope è la [3,3] in cui tutti gli atomi sono carboni. A differenza della Claisen è in genere una
reazione di equilibrio e richiede condizioni più drastiche.
Nel caso mostrato qui sotto l'equilibrio è spostato verso destra dalla coniugazione del doppio legame con il fenile
Ph
Ph
Ph
(E)
(R)
+
(S)
(Z)
maggiore
Ph
minore
Ph
Ph
favorito
Ph
Ph
Ph
sfavorito
La reazione può essere catalizzata (e procedere quindi in condizioni più blande) con palladio (II):
(R)
Ph
(E)
Pd(CH3CN)2Cl2
T amb
(Z)
Ph
senza catalisi ci vogliono 240°C
Ph
Ph
Pd(II)
+
(S)
(E)
(R)
70
Ph
Pd(II)
Ph
:
30
+ Pd(II)
la presenza del carbocatione rende quest'ultimo passaggio favorito rispetto alla
β-eliminazione di idruro. Quindi Pd(II) non viene ridotto
Sintecspec_5_21
Trasposizione di ossi-Cope
Forse più utile della Cope è la ossi-Cope che ha il vantaggio di avere, come la Claisen, un equilibrio spostato
verso destra
HO
OHC
HO
OH
la formazione del carbonile sposta a
destra l'equilibrio
La ossi-Cope avviene molto più velocemente se l'alcool è convertito nel corrispondente alcolato (ossi-Cope
anionica)
H
KH, THF
riflusso
OH
H
O
O
H
H
O
H
O
H
Sintecspec_5_22
TRASPOSIZIONI SIGMATROPICHE [2,3]
Sono sempre promosse da un termine anionico, che può essere un anione vero e proprio o un ilide
2
1
X
Y
1
2
1
3
Z
2
X
X
Y
Y
Z
1
X
3
Y
Z
2
trasposizione [2,3] neutra
Z
trasposizione [2,3] anionica
La trasposizione dei solfossidi allilici appartiene al primo tipo:
O
O
O
S
OH
S
(MeO)3P
La reazione viene condotta in presenza di (MeO)3P che sposta l'equilibrio rompendo il legame S−
−O del solfinato.
La reazione è stereospecifica.
Al secondo tipo appartiene la trasposizione di Wittig:
Z
Z
O
O
base
Z
R
R
O
Z
OH
R
R
Z deve essere un gruppo che faciliti la formazione dell'anione (un gruppo elettronattrattore o un eteroatomo
come S, Si)
Sintecspec_5_23
OH
O
SiMe3
nBuLi
RO
RO
E' simile alla trasposizione degli allil solfossidi, ma in questo caso comporta la formazione di un nuovo legame C−
−C.
A differenza della Claisen (via ortoesteri o silil chetene acetali) viene aggiunta una unità di un C anziché un'unità di
due C.
La trasposizione di Wittig è stata spesso utilizzata per sintesi di macrocicli mediante contrazione di anello:
Williamson
nBuLi
Cl
O
OH
OH
O
Sintecspec_5_24