Legami Chimici
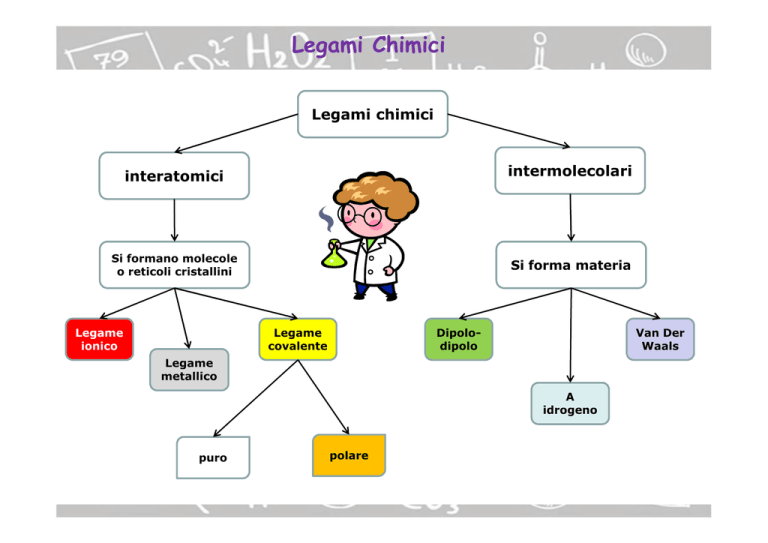
Legami chimici
interatomici
intermolecolari
Si formano molecole
o reticoli cristallini
Si forma materia
Legame
ionico
Legame
covalente
Dipolodipolo
Van Der
Waals
Legame
metallico
A
idrogeno
puro
polare
La maggior parte delle sostanze che ci circondano sono fatte da molecole
una molecola è un aggregato distinto di
atomi, uniti da legami chimici, che è dotato
di proprietà caratteristiche che lo rendono
riconoscibile
La teoria del legame chimico ha
come obiettivo quello di dare una
spiegazione di tali fatti e di
prevedere quali interazioni e di che
tipo possono avvenire fra una data
coppia di atomi
GLI ATOMI TENDONO A LEGARSI SPONTANEAMENTE
FRA DI LORO, PER FORMARE DELLE MOLECOLE.
OGNI QUAL VOLTA QUESTO PROCESSO PERMETTE
LORO DI RAGGIUNGERE UNA CONDIZIONE DI
MAGGIORE STABILITA’ ENERGETICA,
ENERGETICA, SI HA LA
FORMAZIONE DI UN LEGAME CHIMICO
Gilbert Newton Lewis: 1916 – teoria dei legami covalenti (puri, polari, ionici)
IL LEGAME CHIMICO
tradidiloro
loroa aformare
formare
molecole.
• Gli
Gliatomi
atomi interagiscono
interagiscono tra
molecole.
L’eccezione
L’eccezionesono
sonoi igas
gasnobili
nobili (monoatomici).
(monoatomici).
Lewis:
• Teoria
Teoria di Lewis:
–– Gli
esterni,didi
valenza,sono
sonoimplicati
implicati
Glielettroni
elettroni esterni,
valenza,
nelnel
legame
legamechimico
chimico
–– Gli
configurazione
Gliatomi
atomi tendono
tendono ad assumere la configurazione
elettronica
deigas
gasnobili,
nobili,regola
regoladell’ottetto
dell’ottetto
elettronica dei
–– Se
vengonotrasferiti
trasferiti
si ha
legame
ionico
Se gli
gli elettroni
elettroni vengono
si ha
legame
ionico
–– Se
sonoinincompartecipazione
compartecipazionesisihahalegame
Se gli
gli elettroni
elettroni sono
legame
covalente
covalente
Requisiti
Requisiti da
da soddisfare:
soddisfare:
··
Ognuno
deidei
duedue
atomi
cheche
si legano
deve
contribuire
alla
Ognuno
atomi
si legano
deve
contribuire
.
formazione
del legame
con un
atomico.
atomico
alla formazione
del legame
consuo
un orbitale
suo orbitale
atomico.
atomico
.
··
Le energie
dei dei
due due
orbitali
coinvolti
non non
devono
essere
Le energie
orbitali
coinvolti
devono
troppo
loro. tra loro.
essere diverse
troppo tra
diverse
··
La differenza
di elettronegatività
dei 2 atomi
deve
La differenza
di elettronegatività
dei 2 non
atomi
non
essere
maggiore
di 2 (altrimenti
legame assume
carattere
deve essere
maggiore
di circa 2il (altrimenti
il legame
assume
ionico).
carattere ionico).
··
Gli Gli
atomi
devono
congiungersi
lungo
che
atomi
devono
congiungersi
lungouna
unadirezione
direzioneche
permette
permettelalamassima
massimasovrapposizione
sovrapposizione degli
degli orbitali.
orbitali.
Parlando di legami chimici, un'utile rappresentazione degli atomi è
costituita dalle formule di Lewis. Queste sono costituite dal
simbolo dell'elemento al centro e da tanti puntini disposti intorno
ad esso quanti sono gli elettroni più esterni (e- di valenza).
Ricordate che il numero di questi elettroni è uguale al numero del
gruppo a cui appartiene (per gli elementi dei blocchi s e p).
Legame
covalente
COME SI FORMANO I LEGAMI TRA GLI
ATOMI ?
Per raggiungere configurazioni elettroniche stabili gli
elementi tendono a reagire fra loro formando
legami chimici.
Configurazione stabile = situazione di minima E
Il legame chimico è l’interazione fra due atomi che
porta ad uno stato di minima E
Il legame chimico è la forza risultante fra le forze
attrattive (e
(e- - nucleo) e repulsive (nucleo
(nucleo –
nucleo) ed (e
(e- - e- )
Gli elementi che si legano raggiungono l’ottetto
elettronico
Come può una coppia di elettroni
impedire a due atomi di separarsi ?
Quanti legami può
fare un atomo ?
In quali direzioni possono
avvenire questi legami?
- Energia di ionizzazione di un atomo (o potenziale
di ionizzazione):
A(g
A(
g) → A+(g) + e-(g)
- Affinità elettronica di un atomo:
A-(g) → A(
A(g
g) + e-(g)
- Elettronegatività: tendenza di un atomo ad
attrarre su di sè gli elettroni di un legame
Energia di
Affinità
Elettronegatività ∝
+
ionizzazione elettronica
Nei legami chimici sono coinvolti gli elettroni di valenza
ENERGIA DI LEGAME
AB(g
AB(
g) → A(
A(g
g) + B(g
B(g)
I legami chimici sono
sempre il frutto di
interazioni elettrostatiche.
“nube” elettronica con carica negativa
intorno al nucleo
nucleo con carica positiva
centrale
LEGAME COVALENTE
• Il legame covalente si forma fra atomi la cui differenza dei
valori di elettronegatività NON è maggiore di 1,7 (circa).
• I due atomi mettono in comune un elettrone ciascuno. Gli
elettroni che vengono messi in comune sono elettroni spaiati,
cioè elettroni che si trovano isolati in un orbitale.
• Quando i due atomi si avvicinano a sufficienza, avviene una
parziale sovrapposizione dei due orbitali in cui si trovano gli
elettroni spaiati: i due orbitali si compenetrano l’un l’altro per
una
certa
regione
di
spazio,
che
apparterrà
contemporaneamente ad entrambi gli orbitali e di conseguenza
gli elettroni che si trovano in questi orbitali apparterranno
contemporaneamente ai due atomi.
• Il legame covalente è il legame chimico più forte e si
distinguono due tipi di legame covalente:
1 - il legame covalente puro (OMOPOLARE): legame tra atomi
identici (H-H, Cl-Cl, etc)
IDENTICA elettronegatività
2 - il legame covalente polare (ETEROPOLARE): legame tra atomi
diversi (H-Cl, etc)
DIFFERENTE elettronegatività
La sovrapposizione orbitalica nel LEGAME
COVALENTE
I due atomi hanno
elettronegatività paragonabile:
si verifica uno dei casi limite:
limite:
Legame covalente omopolare
I due atomi hanno
elettronegatività paragonabile:
se si verificano le condizioni
adatte, gli elettroni possano
localizzarsi in mezzo ai due atomi
LEGAME COVALENTE OMOPOLARE
Cosa succede in termini energetici:
Figura 7-3 Rappresentazione della
formazione di un legame covalente
tra due atomi di idrogeno.
Legame
covalente
I due atomi hanno
elettronegatività diversa
diversa,, ma
non troppo
troppo::
I due atomi hanno
elettronegatività diversa
diversa,, ma
non troppo
troppo::
gli elettroni si localizzano tra i due
atomi, ma un po’ spostati verso
quello più elettronegativo
LEGAME COVALENTECOVALENTE-POLARE
Nel caso di un legame covalente fra due atomi uguali come in
H2 o Cl2 gli elettroni di legame sono equamente condivisi. Vale a
dire gli elettroni hanno la stessa probabilità di trovarsi su
ciascuno dei due atomi.
Quando invece i due atomi sono diversi, come in HCl, gli
elettroni di legame hanno maggiore probabilità di trovarsi in
prossimità di un atomo piuttosto che dell'altro, e si parla di
legame covalente polare. Infatti la tendenza di attirare o donare
elettroni è diversa per i vari atomi.
Ad esempio per HCl gli elettroni sono maggiormente distribuiti
attorno al Cl che acquista una parziale carica negativa (δ-)
δ+
H-Cl δ-
Distribuzione della carica degli elettroni:
H
2s
Cl
2p
HCl
Orbitale di legame
Essendo il Cl più elettronegativo, la carica degli
elettroni tende ad addensarsi maggiormente sul Cl
-> Legame sigma (σ): massima sovrapposizione!
-> Legame pi-greco (π): sovrapposizione laterale!
Le cariche negative degli
elettroni si trovano a contatto
Se non avviene niente tra gli
Oppure,
si
possono
l’altro
caso
elettroni, i due atomi si respingono
limite:
e non si ha nessun legame.
Uno dei due atomi è più
elettronegativo dell’altro:
uno o più elettroni
passano all’atomo più
elettronegativo
si forma uno ione positivo
ed uno negativo che si
attraggono
LGAME IONICO
Energia del legame ionico
La formazione di un legame ionico fra due
atomi può essere scomposta in due stadi
successivi:
(1) Il trasferimento di un elettrone da un
atomo all’altro
(2) L'attrazione fra i due ioni
Formazione di un legame ionico: NaCl
prima si ha il salto dell’elettrone dall’atomo Na
all’atomo Cl
Na(g)
Na
(g) + Cl(
Cl(g) → Na+(g) + Cl-(g)
poi si ha l’attrazione tra i due ioni di segno
opposto che si avvicineranno fino alla distanza
di legame
Na+(g) + Cl-(g) → NaCl (g)
Formazione del legame ionico nel cloruro di sodio (NaCl
(NaCl))
1 – L’atomo di sodio perde il suo elettrone esterno e diventa uno ione
positivo.
Na([Ne]3s1)
Na+ ([Ne])
= Atomo di sodio (Na)
Na
Na+ + e-
2 – L’atomo di cloro acquista l’elettrone perduto dal cloro e diventa
ione negativo.
Cl +
e-
Cl([Ne]3s22p5)
ClCl-([Ne]3s22p6)
Cl- ([Ar])
Una
volta
formatisi
elettrostaticamente
il
catione
e
l'anione
si
attraggono
Nel solido tali ioni si dispongono secondo un reticolo cristallino ordinato
che permette di rendere massima l'attrazione tra le particelle di
carica opposta e minima la repulsione tra quelle della stassa carica
Ad esempio nel reticolo cubico del NaCl ogni catione Na+ è circondato
da sei anioni Cl- e viceversa
NaCl
Reticolo ordinato = massima attrazione fra gli ioni di carica opposta e
minima repulsione tra ioni di uguale carica
Intervalli di legame per classificare il
carattere COVALENTE O IONICO dei
legami chimici
Proprietà del legame
• L’ordine di legame è il numero di legami tra due atomi.
E’ pari al numero di coppie di e- di legame condivise:1,
singolo; 2, doppio; 3, triplo.
L’ordine di legame può anche essere non intero, come
nelle specie dove gli elettroni sono delocalizzati
• La lunghezza di legame è la distanza tra i nuclei di
atomi legati.
I legami di ordine maggiore sono più corti!!!
• Energia di legame è l’energia richiesta per rompere il
legame tra 2 atomi.
I legami di ordine maggiore sono più forti. Le energie di
legame sono sempre positive!!!
C-C
Legame singolo
1,54 Å
C=C
Legame doppio
1,34 Å
C≡C
Legame triplo
1,20 Å
Nota bene!!! La distanza di legame in genere diminuisce
all’aumentare dell’ordine di legame
Legami multipli
Finora abbiamo visto solo il caso di un legame singolo in cui una sola coppia di
elettroni è condivisa fra i due atomi.
E' tuttavia possibile che due atomi condividano due o tre coppie di elettroni.
In questo caso si parla di Legame Doppio o di Legame Triplo
in questi tipi di legame la densità elettronica risulta
concentrata sopra e sotto l’ asse di legame: legame π
etilene
H
C::C
H
H
oppure
H
H
H
C=C
H
H
acetilene
H:C:::C:H oppure
H-C ≡ C-H
legame doppio
(1σ + 1π)
• Molecola di azoto N2
N N
I due atomi
sono legati
tramite tre
coppie di
legame
Legame
triplo
• Molecola di cloro Cl2
Legame
I due atomi sono legati
tramite 1 coppia di legame singolo
Cl Cl
TEORIA DELL’ORBITALE MOLECOLARE
(MO THEORY)
• Questa teoria costituisce un metodo alternativo alla teoria
del legame di valenza, nella descrizione degli orbitali di
legame.
• Essa assume che gli orbitali atomici s e p puri si combinino
durante la formazione del legame per dare luogo a nuovi
orbitali che risultano diffusi o delocalizzati su tutta la
molecola.
• Questa teoria permette la descrizione delle strutture delle
molecole.
• Si basa sui criteri matematici della meccanica quantistica
ORBITALI MOLECOLARI
Rispetto alla teoria del legame di valenza, al legame tra atomi non
concorrono solo gli elettroni di valenza, ma in generale tutti gli
elettroni degli atomi costituenti la molecola
Nella molecola così concepita non esistono più gli elettroni che
appartengono ai singoli atomi, ma essi sono tutti ridistribuiti nella
molecola su nuovi livelli energetici denominati Orbitali Molecolari.
σ*1s
H2
1s
Orbitale Molecolare:
combinazione lineare
degli orbitali atomici
1s
σ1s
N2
Π*2p
2p
x y z
2p
σ*2p
σ2p
Π2p
N N
σ*2s
2s
2s
σ2s












