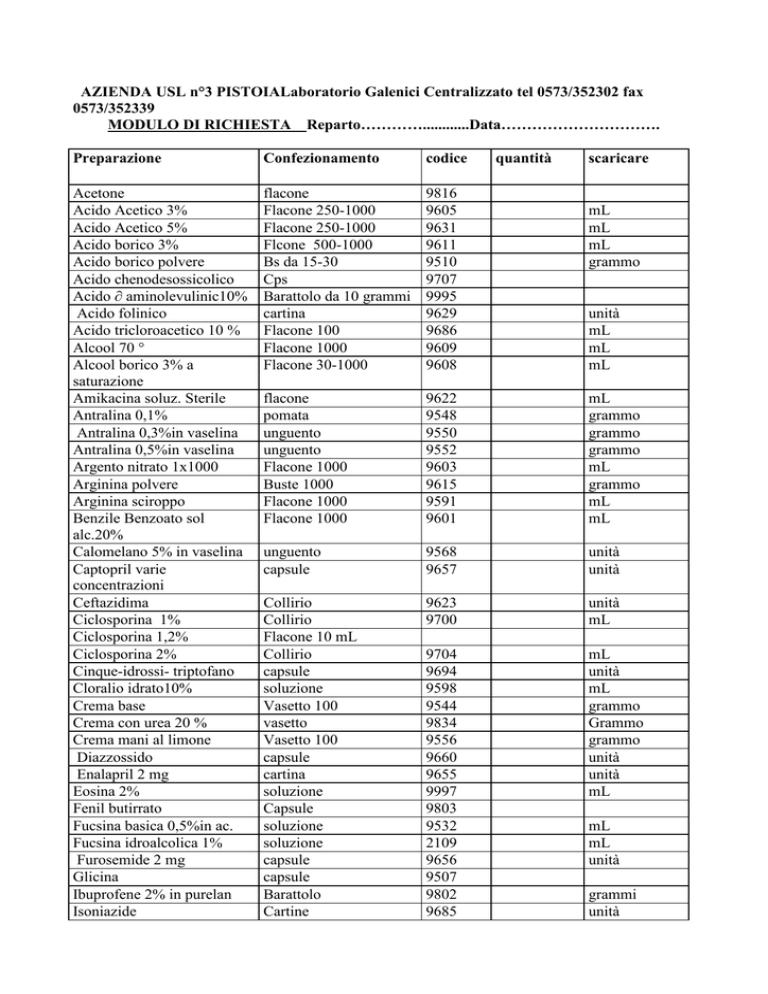
AZIENDA USL n°3 PISTOIALaboratorio Galenici Centralizzato tel 0573/352302 fax
0573/352339
MODULO DI RICHIESTA Reparto…………............Data………………………….
Preparazione
Confezionamento
codice
quantità
scaricare
Acetone
Acido Acetico 3%
Acido Acetico 5%
Acido borico 3%
Acido borico polvere
Acido chenodesossicolico
Acido ∂ aminolevulinic10%
Acido folinico
Acido tricloroacetico 10 %
Alcool 70 °
Alcool borico 3% a
saturazione
Amikacina soluz. Sterile
Antralina 0,1%
Antralina 0,3%in vaselina
Antralina 0,5%in vaselina
Argento nitrato 1x1000
Arginina polvere
Arginina sciroppo
Benzile Benzoato sol
alc.20%
Calomelano 5% in vaselina
Captopril varie
concentrazioni
Ceftazidima
Ciclosporina 1%
Ciclosporina 1,2%
Ciclosporina 2%
Cinque-idrossi- triptofano
Cloralio idrato10%
Crema base
Crema con urea 20 %
Crema mani al limone
Diazzossido
Enalapril 2 mg
Eosina 2%
Fenil butirrato
Fucsina basica 0,5%in ac.
Fucsina idroalcolica 1%
Furosemide 2 mg
Glicina
Ibuprofene 2% in purelan
Isoniazide
flacone
Flacone 250-1000
Flacone 250-1000
Flcone 500-1000
Bs da 15-30
Cps
Barattolo da 10 grammi
cartina
Flacone 100
Flacone 1000
Flacone 30-1000
9816
9605
9631
9611
9510
9707
9995
9629
9686
9609
9608
unità
mL
mL
mL
flacone
pomata
unguento
unguento
Flacone 1000
Buste 1000
Flacone 1000
Flacone 1000
9622
9548
9550
9552
9603
9615
9591
9601
mL
grammo
grammo
grammo
mL
grammo
mL
mL
unguento
capsule
9568
9657
unità
unità
Collirio
Collirio
Flacone 10 mL
Collirio
capsule
soluzione
Vasetto 100
vasetto
Vasetto 100
capsule
cartina
soluzione
Capsule
soluzione
soluzione
capsule
capsule
Barattolo
Cartine
9623
9700
unità
mL
9704
9694
9598
9544
9834
9556
9660
9655
9997
9803
9532
2109
9656
9507
9802
9685
mL
unità
mL
grammo
Grammo
grammo
unità
unità
mL
mL
mL
mL
grammo
mL
mL
unità
grammi
unità
Lattosio bs 25 gr
Lattulosio
Lattulosio +neomicina
L-dopa-carbidopa
Lidocaina viscosa 2%
L-Metionina da 1 grammo
L-Metionina da 10 grammi
L-Metionina da 2 grammi
L-Metionina da 5 grammi
Lugol debole
Lugol forte
Metacolina 0,4 % sterile
Metacolina 3,2% sterile
Metoprololo
Mupirocina pomata
Nadololo
Oxibuprocaina 0,5%
Oxibutinina soluzione sterile
Pepsina
Pomata al saccarosio
Potassio permanganato
0,25x1000
Prednisone
Sodio bicarbonato vari
dosaggi
Sodio cloruro vari dosaggi
Spiramicina
Tacrolimus sospensione
Tintura di iodio debole
Unguen. olio di mand. dolci
7,5%
Unguento salicilico 5%
Unguento solfo salicilico 10
%
Unguento solfo salicilico
20%
Unguento solfo salicilico
40%
Vancomicina soluzione ster.
Vaselina filante
Violetto di genziana 0,5%
Zinco ossido + ittiolo crema
Zinco ossido 20% crema
Zinco oss.25 % cr. per angio
Il Richiedente
buste
clistere
clistere
capsule
Soluz. In flacone
cartine
cartine
cartina
cartina
flacone
flacone
flaconcino
flaconcino
capsule
barattolo
Cartine
Flacone 500 mL
Flacone 100 mL
Cartine
vasetto
Flacone 1000 mL
9703
9811
9812
9693
9640
9637
9639
9690
9638
9595
9596
9592
9593
9659
9617
9687
9586
9701
9668
2110
9613
unità
unità
unità
unità
mL
unità
unità
unità
unità
mL
mL
mL
mL
unità
grammi
unità
mL
mL
grammo
grammo
mL
capsule
Cartine
9702
9619
unità
unità
Cartine
Cartine
sospensione
Flacone 1000 mL
vasetto
9620
9627
9837
2271
9616
Unità
unità
mL
mL
grammo
vasetto
vasetto
9556
9558
Grammo
Grammo
vasetto
9560
Grammo
vasetto
9562
Grammo
flacone
Vasetto 100 gr
Flacone 50-250-1000
Vasetto 100
Vasetto 100
Vasetto 100
9624
1190
9584
9691
9682
9670
mL
Grammo
Grammo
Grammo
grammo
grammo
AZIENDA USL n°3 PISTOIA
Laboratorio Galenici Centralizzato tel0573/352302 fax 0573/352339
MODULO DI RICHIESTA DEI GALENICI Codice Reparto…………... Data…………..
Calcio Clor. reagente standard
Decolorante
Decolorante per BK reagente
Mordente
Safranina
Soda 2% reagente
Sodio cloruro varie conc.
reagente
Sodio cloruro varie conc.
reagente
Tampone per BK reagente
Tampone per BK reagente
Flacone 50
9642
9634
9643
9632
9633
9664
9665
9665
9663
9663
mL
Q.tà
6
4
10
50
50
10
30
10
1
10
30
20
9
50
5
10
5
7
5
2
5
6
1
20
1
5
2
6
20
20
3
20
30
30
100
2
24
6
10
10
10
10
6
10
10
Farmaci urgenti custoditi in armadio stanza caposala
Pronto Soccorso in ordine alfabetico di specialità
Farmaco
Forma
farmaceutica
fiale
AGGRASTAT
250 mcg
fiale
ANEXATE
1 mg.ev
fiale
ANTRA
40 mg
fiale
ATROPINA 1mg/ml
Fiale
BAL
100/2ml
f
BLU DI METILENE 100mg/10ml
cp
BROMOCRIPTINA 2,5 mg
fiale
CALCIO EDETATO BISODICO
polvere
CARBONE ATTIVO g 100
Fiale
CHININA
500 mg/2ml
cp
CLOROCHINA
Fiale
CONTRATHION
fiale
DIAZEPAM –ANSIOLIN –VALIUM 10 mg
DOBUTREX -MIOZAC-REVIVAN 250 mg/20 ml Fiale
fiale
EBRANTIL 50 mg UREPRENE
fiale
EPARINA SODICA
5000 UI/ml
fiale
FARGANESSE
50 mg
fiale
FLEBOCORTID 500 mg
f
FOLINA 15 mg/2ml
fiale
HYPERSTAT
fiale
INDERAL 5 mg(5ml
fiale
INTRASTIGMINA –PROSTIGMINA 500mcg/ml
sciroppo
Ipecacuana
7%
fiale
ISOPTIN
5 mg/2ml
polvere
KAYAXELATE 100
fiale
LASIX
250
fiac
LIDRIAN -LIDOSEN- XILOCAINAfiale
LUVION - KANRENOL
cp
MESTINON
60 mg
fiale
METADOXIL
300 mg
fiale
NARCAN 0,4 mg / 1 ml
cp
NARCORAL-50mg (ANTAXONE_NALOREX)
NITROGLICERINA -VENITRIN
5 mg fiale
fiale
NITROSORBIDE
5 mg
cp
PEMINE
150 mg
fiale
PROTAMINA
50 mg
buste
QUESTRAN 4 g
fiale
REOMAX
50 mg
fiale
REVIVAN -DOPAMINA 200 mg
fiale
RYTMONORM 70mg
fiale
SEREPRILE
50 mg
fiale
SODIO EDETATO- EDTA
0,5 g
Fiale
SODIO NITROPRUSSIATO
FIALE
SODIO TIOSOLFATO ipoSOLFITO 1 g
fiale
SOLU-MEDROL
1000
Principio attivo
tirofiban
flumazenil
omeprazolo
atropina
dimercaprolo
Edetato di calcio
Carbone attivo
Chinina cloridrato
clorochina
Pralidossima
diazepam
Dobutamina
urapidil
Eparina sodica
prometazina
idrocortisone
diazossido
propranololo
neostigmina
ipecacuana
verapamile
Polistirene sulfonato
furosemide
lidocaina
Canrenoato di potassio
Piridostigmina
metadoxina
naloxone
naltrexone
nitroglicerina
Isosorbide dinitratro
penicillamina
Protamina clor.
colestiramina
Acido etacrinico
dopamina
propafenone
tiapride
Edetato di sodio
Nitroprussiato di sodio
Tiosolfato di sodio
metilprednisolone
1
20
15
20
6
15
30
20
TAMPONE PH 7,4
TENORMIN
5 mg /10ml
THAMESOL
3,6%
TRANDATE
5 mg
TRANEX
500 mg
URECHOLINE
UROMITEXAN
400 mg
VASOSUPRINA
10 mg
VECLAM-KLACID
500 mg
fiale
flaconi
fiale
fiale
cp
fiale
Fiale
Fiale
Tampone fisiologico
atenololo
trometamolo
labetalolo
Acido tranexamico
betanecolo
Mesna
Isosuprina cloridrato
claritromicina
Modulo x prelievo farmaci urgenti da frigorifero
DATA …………codice reparto …………. reparto………………
Q.tà
Farmaco frigo
forma
Principio attivo
ADRENALINA
ALBUMINA
KYBERNIN 1000 UI
KYBERNIN 500 UI
MINIRIN
PREPIDIL GEL 1mg/3gi
UMAN COMPLEX D.I. 500
U.I.
BENEFIX 1000 U.I.
EMOCLOT D.I.
KONAKION
IMMUNO HBS
540
UI
IMMUNO HBS
1ml
180
PARTOBULIN
TETANUS GAMMMA 250
U.I.
IG VENA N . I.V.
50
mg/ml
METHERGIN 0,2 mg
LONGASTATINA 0,1
mg/ml
SYNTOCINON 5 U.I.
POTAS CL FKI*2MEQ/ML
20F10ML
DIPRIVAN 100 ml
NALADOR
METALYSE
ENGERIX B
SIERO ANTIOFIDICO
fiale
flaconi
fiale
Fiale
fiale
gel
fiale
ADRENALINA
ALBUMINA
ANTITROMBINA
ANTITROMBINA
DESMOPRESSINA
DINOPROSTONE
FATTORE II-IX-X
fiale
fiale
fiale
fiale
FATTORE IX (NONAGOG ALFA)
FATTORE VIII
FITOMENADIONE
IMMUNOGLOBULINE anti EPATITE B
fiale
IMMUNOGLOBULINE anti EPATITE B
fiale
fiale
IMMUNOGLOBULINE anti RHO
IMMUNOGLOBULINE anti TETANO 250
fiale
IMMUNOGLOBULINE intravenosa 5 g.
fiale
fiale
METILERGOMETRINA(MALEATO)
OCTREOTIDE
fiale
fiale
OXITOCINA
POTAS CLORURO FIALE 2 MEQ
fiale
fiale
fiale
fiale
PROPOFOL
SULPROSTONE
TENECTEPLSI
VACCINO ANTIepatite B
SIERO ANTIOFIDICO (da richiedere
estero)
SIERO (da richiedere ministero )
SIERO (da richiedere ministero)
STREPTOCHINASI (revocato)
SIERO ANTIBOTULINICO
SIERO ANTIDIFTERICO
STREPTASE 750.000
(Revocato)
Timbro e firma del medico richiedente
N.B.Il frigorifero dei farmaci urgenti e’ collocato presso il pronto soccorso
nella stanza della caposala .Tali prodotti possono essere ivi prelevati solo
negli orari di chiusura della farmacia.
CARRELLO DELLE URGENZE
rev 1.0 26/03/2011
MATERIALE PRESENTE NEL CARRELLO DA CONTROLLARE
OGNI 1° LUNEDI’ DEL MESE
Ad ogni controllo e dopo ogni utilizzo, firmare ed archiviare questo modulo
N.B.: ogni volta che viene prelevato materiale dal carrello, deve essere subito
reintegrato; chi apre il dispositivo di sicurezza, deve riapplicarlo firmando e
datando il talloncino, con pennarello indelebile.
•Manico
laringoscopio + pile
•Lame M e L (1+1)
•1 pinza di Magill
•1 forbice non
sterile
•2 ventimask
2 aghi cannula 14G
2 lacci emostatici
•Tubi O.T.
6-7-8 (2 x mis.)
•Mandrino per
I.O.T. M e L (1+1)
2 aghi cannula 16G
2 aghi cannula 18G
2 cerotti seta da
2,5 e 5 cm
2 aghi cannula 20G
2 aghi da arteria
5 aghi ipodermici 18
5 tappi valvolati
3 siringhe
da
insulina
•Maschera
facciale n. 3
•Cannula Mayo
n. 3 (8 cm)
•Maschera
facciale n. 4
•Cannula Mayo n.
4 (9 cm)
•Maschera
facciale n. 5
•Cannula Mayo
n. 5 (10 cm)
•2 catheter
mount
•2 filtri
antibatterici
3 siringhe
da 2,5 ml.
3 siringhe
da 5 ml
3 siringhe
da 10 ml.
3 siringhe da 50/60
cono catetere
3 siringhe
da 20 ml.
3 sir.
emogas
5 rubinetti 3 vie
Atropina solfato 1mg
Flumazenil 1 mg (Anexate)
Diazepam (Valium)
Verapamil cloridrato (Isoptin)
Amiodarone Cloridrato 150mg
(Cordarone o amiodar)
Clonidina cloridrato150mcg
(Catapresan)
Adenosina (Krenosin)
Nifedipina 10 mg cp.
(Adalat)
Naloxone Cloridrato (Narcan)
Sodio bicarbonato 1 M (10 fl)
Magnesio solfato fl
Propafenone Cloridrato
(Rytmonorm)
Lidocaina 2% fl e spray (Ecocain)
Dopamina (Revivan)
Furosemide20 mg (Lasix)
Digossina 0,5 mg (Lanoxin)
Nitroglicerina (fl e spray)
Natispray / Perganit 50 ml flac.
Glucosio
33% 10 ml
(10 fl)
Idrocortisone 500 mg
Calcio Gluconato 10 ml 5 fl.
(1)
Betametasone 4 mg (Bentelan)
Midazolam 15 mg (Ipnovel)
Fluticasone
propionato
(Fluspiral puff)
Flebocortid 500 mg
Efedrina cloridrato 25mg
Urapidil (Ebrantil)
Salbutamolo fiale e spray
(Broncovaleas - Ventolin)
Metilprednisolone 500 e 2000 mg
(Solu Medrol)
Desametasone fosfato 8 mg
(Soldesam)
Sol. fisiologica 10 ml (10 fl)
continua sul retro
Catetere venoso monolume (2)
Catetere venoso bilume (2)
2 lame bisturi n.11 – portaaghi
2 filo per sutura 2/0
Tegaderm (3)
Sondini
naso-gastrici
misura
16 (3)
Telini sterili con foro (2)
Telini sterili senza foro (2)
Minitrach (1)
Guanti sterili misure:
6½ - 7 - 7½ - 8
(2 per misura)
Garze sterili (5 pacchi da 5)
Elettrodi per ECG (30)
Emagel (2)
Amidolite 500 ml (2)
Soluzione fisiologica 100 (3), 250 (2) 1000 (1)
Sol. Glucosata 5% 250 ml (2)
Ringer acetato 1000 (3)
Sodio bicarbonato 1/6 Mol 500 (1)
Mannitolo 18% 500 (1)
Deflussori normali (5)
Deflussori con contagocce (5)
ossigeno
vuoto
1 – mensola
Guanti medi – Disinfettante mani
in gel – Disinfettante a base
di cloro – betadine – glissen (3)
valvole x aspiratore (2) – 5 arcelle
monouso - tubo x aspirazione
1 - Mensola
2 - Ripiano superiore
vetro
taglienti
3
cestello
sinistro
MATERIALE FUORI DAI
CASSETTI
4
cestello
inferiore
destro
2 – ripiano superiore
DAE – gel x ECG
3 – cestello sinistro
- Sondini per aspirazione
bronchiale mis. 14 (5)
- Mandrino per intubazioni
difficili (Frobac o Bougie)
4 – cestello inf. destro
Va e vieni (2)
Pallone di Ambu (1)
Sacca urina (1)
Da tenere in un contenitore unico
per averli tutti disponibili al
momento dell’urgenza
Farmaci in frigo
Adrenalina (1) - Insulina (1)
Propofol 1% (1) - Tracrium (1)
Data ____________________ Firma _____________________________
Ministero della
Salute
DIPARTIMENTO DELLA QUALITÀ
DIREZIONE GENERALE DELLA PROGRAMMAZIONE SANITARIA, DEI
LIVELLI DI ASSISTENZA E DEI PRINCIPI ETICI DI SISTEMA
UFFICIO III
RACCOMANDAZIONE
SUL
CORRETTO
UTILIZZO
DELLE
SOLUZIONI CONCENTRATE DI CLORURO DI POTASSIO – KCL –
ED
ALTRE
SOLUZIONI
CONCENTRATE
CONTENENTI
POTASSIO
Il Cloruro di Potassio – KCl - per via
endovenosa può causare effetti letali se
somministrato in modo inappropriato
La somministrazione endovenosa di Cloruro di Potassio – KCL - è
oggetto di questa raccomandazione.
La somministrazione di KCL è stata implicata in alcuni episodi di decessi
nel nostro paese, come in molti altri paesi. Numerosi ospedali hanno già
attivato procedure per rimuovere questa sostanza dai reparti non impegnati
in attività critiche, ed è necessario che queste procedure siano rapidamente
implementate in tutte le strutture ospedaliere del nostro paese.
Raccomandazione n. 1, Aprile 2005
1. Premessa
L’esperienza e la letteratura internazionale riconoscono che l’inappropriato
utilizzo di soluzioni concentrate di potassio (K) per uso endovenoso (e.v.)
comporta un grave rischio per il paziente ed è una delle principali cause di
incidenti mortali nelle Unità Operative ospedaliere.
Gli errori che più frequentemente si associano all’uso improprio di KCl sono
lo scambio di fiala, la mancata diluizione, la non corretta preparazione del
prodotto da infondere e l’errata identificazione del paziente.
L’efficace implementazione della presente raccomandazione prevede l’attivo
interessamento dell’intero contesto organizzativo e pertanto essa si rivolge
alla direzione aziendale, alla direzione sanitaria, a medici, farmacisti ed
infermieri.
Analoghe raccomandazioni sono state elaborate in altri paesi, quali
Inghilterra, Stati Uniti, Canada e Australia e la loro adozione si è dimostrata
efficace nel ridurre drasticamente il numero degli incidenti mortali dovuti
all’uso improprio delle soluzioni concentrate di K.
2. Obiettivo della Raccomandazione
Ridurre il rischio di sovradosaggio accidentale di K derivante dall’uso
improprio di soluzioni concentrate di KCl e di altre soluzioni ad elevato
contenuto di K, garantendo nel contempo la tempestiva disponibilità del
farmaco in caso di bisogno.
2
3. Ambiti di applicazione
3.1 La presente raccomandazione si applica alle soluzioni contenenti
KCl e alle altre soluzioni contenenti K per uso e.v. con le seguenti
concentrazioni:
• 1 meq/ml
• 2 meq/ml
• 3 meq/ml
3.2 Aree critiche di assistenza
Le aree critiche di assistenza sono la Terapia Intensiva e la Rianimazione,
l’Unità Coronarica, la Nefrologia, la Cardiochirurgia, la Terapia Intensiva
Neonatale, il Pronto Soccorso e i Dipartimenti di Emergenza ed altre aree
assistenziali individuate dalla programmazione aziendale e regionale, nelle
quali è richiesto l’uso urgente del farmaco.
4. Azioni
Le azioni che devono essere messe in atto nel contesto ospedaliero
riguardano i seguenti punti critici:
4.1 Conservazione delle soluzioni concentrate di KCl ed altre soluzioni
ad elevato contenuto di K;
4.2 Prescrizione delle soluzioni concentrate contenenti K;
4.3 Preparazione delle soluzioni diluite contenenti K;
4.4 Controllo della corretta preparazione ed utilizzo delle soluzioni
contenenti K;
4.5 Gestione del processo di corretto utilizzo delle soluzioni concentrate
contenenti K.
3
4.1 Conservazione delle soluzioni concentrate di KCl ed altre soluzioni
ad elevato contenuto di K
A. Le soluzioni concentrate di KCl e le altre soluzioni ad elevato
contenuto di K per uso e.v. devono essere rimosse, laddove presenti,
da tutte le scorte di farmaci ad uso corrente esistenti nei vari
reparti. La conservazione delle soluzioni concentrate di KCl e delle
altre soluzioni ad elevato contenuto di K per uso e.v. deve essere
limitata esclusivamente alla farmacia, alle aree critiche ed ad altre
aree assistenziali, identificate dalla programmazione aziendale e
regionale, e nelle quali sia richiesto l’uso urgente del farmaco.
B. Nella farmacia e nelle unità operative in cui è prevista la
conservazione, le soluzioni concentrate contenenti KCl e le altre
soluzioni ad elevato contenuto di K per uso e.v. devono essere
conservate separate da altri farmaci, in armadi ove possibile chiusi e
in contenitori che rechino la segnalazione di allarme “Diluire prima
della somministrazione: mortale se infuso non diluito”.
C. Le soluzioni concentrate contenenti KCl e le altre soluzioni ad elevato
contenuto di K per uso e.v. non devono essere trasferite tra le diverse
unità operative e tutti gli approvvigionamenti devono essere effettuati
direttamente dalla farmacia. Deve comunque essere prodotta,
nell’ambito ospedaliero, una procedura che garantisca, quando non
attivo il servizio di farmacia, l’approvvigionamento del farmaco in
caso di necessità.
4.2 Prescrizione delle soluzioni contenenti K
A. Le soluzioni contenenti K per uso e.v. dovrebbero essere prescritte,
quando le condizioni cliniche lo consentono, in quelle formulazioni
commerciali già diluite e pronte all’uso.
4
B. Deve essere assicurata la tracciabilità nella documentazione clinica del
paziente della prescrizione da parte del medico (dose, frequenza e
velocità di infusione,firma, data e ora).
4.3 Preparazione delle soluzioni diluite contenenti K
A. Laddove le condizioni cliniche del paziente richiedano l’utilizzo di
soluzioni con diluizione commercialmente non disponibile, le
soluzioni devono essere preparate nella farmacia ospedaliera.
B. Quando non sia possibile attenersi al punto A, le soluzioni possono
essere preparate direttamente nelle unità operative, attenendosi al
protocollo scritto aziendale.
4.4 Controllo della corretta preparazione e somministrazione delle
soluzioni contenenti K
A. Un secondo operatore sanitario dovrebbe sempre controllare, durante
la fase di preparazione, la corretta identificazione del prodotto, la
dose, la via di somministrazione, la correttezza del calcolo della
diluizione rispetto alla prescrizione data, la miscelazione, la corretta
etichettatura del prodotto preparato.
C. In fase di somministrazione, il secondo operatore deve verificare
l’identità del paziente e la corretta velocità di infusione.L’avvenuta
somministrazione
deve
essere
subito
registrata
in
cartella
infermieristica riportando dose, via di somministrazione, velocità di
infusione data, ora e firma dell’operatore.
4.5 Gestione del processo di corretto utilizzo delle soluzioni concentrate
contenenti K
Nell’ambito ospedaliero, la Direzione aziendale sviluppa procedure
specifiche per la corretta gestione del rischio (risk management) associato
5
all’uso di soluzioni concentrate di K, con approccio multidisciplinare, che
includano linee-guida, check-list, modulo di richiesta prestampato, modalità
specifiche di confezionamento e di identificazione del farmaco e
formazione.
La direzione aziendale svolge le seguenti azioni:
A. Identificazione delle aree assistenziali in cui è consentita la
conservazione delle soluzioni concentrate contenenti K.
B. Produzione di una procedura che fornisca indicazioni chiare su:
• Appropriata prescrizione;
• Modalità di approvvigionamento di soluzioni contenenti K da parte
delle unità operative in modo da assicurare, in caso di bisogno, la
tempestiva disponibilità del farmaco;
• Indicazioni per la conservazione in sicurezza delle soluzioni
concentrate di K;
• Protocollo scritto per la preparazione delle soluzioni diluite;
• Indicazioni per garantire la tracciabilità della prescrizione e della
somministrazione;
• Monitoraggio delle richieste e dei consumi al fine di valutarne
l’appropriatezza d’uso.
5. Formazione
Nell’ambito dei programmi di formazione continua per il personale
sanitario coinvolto in attività assistenziali devono essere previsti specifici
richiami sui rischi connessi con la conservazione, la prescrizione, la
preparazione e la somministrazione delle soluzioni concentrate contenenti K
e sulle procedure atte a minimizzare i rischi.
6
6. Riferimenti bibliografici
Cohen M. Important Error Prevention Advisory. Hospital Pharmacy 1997;
32: 489-491.
National Patient Safety Agency. 2002.
www.npsa.nhs.uk/alerts/allAlertsView.asp
Patient
Safety
Alert.
JCAHO. 1998. Sentinel Event Alert. Accessed: 03/07/03 www.jcaho.org
U D, Hyland S. Medication safety 2002, CJHP 55 (4) 278-280.
La predisposizione della presente raccomandazione, a cura dell’Ufficio III
della Direzione Generale della Programmazione Sanitaria, dei livelli di
assistenza e dei principi etici di sistema, si è avvalsa del supporto tecnico del
Gruppo di Lavoro nazionale “Valutazione degli approcci metodologici in
tema di rischio clinico” e delle Società Scientifiche SIP, SIMEU, SIFO,
SIAARTI, SIC, ANCO e SIEUP.
7
Manipolazione Botox 100 U.I. fiale (tossina Botulinica )
(Dalla scheda di sicurezza prodotta dalla ditta ALLERGAN Revisione 8 agosto 2003)
Comservazione : in frigorifero da 2° a 8° lontano da qualsiasi ti po di alimento o
in congelatore a temperatura di -5° C o inferiori
Protezione individuale :Durante la manipolazione del prodotto occorre indossare
l’abbigliamento standard di protezione ( Cappellino , mascherina , camice monouso e guanti )
Lavare le mani con abbondante acqua dopo la manipolazione .
Non mangiare ,non bere, non fumare nell’area di utilizzo del prodotto
In caso di contatto con gli occhi ,lavare immediatamente con abbondante acqua per – 5-10
minuti
In caso di contatto con la pelle lavare accuratamente con acqua e sapone ,
Ricostituzione :ricostituire il flacone con soluz. Fisiologica per uso iniettabile, è buona pratica
effetture la ricostituzione del flacone e la preparazione della siringa sopra un telino sterile di
TNT assorbente e plastificato . La ricostituzione va effettuata iniettando lentamente il diluente
all’interno del flacone ,
evitando effervescenza e l’agitazione vigorosa che denatura la tossina,
la soluzione ottenuta deve essere limpida incolore o di color giallo chiaro
ml di fisiologica aggiunti al
flacone di botox 100 U.I.
Concentrazione risultante in
U/ 0,1ml
0,5 ml
20.0 U
1,0 ml
10,0 U
2,0 ml
5,0 U
4,0 ml
2,5 U
8,0 ml
1,25 U
Comservazione della soluzione ricostituita : Può essere conservata per un massimo di 4 ore
in frigorifero da 2°C a 8°C
Smaltimento : I materiali monouso utilizzati devono essere smaltiti come rifiuti sanitari.
Gli eventuali residui della fiala ricostituita devono essere neutralizzati con pari quantità di
Soluzione di sodio ipoclorito a percentuali dello 0,5 o superiori (attualmente disponibile
Amuchina 1,15%)
Per eventuali versamenti di materiale , la superficie contaminata deve essere risciacquata
per 5 minuti con una soluzione di ipoclorito a percentuali dello 0,5 o superiori ( attualmente
disponibile ANTISAPRIL detergente ) e accuratamente asciugata .
La sterilizzazione in autoclave a 121° per 30 o più minuti consente di rendere sicuro lo
strumentario poliuso utilizzato , che deve essere precedentemente lavato e asciugato con
cura .
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
PRESCRIZIONI DI FARMACI AL DI FUORI DELLE INDICAZIONI AUTORIZZATE
NEL DECRETO A.I.C
TRATTAMENTI IN OFF LABEL
La prescrizione di un farmaco per una indicazione clinica (e relative dosi, modi e tempi di
somministrazione) inclusa nell'AIC (generalmente corrispondente a quella in RCP o scheda tecnica) è
definita “labelled”. L'utilizzo di un farmaco per indicazioni, dosi o
modalità di somministrazione non
contemplate dall'AIC del prodotto stesso è quindi definito “off label”.
SINTESI NORMATIVA e RIFERIMENTI
Legge 94/ 98art3 comma 1 e 2, L. 244/07 art2 c. 348, L.296/06 art. 1, comma 796, lettera z.
●
Il medico, nel prescrivere una specialita' medicinale o altro medicinale prodotto industrialmente, si
attiene alle indicazioni terapeutiche, alle vie e alle modalita' di somministrazione previste
dall'autorizzazione all'immissione in commercio (AIC) rilasciata dal Ministero della Sanita' (L.94/98
art 3, c.1).
●
In singoli casi il medico puo', sotto la sua diretta responsabilita' e previa informazione del paziente
ed acquisizione del consenso dello stesso, impiegare un medicinale prodotto industrialmente per
un'indicazione o una via di somministrazione o una modalita' di somministrazione o di utilizzazione
diversa da quella autorizzata, ovvero riconosciuta agli effetti dell'applicazione dell'articolo 1, comma
4, del decreto-legge 21 ottobre 1996, n. 536, convertito dalla legge 23 dicembre 1996, n. 648,
qualora il medico stesso ritenga, in base a dati documentabili, che il paziente non possa essere
utilmente trattato con medicinali per i quali sia gia' approvata quella indicazione terapeutica o quella
via o modalita' di somministrazione e purche' tale impiego sia noto e conforme a lavori apparsi su
pubblicazioni scientifiche accreditate in campo internazionale (L. 94/98 art3 comma 2)
●
E' fatto divieto al medico curante di impiegare, ai sensi dell'art 2 Legge 94/98, un medicinale
industriale per un'indicazione terapeutica diversa da quella autorizzata, ovvero riconosciuta agli
effetti della L. 648/96, qualora per tale indicazione non siano disponibili almeno dati favorevoli di
sperimentazione clinica di fase seconda.2 c. 348 L. 244 del 24 dicembre 2007
●
La legge 27 dicembre 2006, n. 296 ed in particolare l’art. 1, comma 796, lettera z), pone ulteriori dei
limiti all’uso dei farmaci al di fuori delle indicazioni di registrazione con oneri a carico del SSN. Esso
stabilisce infatti che il ricorso, con carattere diffuso e sistematico, a terapie farmacologiche a carico
del SSN, al di fuori delle condizioni di A.I.C. (autorizzazione all’immissione in commercio), non sia
possibile, nell'ambito di strutture o trattamenti sanitari, per la cura di patologie per le quali risultino
autorizzati farmaci recanti specifica indicazione al trattamento.
Quindi, qualora il medico ritenga che il paziente non possa essere utilmente trattato con medicinali per i quali
sia gia' approvata quella indicazione terapeutica o quella via o modalita' di somministrazione, può, in singoli
casi, utilizzare un farmaco off label se ricorrono i seguenti criteri:
1
●
Mancanza di valida alternativa terapeutica da dati documentabili
●
Presenza di dati favorevoli di sperimentazione clinica di fase seconda
●
Consenso informato del paziente
●
Assunzione di responsabilità del Medico
●
Non disponibilità alla cessione per “uso compassionevole” da parte della ditta produttrice
●
In ogni caso la normativa suddetta stabilisce che l'utilizzo non è a carico SSN.
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
USI OFF LABEL A CARICO SSN/SSR
casi NORMATI da disposizioni nazionali o regionali
Per ovviare alle difficoltà terapeutiche insorte in quei settori che maggiormente avrebbero risentito di
un'interpretazione restrittiva della norma, sono stati presi provvedimenti sia a livello nazionale che regionale
tesi a rendere possibile l'utilizzo di alcuni farmaci in off label a carico del SSN/SSR
Provvedimenti nazionali
l'AIFA ha aggiornato le liste dei farmaci utilizzabili a carico SSN per specifiche indicazioni off label in
base alla legge 648/96 integrandole con ulteriori elenchi tematici. Sul sito dell'AIFA
(www.agenziafarmaco.it) sono visionabili e scaricabili dalla “sezione sperimentazione e normativa” :
●
gli elenchi singoli stilati secondo i criteri della L.648/96
●
gli elenchi organizzati in gruppi tematici (ad oggi sono 5 = oncologia, oncologia pediatrica,
ematologia, trapiantologia, neurologia)
Le modalità dell'uso sono definite nei singoli provvedimenti, per tutti la prescrizione è
esclusivamente specialistica (centri pubblici autorizzati) e la distribuzione limitata nell'ambito delle
Aziende Sanitarie (non tramite le farmacie convenzionate).
Provvedimenti regionali
La Regione Toscana, con delibere successive ha ulteriormente fornito alle aziende sanitarie
toscane, direttive sull’impiego, con onere a carico del SSR, dei farmaci fuori dalle indicazioni previste dal
provvedimento di autorizzazione all’immissione in commercio e non ricomprese dagli speciali elenchi della
legge. 648/1996 o dalle suddette liste tematiche off label nazionali.
I provvedimenti regionali sono i seguenti:
1. Delibera GRT n. 394 del 26 maggio 2008 = lista dei medicinali oncologici off label utilizzati nel
trattamento di tumori solidi ed ematologici nell’adulto,
2. Delibera GRT n. 622 del 4 agosto 2008 = lista dei farmaci oncologici off-label per uso pediatrico
(Allegato 2 A) e dei farmaci non antitumorali di supporto alla chemioterapia pediatrica,
3. Delibera GRT n. 836 del 20 ottobre 2008 = lista dei medicinali utilizzabili nel trattamento di malattie
reumatologiche,
4. Delibera GRT n. 918 del 10 novembre 2008 = lista dei medicinali utilizzabili nel trattamento
correlato al trapianto d’organo.
I medicinali inseriti negli elenchi nazionali e negli allegati alle delibere regionali sono, pertanto,
erogabili a totale carico del Servizio Sanitario Regionale esclusivamente nel rispetto delle estensioni
di indicazioni riportate nell’elenco medesimo e delle indicazioni fornite dalle singole disposizioni e
tramite distribuzione diretta dalle strutture aziendali
2
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
tabella riepilogativa uso off label
casi NORMATI da disposizioni nazionali o regionali
Mancanza di valida alternativa terapeutica da dati documentabili
Disponibilità per tale indicazione di dati favorevoli di sperimentazione clinica di fase seconda
Non disponibilità alla cessione per “uso compassionevole” da parte della ditta produttrice
Assunzione di responsabilità da parte del medico
Consenso informato del paziente (espresso a seguito di informazione completa da parte del medico delle
controindicazioni , dei possibili effetti negativi e la relativa gravità)
Piano terapeutico redatto dal medico proponente con l'annotazione “0ff label” ed il relativo riferimento
normativo (es “di cui alla L.648/06, lista AIFA xx, GDRT n.XX del xxxxxx”) come da modello allegato A.
I casi previsti dalla normativa nazionale possono essere attivati solo da specialisti afferenti a strutture
pubbliche autorizzate. I casi normati da delibere regionali anche da MMG o PLS.
Dispensazione diretta dalla struttura prescrittrice o dall'AUSL di residenza del paziente (strutture aziendali)
Obbligo di trasmissione dati di spesa alla Regione da parte delle Aziende
Obbligo di trasmissione dati di monitoraggio all'AIFA da parte delle strutture prescrittrici (solo per i casi
previsti dalla 648/06 e dalle liste off label nazionali)
3
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
USI OFF LABEL
casi NON NORMATI da disposizioni nazionali o regionali
Restano, inoltre, valide le disposizioni previste dalla DGRT 148/2007 ossia: per l’eventuale utilizzo
con oneri a carico del SSR di un medicinale per il trattamento di una patologia non prevista dal decreto di
autorizzazione all’immissione in commercio (AIC) del medicinale stesso e non ricompresa né negli speciali
elenchi di cui alla L.648/96 né negli allegati alle delibere suddette, il medico dipendente o convenzionato con
il SSN, contestualmente alla prescrizione, oltre agli adempimenti di cui sopra, è tenuto a trasmettere
una sintetica relazione alla Commissione Terapeutica Regionale (CTR), per il tramite del Settore
Farmaceutica della Direzione Generale del Diritto alla Salute e delle Politiche di Solidarietà (c/o Regione
Toscana Via T.Alderotti 26/n – 50139 Firenze) e alla Direzione Sanitaria della propria Azienda, (tramite il
Dipartimento del farmaco) circa l’attivazione della terapia avendo cura di specificare la patologia per la quale
il farmaco viene impiegato.
tabella riepilogativa uso off label
casi NON normati da disposizioni nazionali o regionali
Tutti gli adempimenti della tabella riferita ai casi normati
Piano terapeutico redatto dal medico proponente con l'annotazione “0ff label ALL. 5 DGRT 148/07” (vedi
facsimile modello Asl 3 allegato)
Invio di sintetica relazione circa l'attivazione della terapia alla Commissione Terapeutica Regione Toscana
ed alla Direzione Sanitaria della Azienda USL
Sulla base delle risultanze delle conseguenti valutazioni della sopraccitata Commissione,
la Direzione Generale del Diritto alla Salute e Politiche di Solidarietà provvederà all’eventuale
aggiornamento degli specifici elenchi allegati alle menzionate delibere.
4
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
IMPIEGO ALL'INTERNO DELLE STRUTTURE AZIENDALI
I medicinali sono richiesti alle farmacie ospedaliere tramite Piano individuale di trattamento riportante
anche il relativo riferimento normativo che ne autorizza l'uso in off label.
Casi non ricompresi da normative nazionali o regionali debbono essere autorizzati dalla Direzione
Sanitaria previo invio di apposita sintetica relazione, a firma del responsabile, da notificare anche alla CTR.
IMPIEGO AL DOMICILIO DEL PAZIENTE
I medicinali, laddove previsto dalla classificazione, sono erogati per l’impiego al domicilio del
paziente sulla base di un Piano individuale di trattamento rilasciato dal medico dipendente o convenzionato
con il SSR esclusivamente con distribuzione diretta da parte delle strutture aziendali.
Nel Piano individuale di trattamento, oltre ai dati anagrafici, ASL di appartenenza , farmaco ,
diagnosi, regime posologico a e durata di validità, il medico deve annotare il relativo riferimento
normativo che ne autorizza l'uso in off label. A titolo esemplificativo è raccomandato l'utilizzo del
facsimile allegato. (modello A: Segnalazione di impiego MEDICINALI “OFF LABEL” a favore di
residente regione Toscana)
Casi NORMATI
Il paziente con il Piano di trattamento in corso di validità (allegato A) può presentarsi presso uno dei
punti farmaceutici aziendali ospedalieri o territoriali per ritirare i medicinali in modo frazionato nel rispetto del
limite di validità e dello schema posologico indicati nel Piano medesimo.
Casi NON NORMATI
I casi non ricompresi da normative nazionali o regionali debbono essere notificati alla CTR ed alla
Direzione Sanitaria Aziendale (vedi capitolo precedente).
Il medico proponente deve inviare copia del il piano terapeutico (allegato A) comprensivo di sintetica
relazione a documentazione dell'indispensabilità dell'utilizzo, indicando i relativi riferimenti di letteratura.
In caso di medico dipendente ASL il piano terapeutico, con la relativa relazione, deve essere a firma
del responsabile UO e vistato dal Direttore Sanitario che autorizza l'erogazione diretta.
5
Azienda Usl3 di Pistoia protocollo uso farmaci off label (agg 2010)
RENDICONTAZIONE DATI
Impiego all'interno delle strutture aziendali (ricovero, DH)
Entro il 5 del mese successivo, le farmacie interne inviano al Responsabile di UO Farmaceutica
Ospedaliera, una tabella mensile riepilogativa con l’elenco dei pazienti trattati (nel rispetto della legge sulla
privacy) e dei medicinali utilizzati erogati ai punti aziendali comprensiva dell'onere finanziario sostenuto. Il
Responsabile UO Farmaceutica Ospedaliera invierà il riepilogo mensile agli uffici regionali competenti (*).
Impiego a domicilio del paziente
Entro il 5 del mese successivo, i punti di distribuzione farmaceutici aziendali inviano al Responsabile
UO Farmaceutica Territoriale una tabella mensile riepilogativa con l’elenco dei pazienti trattati (nel rispetto
della legge sulla privacy) e dei medicinali erogati comprensiva dell’onere finanziario sostenuto. Il
Responsabile UO Farmaceutica Territoriale invierà il riepilogo mensile agli uffici regionali competenti (*).
(*) Direzione Generale del Diritto alla Salute e delle Politiche di Solidarietà, Settore Farmaceutica della
Regione Toscana Via T.Alderotti 26/n – 50139 Firenze.
RESPONSABILITA' PER DANNO ERARIALE
L’obbligo di rifondere il SSR delle somme eventualmente impropriamente sostenute viene posto a
carico del medico che ha originato la prescrizione.
La trascrizione off-label effettuata dal MMG, se indotta dallo specialista, comporta una corresponsabilità.
I Direttori di Unità Operativa sono individuati quali responsabili dei procedimenti applicativi delle disposizioni
di cui al presente allegato, anche sotto il profilo della responsabilità amministrativa per danno erariale.
Nella fattispecie il Direttore di Unità Operativa è individuato quale responsabile del danno erariale in caso di :
●
applicazione di protocolli che prevedano uso diffuso e sistematico per indicazioni non registrate, non
normati, che non siano stati preventivamente notificati alla competente Direzione Sanitaria Aziendale
e da essa approvati;
●
applicazione di protocolli per singoli pazienti per indicazioni non registrate, non ricomprese negli
elenchi da normative nazionali o regionali, che non siano stati preventivamente notificati alla
competente Direzione Sanitaria Aziendale e da essa approvati.
Per eventuali chiarimenti sono disponibili i farmacisti dirigenti dell'UO Farmaceutica Territoriale (zona Pistoia
tel 0573-352818-3624-2860) ( zona Valdinievole tel 0572- 463508/505)
Allegati
A) facsimile Piano terapeutico individuale di trattamento in Off labell
6
Flow chart PP.DS.14
Flow chart della procedura per la gestione dei farmaci in ospedale
P.O. di Pescia
Rev. 0: .23/02/2011
Responsabili
Registrazioni
Documenti di
riferimento
Paziente ricoverato
Cartella Clinica
Integrata (CCI)
Valutazione Pz e documentazione clinica
Al momento
del ricovero il paziente praticava già una terapia
(1)
farmacologica?
Scheda Terapeutica
Unica (STU)
Medico
Si
Conferma
necessità, appropriatezza ed
efficacia
Medico
Si
No
No
CCI, STU
Sospensione
No
Necessità
prescrizione terapeutica
farmacologica?
PA.GRC.16
Questionario
anamnestico
Pronto soccorso
Mantenimento
Eventuale avvio verso
altri tipi di trattamento
(chirurgico, fisico etc)
Medico
Medico
Si
(2)
Medico
Scelta della tipologia e delle modalità di
somministrazione del farmaco
Medico
Scelta del farmaco da somministrare
Prescrizione terapia farmacologica
(3)
in forma scritta
STU
Programma
informatico
Gestione delle scorte
Distribuzione
PA.DS.02
PA.GRC.17
Medico
Vademecum STU
Abbrev. e simb.
standardizzati
CPSE
(6)
Compilazione delle richieste
Elenco scorte
PA.GRC.02
Pront.
Terapeut.
Aziendale
Op. U.O. Farm.
(7)
Op. U.O. Farm.
(8)
Personale addetto
cosegna farmaci
(10)
Gestione farmaci particolari
(Vedi paragrafo 5.8 PP.DS.14 )
Processo di approvvigionamento, presa in carico,
(9)
tenuta e conservazione dei farmaci
Controllo prescrizione in fase di preparazione
Preparazione terapia farmacologica
Op. U.O. Farm.
CPSE, CPSI,
Medici
Op. U.O. Farm.
Prescrizione farmaci off-label
(Vedi allegato 1 PP.DS.14 )
(11)
Op. U.O. Farm.
CPSE
PA.GRC.16
Norme buona
prep.medicinali
(FU XI),
PR.05, IO.05
Controllo prescrizione in fase di somministrazione
Verifica della validità e integrità del farmaco
Identificazione paziente
CPSI
Controllo storia del paziente, allergie, ecc
(12)
Somministrazione terapia
PA.GRC.17
Vademecum STU
Documentazione dell’avvenuta somministrazione
Monitoraggio della terapia farmacologica
Modifica prescrizione
PA.DS.02
PA.GRC.17
Vademecum
STU
(4)
È confermata l’efficacia della terapia?
STU, CCI
No
aggiustamento dosaggio
Medico
Si
Il dosaggio è sufficiente?
No
Si
Mantenimento terapia
Continuità assistenziale
STU
Scheda ambulatoriale
Lettera di dimissione
Lettera di trasferimento
Medico / CPSE
(5)
Prescrizione finale della terapia
Personale altro
Livello assistenz.
distribuzione
diretta farmaci
Medico
Medico
Op. U.O.
Farmacia
PA.DS.02
PA.GRC.17
Vademecum STU
PTA
Note
Al momento del ricovero alcuni pazienti seguono già una particolare terapia farmacologia domiciliare. Si ricorda che il Medico del reparto accettante è
tenuto ad analizzare tale terapia e a stabilire attraverso consegne scritte se questa debba essere sospesa, sostituita con specialità ricomprese nel PTA o
- proseguita tale e quale anche durante il ricovero ospedaliero, in caso di mancanza di alternative terapeutiche disponibili. In quest’ultimo caso dovrà
predisporre la richiesta di acquisto dei farmaci ritenuti necessari ma non disponibili in Farmacia, sull’apposita modulistica in blocchi di cui ogni
reparto dispone: “protocollo di richiesta farmaci non inclusi in prontuario”. L’eventuale residuo del medicinale dovrà essere consegnato al paziente al
momento della dimissione.
(2) Il farmaco deve essere scelto in base alla diagnosi, efficacia terapeutica, interazioni farmacologiche, controindicazioni, allergie. Deve essere indicato il
nome commerciale e/o il principio attivo, dose, forma farmaceutica, posologia, via e modalità di somministrazione con indicazione temporale e in
alcuni casi età e peso del paziente. La prescrizione deve essere effettuata tenendo conto dei prodotti inseriti nel PTA. Le eccezioni vanno notificate alla
Direzione Sanitaria.
(3) Il medico prescrive la terapia sulla STU. Le prescrizioni devono essere chiaramente leggibili (scrivere in stampatello) e non devono dare adito a
confusione: chiarezza grafica, di contenuto, completezza, tracciabilità. La trascrizione della prescrizione deve essere evitata, in quanto rappresenta una
delle maggiori cause di errori. Deve essere evitato al massimo l’uso di numeri decimali (es. scrivere 500mg invece di 0,5g), in caso di utilizzo di
numeri decimali, usare sempre uno “zero” iniziale prima di un numero decimale inferiore ad uno (es. 0,5ml), per contro evitare l’uso di uno “zero”
terminale dopo un numero unitario (es.5,0ml) poiché tale scritta potrebbe prestarsi ad erronea lettura con somministrazione di dosaggio 10 volte più
Pediatra
elevato. Evitare le abbreviazioni dei nomi dei farmaci o la terminologia latina per l’uso. Tutte le abbreviazioni e i simboli standardizzati
sono
disponibili e riportati sull’informatore farmaceutico disponibile in reparto. Evitare nelle prescrizioni la frase “al bisogno”, ma, qualora riportata, deve
essere specificata la posologia, la dose massima giornaliera e l’eventuale intervallo di tempo fra le somministrazioni. La prescrizione farmacologica in
forma verbale di regola non è ammessa; deve essere riservata solo a situazioni di emergenza/urgenza. Occorre la conferma del nome del farmaco da
parte di un infermiere che è tenuto a fare lo “spelling”. Appena possibile, deve comunque essere convalidata in forma scritta dal prescrittore, con
annotazione, nella documentazione di competenza, della pregressa prescrizione verbale, affinché sia rintracciabile la reale sequenza degli atti. La
prescrizione verbale non è comunque ammessa per i farmaci per i quali la norma prevede la prescrizione scritta obbligatoria. Il professionista a cui
compete dar seguito alla citata prescrizione ha cura di annotare nella cartella clinica, la disposizione ricevuta, corredata di precisazione temporale,
delle generalità del prescrittore e di ogni altro elemento correlato che stimi appropriato registrare.
(4) La modifica di una prescrizione, per i profili di responsabilità e sul piano concettuale, si configura quale nuova prescrizione e, come tale, deve
soddisfare i requisiti sopraindicati. E’ necessario mantenere la traccia di quanto precedentemente prescritto permettendo di apprezzare agevolmente
l’intervenuto cambiamento
(5) Al momento del passaggio ad altro setting assistenziale del paziente deve essere garantita la continuità della terapia farmacologia anche tramite la
stesura di una lista dei farmaci in uso al momento di passaggio ad altro setting
(6) Il responsabile di ogni Struttura Organizzativa definisce un elenco quali quantitativo dei medicinali e DM che devono costituire la dotazione ordinaria.
L’elenco deve essere disponibile per la consultazione presso la stessa Articolazione Organizzativa. L’entità delle scorte presente deve essere correlata
alle esigenze e agli effettivi consumi della struttura per far fronte al fabbisogno di una settimana e corrispondere al PTA. L’elenco deve essere
stampato e ben visibile al personale.
(7) La Caposala o infermiere della struttura delegata controlla le scorte ipotizzando il fabbisogno dei farmaci di largo consumo ed inserisce la richiesta nel
programma informatico. Le richieste di prodotti farmaceutici per il reintegro delle scorte di reparto sono eseguite, di norma, dal personale
infermieristico. Le richieste di prodotti farmaceutici con caratteristiche particolari (farmaci personalizzati, farmaci ad alto costo) non effettuate per
reintegrare la scorta di reparto devono essere firmate dal medico. Le richieste dei reparti del materiale di consumo farmaceutico devono essere
effettuate nel rispetto delle modalità operative descritte nel paragrafo 5.2.3 della Procedura di Presidio PP.DS.14 e seguono diversi percorsi come di
seguito indicato: Laboratorio farmacia interna PO di Pistoia, Caposala PS PO Pescia, Direzione Sanitaria,Sezione Tecnologie Sanitarie, Ditta
AIRLIQUIDE.
(8) Distribuzione: a) Dal MAV ai reparti. Il MAV distribuisce ai reparti i farmaci e i DM richiesti. b) Dalla Farmacia ai reparti. Per i prodotti non
presenti al MAV (farmaci sottoposti alla legge sugli stupefacenti, emoderivati, farmaci esteri, galenici, ecc). La procedura di distribuzione per i
farmaci non urgenti dalla farmacia prevede che il materiale richiesto sia consegnato ai reparti al momento della consegna della richiesta compilata in
duplice copia sull’apposito registro, nell’orario di apertura della farmacia. La richiesta sarà accompagnata anche dal modulo personalizzato qualora
necessario
(9) La presa in carico, la tenuta, lo stoccaggio e la conservazione dei farmaci, nonché il controllo delle scadenze, la gestione dei farmaci scaduti e il
controllo e restituzione dei prodotti a seguito di segnalazione della farmacia sono descritti nei paragrafi 5.4 e 5.5 della Procedura di Presidio PP.DS.14
(10) La gestione delle seguenti tipologie di farmaci è descritta in dettaglio della procedura di Presidio PP.DS.14 e suoi allegati:
- Campioni gratuiti
- Farmaci personale del paziente
- Farmaci con nomi o etichette simili
- Farmaci ad alto rischio: Potassio Cloruro, Botox, Stupefacenti
- Farmaci carrello delle emergenze
(11) Nell’allestimento delle preparazioni da effettuarsi in Farmacia occorre attenersi alla Norme di Buona Preparazione dei Medicinali. Oltre al controllo
della precisa corrispondenza tra la prescrizione medica e il medicinale prelevato per l’impiego, il personale addetto deve comunque sempre verificare
la scadenza ed integrità dei farmaci dispositivi medici. Devono essere controllate le diverse prescrizioni per lo stesso paziente. Deve essere effettuato
sempre il controllo della prescrizione: in caso di informazione mancante o dubbia l’infermiere e/o il farmacista devono chiedere chiarimenti al medico.
La preparazione della terapia deve essere effettuata subito prima della somministrazione per evitare il deterioramento dei componenti del prodotto.
Nella preparazione della terapia farmacologia vengono considerati il contesto ambientale in cui si opera, la tipologia del farmaco, le caratteristiche
dello stesso, le modalità di ricostituzione e di diluizione, la stabilità chimico-fisica, eventuali incompatibilità con altri farmaci. Evitare durante la
preparazione le frequenti interruzioni. Attenersi alla specifica procedura per l’allestimento di farmaci chemioterapici.
(12) La somministrazione della terapia deve essere un atto unitario, sequenziale e cronologico. Atto unitario in quanto deve essere compiuto da una sola
persona. Il principio dell’unitarietà dell’azione (colui che prepara il farmaco è quello che lo somministra) riconosce delle eccezioni; esse sono date da:
situazioni di emergenza, attività di insegnamento agli studenti, preparazione centralizzata in farmacia, ecc. La somministrazione non deve mai essere
effettuata nel caso in cui la prescrizione risultasse non chiara e incompleta. In caso di ancata corrispondenza (es. non disponibilità del farmaco
richiesto) e di sostituzione dello stesso con prodotto di apparente analoga composizione, o di dubbi riguardo l’integrità del prodotto il farmaco non
deve comunque Prima di ogni somministrazione, colui che somministra deve identificare il paziente controllandone nome e cognome riportati sulla
scheda di terapia e sul braccialetto identificativo se presente, chiedendo conferma delle generalità al paziente (se è in grado di farlo), oppure
consultando la documentazione sanitaria. Informare il paziente se possibile circa la terapia che gli è stata prescritta inclusi gli effetti collaterali e di
incoraggiarlo a fare domande relativamente alla terapia somministrata: la corretta informazione al paziente aumenta la sua compliance. L’addetto alla
somministrazione deve controllare attraverso la cartella clinica, la STU e il braccialetto identificativo se presente, la presenza di eventuali allergie. Le
unità posologiche del farmaco non devono essere rimosse dalla loro confezione originale, fino al momento della loro preparazione o
somministrazione. Si appone la sigla (infermiere/ostetrica) dell’avvenuta somministrazione sulla STU. In caso di variazioni rispetto al piano
terapeutico, incluso il rifiuto della terapia da parte del paziente, occorre registrare l’accaduto sulla documentazione sanitaria, informandone il medico
responsabile.
(1)