![(Microsoft PowerPoint - Bioenergetica [modalit\340 compatibilit\340])](//s1.studylibit.com/store/data/001091089_1-c31cee3923ca787caf520f2384eef8ca-768x994.png)
LA CAPACITÀ
DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI
Bisogni degli esseri viventi:
•Energia (luce, molecole organiche)
•Catalizzatori biologici (enzimi)
La termodinamica studia i
flussi/trasformazioni di energia
Bioenergetica: termodinamica
applicata ai sistemi biologici
Energia: capacità di compiere un lavoro
o meglio
Capacità di causare specifici cambiamenti
1. Lavoro di sintesi: cambiamenti nei legami
chimici (turnover, crescita)
2. Lavoro
meccanico:
cambiamenti
nella
localizzazione o nell’orientamento di una cellula
o di una sua parte
3. Lavoro di concentrazione: movimento di
molecole attraverso una membrana contro
gradiente di concentrazione
4. Lavoro elettrico: movimento di ioni attraverso
una
membrana
contro
un
gradiente
elettrochimico.
5. Calore: aumento di temperatura (utile negli
animali a sangue caldo,OMEOTERMI).
6. Bioluminescenza: produzione di luce
Gli organismi viventi ottengono E dalla luce del sole (fototrofi) o dalle
molecole organiche del cibo (chemiotrofi).
ENTROPIA: disordine (S)
ENTALPIA: calore (H)
Flusso di energia attraverso la biosfera è unidirezionale: sole→
→biosfera
→entropia universo
Flusso di materia è ciclico
Il nitrato ( inorganico ) è trasformato dalle piante in ammoniaca e lo usano per la
sintesi di Aa, proteine, nucleotidi, ac. nucleici.
Tutte le forme di energia possono essere di due tipi:
•CINETICA o energia di movimento
(movimento di elettroni, onde, atomi etc;
es: E. elettrica, E. Termica, suono, velocità, …)
•POTENZIALE o energia di posizione
(o energia immagazzinata;
es energia chimica, nucleare, molla compressa, …)
Concetto di sistema in termodinamica
Sistema: porzione di universo considerato relativamente agli scambi di energia (sotto
forma di calore o lavoro) con ambiente circostante.
NB:
Chiuso: scambia solo E
Aperto: sia E che massa
Gli esseri viventi sono sistemi aperti!
I legge della termodinamica: Legge della conservazione dell’E.
L’energia può essere convertita da una forma all’altra, ma non può mai
essere creata né distrutta.
Nel caso delle reazioni e dei processi biologici si è maggiormente interessati
al cambiamento di ENTALPIA o contenuto di calore (H).
H = E + PV
Nelle reazioni biologiche ∆ P e ∆ V = 0
Becker et
al.
∆H negativo : reazione esotermica;
∆ H positivo: reazione endotermica
∆ H = H prodotti – H reagenti
II legge della termodinamica:aumento dell’entropia S
In ogni cambiamento chimico e fisico il disordine complessivo del sistema e
dell’ambiente (universo) aumenta sempre.
In base al I e II principio della termodinamica
Energia libera = G
∆H=∆G+T∆S
∆G = ∆ H – T ∆ S
Ogni reazione spontanea è caratterizzata da
una diminuzione di E libera (∆ G sistema < 0)
e da un aumento di entropia ( ∆ S universo > 0).
Tutte le reazioni che avvengono spontaneamente hanno come conseguenza una
diminuzione nel contenuto di Energia libera del sistema.
•Le reazioni esoergoniche liberano energia (∆G negativo)→
→spontanee
•Una reazione endoergonica richiede E (∆G positivo) →non spontanee
La variazione di energia libera (∆G) indica se la reazione è spontanea
∆G negativo→
→spontanea
∆G positivo→
→non spontanea
Nei viventi metabolismo include reazioni sia esoergoniche che endoergoniche
Strategia dell’accoppiamento delle reazioni! in modo che ∆G complessivo<0
L’accoppiamento tra 2 reazioni/processi in una cellula può avvenire:
•tra reazioni diverse ma con intermedio comune
•Formazione di proteina in stato/conformazione “attivato” (es proteine motrici)
•Uso di gradienti elettrochimici
Es. energia potenziale sotto forma di gradiente di concentrazione
Luce solare
fototrofi
ATP
Ossidazione
nutrienti
chemiotrofi
L’ATP è la molecola più usata dai viventi per
accoppiare reazioni esoergoniche ed
endoergoniche.
ATP ha alta energia potenziale nei legami dei
gruppi P
la rimozione/idrolisi del P è fortemente
esoergonica
Cioè ha un alto potenziale di trasferimento del
gruppo P
L’ATP libera energia utile per le reazioni endoergoniche
attraverso il trasferimento del gruppo fosfato.
ATP
Lavoro chimico
Lavoro meccanico
Lavoro di trasporto
Membrana della proteina
P +
Proteina
motrice
Soluto
P
Reagenti
P
P
P
Prodotto
Molecola formata
P
Proteina mobile
ADP + P
Soluto trasportato
Becker et al.
Diminuzione della stabilizzazione per risonanza dei gruppi carbossilato e fosfato in
seguito alla formazione di legami.
(b) Un legame anidridico dà come risultato una maggiore delocalizzazione elettronica in
entrambi i prodotti, quindi ha una maggiore energia di idrolisi
Perché l’idrolisi dell’ATP è tanto esoergonica?
Becker et al.
L’idrolisi dell’ATP a ADP + Pi è esoergonica a causa della
-repulsione di carica tra gruppi fosfato e
-della stabilizzazione per risonanza di entrambi i prodotti dell’idrolisi.
-Quindi il prodotto di reazione è + stabile e favorito termodinamicamente
La vera struttura dei gruppi fosfato è in realtà la media delle strutture che vi
contribuiscono, detta IBRIDO DI RISONANZA, nel quale gli e ־in eccesso sono
delocalizzati su tutti i possibili legami
Becker et al.
Importante: l’ ATP è un composto fosforilato ad E intermedia!
La coppia ATP/ADP rappresenta un mezzo reversibile per conservare, trasferire
e rilasciare E all’interno della cellula.
L’E libera rilasciata al momento dell’idrolisi dell’ATP fornisce la forza per
trascinare i numerosi processi necessari per la vita.
Ciclo dell’ATP
Catabolismo
respirazione cellulare
L’ATP è continuamente consumata e rigenerata
Lavoro cellulare
(anabolismo, trasporto molecole,
attivazione proteine,..)
Anche i coenzimi trasportatori di elettroni (NAD, FAD, NADP)
sono molecole con alto contenuto di energia potenziale
↑potenziale di trasf . di e-
In una reazione reversibile all’equilibrio la tendenza a dare prodotti o reagenti è la
stessa
L’equilibrio è influenzato dalla concentrazione di reagenti e prodotti
Nei sistemi biologici le reazioni sono quasi sempre tenute lontane dall’equlibrio!
L’energia libera associata al sistema è minima all’equilibrio e aumenta
quando ci si sposta dall’equilibrio in una delle 2 direzioni!
dG<0→
→ reazione procede vs dx
dG=0 → reazione all’equilibrio
dG>0 → reazione procede vs sx
R: costante dei gas
T: 298Kelvin=25°C
∆G dice solo se una reazione può avvenire, ma non dice se avverrà
∆(valore assoluto =energia scambiata; segno: spontaneità, direzione del processo).
NB: le uniche reazioni che avvengono a velocità
apprezzabile in una cellula sono quelle per le quali sono
presenti e attivi i catalizzatori proteici (enzimi) o ad RNA
(ribozimi) appropriati.
Il ruolo di un catalizzatore è quello di abbassare l’ energia
di attivazione (Ea) richiesta per fare avvenire una reazione.
In questo modo la reazione è accelerata
L’accelerazione della velocità di reazione è detta CATALISI
L’energia di attivazione (EA) è la quantità minima di E cinetica che le
molecole di reagente devono possedere per consentire il verificarsi delle
collisioni, che portano alla formazione del prodotto.
Attivazione termica→
⇑ frazione molecole con
alta energia
(b) Il numero di molecole con
sufficiente energia per superare la
barriera dell’(EA) e collidere può
aumentare alzando la temperatura da
T1 a T2. non realizzabile nei viventi
Catalisi → ↓EA
l’Ea può essere abbassata da un
catalizzatore, aumentando in tal
modo il numero di molecole da N1 a
N’2
Che cosa fa un catalizzatore?
Legando i reagenti ad una sorta di superficie in modo da giustapporre
le parti potenzialmente reattive di molecole adiacenti, è favorita la loro
interazione ed effettivamente ridotta l’E di attivazione.
Fornire questa superficie reattiva è compito del CATALIZZATORE.
NB: Il catalizzatore non è permanentemente modificato o consumato
al procedere della reazione.
Es di catalizzatori: enzimi, ribozimi, metalli
UN CATALIZZATORE:
1) ↑ la velocità di una reazione (107-1014 volte)
2) Forma complessi transitori con le molecole di substrato,
legandosi ad esse in modo da facilitarne interazione
3) Cambia solo la velocità con cui si raggiunge l’equilibrio, ma non
può in alcun modo far avvenire una reazione endoergonica.
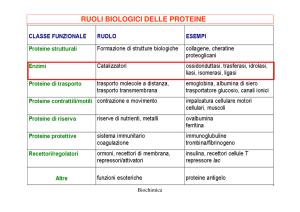
Gli enzimi sono proteine che agiscono come catalizzatori biologici:
accelerano la velocità delle reazioni senza alterare il ∆G.
Con la catalisi l’enzima abbassa l’Energia di attivazione richiesta affinchè la
reazione inizi
Ogni enzima contiene un SITO ATTIVO che riconosce e lega
specificamente il substrato e dove avviene l’evento catalitico.
Sito attivo:
“tasca”molecolare in cui si inserisce specificamente il substrato
Gli aa del sito attivo generalmente non sono contigui lungo la sequenza
primaria, ma vengono portati vicini col ripiegamento 3D della catena
polipeptidica.
Tipico è anche il coinvolgimento di Aa in posizioni distanti lungo la
struttura primaria.
Dei 20 Aa solo pochi sono implicati nei siti attivi: cisteina, istidina, serina,
aspartato, glutammato, lisina.
Alcuni enzimi includono componenti NON proteiche: i cofattori
COFATTORI= piccole molecole organiche (coenzimi) oppure ioni metallici che
spesso partecipano alla catalisi in modo determinante.
Grazie al sito attivo gli enzimi hanno un elevato grado di specificità di substrato.
ENZIMI x sintesi o degradazione: specificità di gruppo ( più economico per
la cellula).
Gli ENZIMI sono altamente specifici nell’interazione col
substrato e per il tipo di reazione catalizzata
Ogni cellula possiede migliaia di enzimi specifici per diverse reazioni
La catalisi avviene favorendo lo stato di transizione:
1. Portare vicine tra loro molecole dei reagenti
2. Orientarle come nello stato di transizione
3. Creare microambiente che ne agevola reazione
Caratteri degli enzimi
1. Elevata specificità
2. Regolazione
3. Sensibilità a T, pH, forza ionica,..
Interazione enzima-substrato
a)Modello chiave serratura- rigido
b)Modello adattam.indotto→
→distorsione di enzima e substrato→
→reazione favorita
Le reazioni catalizzate da enzimi sono 107 – 1014 volte più veloci!
L’attività degli enzimi è influenzata da temperatura e pH .
T elevata denatura l’enzima
intestino
stomaco
La
DIPENDENZA
DAL
PH
è
generalmente dovuta alla presenza
di uno o più Aa carichi nel sito
attivo
e
riflette
l’ambiente
fisiologico in cui l’enzima opera.
Sensibilità ad altri fattori:
• substrati alternativi
• Ambiente ionico.
a) V reazione aumenta con aumento di enzima (eccesso di substrato)
b) V reazione aumenta fino ad un MAX se la conc. di enzima è
costante
saturazione
Inibizione degli enzimi
Inibizione reversibile e irreversibile
a) Inib revers. competitiva
b) Inib revers. non competitiva
Inibitori enzimatici come farmaci specifici e selettivi
Es. Sulfonammidi, antibiotici, farmaci antitumorali,…
Regolazione allosterica
L’Enzima esiste in due forme attiva /non attiva, determinate dal legame con
effettore allosterico (positivo o negativo) su sito allosterico (diverso dal sito
attivo)
Enzimi multimerici; subunità catalitiche e regolatorie; cooperatività
Inibitori e/o effettori allosterici possono regolare l’attività enzimatica
Es: inibizione a feed-back (o
da prodotto finale).
Un
prodotto
metabolico
inibisce uno degli enzimi
coinvolti
nella
catena
metabolica che porta alla
sintesi del prodotto.
Oltre alla regolazione allosterica molti E sono anche
soggetti a controllo mediante modificazione chimica.
A) Aggiunta/rimozione di gruppi P
a) Fosforilazione ad opera delle
proteinchinasi:
trasferimento di un gruppo
fosfato dall’ATP al gruppo
–OH di una serina, treonina o
tirosina.
b)
Defosforilazione ad
delle protein-fosfatasi
opera
Es: glicogeno fosforilasi regolata
mediante
fosforilazione/defosforilazione
B) Taglio proteolitico
Es: proteasi pancreatiche sintetizzate come precursori inattivi
Non tutti gli enzimi sono proteine!
Ribozima
Auto-excisione e splicing dell’introne
dal pre-rRNA:
Una molecola precursore di rRNA di
Tetraymena contiene un introne in grado di
catalizzare la propria excisione dalla molecola
di pre.rRNA.
Altri es.: ribonucleasi P, ribosomi
A seguito del preciso adattamento chimico tra il sito attivo di un enzima e i
suoi substrati, gli enzimi sono molto efficaci quali catalizzatori.
Le reazioni catalizzate da enzimi sono 107 – 1014 volte più veloci.
Attivazione del substrato.
Il ruolo del sito attivo non è solo quello di riconoscere e legare l’opportuno
substrato, ma è anche quello di attivare il substrato.
1) Il cambiamento nella conformazione dell’enzima, indotto dal legame
iniziale del substrato al sito attivo, causa non solo una migliore
complementarietà e un più stretto adattamento E-S, ma anche distorce 1
o più legami del substrato indebolendoli e rendendoli più suscettibili
all’attacco catalitico.
2) L’Enzima può anche accettare o donare protoni, aumentando la reattività
chimica del substrato.
3) Gli Enzimi possono anche accettare o donare e-, formando in tal modo
legami covalenti temporanei tra E e S.
![(Microsoft PowerPoint - Bioenergetica [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001091089_1-c31cee3923ca787caf520f2384eef8ca-768x994.png)