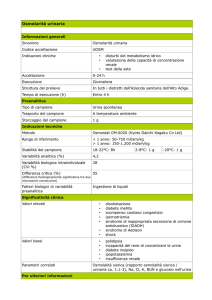
Il Sangue e il plasma
2. Eritrociti, pressione osmotica
del plasma, tonicità
Carlo Capelli – Fisiologia Facoltà di
Università di Verona
Obiettivi
Eritrociti: caratteristiche morfologiche e “life span”
Proteine plasmatiche: composizione e principali funzioni
Proteine plasmatiche e pressione colloido-osmotica
Concetto di pressione osmotica
Tonicità e osmolalità effettiva
A parità di soluti osmoticamente attivi, la TBW determina
l’osmolalità
7. La concentrazione di Na+ extracellulare determina il
volume del liquido extracellulare
8. Meccanismi cellulari che regolano il mantenimento del
volume cellulare
9. Equilibrio di Gibbs-Donnan
1.
2.
3.
4.
5.
6.
1. Eritrociti
• Forma biconcava
2.4 ± 0.15 µ
2.4 µ
Area: 140 ± 17 µ2
Volume: 84 ± 17 µ3
8.3 µ
1.0 ± 0.30 µ
8.3 ±0.43 µ
• Indice di sfericità
• per una sfera è uguale a 1; gg.rr. normali 0.77 ± 0.025 4.84 V2/3
SI =
A
2. Indice di Sfericità e Eritrociti
• Indice di sfericità
• La superficie dell’eritrocita di forma discoide è molto più ampia di
quella che avrebbe la cellula se avesse un forma sferica
• Quindi, la forma discoide ottimizza l’area disponibile per la
diffusione dei gas
• Vi sono sostanze che inducono una trasformazione reversibile da
discoide a sfera. Esse comprendono anche dei detergenti anionici
• Queste sostanze, in alte concentrazione, sono lisanti.
• Quindi, vi sono delle proteine plasmatiche che preservano la forma
discoide
• In alcune condizioni ed in patologie compaiono forme abnormi di
eritrociti.
“Life span” degli eritrociti
• Normalmente, la probabilità di un globulo rosso di andare
incontro a distruzione dipende dall’età della cellula - teoria
dell’aging o teoria intrinseca della distruzione.
• In patologia, la probabilità di andare incontro a distruzione
è del tutto indipendente dall’età - teoria estrinseca della
distruzione; la distruzione sarebbe indipendente dall’età
• Nel primo caso si deve parlare di “life span”, nel secondo
di emi-vita per caratterizzare la durata della vita della
popolazione cellulare
“Life span” degli eritrociti
• Il life span è la media della durata dell’esistenza di una
popolazione di cellule
• L’esistenza si distribuisce secondo una curva gaussiana,
distribuzione normale
• In media attorno ai 100 giorni per gg.rr. sani
“Life span” degli eritrociti
1.
•
2.
•
Curva in tratto continuo:
descrive i risultati sperimentali
ottenuti con gg.rr. marcati con
materiale radioattivo
Curva tratteggiata
Il
tracciato
monoesponenziale
descrive la curva che ci si potrebbe
attendere se la distruzione dei gg.rr.
fosse indipendente dall’età
dy
=-k • y
dx
Proteine plasmatiche
1. Riserva di a.a.
2. Carriers
3. Sostanze tampone
(anfotere)
4. Zimogeni
5. Responsabili della
pressione colloidoosmotica
• 60 % proteine
plasmatiche totali:
albumina
• 40 % proteine
plasmatiche totali:
globuline
1. Pressione osmotica - Movimento di H2O
• Il trasporto dell’acqua attraverso le membrane biologiche è sempre passivo ed è una
funzione lineare non saturabile della cosiddetta net driving force (NDF)
• L’acqua passa attraverso pori specifici (AQP1 e AQP2) costituiti da proteine
specializzate (acquaporine)
• La forza netta (NDF): i) potenziale chimico (∆µH2O), dipende dalla differenza tra le
concentrazioni dell’acqua e; ii) differenza di pressione idrostatica (∆µH2O, Pressione) a
cavallo della membrana.
ΔµH2 O, Totale = ΔµH2 O + ΔµH2 O, Pressione
Volume parziale molare di H2O
ΔµH2O, Totale
Differenza di energia totale
H O]
[
= RT ln
+ V (P - P )
H O]
[
2
i
H 2O
2
o
i
Parte idrostatica
Parte chimica
Lavoro per mole
o
2. Pressione osmotica - Movimento di H2O
• osmolalità, ovvero di concentrazione di soluti osmoticamente
attivi per kg di solvente puro
• In soluzioni diluite, il gradiente di concentrazione di H2O a
cavallo delle membrane è grossomodo proporzionale alla
differenza delle osmolalità
H O]
[
ln
[ H O]
2
i
2
o
≅ VH2O ( Osm o - Osm i )
ΔµH2O, Totale = VH2O • ⎡⎣ RT( Osm o - Osm i ) + ( Pi - Po ) ⎤⎦
Energia per mole
Volume
Mole
Pressione
3. Pressione osmotica - Movimento di H2O
ΔµH2O, Totale = VH2O • ⎡⎣ RT( Osm o - Osm i ) + ( Pi - Po ) ⎤⎦
Energia per mole
Volume
Mole
Pressione
• Il termine tra parentesi quadre è una pressione.
• Corrisponde, quindi, al fattore intensivo, la forza che determina il flusso dell’acqua
(Jv, litri/cm2 s) attraverso la membrana
• Lp: conduttività idraulica di membrana
J v = L p ⎡⎣ RT ( Osm o - Osm i ) + ( Pi - Po ) ⎤⎦
4. Pressione osmotica - Movimento di H2O
• Equilibrio
• In questo caso ∆µH2O, Totale è uguale a zero.
RT( Osm o - Osm i ) =
Differenza di pressione osmotica, ∆π
Pi - Po )
(
Differenza di Pressione idrostatica, ∆P
• Una differenza di 1 mosmole/kg = differenza di 19.3 mm Hg a 37 °C (1 osmole ≈ 25
atmosfere a 37° e 22,4 atmosfere a 0 °C; π = nRT).
• Le membrane delle cellule animali non sono molto rigide. Quindi, ∆P a cavallo delle
membrane è sempre praticamente zero e non costituisce una forza netta per il trasporto
di acqua.
• Il trasporto di acqua è determinato dalle differenze di pressione osmotica. Questo
movimento prende il nome di osmosi
• Caso particolare: trasporto di ultrafiltrato attraverso le pareti dei capillari: 1) esiste una
differenza di P a cavallo delle pareti dei capillari; 2) esiste una differenza di pressione
osmotica dovuto all’accumulo di proteine nel plasma - 25 mm Hg - Pressione
colloidoosmotica o pressione oncotica
1. Tonicità e osmolalità effettiva
Osmolalità totale
[ ]+
Osmolalità totale (mOsm) = 2 • Na
+
Glucosio (mg/dl)
18
+
BUN (mg/dl)
2.8
Osmolalità effettiva o tonicità
[ ]+
Tonicità (mOsm) = 2 • Na
+
Glucosio (mg/dl)
18
Liquido iso-osmolali: 290 mOsm
Liquidi isotonici
• Soluzione isotonica: la sua osmolalità effettiva è uguale a quella della soluzione
di riferimento, p.e il plasma
• Soluzione ipotonica: osmolalità effettiva è minore di quella della soluzione di
riferimento
• Soluzione ipertonica: osmolalità effettiva è maggiore di quella della soluzione di
riferimento
2. Tonicità e osmolalità effettiva
• Gli spostamenti di acqua tra i compartimenti
extracellulare e intracellulare sono dovuti ad
alterazioni dell’osmolalità effettiva del liquidi
extracellulare (tonicità)
• Dal punto di vista clinico, queste modificazioni della
tonicità sono solitamente dovuti ad iponatriemia,
ipernatriemia o iperglicemia
3. Tonicità e osmolalità effettiva
• Modificazioni stabili del volume
cellulare non si stabiliscono in
presenza di modificazioni della
concentrazione extracellulare di un
soluto scambiabile
4. Osmosi ed Eritrociti
• Il trasporto di acqua attraverso la membrana per osmosi dipende
dalla concentrazione di Hb all’interno dell’eritrocita
• Quando il volume aumenta del 30 %,
l’eritrocita diventa sferico
• Emolisi: l’Hb lascia la cellula
• In vivo abbiamo una continua emolisi,
ma in alcune condizioni si ha un’emolisi
accentuata (emolisine)
• Test per la fragilità degli eritrociti:
sferociti e eritrociti vecchi, si emolizzano
a volumi più piccoli
1. Concentrazione di Na+ e volume del
liquido extracellulare
• Le variazioni del volume di liquido extracellulare sono molto importanti
perché condizionano il volume effettivo circolante.
• Poiché solitamente viene stabilizzata l’osmolalità, un aumento della
quantità di Na+ extracellulare causerà l’aumento del volume extracellulare
+
+
⎡
⎤⎦ × Volume
Na
extracellulare
=
Na
ECF
⎣
e
mmoli
litri
mmoli/litro
⎛ Osmolalità ⎞
Na
extracellulare
ECF
⎟⎠ × Volume
= ⎜⎝
2
mmoli
litri
+
• Poiché il Na+ intracellulare è scarso, quello extracellulare costituisce, in
pratica, il Na+ corporeo totale
• Il rene risponde ad aumenti del volume effettivo circolante aumentando
l’escrezione di Na+
2.Acqua coporea totale e osmolalità
• Se manteniamo costante il Na+ corporeo totale, una variazione dell’acqua
corporea totale determina l’osmolalità Osmoli
totali
Osmolalità ] ×
TBW
= [
litri
milliosmoli
milliosmoli/litro
• Per esempio, se si instaura una diminuzione dell’osmolalità per espansione di
TBW, gli osmocettori sono stimolati. La risposta riflessa porta ad una riduzione
del senso di sete ed all’aumento della diuresi. 1. Ruolo della pompa Na+-K+ nel
mantenere il volume cellulare
• La depolarizzazione della
cellula che consegue
all’inibizione della pompa
favorisce anche l’entrata di
Cl- con ulteriore aumento
delle particelle
osmoticamente attive
nell’ambiente intracellulare
2. Risposte cellulari alle variazioni rapide
di volume intracellulare
• Risposte basate sull’attivazione di canali ionici
1.
•
Aggiunta di soluti impermeabili all’ambiente extracellulare
Ambiente extracellulare iperosmolare --> la cellula si disidrata
RVI: Regulatory Volume Increase
3. Risposte cellulari alle variazioni rapide
di volume intracellulare
2.
•
Aggiunta di acqua all’ambiente extracellulare
Ambiente extracellulare iposmolare --> la cellula si imbibisce
RVD: Regulatory Volume Decrease
4. Risposte cellulari alle variazioni lente di
volume intracellulare
• Le risposte adattative croniche al’iperosomolalità prevedono
l’aumento di soluti organici (osmoliti o osmoli idiogeniche)
nella cellula (sorbitolo, inositolo, betaina, taurina) che
incrementano l’osmolalità intracellulare.
• Queste risposte sono molto spiccate nelle cellule nervose. P.e, la
disidratazione attiva l’aldoso reduttasi per la sintesi del sorbitolo
• Per questo motivo, non è saggio correggere in modo aggressivo
ed affrettato un disturbo idro-salino che ha comportato variazioni
dell’osmolalità plasmatica di lunga durata.
1. Equilibrio di Gibbs-Donnan
• I due compartimenti hanno pareti rigide
• Sono separati da una membrana semipermeabile
• All’interno delle cellule vi sono delle macromolecole cariche negativamente (proteine)
+
⎡
RT
⎣ Na ⎤⎦ i
Vm = ln
F
⎡⎣ Na + ⎤⎦
o
⎡
RT
⎣Cl ⎤⎦ i
Vm = ln
(-1) F
⎡⎣Cl- ⎤⎦
o
⎡⎣ Na + ⎤⎦
⎡
Cl
RT
⎣ ⎤⎦ i
i
- ln
=
ln
+
F
⎡⎣ Na ⎤⎦
⎡⎣Cl- ⎤⎦
o
o
2. Equilibrio di Gibbs-Donnan
r: rapporto di Donnan
⎡⎣ Na + ⎤⎦
⎡⎣Cl- ⎤⎦
o
i
=
=r
+
⎡⎣ Na ⎤⎦
⎡⎣Cl ⎤⎦
i
o
• All’equilibrio il numero totale di cariche
negative deve controbilanciare il numero
di quelle positive in ogni compartimento
Tuttavia:
• Questo ha comportato uno squilibro di cariche positive e negative a cavallo della
membrana quantificato dal rapporto di Donnan, r
• Nell’esempio ciò ha comportato un ∆V di -18.4 mV all’interno rispetto all’esterno
• Se pensiamo alla differenza tra plasma libero dalle proteine e liquido intracellulare,
avremo un r = 145/153 = 0.947
• Questo corrisponde a un ∆V di -1.43 mV (61.5 mV * log 0.947 = 61.5 * -0.023)
4. Equilibrio di Gibbs-Donnan
• Inoltre, anche se gli ioni sono in
equilibrio, sono presenti più particelle
osmoticamente attive nel compartimento
intracellulare.
• Nel nostro esempio, ∆π equivale a 1.3 atm
(967 mmHg). Quindi, in un ipotetica
cellula con pareti rigide, questo stato di
fatto condurrebbe all’instaurazione di una
pressione idrostatica all’interno della
cellula dovuta al passaggio di acqua per
osmosi
Possiamo fare anche un esempio più vicino alla realtà fisiologica
1. Plasma: Na+, 159 mmol/kg H2O; Cl-, 141.3 mmol/kg H2O; Proteine: 1 mmol/kg H2O
(π = 19.3 mm Hg)
2. Citoplasma: Na +, 150 mmol/kg H2O; Cl -, 150 mmol/kg H2O.
3. Nel plasma la somma delle concentrazioni di Na + e Cl- è superiore di 0.6 mmol/kg
H2O rispetto a quella del citoplasma. La somma totale di soluti è: 1 + 1.6 mosmol/kg
H2O = 1.6 mosmol/kg H2O.
4. Quindi la pressione osmotica totale è 1.6 mosmol/kg * 19.3 mm Hg = 31 mm Hg
5. Equilibrio di Gibbs-Donnan
•
•
•
•
•
E’ evidente, quindi, che le proteine nel plasma sono in grado di
elevare la pressione osmotica rispetto a quella del liquido
intracellulare sia direttamente che indirettamente.
Le cellule non sono, per altro, dotate di pareti rigide.
Quindi non si possono instaurare gradienti di pressione
idrostatica.
Però, la distribuzione di ioni descritta dall’equilibrio di Donnan,
conduce all’ingresso inevitabile di acqua nelle cellule.
Se non fosse corretto, ciò porterebbe “all’esplosione” delle
cellule
Bibliografia
• Burton AC, Fisiologia e Biofisica del Circolo, Il Pensiero Scientifico
Editore, Roma
• Fisiologia Medica, AA.VV., a cura di F Conti, II edizione.
• Fisiologia dell’Uomo, autori vari, Edi.Ermes, Milano
• Capitolo 9: Il Sangue (Capitoli 9.1 e 9.2)
• Fisiologia Generale e Umana, Rhoades-Pflanzer
• Capitolo 17: Funzioni del sangue