Cromo Cr (1797)
Configurazione elettronica: [Ar]3d54s1
Abbondanza nella litosfera: 122 ppm.
Si estrae dal minerale cromite FeCr2O4.
1
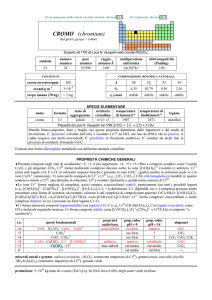
PROPRIETA’ DEL CROMO
Proprietà
Z
Numero di isotopi
naturali
Massa atomica
Configurazione
elettronica
Aspetto
Elettronegatività
Stati di ossidazione
Raggio del metallo/pm
Raggio ionico (6coordinato/pm M(VI)
M(V)
M(IV)
p.f./°C
p.e./°C
ΔHvap(gas
monoatomico)/kJ mol-1
Densità (25 °C)/ g cm-3
Abbondanza naturale (e
relativa)
Cr
24
4
Mo
42
7
W
74
5
51.996
[Ar]3d54s1
95.94
[Kr]4d55s1
138.85
[Xe]4f145d46s2
Metallo
argenteo e
lucente
1.6
(-II), (-I), 0,
(I), II, III,
(IV), (V), VI
128
Metallo
argenteo e
lucente
1.8
(-II), (-I), 0, I,
(II), III, IV, V,
VI
139
Metallo
argenteo e
lucente
1.7
(-II), (-I), 0, I,
(II), (III), IV, V,
VI
139
44
49
55
1900
2690
342
59
61
65
2620
4650
590
60
62
66
3370
5500
824
7.14
122 ppm
(25°)
10.28
1.2 ppm
(56°)
19.3
1.2 ppm
(56°)
I più importanti stati di ossidazione (generalmente i più abbondanti e stabili) sono riportati in grassetto. Altri
stati ben caratterizzati, ma meno importanti, sono riportati in caratteri normali. Gli stati di ossidazione instabili
o in dubbio, sono riportati in parentesi.
2
PRODUZIONE DEL CROMO
Il cromo è prodotto in due forme
Ferrocromo: lega ottenuta riducendo con carbone la cromite. (acciai
al cromo: duri e inossidabili).
FeCr2O4 + C
Δ
Fe + 2Cr + 4CO
Cromo metallico puro:
- La cromite viene ossidata in corrente di aria in carbonato fuso.
2FeCr2O4 + 4Na2CO3 + 7/2O2
4Na2CrO4 + 4CO2 + Fe2O3
Na2CrO4: solubile; Fe2O3: insolubile.
- Na2CrO4 per acidificazione dà Na2Cr2O7 che viene ridotto con
carbone a ossido di cromo(III).
Na2Cr2O7 + 2C
Δ
Cr2O3 + Na2CO3 + CO
- L’ossido di cromo(III) a sua volta è ridotto con Alluminio
Cr2O3 + 2Al
2Cr + Al2O3
- Il cromo puro è un metallo fragile raramente usato da solo ma
più spesso in leghe.
- Il Cr è poco reattivo a bassa temperatura: viene protetto da un
rivestimento superficiale di ossido.
- Il Cr è usato per la cromatura: Cr2O3 viene sciolto in H2SO4 ed il
Cr viene depositato elettroliticamente sulla superficie del metallo.
(protegge il ferro e altri metalli dalla corrosione conferendo un
aspetto lucente)
- Il cromo metallico si scioglie in acidi forti come HCl o H2SO4 ma
passiva (si ricopre di un film di ossido) con HNO3.
3
CHIMICA REDOX DEL CROMO
Stati di ossidazione in soluzione acquosa
In ambiente acido:
Cr2O72(arancio)
1.33
Cr3+ -0.41
(violetto)
Cr2+ -0.91
(celeste)
Cr
(pH = 0)
-0.74
0.29
Potenziali di ossido riduzione del cromo in ambiente acido
In ambiente alcalino:
CrO42-
-0.13
Cr(OH)3
-1.1
Cr(OH)2
-1.4
Cr
(pH = 14)
4
Questi dati conducono ai seguenti valori di ΔG°:
II
Cr
CrIII
CrVI
Ione
pH = 0
-1.82
-2.22
1.74
ΔG° (in eV)
pH =14
-2.8
-3.9
-4.29
In ambiente acido la forma termodinamicamente più stabile è quindi il Cr(III).
In ambiente alcalino lo ione più stabile è il cromo(VI).
I Sali cromosi Cr(II) sono dei forti riducenti (E°Cr3+/Cr2+ = -0.41 V) e vengono ossidati dall’ossigeno.
Acidic solution
Basic solution
5
Diagramma di Pourbaix per il Cromo
6
Cromo (III)
I composti di cromo(III) sono i più importanti e più stabili composti
di cromo. (es.: KCr(SO4)2)
Stato di ossidazione Cr(III) molto stabile in soluzioni acide.
Facilmente ossidato a Cr(VI) in soluzione alcalina.
L’esaacqua ione [Cr(H2O)6]3+, è un ottaedro regolare di colore
violetto.
3+
H2O
H2O
H 2O
Cr
H2O
H 2O
H 2O
Le soluzioni acquose di Cr(III) sono spesso verdi poiché una o più
molecole d’acqua sono sostituite da altri leganti quali alogenuri,
idrossido e in genere atomi di ossigeno di ossoanioni.
- Lo ione esaacquo [Cr(H2O)6]3+ e’ acido e lo ione idrosso
condensa per dare una specie dimerica con due ponti idrosso:
[Cr(H2O)6]3+
[Cr(H2O)5OH]2+ + H+
Ka ≈ 1x10-4
2H2O +
4+
H
O
(H2O)4 Cr
Cr(H2O)4
O
H
a) lenta aggiunta di NaOH acquoso a una soluzione di [Cr(H2O)6]3+
produce il precipitato verde pallido Cr(OH)3
[Cr(H2O)6]3+ + OH- → ↓Cr(OH)3(s)
7
L’idrossido di Cromo è anfotero
b) Cr(OH)3 si ridiscioglie per aggiunta di un eccesso di NaOH per
dare gli ioni cromiti di colore verde brillante:
Cr(OH)3(s) + OH- → [Cr(OH)4]Cr(OH)4- + OH- → [Cr(OH)6]3c) Cr(OH)3 si discioglie per aggiunta di H2SO4 riformando
[Cr(H2O)6]3+
Cr(OH)3(s) + H+ → [Cr(H2O)6]3+
Tutte le reazioni dell’esperienza sono da bilanciare.
OSSIDO DI CROMO(III)
L’Ossido di cromo(III) Cr2O3 è un solido verde: viene usato come
pigmento in vernici, gomma e cemento e come catalizzatore.
Cr2O3 diventa inerte agli acidi e alle basi se riscaldato fortemente,
ma se è idrato ha comportamento anfotero dando [Cr(H2O)6]3+ con
acidi e cromiti [Cr(OH)6]3- con alcali concentrati.
8
Sistema Redox Cr3+/Cr2+
Le due provette sono riempite con una soluzione acquosa acida di
Cr(III) violetto. I composti di Cr(III) sono estremamente resistenti
alla riduzione in ambiente acido. Tuttavia possono essere ridotti a
Cr2+ (ioni cromosi) con agenti riducenti come Zn come si può
dedurre dai valori di potenziali standard.
E°(Cr3+/Cr2+) = -0.41V,
E°(Zn2+/Zn) = -0.76 V
La provetta di sinistra ci serve come confronto mentre nella provetta
di destra il Cr(III) è ridotto a Cr(II) con Zn: la soluzione è azzurra
(liberazione di H2).
[Cr(H2O)6]3+ + Zn + H+ → [Cr(H2O)6]2+ + Zn2+ + H2 (da bilanciare)
Lo ione [Cr(H2O)6]2+ è uno dei più forti agenti riducenti noti in
soluzione acquosa. Se la soluzione è acida il Cr2+ lentamente
riduce l’acqua ad H2 ed i composti di Cr(II) sono ossidati dall’aria a
Cr3+.
9
Reazione con sodio acetato
[Cr(H2O)6]2+ + CH3C(O)ONa → [Cr2(O2CCH3)4(H2O)2] + Na+ (da bilanciare)
CH3
O
CH3
H2O
C
O
CH3
O O
O
Cr
Cr
O O
O O
CH3
O
H2O
CH3
acetato di Cr(II) diidrato rosso dCr-Cr = 2.36 Å
Questo composto è uno dei più stabili composti cromosi.
10
Cromo(VI)
Sono forti agenti ossidanti
Cr(VI) e’ cancerogeno EVITARE INALAZIONE E CONTATTO
(CrO4= cromato, Cr2O7= bicromato, CrO3 triossido di cromo,
CrO2X2 ossoalogenuri)
Cromati e bicromati
Il cromato di sodio Na2CrO4 è un solido giallo molto solubile in
acqua ed è un forte ossidante.
Per acidificazione, i cromati CrO42- formano HCrO4- e bicromati
Cr2O72- di colore rosso arancio, in cui due unità tetraedriche
condividono un vertice. HCrO4- e Cr2O72- esistono in equilibrio in
un ampio intervallo di pH da 2 a 6.
-
2O
O
+ 2H+
2 Cr
O
2 Cr
O
OH
O
O
O
giallo
O
O
Cr
O
2-
OH
O
- H2O
Cr
HO
O
2CrO42-(aq) + 2H+(aq)
O
O
O
Cr
O
Cr
O
O
O
O
arancione
Cr2O72-(aq) + H2O(l)
K≈ 1014
Il Na2Cr2O7 è un solido arancio largamente usato come agente
ossidante e nella concia delle pelli.
11
a) soluzione acquosa di cromato di sodio (Na2CrO4 )
b) Aggiungendo acido solforico alla soluzione gialla il
cromato CrO42- (giallo) viene convertito nello ione bicromato
Cr2O72- (arancione).
12
Reazione reversibile:
Cr2O72-(aq) + 2OH-(aq)
2CrO42-(aq) + H2O(l)
OSSIDO DI CROMO(VI) o TRIOSSIDO DI CROMO
(ACIDO CROMICO)
CrO3 e’un solido color arancio brillante che viene comunemente
chiamato ‘acido cromico’. Si prepara normalmente per aggiunta di
H2SO4 conc. ad una soluzione satura di bicromato di sodio.
Na2Cr2O7 + H2SO4 → 2CrO3 + Na2SO4 + H2O
CrO3 è tossico e corrosivo. Si scioglie facilmente in acqua ed è sia
un acido molto forte che un agente ossidante. E’ un ossido acido
che si scioglie in soluzione di NaOH, formando lo ione cromato
CrO42-.
CrO3 + 2NaOH → 2Na+ + CrO42- + H2O
13
PEROSSO COMPOSTI
Quando il perossido di idrogeno viene aggiunto ad una soluzione
acidificata di un bicromato (o di qualunque altra specie di Cr(VI))
avviene una reazione complessa: i prodotti dipendono dal pH e
dalla concentrazione del Cr.
Si forma un perosso-composto di Cr(VI) instabile di colore blu-violetto
intenso:
O
O
Cr2O72-
Cr
+
+ H2O2 + H
O
O
O
H2O
(da bilanciare)
composto instabile blu-viola
che decompone rapidamente in soluzione acquosa secondo la
seguente reazione (da bilanciare):
O
O
Cr
O
O
O
+ H+ + H2O
[Cr(H2O)6]3+ + O2 + H2O
H2O
verde
14
REAZIONE CON ACIDO OSSALICO
L’acido ossalico funziona come agente riducente, legante chelante
e per fornire l’acidità necessaria all’ambiente.
Cr2O72- + H2C2O4 → [Cr(C2O4)2(H2O)2]- + CO2 (da bilanciare)
marrone
OH2
Cr
OH2
Cr
OH2
OH2
Isomero TRANS
Simmetria: D 2h
Isomero CIS
Simmetria: C 2
In entrambe le strutture le linee fucsia rappresentano l'anione ossalato
15
SINTESI DI Cr(acac)3 [tris(2,4-pentandionato)cromo(III)]
In presenza di base il 2,4-pentandione (acetilacetone, acacH) perde
un protone e forma l’anione acetilacetonato, acac.
H
H
H3C
O
H3C
H3C
H3C
H3C
-H
O
O
O
H
H
H
O
O
O
O
H3C
H3C
H3C
La reazione di deprotonazione avviene facilmente perché gli
idrogeni su un carbonio in α ad un carbonile sono relativamente
acidi.
Nel nostro caso l’ambiente basico è fornito dall’idrolisi dell’urea che
libera ammoniaca secondo la reazione:
Reazione 1 idrolisi termica urea:
(NH2)2CO + H2O
2NH3 + CO2
Reazione 2 equilibrio acquoso ammoniaca:
-
+
NH3 + H2O
NH4 (aq) + OH (aq)
Reazione 3 deprotonazione acetilacetone:
acacH + OH
-
-
acac + H2O
Reazione 4 formazione complesso:
3+
-
Cr +3acac
Cr(acac)3
16
Acetilacetonato: legante bidentato (chela attraverso i due atomi di
ossigeno).
H3C
H3C
H3C
O
O
O
H
H
H
O
O
O
H3C
H3C
H3C
Forma complessi stabili con la maggior parte degli ioni metallici:
M(acac)n+.
Complessi insolubili in acqua (parte periferica costituita da gruppi
organici idrofobici).
H 3C
H
O
H 3C
O
CH3
O
Cr
H
O
O
H3 C
CH3
O
H 3C
H
17