ENZIMI
Importanza degli enzimi in Medicina
1.
2.
3.
4.
5.
6.
Chiave per capire errori del metabolismo
Importanti nelle reazioni di detossificazione
Targets di chemioterapia
Essenziali per formulare il razionale di un farmaco
Punto di riferimento nella diagnosi e nel monitoraggio terapeutico
Il ruolo primario delle vitamine è svolto come cofattori di enzimi
Tutti gli enzimi sono proteine****
-hanno un peso molecolare tra 15 kDa – 1000 kDa
-mostrano le stesse proprietà fisiche e chimiche delle proteine:
1. denaturazione
2. precipitazione
3. sensibilità alle proteasi
**** alcuni RNA catalitici o ribozimi possono essere classificati come enzimi
Gli enzimi sono caratterizzati da tre proprietà distintive:
1. CAPACITA’ CATALITICA
2. SPECIFICITA’ DI SUBSTRATO
3. REGOLAZIONE
I residui amminoacidici che formano il sito
di legame sono disposti in modo tale da
reagire specificamente con il substrato
mediante forze attrattive
Molti enzimi necessitano di componenti chimici
addizionali detti cofattori
ioni inorganici (Fe2+, Mg2+, Zn2+)
I cofattori possono essere
coenzimi (molecole organiche o
metallo-organiche)
I coenzimi legati covalentemente all’enzima
sono chiamati gruppi prostetici
GRUPPO PROSTETICO + APOENZIMA = OLOENZIMA
Esempi di enzimi che contengono come cofattori ioni inorganici
Fe2+ o Fe3+
Catalasi
Perossidasi
Cu2+
Citocromo ossidasi
Zn2+
Anidrasi carbonica
Alcol deidrogenasi
Mg2+
Glucosio-6-fosfatasi
Piruvato chinasi
Mn2+
Ribonucleotide reduttasi
Ni2+
Ureasi
Mo
Dinitrogenasi
Se
Glutatione perossidasi
Esempi di enzimi e coenzimi che trasferiscono gruppi chimici
coenzima
gruppi trasferiti
enzimi
FAD
NAD
atomi di idrogeno
ione idruro
deidrogenasi
coenzima A
gruppi acilici
acil-transferasi
tiamina pirofosfato
gruppi idrossialchil.
decarbossilasi
piridossalfosfato
gruppo amminico
amminotransferasi
biotina
CO2
carbossilasi
tetraidrofolato
formil, metilen, metil
transferasi C1
A
P
(spontanea)
v=
-d[A]
= K[A]
dt
La velocità è proporzionale alla concentrazione di A e K è la costante di
proporzionalità o costante di velocità
Poiché v è proporzionale ad A (unico reagente), la reazione A
è detta reazione di primo ordine (reaz. unimolecolare)
P
Invece nella reazione:
A+B
C+D
v= K[A] [B]
Poiché v è proporzionale al prodotto di due concentrazioni, la reazione è di
secondo ordine.
Energia libera media
(stato iniziale)
(Energia richiesta
per aumentare l’E
media di una mole
di reagenti)
C + D si verifica perché ad ogni istante dato
La reazione A + B
sia A che B hanno l’energia necessaria per raggiungere una condizione
reattiva nota come stato di transizione.
Ci sono due modi per accelerare una reazione chimica:
A
P
P
aumento della temperatura:
aumenterà l’energia media dei reagenti
diminuendo così l’energia necessaria a
raggiungere lo stato di transizione.
aggiunta di un catalizzatore:
il catalizzatore abbassa il ∆G
combinandosi temporaneamente con i
reagenti in modo da promuovere il loro
ingresso nella condizione reattiva dello
stato di transizione
CINETICA DELLE REAZIONI ENZIMATICHE
Il cambiamento nella velocità di reazione in funzione della variazione
nella concentrazione del reagente è una delle misure principali
dell’analisi cinetica
Curva di saturazione del substrato per una reazione enzimatica
(A)
A bassa [S], v è proporzionale a [S] (reazione di primo ordine)
Ad alta [S], v diviene indipendente da [S] e si avvicina ad un limite massimo. Il valore
di v a questo limite è indicato come Vmax.
La reazione enzimatica obbedisce ora ad una cinetica di ordine zero, cioè la velocità
è indipendente dalla [reagente] e dipende direttamente dall’enzima.
Quando v non aumenta anche se [S] aumenta, il sistema è saturato dal substrato
Teoria generale di azione degli enzimi proposta da
Michaelis e Menten:
l’enzima E ed il suo substrato S si associano
reversibilmente per formare un complesso ES.
Il prodotto si forma in un secondo stadio quando
ES si rompe per dare E+P
lo stadio precoce della reazione
è mostrato in scala maggiore
K1
E + S
ES
K-1
K2
K-2
E+P
L’equazione di Michaelis-Menten
v
0
=
v
K
max
m
S
+ [S ]
Km = costante di Michaelis-Menten
Vo = velocità iniziale
Vmax = velocità allo stato stazionario
La velocità di una reazione enzimatica v in qualsiasi istante è
determinata dal rapporto fra due costanti Km e Vmax e la
concentrazione del substrato in quell’istante.
Il valore di Km è definito dalla concentrazione di substrato che dà
una velocità pari alla metà della velocità massima:
quando [S]= Km, v= Vmax/2
Significato della costante di Michaelis
L’equazione di Michaelis-Menten descrive una
curva chiamata iperbole rettangolare
Km è anche una misura dell’affinità dell’enzima per il suo substrato:
se un enzima ha un piccolo valore di Km, vuol dire che raggiunge la
massima efficienza catalitica a basse concentrazioni di substrato
(bassa Km = alta affinità)
La Commissione Internazionale sugli Enzimi definisce l’Unità Internazionale di
Enzima come la quantità che catalizza la formazione di una micromole di
prodotto in un minuto.
Il numero di turnover di un enzima, Kcat, è una misura della sua massima attività
catalitica.
Kcat = numero di molecole di substrato convertite in prodotto per molecola di
enzima per unità di tempo quando l’enzima è saturato con il substrato
L’equazione di Michaelis-Menten descrive una
curva chiamata iperbole rettangolare
v
0
=
v
K
max
m
S
+ [S ]
A causa della forma iperbolica del grafico di v in funzione di [S]
la determinazione precisa del valore di Vmax non è possibile.
Dall’equazione di Michaelis-Menten si possono ottenere grafici lineari:
prendendo i reciproci di entrambi i membri dell’equazione di M-M
v
questa equazione descrive
una linea retta
0
=
v
K
max
m
x=
+ [S ]
Grafico dei doppi reciproci di Lineweaver-Burk
y=
S
Il riconoscimento enzima-substrato e gli eventi catalitici che seguono sono
fortemente dipendenti dal pH
L’optimum di pH può non coincidere con l’ambiente naturale in cui l’enzima
si trova: risposta al pH = regolazione intracellulare dell’attività enzimatica
Effetti della temperatura sull’attività enzimatica
La diminuzione dell’attività a temperature
superiori a 50° è dovuta alla denaturazione
termica.
Inibizione enzimatica
competitiva
inibizione reversibile
non competitiva
l’inibitore interagisce con l’enzima attraverso reazioni non covalenti
di associazione/dissociazione
inibizione irreversibile
l’inibitore causa alterazioni covalenti stabili dell’enzima
I due tipi di inibizione si possono distinguere dal particolare tipo di
andamento che si ottiene quando i dati cinetici sono analizzati in
diagrammi lineari di Lineweaver-Burk
INIBIZIONE REVERSIBILE
La Succinato deidrogenasi – un esempio classico di inibizione competitiva
INIBIZIONE REVERSIBILE
inibizione competitiva
Il substrato e l’inibitore competono
per lo stesso sito di legame sull’enzima
(sito attivo)
L’aumento della [S] aumenta la probabilità che sia S a legarsi all’enzima invece
dell’inibitore. Alti valori di [S] possono annullare l’effetto di I.
La caratteristica di questo tipo di
inibizione è che Vmax non è
influenzata da I (tutte le rette
mostrano la stessa intercetta
sull’asse y)
Km aumenta
Vmax è invariata
INIBIZIONE REVERSIBILE
inibizione non competitiva
L’inibitore ed il substrato si
legano a siti diversi dell’enzima
e il legame di I non influenza il
legame di S
Km invariata
L’inibizione non può essere superata
aumentando la [S]
Vmax diminuisce (diminuzione dell’enzima attivo)
INIBIZIONE IRREVERSIBILE
- l’inibitore si lega irreversibilmente all’enzima (per es. con un
legame covalente) .
-tipo di cinetica osservata: simile all’inibizione non competitiva
- differenza: la diluizione non è efficace a dissociare il complesso
E-I e non ripristina l’attività enzimatica
Substrati suicidi:
sono inibitori analoghi del substrato che si legano covalentemente all’enzima
con specificità ed alta affinità.
la penicillina è un inibitore irreversibile dell’enzima
glicoproteina transpeptidasi che crea i legami crociati
nelle catene di peptidoglicano durante la sintesi della
parete cellulare batterica.
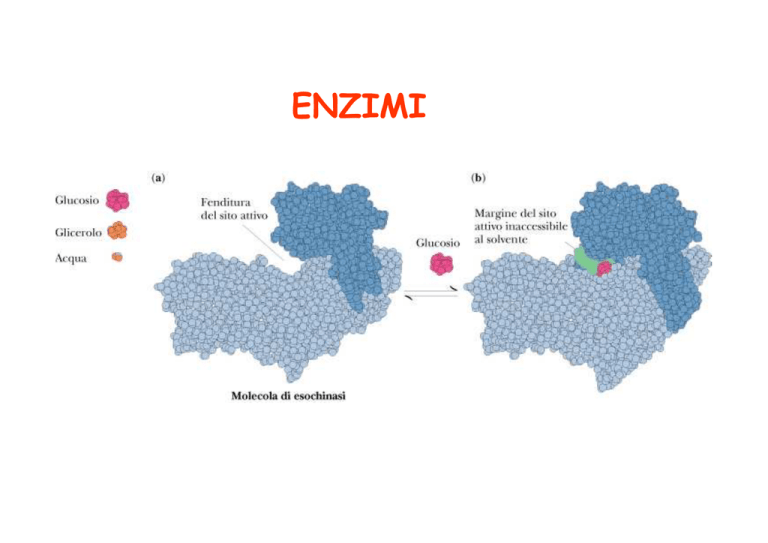
La specificità è il risultato del riconoscimento molecolare
Il sito attivo dell’enzima comprende solo
una parte della sua struttura, una speciale
tasca complementare alla struttura del substrato
Adattamento indotto
il complesso cataliticamente attivo enzima-substrato è una struttura
interattiva:
-la forma del sito attivo dell’enzima si modifica in seguito al legame di S
-l’enzima induce il substrato ad adottare una forma che mimi lo stato
di transizione della reazione
processo di riconoscimento
dinamico fra E e S
Controllo dell’attività enzimatica
1.
2.
3.
4.
accumulo del prodotto (dimin. velocità di sintesi di P)
disponibilità del substrato
controllo genetico
modifica covalente
reversibile
irreversibile
5. isozimi
6. proteine modulatrici
7. enzimi allosterici
4.
Modificazioni covalenti reversibili:
Fosforilazione
Adenilazione
Uridililazione
ADP-Ribosilazione
Metilazione
Fosforilazione
Gli enzimi regolati mediante modifiche covalenti sono chiamati
enzimi interconvertibili
Modificazioni covalenti irreversibili:
Proteolisi (zimogeni)
insulina
enzimi proteolitici del tratto digestivo
L’attivazione proteolitica del chimotripsinogeno’
coagulazione del sangue
Controllo dell’attività enzimatica
1.
2.
3.
4.
accumulo del prodotto
disponibilità del substrato
controllo genetico
modifica covalente
reversibile
irreversibile
5. isozimi
6. proteine modulatrici
7. enzimi allosterici
Gli isozimi della
lattato deidrogenasi
5. Isozimi
(M4)
Numerosi enzimi esistono
in più strutture quaternarie
che differiscono nelle
proporzioni di associazione
di due subunità A e B.
(H4)
Enzimi di interesse clinico che si presentano in forme multiple
Enzima
Lattico deidrogenasi (infarto del miocardio, epatite virale)
Isocitrico deidrogenasi (epatiti virali)
Glucosio-6-fosfato deidrogenasi (anemia)
Glutammico deidrogenasi (affezioni epatiche)
Aspartico transaminasi (infarto del miocardio)
Creatina chinasi (indice di infarto e distrofia muscolare)
Acetilcolinesterasi (anestesia)
Colinesterasi (indice di funzionalità epatica)
Fosfatasi alcalina (affezioni epatiche e dell’app. scheletrico)
Fattori che influenzano le attività enzimatiche nel
plasma negli stati patologici:
• l’organo o il tessuto interessato dalla malattia
• la natura della lesione
• la distribuzione degli enzimi nel tessuto interessato
• effetti secondari su altri organi
• la velocità del rilascio dell’enzima da parte delle cellule
danneggiate
• la scomparsa dell’enzima dal circolo sanguigno
Controllo dell’attività enzimatica
1.
2.
3.
4.
accumulo del prodotto
disponibilità del substrato
controllo genetico
modifica covalente
reversibile
irreversibile
5. isozimi
6. proteine modulatrici
7. enzimi allosterici
6. Proteine modulatrici
La proteina chinasi AMP ciclico dipendente (PKA)
Controllo dell’attività enzimatica
1.
2.
3.
4.
accumulo del prodotto
disponibilità del substrato
controllo genetico
modifica covalente
reversibile
irreversibile
5. isozimi
6. proteine modulatrici
7. enzimi allosterici
7. Enzimi allosterici
la loro cinetica non obbedisce
all’equazione di Michaelis-Menten
Grafico sigmoide di V in funzione di [S]
Il modello della regolazione enzimatica: la glicogeno fosforilasi
1. In condizioni normali, l’attività di questo enzima nel muscolo è regolata
allostericamente da metaboliti che riflettono lo stato energetico cellulare
(AMP, ATP, glucosio 6 fosfato)
2. In caso di stress l’adrenalina stimola una cascata di reazioni che culminano
nella fosforilazione (attivazione) dell’enzima
La reazione della fosfoglucomutasi
muscolo: energia per la contrazione muscolare
fegato: glucosio che viene esportato agli altri tessuti
STRUTTURA DEL MONOMERO
DELLA GLICOGENO FOSFORILASI
DIMERO DELLA
GLICOGENO
FOSFORILASI
Curve di v in funzione di [S] per la glicogeno fosforilasi
b) L’ATP è un inibitore a feed-back che influenza l’attività dell’enzima per il substrato
c) L’AMP è effettore eterotropico positivo; si lega allo stesso sito dell’ATP (in
competizione) ed influenza l’affinità dell’enzima per il substrato
Livelli significativi di AMP indicano che lo stato di energia della cellula è basso e che dovrebbe
essere prodotta più energia (ATP).
I cambiamenti nelle concentrazioni cellulari di ATP e AMP e la loro competizione per il legame
allo stesso sito con effetti opposti assicura che la produzione di energia sia proporzionata
alle esigenze cellulari
1.
Meccanismo della modifica covalente
e della regolazione allosterica della
glicogeno fosforilasi
2.
La fosforilazione causa nella fosforilasi
un drastico cambiamento conformazionale
La glicogeno fosforilasi è regolata da
cascate enzimatiche
L’attivazione ormonale dell’adenilato ciclasi
La reazione dell’adenilato ciclasi
MECCANISMI DI AZIONE DEGLI ENZIMI
I tipi di meccanismi catalitici utilizzati dagli enzimi sono stati
classificati come:
catalisi acido-basica
catalisi covalente
catalisi favorita da ioni metallici
catalisi favorita da effetti di prossimità e di orientamento
catalisi acido-basica
(presente in quasi tutte le reazioni
enzimatiche): la velocità aumenta se
cambia il pH.
Esistono di 2 tipi di catalisi acido-basica:
catalisi acido-base specifica:
gli ioni H+ o OH- accelerano la reazione
(la concentrazione del tampone non ha
alcun effetto sulla reazione)
catalisi acido-base generale
un acido o una base, diversi da H+ o OHaccelerano una reazione (il tampone può
donare o accettare protoni, influenzando
così la velocità di reazione)
Catalisi covalente: alcune reazioni enzimatiche devono gran parte dell’aumento
della loro velocità alla formazione di legami covalenti fra E ed S
X= centro nucleofilo che
attacca un centro
elettrofilo
catalisi favorita da ioni metallici: alcuni enzimi richiedono ioni metallici per
svolgere la loro massima attività catalitica
l’alcol deidrogenasi epatica
uno ione zinco del sito attivo dell’enzima
alcol deidrogenasi stabilizza la formazione
di una carica negativa sull’atomo di ossigeno
dell’acetaldeide, portando alla comparsa di
una parziale carica positiva indotta sull’atomo
di carbonio carbonilico
catalisi favorita da effetti di prossimità e di orientamento
le reazioni chimiche avvengono più velocemente quando i reagenti si
trovano in prossimità, cioè vicini gli uni agli altri.
Gli enzimi non solo mantengono i substrati e i gruppi catalitici vicini gli uni agli
altri, ma li orientano in modo tale da favorire la catalisi
MECCANISMI ENZIMATICI
Serina proteasi
Aspartato proteasi
Serina proteasi
classe di enzimi proteolitici il cui meccanismo catalitico è basato sulla
presenza di un residuo di serina nel sito attivo.
-tripsina
enzimi digestivi sintetizzati nel pancreas e secreti
-chimotripsina nell’apparato digerente come proenzimi inattivi o zimogeni
-elastasi
-trombina
-plasmina
-attivatore tissutale del plasminogeno
-acetil colinesterasi= non è una proteasi ma una serina esterasi il cui
meccanismo d’azione è correlabile a quello delle serina proteasi. Essa
idrolizza il neurotrasmettitore acetilcolina nello spazio sinaptico
interneuronico.
Tripsina, chimotripsina ed elastasi catalizzano tutti la stessa reazione:
la scissione di una catena polipeptidica.
Tripsina: agisce su aa basici
(arginina, lisina)
Chimotripsina: agisce su aa
aromatici
Elastasi: agisce su piccoli
residui di aa neutri
Tre residui polari (His 57, Asp102, Ser195) formano la cosiddetta triade catalitica
in corrispondenza del sito attivo il quale è costituito da una depressione sulla
superficie dell’enzima.
Le proteasi a serina sono sensibili alla inibizione da parte di fluorofosfati organici
complesso covalente
enzima-inibitore
Il diisopropilfluorofosfato reagisce con i residui di serina del sito attivo delle
serina proteasi e delle serina esterasi (come l’acetilcolinesterasi) causando una
inattivazione.
Acetilcolinesterasi: serina esterasi che degrada il neurotrasmettitore
acetilcolina nei neuroni.
DIFP: altamente tossico perché inibisce le acetilcolinesterasi.
Sarin: molecola simile al DIFP (1995, metropolitana di Tokyo)
Gas mortale VX: 10 volte più tossico del Sarin (Inghilterra)
Aspartato proteasi
classe di enzimi proteolitici il cui meccanismo catalitico è basato
sulla presenza di due residui di acido aspartico nel sito attivo.
Alcune aspartato proteasi rappresentative
Nome
Sorgente
Funzione
Pepsina
Stomaco
Digestione proteine della dieta
Catepsina D
Milza, Fegato
Digestione lisosomiale proteine
Renina
Rene
Regolazione pressione arteriosa
Proteasi HIV-1
Virus AIDS
Maturazione delle proteine del
virus dell’AIDS
A differenza delle serina proteasi, le aspartato proteasi non formano legami covalenti
con i loro substrati peptidici.
La proteasi del virus HIV-1 dell’AIDS è una aspartato proteasi
La proteasi HIV-1 scinde la poliproteina originando proteine diverse necessarie
alla crescita virale e all’infezione cellulare
Gli inibitori delle proteasi prolungano la vita dei pazienti affetti da AIDS
Terapia: inibitori proteasi + AZT
Farmaci progettati con un disegno strategico basato sulla struttura: la parte della struttura
contenente il gruppo -OH si inserisce fra i due gruppi carbossilici del sito attivo della
proteasi
Struttura dell’AZT
inibitore della
trascrittasi inversa
CARATTERISTICHE DI UN FARMACO
Biodisponibilità: capacità di raggiungere nell’organismo il luogo di azione desiderato
Specificità: per la proteasi dell’HIV nei linfociti e non per le altre proteasi
Novità: per contrastare i ceppi mutanti dell’HIV resistenti agli inibitori delle
proteasi (ricerche ancora in corso)