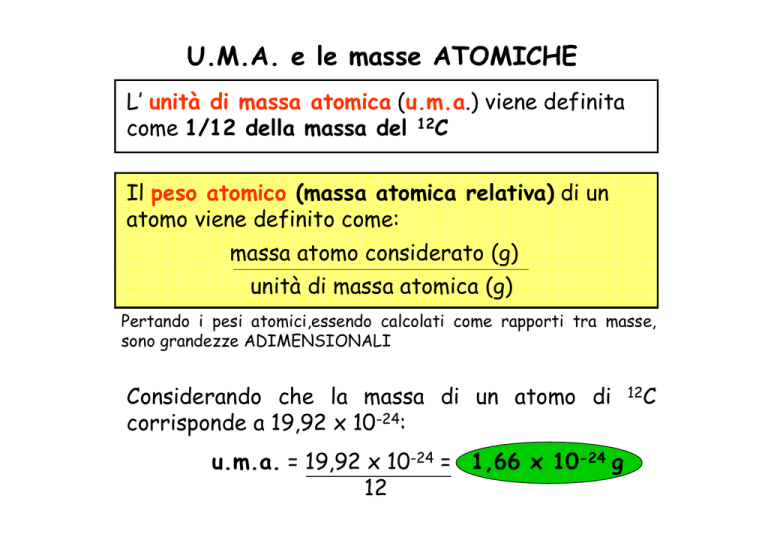
U.M.A. e le masse ATOMICHE
L’ unità di massa atomica (u.m.a.) viene definita
come 1/12 della massa del 12C
Il peso atomico (massa atomica relativa) di un
atomo viene definito come:
massa atomo considerato (g)
unità di massa atomica (g)
Pertando i pesi atomici,essendo calcolati come rapporti tra masse,
sono grandezze ADIMENSIONALI
Considerando che la massa di un atomo di
corrisponde a 19,92 x 10-24:
u.m.a. = 19,92 x 10-24 = 1,66 x 10-24 g
12
12C
PESO ATOMICO
Na = sodio
peso atomico = 22,98977
La massa di un atomo di sodio corrisponde a 22,98977 la
massa campione (u.m.a.).
Il Na è presente in natura sotto forma di un singolo nuclide.
In generale gli elementi si presentano costituiti da
MISCELE di isotopi. Quindi nel calcolo del peso
atomico naturale di un elemento si deve tenere conto
sia della massa dei singoli isotopi sia della loro
abbondanza relativa (media ponderata).
12
C
6
13
98,89 %
P.A.= 12
6
C
1,11 %
P.A.= 13,0034
P.A.c = 12 x 98,89 + 13,0034 x 1,11 = 12,0111
100
56
Fe
26
26 Protoni
56Fe
91,72%
Fe è stabile con 30 neutroni
57Fe
2,2%
Fe è stabile con 31 neutroni
58Fe
0,28%
Fe è stabile con 32 neutroni
30 neutroni
26 elettroni
(26 ٠ 1,672623 ٠ 10-24) + (30 ٠ 1,6749286 ٠ 10-24) + (26 ٠ 9,109389 ٠ 10-28)
Massa calcolata
(sommando le masse dei
componenti)
=
9,3759740 ٠ 10-23 g
Massa sperimentale = 9.28822 ٠ 10-23 g
∆M = 8,7754 ٠ 10-25 g ≡ 7,8979 ٠ 10-12 J
Il difetto di massa ∆M, applicando l’equazione di Einstein
(E = mc2), dà una misura della energia nucleare
PESO MOLECOLARE
“Rappresenta la SOMMA delle masse atomiche
relative degli atomi presenti nella molecola”
C2H6O = ETANOLO
P.M.C
= 2 x P.A.C + 6 x P.A.H + P.A.O
2H6O
= 2 x 12,011 + 6 x 1,0079 + 15,999 =
46,068
Massa atomica
Numero atomico
8
Ossigeno
15,9994
Elettronegatività
13,61
Prima
ionizzazione
(eV)
O
0,66
[He] 2s2 2p4
Raggio atomico (Å)
3,5
-2
Numeri di
ossidazione
Si definisce mole la quantità di una sostanza che
contiene un numero di Avogadro (N) di molecole
della sostanza stessa
N° moli =
grammi
PM (PA)
N = 6.022 x 1023
H
1,008
He
4,0026
Li
6,939
Be
9,0122
B
10,811
C
N
F
O
12,0112 14,0067 15,9994 18,9984
Ne
20,183
Na
22,9898
Mg
24,312
Al
26,9815
Si
28,086
P
30,974
S
32,064
Cl
35,453
Ar
39,948
K
39,102
Ca
40,08
Ga
69,72
Ge
72,59
As
74,922
Se
78,96
Br
79,909
Kr
83,80
Rb
85,47
Sr
87,62
In
114,82
Sn
118,69
Sb
121,75
Te
127,60
I
126,904
Xe
131,30
Cs
132,905
Ba
137,34
Tl
204,37
Pb
207,19
Bi
208,98
Po
210
At
210
Rn
222
MOLE
Una mole di 12C (P.A. 12) pesa 12 g e contiene 6,022 x
1023 atomi di carbonio
Una mole di H2O (P.M. 18) pesa 18 g e contiene 6,022 x
1023 molecole d’ H2O
Una mole di MgCl2 (P.F. 95) pesa 95 g e contiene
6,022 x 1023 formule minime di cloruro di magnesio
12C
P.A.= 12 g/mol
H2O
P.M.= 18 g/mol
MgCl2 P.F.= 95 g/mol
Esempio: il P.A. del Neon è 20,183
20,183 g di Neon contengono quindi 6.022 x 1023 atomi di Neon (1 mole)
50,4575 g di Neon contengono 50,4575/20,183 = 2,5 moli
4,0366 g di Neon contengono 4,0366/20,183 = 0,2 moli (200 mmoli)
10 mg di Neon contengono 0,01/20,183 = 4,95 x 10-4 moli (495 mmoli)
molecole:
Noto il peso molecolare (P.M.) di un composto qualsiasi, una quantità in grammi di
quel composto numericamente uguale al P.M. contiene 6.022 x 1023 MOLECOLE,
cioè una mole di molecole ( una grammomolecola)
PMglucosio = 180
PMsaccarosio= 342
PM urea = 60
In 5 mg di glucosio: 5 x 10-3 / 180 = 27,78 mmoli dello zucchero
In 1 mg di saccarosio: 1 x 10-3 / 342 = 2,92 mmoli dello zucchero
In 30 g di urea: 30 / 60 = 0,5 moli
Una quantità di 75 mmoli di saccarosio ha una massa di 0,075 x 342 = 25,65 g
N° moli =
grammi
PM (PA)
c.n.
0oC 1 atm
Il volume di 22,4 litri è quello occupato da:
A 1 mole di azoto liquido
B 1 Kg di acqua allo stato di vapore
C 1 mole di qualunque gas in condizioni standard
D 1 equivalente di una soluzione molare
E 1 mole di qualunque sostanza alle condizioni standard
La mole di una proteina pesa 60 Kg; nella mole in questione sono
contenuti:
A 60 aminoacidi
B 6000 aminoacidi
C 60.000 molecole
D 6,023 x 1023 molecole di proteina
E 6,023 x 1023 molecole di aminoacidi
Il peso atomico del cloro è un numero decimale
(35,453) e non un numero intero (35) perchè ?
A ogni atomo di cloro ha massa uguale a 35,453
B tutti gli atomi di cloro hanno proprietà identiche
C ci sono almeno due isotopi naturali del cloro
D ogni atomo di cloro contiene 17 protoni
E ogni atomo di cloro contiene 17 neutroni
La risposta esatta è C perché:
Ogni elemento è presente come miscela di isotopi
Il PA è in pratica una media pesata dei pesi atomici degli isotopi
e non può essere un numero intero
Un litro di acqua contiene circa:
A 55 moli
B 55 molecole
C 55 grammi
D 5,5 moli
E 55x1023 moli
La risposta esatta è A perché:
Il PM dell’acqua è 16(PAO)+ 2 x 1(PAH) = 18
1 lt di H2O pesa 1000g quindi il n.di moli contenute sono:
n H2O = 1000g / 18g mol-1 = 55 mol
Quale delle seguenti affermazioni è corretta?
A Una molecola di ossigeno pesa 32g
B Una molecola di ossigeno pesa 16g
C Una mole di ossigeno pesa 32g
D Una mole di ossigeno pesa 16g
E Una mole di ossigeno pesa 8 g
La risposta esatta è C perché:
L’ossigeno non è presente in natura come O, ma come molecola O2
Il PM dell’O2 è 32 g, quindi una mole di ossigeno pesa 32 g
Quanti grammi pesano 11,2 litri di CH4 in condizioni standard?
A 11
B 10
C 16
D
8
E
4
La risposta esatta è D perché:
In condizioni standard (P= 1 atm e T= 10C) una mole di qualsiasi
gas occupa 22,4 litri
11,2 litri sono quindi 0,5 moli di CH4












