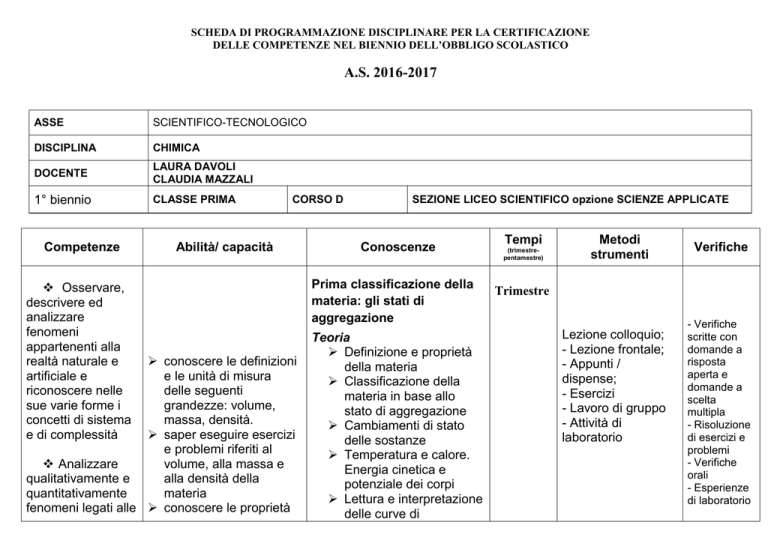
SCHEDA DI PROGRAMMAZIONE DISCIPLINARE PER LA CERTIFICAZIONE
DELLE COMPETENZE NEL BIENNIO DELL’OBBLIGO SCOLASTICO
A.S. 2016-2017
ASSE
SCIENTIFICO-TECNOLOGICO
DISCIPLINA
CHIMICA
DOCENTE
LAURA DAVOLI
CLAUDIA MAZZALI
1° biennio
CLASSE PRIMA
Competenze
Osservare,
descrivere ed
analizzare
fenomeni
appartenenti alla
realtà naturale e
artificiale e
riconoscere nelle
sue varie forme i
concetti di sistema
e di complessità
CORSO D
Abilità/ capacità
conoscere le definizioni
e le unità di misura
delle seguenti
grandezze: volume,
massa, densità.
saper eseguire esercizi
e problemi riferiti al
Analizzare
volume, alla massa e
qualitativamente e
alla densità della
quantitativamente
materia
fenomeni legati alle conoscere le proprietà
SEZIONE LICEO SCIENTIFICO opzione SCIENZE APPLICATE
Conoscenze
Prima classificazione della
materia: gli stati di
aggregazione
Teoria
Definizione e proprietà
della materia
Classificazione della
materia in base allo
stato di aggregazione
Cambiamenti di stato
delle sostanze
Temperatura e calore.
Energia cinetica e
potenziale dei corpi
Lettura e interpretazione
delle curve di
Tempi
(trimestrepentamestre)
Metodi
strumenti
Verifiche
Trimestre
Lezione colloquio;
- Lezione frontale;
- Appunti /
dispense;
- Esercizi
- Lavoro di gruppo
- Attività di
laboratorio
- Verifiche
scritte con
domande a
risposta
aperta e
domande a
scelta
multipla
- Risoluzione
di esercizi e
problemi
- Verifiche
orali
- Esperienze
di laboratorio
trasformazioni di
energia a partire
dall’esperienza
Essere
consapevole delle
potenzialità e dei
limiti delle
tecnologie nel
contesto culturale e
sociale in cui
vengono applicate
Individuare le
strategie
appropriate
per la soluzione di
problemi
macroscopiche degli
riscaldamento e
stati di aggregazione
raffreddamento delle
sostanze
conoscere i nomi dei
passaggi di stato
Teoria corpuscolare e
conoscere la definizione
cinetica della materia
di temperatura e le sue
Interpretazione degli
unità di misura
stati fisici della materia e
conoscere le definizioni
dei passaggi di stato alla
ed il significato di
luce della teoria
calore, energia cinetica
corpuscolare e cinetica
ed energia potenziale
Notazione esponenziale
dei corpi
Cifre significative di una
saper interpretare a
misura. Arrotondamenti
livello macroscopico e
dei risultati ottenuti dalle
microscopico le curve di
4 operazioni aritmetiche
riscaldamento e
Laboratorio
raffreddamento delle
Sicurezza in laboratorio:
sostanze
regole di
saper esprimere una
comportamento
misura con la notazione
Rischi connessi alla
esponenziale
manipolazione di
saper stabilire le cifre
sostanze chimiche:
significative di una
etichette, pittogrammi,
misura e le cifre
frasi R e S, frasi H e P
significative nel caso di
Strumenti di uso più
arrotondamenti di
comune nel laboratorio
risultati ottenuti dalle 4
di chimica:
operazioni aritmetiche
caratteristiche e funzioni
saper interpretare le
Costruzione della curva
proprietà degli stati fisici
di riscaldamento di una
della materia e i
sostanza pura
passaggi di stato alla
luce della teoria
corpuscolare e cinetica
conoscere il nome e la
funzione degli strumenti
di uso più comune in
laboratorio e saperli
utilizzare
conoscere e applicare
le principali norme di
sicurezza in laboratorio
raccogliere in modo
corretto i dati relativi al
riscaldamento di una
sostanza solida e
costruire la curva
riportando in un
diagramma la
temperatura in funzione
del tempo
La classificazione della
materia: miscugli e
sostanze
conoscere la definizione Teoria
di miscuglio e sostanza
Classificazione della
conoscere le differenze
materia in base alla
fra i miscugli omogenei
composizione : miscugli
e i miscugli eterogenei
e sostanze
conoscere il campo di
Miscugli omogenei ed
applicabilità e i principi
eterogenei
su cui si basano le
Tecniche di separazione
principali tecniche di
Soluzioni: solubilità e
separazione
concentrazione
Modi per esprimere la
conoscere le definizioni
concentrazione: %m/m,
di soluzione, solubilità e
%m/V, %V/V, ppm
concentrazione
conoscere il significato Laboratorio
Applicazione delle
dei modi per esprimere
tecniche di separazione
la concentrazione delle
Preparazione di
soluzioni
soluzioni di data
saper calcolare la
concentrazione
concentrazione di una
soluzione in
percentuale e in parti
per milione
saper effettuare
operazioni di
separazione dei
componenti su miscugli
omogenei ed
eterogenei
dopo aver eseguito i
calcoli necessari, saper
preparare una
soluzione di data
concentrazione,
utilizzando in modo
corretto gli strumenti
Osservare,
descrivere ed
analizzare
fenomeni
appartenenti alla
realtà naturale e
artificiale e
riconoscere nelle
sue varie forme i
concetti di sistema
e di complessità
Le reazioni chimiche
Penta conoscere la differenza Teoria
mestre
tra una trasformazione
Trasformazioni fisiche e
fisica e una
chimiche della materia
trasformazione chimica
Definizione di elemento
conoscere le definizioni
e composto
di elemento e composto
Elementi chimici e loro
saper enunciare le leggi
simboli
di Lavoisier e di Proust
La conservazione della
conoscere i contenuti
massa nelle reazioni
della teoria atomica di
chimiche:
legge
di
Analizzare
Dalton
Lavoisier
qualitativamente e saper collegare le leggi
Legge delle proporzioni
quantitativamente
di Lavoisier e di Proust
definite o legge di
fenomeni legati alle
alla teoria atomica di
Proust
trasformazioni di
Dalton
Teoria atomica di Dalton
energia a partire
saper interpretare le
Interpretazione
delle
dall’esperienza
informazioni contenute
leggi di Lavoisier e di
nelle formule chimiche
Proust alla luce della
di elementi e composti
teoria atomica di Dalton
Essere
saper rappresentare
Formule chimiche di
consapevole delle
una reazione chimica
elementi e composti
potenzialità e dei
tramite un’equazione
Rappresentazione delle
limiti delle
saper bilanciare una
reazioni
tramite
le
tecnologie nel
semplice equazione
equazioni
chimiche
contesto culturale e
chimica
bilanciate
sociale in cui
saper riconoscere le
Laboratorio
vengono applicate
caratteristiche
Fenomeni osservabili
macroscopiche di una
durante una reazione
Individuare le
trasformazione chimica
chimica
strategie
saper riconoscere la
Verifica sperimentale
-Lezione colloquio;
- Lezione frontale;
- Appunti /
dispense;
- Esercizi
- Lavoro di gruppo
- Attività di
laboratorio
- Verifiche
scritte con
domande a
risposta
aperta e
domande a
scelta
multipla
- Risoluzione
di esercizi e
problemi
- Verifiche
orali
- Esperienze
di laboratorio
appropriate
per la soluzione di
problemi
validità della legge di
Lavoisier dai risultati
della prova
sperimentale
saper riconoscere la
validità della legge di
Proust dai risultati della
prova sperimentale
della legge di Lavoisier
Verifica sperimentale
della legge di Proust
L’atomo
Teoria
saper spiegare ed
Tubo a raggi catodici:
interpretare
scoperta dell’elettrone
l’esperimento del tubo a
Massa e carica elettrica
raggi catodici
delle 3 principali
conoscere le
particelle subatomiche
caratteristiche delle
Numero atomico e
particelle subatomiche
numero di massa
conoscere le definizioni
Isotopi
di numero atomico,
Massa atomica e
numero di massa,
massa molecolare
massa atomica e
Modello atomico di
massa molecolare
Thomson
relativa
Esperimento e modello
saper determinare il
atomico di Rutherford
numero delle particelle
Modello atomico di Bohr
subatomiche di un
Introduzione al concetto
nuclide
di orbitale
saper calcolare la
Configurazioni
massa atomica come
media ponderata
elettroniche complete ed
saper calcolare la
esterne degli atomi
massa molecolare dalle
Elettroni di valenza degli
masse atomiche
atomi e simboli di Lewis
relative
Laboratorio
conoscere il modello
Analisi alla fiamma
atomico di Thomson
saper spiegare ed
interpretare
l’esperimento di
Rutherford
Riconoscere gli
elementi innovativi che
introdusse Bohr nel suo
modello atomico
rispetto ai modelli
precedenti
superandone i limiti
Riconoscere il
significato matematico
di orbitale
Saper scrivere la
configurazione
elettronica completa ed
esterna di un atomo
saper rappresentare la
configurazione
elettronica esterna di un
atomo con i simboli di
Lewis
saper identificare un
elemento metallico con
l’analisi alla fiamma
Ordine tra gli elementi: la
tavola periodica
conoscere i principi
di costruzione della
tavola periodica
moderna
saper correlare la
struttura elettronica
alla tavola periodica
saper motivare la
variazione delle
proprietà periodiche
nell’ambito dei gruppi
e dei periodi
riconoscere gli
elettroni di valenza di
un atomo
saper individuare gli
ioni stabili di alcuni
elementi metallici e
non metallici
utilizzando la regola
dell’ottetto
Correlazione tra
struttura atomica e
tavola periodica
Proprietà periodiche
Famiglie chimiche e loro
proprietà