RISPERIDONE formulazione im (18-10-2006)
Specialità: Risperdal® (Janssen Cilag)
Forma farmaceutica:
1 fl 25 mg
Prezzo: € 165,69
1 fl 37,5 mg
€ 213,80
1 fl 50 mg
€ 267,24
Prezzo da banca dati Farmadati settembre 2006
ATC: N05AX08
Categoria terapeutica: altri antipsicotici
Fascia di rimborsabilità:
Classe PTN: H - Osp2
Indicazioni Ministeriali: Risperidone polvere e solvente per sospensione iniettabile a rilascio prolungato
nei dosaggi 25 mg/2 ml, 37,5 mg/2 ml e 50 mg/2 ml è indicato nel trattamento delle psicosi
schizofreniche croniche e nella profilassi delle recidive (esacerbazioni acute) in soggetti che hanno
dimostrato di tollerare le forme orali di risperidone e con accertati problemi di compliance.
Risperidone iniettabile, inoltre, migliora i sintomi affettivi (come p.e. depressione, senso di colpa, ansia)
associati alla schizofrenia.
Decisioni della CTR: Farmaco inserito in PTORV (data valutazione 03.05.06)
Commenti: Risperidone depot è la prima formulazione a rilascio prolungato di un antipsicotico atipico.
Considerato il potenziale vantaggio della formulazione depot in termini di compliance e di aderenza al
trattamento per questa tipologia di pazienti che spesso non accetta i trattamenti farmacologici e alla luce
dei dati di sicurezza ad un anno, la Commissione decide di inserire la formulazione depot nel PTORV
riservandosi di rivalutare la molecola dopo 6 mesi sulla base dei consumi registrati.
ANALISI DELLA LETTERATURA
Risperidone è un antipsicotico atipico da tempo in commercio in formulazione orale nel trattamento delle
psicosi schizofreniche acute e croniche. Risperidone inoltre migliora i sintomi affettivi (come p.e.
depressione, senso di colpa, ansia) associati alla schizofrenia.
Dall’agosto del 2005 è autorizzata anche la commercializzazione della sospensione iniettabile a rilascio
prolungato intramuscolo, indicata per il trattamento delle psicosi schizofreniche croniche e nella profilassi
delle recidive (esacerbazioni acute) in soggetti che hanno dimostrato di tollerare le forme orali di
risperidone e con accertati problemi di compliance (1).
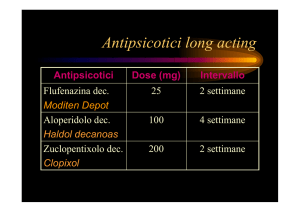
Si tratta della prima forma “depot” di un antipsicotico atipico; tali formulazioni sono invece disponibili da
tempo per gli antipsicotici tradizionali (flufenazina, perfenazina, aloperidolo, zuclopentixolo). Il prodotto
deve essere conservato ad una temperatura compresa tra i 2° e gli 8° C e al riparo dalla luce. La polvere
deve essere sospesa esclusivamente con il solvente contenuto nella siringa preriempita fornita nella
confezione; il prodotto ricostituito deve essere somministrato con gli aghi presenti all’interno della
confezione. La ricostituzione della sospensione necessita di una serie di passaggi di una certa
indaginosità.
La somministrazione deve avvenire ogni 2 settimane mediante iniezione intramuscolare profonda nel
gluteo. La dose raccomandata è di 25 mg ogni 2 settimane, ma per alcuni pazienti può essere necessario
un dosaggio superiore, di 37.5 o 50 mg. La dose massima non può superare i 50 mg ogni due settimane.
Dopo la prima somministrazione la fase di latenza è di 3 settimane, nel corso delle quali il paziente deve
essere opportunamente coperto con un antipsicotico (1).
Efficacia clinica
Gli studi randomizzati condotti con questa forma farmaceutica sono due, uno verso placebo ed uno verso
risperidone orale (2, 3, 4, 5). Non sono invece disponibili studi verso le formulazioni a rilascio prolungato
degli antipsicotici tradizionali.
In un primo studio randomizzato e in doppio cieco di 12 settimane, pazienti ospedalizzati e non di
età compresa tra i 18 e i 55 anni affetti da schizofrenia secondo i criteri DSM – IV e con un punteggio
PANSS (Positive and negative sindrome scale) compreso tra 60 e 120 sono entrati in un periodo di run in
di 2 settimane (in cui è stato loro somministrato risperidone orale) e sono successivamente stati
randomizzati a ricevere placebo im ogni due settimane oppure risperidone im 25, 50 o 75 mg ogni 2
settimane. Nelle prime tre settimane del periodo in doppio cieco i pazienti in trattamento attivo hanno
anche assunto risperidone orale (2, 4, 6 mg a seconda del gruppo di assegnazione) per coprire il periodo
di latenza (2). Parametro primario di efficacia veniva definito il cambiamento dal baseline del punteggio
PANSS con una riduzione ≥ 20% definita a priori come clinicamente significativa. I pazienti venivano
valutati ogni 2 settimane. Ciascun paziente veniva altresì valutato settimanalmente secondo la scala
Clinical Global Impression (CGI). Dei 554 pazienti sottoposti a screening, 461 sono entrati nel periodo di
run in e 400 sono entrati nel periodo in doppio cieco. L’efficacia è poi stata valutata sui 370 pazienti che
sono stati sottoposti ad almeno una valutazione post baseline. Lo studio è stato abbandonato
prematuramente dal 68% dei pazienti del gruppo placebo e dal 51-52% dei gruppi in trattamento attivo:
gli abbandoni erano dovuti primariamente alla mancanza di efficacia (soprattutto gruppo placebo) e ad
eventi avversi. Queste elevate percentuali di drop out limitano la validità dei risultati (2, 6). A partire da
un punteggio PANSS al baseline dei 4 gruppi di 80.1- 82.3 si assisteva alla 12 settimana ad una
diminuzione di –6,8 punti nel gruppo placebo e di –22.1, -16.2 e –14.9 punti nei gruppi ai vari dosaggi:
tutte le differenze erano significative (p< 0.001). Un miglioramento giudicato clinicamente significativo è
stato ottenuto rispettivamente dal 17%, 47%, 48% e 39% dei pazienti rispettivamente (p< 0.001 per
tutti i gruppi verso placebo). Anche relativamente al CGI i risultati ottenuti dai gruppi trattati con
risperidone sono risultati significativi. Eventi avversi si sono presentati in percentuali simili nei 4 gruppi di
trattamento, con sintomi extrapiramidali riportati dal 13% dei pazienti del gruppo placebo e dal 10%,
24% e 29% rispettivamente dei pazienti in trattamento attivo (p= NS).
In un secondo studio randomizzato in doppio cieco e double dummy 640 pazienti (da iniziali 779
sottoposti a screening) di età compresa tra i 18 e i 65 anni, affetti da schizofrenia secondo i criteri DSMIV e punteggio PANSS totale ≥ 50, dopo un periodo di run in con risperidone orale della durata di 8
settimane sono stati randomizzati a continuare il trattamento orale o ricevere risperidone im ogni 2
settimane al dosaggio di 25, 50 o 75 mg per la durata di 12 settimane (3, 5). Nel corso delle prime 3
settimane di trattamento in doppio cieco i pazienti assegnati a risperidone im hanno anche assunto
risperidone orale per coprire il periodo di latenza. La variabile di efficacia primaria dello studio era la
variazione dal baseline del punteggio PANSS, variabili secondarie erano invece le singole voci della scala
PANSS e la valutazione CGI. End-point primario era invece la dimostrazione della non inferiorità di
risperidone im rispetto a risperidone orale nel controllo dei sintomi. Lo studio è stato completato dall’84%
dei pazienti nel gruppo risperidone orale e dall’80% dei pazienti dei gruppi risperidone im. Il punteggio
PANSS totale è risultato significativamente migliorato per tutti i gruppi di trattamento rispetto al baseline
(p<0.001) e così pure è avvenuto per le singole voci della scala; i risultati del test di non inferiorità
hanno concluso per una efficacia sovrapponibile tra le due formulazioni.
In uno studio in aperto della durata di 12 mesi, 615 pazienti con diagnosi di schizofrenia secondo i
criteri DSM-IV e un punteggio PANSS totale medio di 66, considerati stabili dal punto di vista della
sintomatologia e già riceventi una terapia antipsicotica sono stati dapprima trattati con risperidone orale
(1 - 6 mg/die) per 2 settimane ed hanno poi ricevuto risperidone im alla dose di 25, 50 o 75 mg ogni 2
settimane (4, 5, 6). La dose di risperidone im veniva determinata in base alla dose orale utilizzata e
poteva venire titolata nel corso dello studio. L’efficacia veniva valutata secondo la scala PANSS, mentre
per la gravità dei sintomi extrapiramidali veniva utilizzata la Extrapyramidal Symptom Rating Scale
(ESRS). Un miglioramento clinico (riduzione ≥ 20% del punteggio PANSS) è stato ottenuto dal 49% dei
pazienti e questo risultato è stato ritenuto dagli autori significativo considerando che i pazienti
presentavano già al baseline una malattia stabilizzata. Ben il 35% dei pazienti, però ha terminato lo
studio prematuramente.
Non sono disponibili dati di confronto verso le forme depot degli antipsicotici tradizionali .
Una review Cochrane conclude che risperidone può costituire un’opzione per pazienti relativamente
poco gravi e con malattia stabile, sottolineando però i pochi dati disponibili e la scarsa accuratezza degli
studi nel riportare gli eventi avversi. Per i pazienti più gravi i benefici di risperidone long acting,
nonostante possa migliorare la compliance, appaiono invece molto limitati (7).
Tollerabilità
Aumento di peso (2,7 kg in 1 anno), depressione, affaticamento e sintomi extrapiramidali sono gli eventi
avversi comunemente registrati (1). Le reazioni avverse verificatesi nello studio di confronto vs la forma
orale sembrano paragonabili nei due gruppi. In farmacologia animale si sono tuttavia verificati, solo con
la formulazione iniettabile, dei casi di osteodistrofia per cui la FDA ha richiesto uno studio di
farmacovigilanza ad hoc, i cui risultati dovrebbero essere a breve disponibili (8). Successivamente alla
commercializzazione, sono stati osservati casi di sintomi extrapiramidali reversibili in neonati esposti
durante l’ultimo trimestre di gravidanza e casi di adenomi pituitari benigni (9). Nel luglio del 2006, in
seguito a segnalazioni spontanee di alcuni casi di re-insorgenza di deliri e/o allucinazioni nelle settimane
successive alla prima somministrazione, la ditta produttrice, in accordo con l’Agenzia francese di
sicurezza sanitaria dei prodotti ha modificato al scheda tecnica, richiamando l’attenzione dei sanitari ad
un attento monitoraggio dei pazienti nelle prime tre – quattro settimane di trattamento, nel corso delle
quali risperidone deve comunque essere somministrato per os. Viene inoltre specificato come l’utilizzo di
risperidone im long acting non sia raccomandato, in assenza di dati clinici, in pazienti trattati con
risperidone orale a dosi superiori ai 6 mg/die (10).
Sintesi
Risperidone microsfere biodegradabili in sospensione acquosa costituisce la prima formulazione di un
antipsicotico atipico disponibile come formulazione long active da somministrare per via parenterale. Il
farmaco deve essere conservato tra i 2° e gli 8° C e necessita di procedure di ricostituzione di una certa
complessità.
Sono disponibili due studi di confronto, uno verso placebo ed uno verso la forma orale, entrambi in
doppio cieco e della durata di 12 settimane, un periodo piuttosto limitato per valutare l’efficacia e la
tollerabilità di un preparato long acting e in una patologia cronica. Lo studio verso placebo ha riportato un
miglioramento significativo del punteggio PANSS con risperidone, mentre quello verso formulazione orale
riporta l’equivalenza terapeutica delle due formulazioni.
Uno studio in aperto della durata di un anno su pazienti con patologia già stabile al baseline ha
dimostrato un miglioramento ≥ 20 del punteggio della scala PANSS.
Non esistono studi di confronto verso antipsicotici tradizionali nella forma depot.
Le reazioni avverse verificatesi nello studio di confronto vs la forma orale sembrano paragonabili nei due
gruppi. In farmacologia animale si sono tuttavia verificati, solo con la formulazione iniettabile, dei casi di
osteodistrofia per cui la FDA ha richiesto uno studio di farmacovigilanza ad hoc (8). Nel luglio del 2006, in
seguito a segnalazioni spontanee di alcuni casi di re-insorgenza di deliri e/o allucinazioni nelle settimane
successive alla prima somministrazione, la ditta produttrice, in accordo con l’Agenzia francese di
sicurezza sanitaria dei prodotti ha modificato al scheda tecnica raccomandando un attento monitoraggio
dei pazienti nelle prime settimane di trattamento e sottolineando l’assenza di dati clinici per la
formulazione long acting in pazienti trattati con più di 6mg/die per os (10).
Nel valutare i vantaggi attribuibili al potenziale miglioramento della compliance con la forma farmaceutica
long acting è opportuno considerare i seguenti punti: gli studi effettuati non hanno mai incluso la
compliance tra gli outcome; la percentuale di miglioramento sulla scala PANSS (≥20%) registrata dallo
studio di maggior durata (1 anno) è stato considerato limitativo dai revisori della Cochrane Library che
ritengono clinicamente significativi miglioramenti ≥ 40% del punteggio; i pazienti inclusi negli studi
presentavano un punteggio PANSS inferiore a 90, indice di bassa gravità della patologia.
Bibliografia
1. Risperdal sospensione iniettabile. Riassunto delle caratteristiche del prodotto. Agosto 2005.
2. Kane JM, et al. Am J Psychiatry 2003; 160:1125-1132.
3. Chue P, et al. European Neuropsychopharmacology 2005; 15: 111-117.
4. Fleischhacker WW, et al. J Clin Psychiatry 2003; 64 (10): 1250-7.
5. Love RC, et al. Am J Health Syst Pharm 2004; 61: 1792-800.
6. AAVV La Revue Prescrire 2004; 24(255): 732-735.
7. Hosalli P, et al. The Cochrane database of systematic reviews 2003; issue 4. art. N. CD004161
8. http://www.fda.gov/cder/foi/appletter/2003/21346ltr.pdf (accesso del 27.09.06)
9. http://www.fda.gov/cder/foi/appletter/2006/021346s013ltr.pdf (accesso del 27.09.06)
10. www.farmacovigilanza.org
Costi comparativi:
PRINCIPIO
ATTIVO
FORMA
FARMACEUTICA
DOSAGGIO DA
SCHEDA TECNICA
Risperidone
Cpr
Risperidone
Sospensione
acquosa long
acting
Flufenazina
Sospensione
oleosa depot
4-6 mg/die
25 – 50 mg ogni 2
settimane (26 fl
anno da 25 mg o
50 mg)
25 mg ogni 3-4
settimane ( 12-17
fl/anno)
50 – 150 mg ogni
4 settimane
200 – 400 mg ogni
2-4 settimane
Aloperidolo
Zuclopentixolo
Sospensione
oleosa depot
Sospensione
oleosa depot
COSTO PER ANNO
DI TRATTAMENTO
(pubblico)
€ 1182,60 - 1803,10
COSTO PER
ANNO DI
TRATTAMENTO
(ospedale)
€ 536,55 – 817,60
€ 4313,4 – 6948,24
€ 2610,14 –
4209,92*
€ 54,48 – 77,18
€ 24,72 – 35,02
€ 53,40 – 122,04
€ 24,24 – 55,44
€ 75,6 – 302,40
€ 24,24 – 96,96
Prezzi al pubblico da banca dati Farmadati settembre 2006
* Prezzo massimo di cessione al SSN ex factory, IVA esclusa ( GU n. 194 del 22/08/2005)
Per tutti gli altri farmaci il prezzo massimo di cessione al SSN è pari al 50% del prezzo al pubblico ( da banca dati
Farmadati, settembre 2006) , IVA esclusa
Forma Farmaceutica:
1 fl 25 mg
Prezzo: € 165,69
1 fl 37,5 mg
€ 213,80
1 fl 50 mg
€ 267,24
Prezzo da banca dati Farmadati settembre 2006
ATC: N05AX08
Categoria terapeutica: altri antipsicotici
Classe PTN: H - Osp2
Indicazioni Ministeriali: Risperidone polvere e solvente per sospensione iniettabile a rilascio prolungato
nei dosaggi 25 mg/2 ml, 37,5 mg/2 ml e 50 mg/2 ml è indicato nel trattamento delle psicosi
schizofreniche croniche e nella profilassi delle recidive (esacerbazioni acute) in soggetti che hanno
dimostrato di tollerare le forme orali di risperidone e con accertati problemi di compliance.
Risperidone iniettabile, inoltre, migliora i sintomi affettivi (come p.e. depressione, senso di colpa, ansia)
associati alla schizofrenia.
Decisioni della CTR: Farmaco inserito in PTORV (data valutazione 03.05.06)
Commenti: Risperidone depot è la prima formulazione a rilascio prolungato di un antipsicotico atipico.
Considerato il potenziale vantaggio della formulazione depot in termini di compliance e di aderenza al
trattamento per questa tipologia di pazienti che spesso non accetta i trattamenti farmacologici e alla luce
dei dati di sicurezza ad un anno, la Commissione decide di inserire la formulazione depot nel PTORV
riservandosi di rivalutare la molecola dopo 6 mesi sulla base dei consumi registrati.
ANALISI DELLA LETTERATURA
Risperidone è un antipsicotico atipico da tempo in commercio in formulazione orale nel trattamento delle
psicosi schizofreniche acute e croniche. Risperidone inoltre migliora i sintomi affettivi (come p.e.
depressione, senso di colpa, ansia) associati alla schizofrenia.
Dall’agosto del 2005 è autorizzata anche la commercializzazione della sospensione iniettabile a rilascio
prolungato intramuscolo, indicata per il trattamento delle psicosi schizofreniche croniche e nella profilassi
delle recidive (esacerbazioni acute) in soggetti che hanno dimostrato di tollerare le forme orali di
risperidone e con accertati problemi di compliance (1).
Si tratta della prima forma “depot” di un antipsicotico atipico; tali formulazioni sono invece disponibili da
tempo per gli antipsicotici tradizionali (flufenazina, perfenazina, aloperidolo, zuclopentixolo). Il prodotto
deve essere conservato ad una temperatura compresa tra i 2° e gli 8° C e al riparo dalla luce. La polvere
deve essere sospesa esclusivamente con il solvente contenuto nella siringa preriempita fornita nella
confezione; il prodotto ricostituito deve essere somministrato con gli aghi presenti all’interno della
confezione. La ricostituzione della sospensione necessita di una serie di passaggi di una certa
indaginosità.
La somministrazione deve avvenire ogni 2 settimane mediante iniezione intramuscolare profonda nel
gluteo. La dose raccomandata è di 25 mg ogni 2 settimane, ma per alcuni pazienti può essere necessario
un dosaggio superiore, di 37.5 o 50 mg. La dose massima non può superare i 50 mg ogni due settimane.
Dopo la prima somministrazione la fase di latenza è di 3 settimane, nel corso delle quali il paziente deve
essere opportunamente coperto con un antipsicotico (1).
Efficacia clinica
Gli studi randomizzati condotti con questa forma farmaceutica sono due, uno verso placebo ed uno verso
risperidone orale (2, 3, 4, 5). Non sono invece disponibili studi verso le formulazioni a rilascio prolungato
degli antipsicotici tradizionali.
In un primo studio randomizzato e in doppio cieco di 12 settimane, pazienti ospedalizzati e non di
età compresa tra i 18 e i 55 anni affetti da schizofrenia secondo i criteri DSM – IV e con un punteggio
PANSS (Positive and negative sindrome scale) compreso tra 60 e 120 sono entrati in un periodo di run in
di 2 settimane (in cui è stato loro somministrato risperidone orale) e sono successivamente stati
randomizzati a ricevere placebo im ogni due settimane oppure risperidone im 25, 50 o 75 mg ogni 2
settimane. Nelle prime tre settimane del periodo in doppio cieco i pazienti in trattamento attivo hanno
anche assunto risperidone orale (2, 4, 6 mg a seconda del gruppo di assegnazione) per coprire il periodo
di latenza (2). Parametro primario di efficacia veniva definito il cambiamento dal baseline del punteggio
PANSS con una riduzione ≥ 20% definita a priori come clinicamente significativa. I pazienti venivano
valutati ogni 2 settimane. Ciascun paziente veniva altresì valutato settimanalmente secondo la scala
Clinical Global Impression (CGI). Dei 554 pazienti sottoposti a screening, 461 sono entrati nel periodo di
run in e 400 sono entrati nel periodo in doppio cieco. L’efficacia è poi stata valutata sui 370 pazienti che
sono stati sottoposti ad almeno una valutazione post baseline. Lo studio è stato abbandonato
prematuramente dal 68% dei pazienti del gruppo placebo e dal 51-52% dei gruppi in trattamento attivo:
gli abbandoni erano dovuti primariamente alla mancanza di efficacia (soprattutto gruppo placebo) e ad
eventi avversi. Queste elevate percentuali di drop out limitano la validità dei risultati (2, 6). A partire da
un punteggio PANSS al baseline dei 4 gruppi di 80.1- 82.3 si assisteva alla 12 settimana ad una
diminuzione di –6,8 punti nel gruppo placebo e di –22.1, -16.2 e –14.9 punti nei gruppi ai vari dosaggi:
tutte le differenze erano significative (p< 0.001). Un miglioramento giudicato clinicamente significativo è
stato ottenuto rispettivamente dal 17%, 47%, 48% e 39% dei pazienti rispettivamente (p< 0.001 per
tutti i gruppi verso placebo). Anche relativamente al CGI i risultati ottenuti dai gruppi trattati con
risperidone sono risultati significativi. Eventi avversi si sono presentati in percentuali simili nei 4 gruppi di
trattamento, con sintomi extrapiramidali riportati dal 13% dei pazienti del gruppo placebo e dal 10%,
24% e 29% rispettivamente dei pazienti in trattamento attivo (p= NS).
In un secondo studio randomizzato in doppio cieco e double dummy 640 pazienti (da iniziali 779
sottoposti a screening) di età compresa tra i 18 e i 65 anni, affetti da schizofrenia secondo i criteri DSMIV e punteggio PANSS totale ≥ 50, dopo un periodo di run in con risperidone orale della durata di 8
settimane sono stati randomizzati a continuare il trattamento orale o ricevere risperidone im ogni 2
settimane al dosaggio di 25, 50 o 75 mg per la durata di 12 settimane (3, 5). Nel corso delle prime 3
settimane di trattamento in doppio cieco i pazienti assegnati a risperidone im hanno anche assunto
risperidone orale per coprire il periodo di latenza. La variabile di efficacia primaria dello studio era la
variazione dal baseline del punteggio PANSS, variabili secondarie erano invece le singole voci della scala
PANSS e la valutazione CGI. End-point primario era invece la dimostrazione della non inferiorità di
risperidone im rispetto a risperidone orale nel controllo dei sintomi. Lo studio è stato completato dall’84%
dei pazienti nel gruppo risperidone orale e dall’80% dei pazienti dei gruppi risperidone im. Il punteggio
PANSS totale è risultato significativamente migliorato per tutti i gruppi di trattamento rispetto al baseline
(p<0.001) e così pure è avvenuto per le singole voci della scala; i risultati del test di non inferiorità
hanno concluso per una efficacia sovrapponibile tra le due formulazioni.
In uno studio in aperto della durata di 12 mesi, 615 pazienti con diagnosi di schizofrenia secondo i
criteri DSM-IV e un punteggio PANSS totale medio di 66, considerati stabili dal punto di vista della
sintomatologia e già riceventi una terapia antipsicotica sono stati dapprima trattati con risperidone orale
(1 - 6 mg/die) per 2 settimane ed hanno poi ricevuto risperidone im alla dose di 25, 50 o 75 mg ogni 2
settimane (4, 5, 6). La dose di risperidone im veniva determinata in base alla dose orale utilizzata e
poteva venire titolata nel corso dello studio. L’efficacia veniva valutata secondo la scala PANSS, mentre
per la gravità dei sintomi extrapiramidali veniva utilizzata la Extrapyramidal Symptom Rating Scale
(ESRS). Un miglioramento clinico (riduzione ≥ 20% del punteggio PANSS) è stato ottenuto dal 49% dei
pazienti e questo risultato è stato ritenuto dagli autori significativo considerando che i pazienti
presentavano già al baseline una malattia stabilizzata. Ben il 35% dei pazienti, però ha terminato lo
studio prematuramente.
Non sono disponibili dati di confronto verso le forme depot degli antipsicotici tradizionali .
Una review Cochrane conclude che risperidone può costituire un’opzione per pazienti relativamente
poco gravi e con malattia stabile, sottolineando però i pochi dati disponibili e la scarsa accuratezza degli
studi nel riportare gli eventi avversi. Per i pazienti più gravi i benefici di risperidone long acting,
nonostante possa migliorare la compliance, appaiono invece molto limitati (7).
Tollerabilità
Aumento di peso (2,7 kg in 1 anno), depressione, affaticamento e sintomi extrapiramidali sono gli eventi
avversi comunemente registrati (1). Le reazioni avverse verificatesi nello studio di confronto vs la forma
orale sembrano paragonabili nei due gruppi. In farmacologia animale si sono tuttavia verificati, solo con
la formulazione iniettabile, dei casi di osteodistrofia per cui la FDA ha richiesto uno studio di
farmacovigilanza ad hoc, i cui risultati dovrebbero essere a breve disponibili (8). Successivamente alla
commercializzazione, sono stati osservati casi di sintomi extrapiramidali reversibili in neonati esposti
durante l’ultimo trimestre di gravidanza e casi di adenomi pituitari benigni (9). Nel luglio del 2006, in
seguito a segnalazioni spontanee di alcuni casi di re-insorgenza di deliri e/o allucinazioni nelle settimane
successive alla prima somministrazione, la ditta produttrice, in accordo con l’Agenzia francese di
sicurezza sanitaria dei prodotti ha modificato al scheda tecnica, richiamando l’attenzione dei sanitari ad
un attento monitoraggio dei pazienti nelle prime tre – quattro settimane di trattamento, nel corso delle
quali risperidone deve comunque essere somministrato per os. Viene inoltre specificato come l’utilizzo di
risperidone im long acting non sia raccomandato, in assenza di dati clinici, in pazienti trattati con
risperidone orale a dosi superiori ai 6 mg/die (10).
Sintesi
Risperidone microsfere biodegradabili in sospensione acquosa costituisce la prima formulazione di un
antipsicotico atipico disponibile come formulazione long active da somministrare per via parenterale. Il
farmaco deve essere conservato tra i 2° e gli 8° C e necessita di procedure di ricostituzione di una certa
complessità.
Sono disponibili due studi di confronto, uno verso placebo ed uno verso la forma orale, entrambi in
doppio cieco e della durata di 12 settimane, un periodo piuttosto limitato per valutare l’efficacia e la
tollerabilità di un preparato long acting e in una patologia cronica. Lo studio verso placebo ha riportato un
miglioramento significativo del punteggio PANSS con risperidone, mentre quello verso formulazione orale
riporta l’equivalenza terapeutica delle due formulazioni.
Uno studio in aperto della durata di un anno su pazienti con patologia già stabile al baseline ha
dimostrato un miglioramento ≥ 20 del punteggio della scala PANSS.
Non esistono studi di confronto verso antipsicotici tradizionali nella forma depot.
Le reazioni avverse verificatesi nello studio di confronto vs la forma orale sembrano paragonabili nei due
gruppi. In farmacologia animale si sono tuttavia verificati, solo con la formulazione iniettabile, dei casi di
osteodistrofia per cui la FDA ha richiesto uno studio di farmacovigilanza ad hoc (8). Nel luglio del 2006, in
seguito a segnalazioni spontanee di alcuni casi di re-insorgenza di deliri e/o allucinazioni nelle settimane
successive alla prima somministrazione, la ditta produttrice, in accordo con l’Agenzia francese di
sicurezza sanitaria dei prodotti ha modificato al scheda tecnica raccomandando un attento monitoraggio
dei pazienti nelle prime settimane di trattamento e sottolineando l’assenza di dati clinici per la
formulazione long acting in pazienti trattati con più di 6mg/die per os (10).
Nel valutare i vantaggi attribuibili al potenziale miglioramento della compliance con la forma farmaceutica
long acting è opportuno considerare i seguenti punti: gli studi effettuati non hanno mai incluso la
compliance tra gli outcome; la percentuale di miglioramento sulla scala PANSS (≥20%) registrata dallo
studio di maggior durata (1 anno) è stato considerato limitativo dai revisori della Cochrane Library che
ritengono clinicamente significativi miglioramenti ≥ 40% del punteggio; i pazienti inclusi negli studi
presentavano un punteggio PANSS inferiore a 90, indice di bassa gravità della patologia.
Bibliografia
1. Risperdal sospensione iniettabile. Riassunto delle caratteristiche del prodotto. Agosto 2005.
2. Kane JM, et al. Am J Psychiatry 2003; 160:1125-1132.
3. Chue P, et al. European Neuropsychopharmacology 2005; 15: 111-117.
4. Fleischhacker WW, et al. J Clin Psychiatry 2003; 64 (10): 1250-7.
5. Love RC, et al. Am J Health Syst Pharm 2004; 61: 1792-800.
6. AAVV La Revue Prescrire 2004; 24(255): 732-735.
7. Hosalli P, et al. The Cochrane database of systematic reviews 2003; issue 4. art. N. CD004161
8. http://www.fda.gov/cder/foi/appletter/2003/21346ltr.pdf (accesso il 27.09.06)
9. http://www.fda.gov/cder/foi/appletter/2006/021346s013ltr.pdf (accesso il 27.09.06)
10. www.farmacovigilanza.org
Costi comparativi:
PRINCIPIO
ATTIVO
FORMA
FARMACEUTICA
DOSAGGIO DA
SCHEDA TECNICA
Risperidone
Cpr
Risperidone
Sospensione
acquosa long
acting
Flufenazina
Sospensione
oleosa depot
4-6 mg/die
25 – 50 mg ogni 2
settimane (26 fl
anno da 25 mg o
50 mg)
25 mg ogni 3-4
settimane ( 12-17
fl/anno)
50 – 150 mg ogni 4
settimane
200 – 400 mg ogni
2-4 settimane
Aloperidolo
Zuclopentixolo
Sospensione
oleosa depot
Sospensione
oleosa depot
COSTO PER ANNO
DI TRATTAMENTO
(pubblico)
€ 1182,60 - 1803,10
COSTO PER
ANNO DI
TRATTAMENTO
(ospedale)
€ 536,55 – 817,60
€ 4313,4 – 6948,24
€ 2610,14 –
4209,92*
€ 54,48 – 77,18
€ 24,72 – 35,02
€ 53,40 – 122,04
€ 24,24 – 55,44
€ 75,6 – 302,40
€ 24,24 – 96,96
Prezzi al pubblico da banca dati Farmadati settembre 2006
* Prezzo massimo di cessione al SSN ex factory, IVA esclusa ( GU n. 194 del 22/08/2005)
Per tutti gli altri farmaci il prezzo massimo di cessione al SSN è pari al 50% del prezzo al pubblico ( da banca dati
Farmadati, settembre 2006) , IVA esclusa