Dipartimento Salute della Donna e Medicina Territoriale
DOTTORATO DI RICERCA IN
SCIENZE GINECOLOGICHE E OSTETRICHE
Ciclo XXIII
Trattamento Chirurgico
del Tumore della Mammella
in Regime di Day Surgery
Relatore
Chiar.mo Prof. Massimo Moscarini
Dottorando
Dott. Carlo Carriero
ANNO ACCADEMICO
2009 / 2010
INDICE
PREMESSE E SCOPI
p. 1
INTRODUZIONE
p. 3
Epidemiologia
p. 3
Terapia chirurgica del tumore della mammella
p. 7
La biopsia del linfonodo sentinella
p. 22
Reperimento ed exeresi di lesioni non palpabili
p. 36
Il Day Surgery
p. 44
Day surgery e tumore della mammella
p. 52
MATERIALI E METODI
p. 60
ANALISI DEI DATI E COMMENTO DEI RISULTATI
p. 71
CONCLUSIONI
p. 82
BIBLIOGRAFIA
p. 86
ALLEGATO
PREMESSE E SCOPI DELLA TESI
Il tumore della mammella rappresenta una delle malattie oncologiche più
frequenti in assoluto nel sesso femminile. La sua diagnosi precoce con i
programmi di screenig, il suo trattamento ed il follow up delle pazienti
rappresentano voci consistenti nel bilancio della spesa sanitaria. L’intervento
chirurgico è ancora oggi, nella maggioranza dei casi, il primo atto terapeutico.
Dopo l’introduzione della radioterapia integrata alla chirurgia conservativa, nel
corso degli anni, l’aggressività chirurgica ha subito una formidabile modulazione.
Più recentemente, nell’ultimo decennio, anche per quanto riguarda il cavo
ascellare, il chirurgo ha potuto in molti casi omettere la dissezione radicale, grazie
alla tecnica del linfonodo sentinella. Le caratteristiche anatomiche dell’organo e lo
standard attuale di trattamento chirurgico permette spesso di effettuare un
intervento in tempi operatori brevi e addirittura in anestesia loco-regionale.
Alla luce di queste considerazioni è stato proposto ad un gruppo di pazienti affette
da tumore della mammella, selezionate con rigidi criteri, di sottoporsi all’interveto
in regime di day surgery, senza modificare lo standard di trattamento chirurgico,
ma riducendo al minimo il tempo di degenza.
Lo scopo del nostro lavoro è stato in primis quello di analizzare e codificare quei
casi in cui il tumore della mammella può essere trattato in day surgery. Altro
obbiettivo è stato quello di analizzare in modo più specifico i casi in cui la
paziente è stata sottoposta anche a biopsia del linfonodo sentinella. Tale tecnica,
1
seppur richieda uno sforzo organizzativo che coinvolge diverse branche
specialistiche, è sicuramente adatta ad una dimissione precoce.
La letterature scientifica descrive in alcuni lavori la possibilità di ricorrere a tale
regime di ricovero, tuttavia non esistono studi randomizzati con elevato livello di
evidenza che confrontino l’approccio in day surgery con il ricovero ordinario per
il tumore della mammella.
Sul versante della razionalizzazione delle risorse economiche è sempre più
incentivato il ricorso a degenze brevi, e quindi alla gestione domiciliare del postoperatorio anche per patologie in passato trattate con ricoveri di alcuni giorni.
In un ottica di riduzione dei costi sanitari, riduzione delle liste d’attesa, riduzione
della morbilità, riduzione dell’impatto psicologico della degenza ospedaliera nel
paziente oncologico, è stato valutato se l’approccio in day surgery potesse
rispondere ad alcune di queste esigenze, in modo da fornire alla paziente affetta da
carcinoma della mammella, anche in forma infiltrante, una valida alternativa al
pernottamento in ospedale dopo l’intervento chirurgico.
2
INTRODUZIONE
EPIDEMIOLOGIA DEL TUMORE DELLA MAMMELLA
Il carcinoma mammario è di gran lunga la neoplasia più frequente nelle donne dei
Paesi industrializzati ed è la maggiore causa di morbilità e mortalità oncologiche
nell’Unione Europea e la seconda dopo il polmone negli Stati Uniti. A livello
mondiale è il secondo per incidenza e il quinto per mortalità con circa 1 milione di
nuovi casi e 350.000 morti ogni anno (Parkin DM, Int J Cancer 2001;94:153-6)
Incidenza
L’incidenza del cancro della mammella presenta un’ampia variabilità geografica:è
quasi 10 volte più frequente nei paesi occidentali. I tassi più alti ( 70-90/100.000 ) si
registrano nel Nord America, nell’Europa Nord-Occidentale, in Brasile, in Argentina
e in Australia (Parkin DM, IARC Scientific Publ.No. 155. Lyon, France:
International Agency for Research on Cancer, 2002. Ries LAG, et al. SEER Cancer
Statistics Review, 1975-2002. Bethesda,MD: National Cancer Institute, 2005). In
Italia circa 30-40.000 donne ogni anno si ammalano di carcinoma della mammella:
circa 7-8000 in età inferiore a 50 anni, 13-14000 tra i 50 e i 70 anni ed altri 8-10000
nell’età più avanzata. Il numero di donne attualmente viventi in Italia che hanno
avuto in passato una diagnosi di cancro della mammella è stimabile ad oltre 300.000.
Le stime di incidenza, basate sui dati dei registri tumori, mostrano valori più alti al
Nord, intermedi al Centro ed inferiori al Sud: i tassi di incidenza standardizzati per
3
età sono del 30-35% più alti nel Nord che nel Sud. Le differenze geografiche si
stanno però riducendo e sono praticamente confinate all’età superiore a 50 anni: nelle
donne più giovani l’incidenza è ormai simile in tutta Italia. Il tasso di incidenza
cumulativo fra 0 e 79 anni ha raggiunto il 10%: in assenza di mortalità per altre cause,
10 donne su 100 sono destinate a contrarre la malattia nel corso della loro vita. Due
donne su cento si ammalano già prima dei 50 anni. I tassi di incidenza aumentano
esponenzialmente con l’età (come per gli altri tumori epiteliali) fin verso i 50 anni,
quindi subiscono una pausa, o addirittura una lieve diminuzione, per poi riprendere a
crescere, ma con un tasso inferiore, dopo l’età della menopausa.
400
mortalità
tassi per 100.000
350
300
incidenza
250
200
150
100
50
0
14 20 30 40 50 60 70 80 90
età
Figura 1: Tassi di incidenza del tumore della mammella nelle diverse fasce di età
(da Linee Guida FONCaM 2005 modificato)
4
Nell’ultimo decennio tutti i registri tumori segnalano un incremento progressivo
dell’incidenza del tumore della mammella, tale fenomeno viene attribuito secondo gli
studi a tre fattori principalmente: reale incremento (30%), maggior numero di
diagnosi precoci grazie all’uso della mammografia (60%), maggiore probabilità di
diagnosticare il cancro per l’aumento della vita media della donna (10%).
Mortalità e Sopravvivenza
La sopravvivenza per il tumore della mammella è aumentata gradualmente nei paesi
più ricchi, ed è ora di oltre 85%. Le ragioni per tale miglioramento sono da ricercare
nell’ampia diffusione dello screening mammografico per la diagnosi precoce e
nell’aumentato numero di donne che ricevono il trattamento ottimale per la loro
malattia, con particolare riferimento all’adozione di adeguati programmi di terapia
sistemica adiuvante. La sopravvivenza rimane più bassa nei paesi in via di sviluppo,
dove è circa del 50-60% (Colditz GA, Cancer epidemiology and prevention. New
York:
Oxford
University
Press,
2006:995-1012).
Nell’Unione
Europea
complessivamente la mortalità è passata da 21.3 nel 1990 a 18.4/100.000, con una
riduzione annuale del 2.1% fra il 1995 e il 2000 (Levi F, et. al. Eur J Cancer Prev
2005;14:497-502).
Nella maggior parte dei paesi del nord Europa inclusi i paesi scandinavi ed il Regno
Unito, ma anche in alcuni paesi dell’Europa centrale e del sud, quali Germania,
Polonia, Repubblica Ceca, Austria, Svizzera, Italia e Spagna, si è osservata una
riduzione apprezzabile nei tassi di mortalità (tra -7 e -18% durante gli ultimi cinque
5
anni). Le riduzioni sono state particolarmente significative sotto i 50 anni di età,
avvicinandosi al 20% di decremento in molti paesi.
Riduzioni nella mortalità più limitate sono state osservate in Francia, Grecia,
Portogallo e nella maggior parte dei paesi dell'est, mentre in Russia la mortalità per
tumore della mammella è aumentata da 16.1 a 17.3/100.000 (+7.5%) negli ultimi
cinque anni. Le riduzione più limitate in alcuni paesi nell’est Europa sono
probabilmente dovute al fatto che in queste aree i tassi erano originalmente più bassi,
e riflettono in parte i ritardi negli avanzamenti nella diagnosi precoce e nel
trattamento di questa neoplasia (Levi F, et al. Ann Oncol 2004;15:1425-31).
Suddividendo le pazienti in base all’età, la sopravvivenza a 5 anni è inferiore tra le
donne più giovani rispetto a quelle fra i 45/54 anni. Dopo i 55 anni la sopravvivenza
diminuisce progressivamente con l’aumentare dell’età. La fascia d’età intermedia è
quella che ha la migliore prognosi in assoluto.
6
TRATTAMENTO CHIRURGICO DEL TUMORE DELLA MAMMELLA
Resezione mammaria limitata (biopsia/tumorectomia)
Qualsiasi intervento chirurgico deve essere preceduto da un accertamento citologico o
istologico (agoaspirato o agobiopsia) della lesione, poiché ciò consente una
programmazione chirurgica più appropriata. La biopsia chirurgica è riservata ai casi
nei quali questi accertamenti non siano stati eseguiti o non abbiano risolto il dubbio
diagnostico. La resezione mammaria limitata consiste nell’asportazione di una
piccola porzione di tessuto mammario comprendente il tumore; nelle forme
superficiali la biopsia può contemplare l’asportazione di una porzione di cute
soprastante la neoplasia per la verifica della possibile infiltrazione cutanea. Può
essere effettuata nella stessa seduta operatoria ove sia possibile eseguire l’esame
istologico estemporaneo; in caso contrario, quando a essa deve seguire un ulteriore
intervento, è consigliabile attendere il tempo necessario per ottenere una completa
cicatrizzazione della sede del prelievo. In tale modo le cellule tumorali eventualmente
presenti nel letto bioptico rimarranno intrappolate e il rischio di una diffusione locale
sarà minore. Effettuare l’intervento a cicatrizzazione avvenuta consentirà una
migliore definizione e valutazione dei margini di resezione. Se il nodulo tumorale è
stato correttamente escisso, non vi è un aumentato rischio di recidiva locale anche se
l’intervento definitivo viene procrastinato di 20-30 giorni. La biopsia deve consentire
la caratterizzazione istopatologica e biologica della neoplasia; deve essere
possibilmente escissionale nei tumori di limitate dimensioni e incisionale nei tumori
voluminosi. L’escissione bioptica deve avvenire attraverso un’incisione cutanea che
7
deve tener conto della eventuale successiva incisione per l’intervento definitivo.
Nell’eseguire la biopsia le manovre debbono essere delicate, al fine di ridurre al
minimo la manipolazione e il conseguente rischio di contaminazione neoplastica nel
campo operatorio. Per tale motivo è essenziale sostituire guanti e strumenti al termine
della biopsia, prima della sintesi ghiandolare. L’eventuale successivo intervento
conservativo o demolitivo deve asportare in blocco il focolaio di biopsia senza
aprirlo.
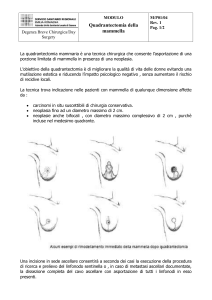
Resezione mammaria ampia (tumorectomia allargata)
Per resezione ampia, ampia exeresi o tumorectomia allargata, si intende
l’asportazione di una porzione di tessuto mammario comprendente il tumore e un
margine non inferiore al centimetro di parenchima circostante macroscopicamente
sano. E’ da preferire un’incisione curvilinea soprastante la lesione, comprendente una
porzione di cute nel caso il tumore sia superficiale. In alcuni casi quando è necessario
asportare tutto il territorio duttale, può essere opportuno utilizzare l’incisione radiale
a losanga così che l’intervento appare del tutto sovrapponibile alla classica
quadrantectomia con margini peritumorali più limitati. L’escissione del parenchima
circostante il tumore può essere facilitata dalla palpazione del tumore che offre una
differente consistenza. In caso di lesione non palpabile il chirurgo avvalendosi del
metodo di reperimento utilizzato deve condurre l’exeresi in modo che la lesione possa
essere contenuta al centro del volume ghiandolare asportato. Nelle lesioni non
palpabili la radiografia del pezzo operatorio consente al chirurgo di radicalizzare
8
immediatamente il margine più vicino al tumore. In caso di incisioni cutanee non
corrispondenti alla sede della neoplasia è indispensabile posizionare una o più clip
metalliche per la definizione di campo per la successiva radioterapia.
Quadrantectomia (intervento di Veronesi)
Per quadrantectomia si intende l’asportazione di un ampio settore di ghiandola
mammaria con la cute soprastante e la fascia del muscolo grande pettorale. La
quadrantectomia viene effettuata con un’incisione cutanea a losanga con asse
maggiore radiale, disegnata in modo che la proiezione cutanea del tumore o il taglio
dell’accertamento bioptico, laddove eseguiti, vengano a trovarsi al centro della
losanga stessa. E’ inutile estendere l’incisione cutanea troppo perifericamente o
troppo vicino al capezzolo quando non lo richieda la sede della lesione, così come è
da evitare l’incisione sul pilastro ascellare che determina successivamente
un’antiestetica retrazione cicatriziale. Per lesioni retroareolari non profonde è
necessario asportare un cilindro di tessuto comprendente l’areola, il tumore e la fascia
del pettorale. Incisa la cute, l’exeresi del quadrante procede allargandosi in profondità
fino ad asportare la fascia del muscolo grande pettorale. La linea di incisione non
deve essere perpendicolare al piano di tale muscolo bensì obliqua: ne risulterà un
pezzo operatorio in cui il tessuto sottocutaneo, quello ghiandolare e la fascia
muscolare hanno i diametri ortogonali progressivamente più estesi rispetto alla cute
soprastante. L’asportazione del parenchima mammario deve comunque includere i
dotti compresi fra il tumore e il capezzolo. Perifericamente è sufficiente un margine
9
di 2 cm. L’exeresi si identifica con un quadrante della mammella in pazienti con seni
piccoli, mentre in seni voluminosi sono sufficienti mediamente 2 cm di parenchima
macroscopicamente sano intorno alla sede della lesione tumorale. Completata
l’emostasi, si avvicinano con punti di materiale riassorbibile le superfici di sezione
della ghiandola controllando che tale sutura non determini retrazioni cutanee che
vanno eliminate mobilizzando la ghiandola dal piano cutaneo o dai piani profondi.
Mastectomia sottocutanea
L’intervento prevede l’asportazione dell’intera ghiandola mammaria preservando la
cute della mammella e il complesso areola-capezzolo. Le incisioni cutanee di solito
praticate sono la sottomammaria o la trasversale equatoriale passando attraverso
areola e capezzolo per via periareolare superiore. Si inizia a isolare la ghiandola
mammaria dalla cute preparando i lembi lungo il piano della fascia superficialis che è
relativamente avascolare. Lo spessore dipende dalla corporatura della paziente: in una
paziente magra può essere di soli 2-3 mm, in una obesa può essere di 5-10 mm. La
preparazione dei lembi, che devono essere sollevati con delicatezza, può anche essere
effettuata con il bisturi elettrico che coagula facilmente i piccoli vasi perforanti. é
questo il tempo più difficile dell’atto chirurgico perché si deve evitare di preparare
lembi troppo sottili, quindi a rischio di necrosi, oppure troppo spessi con il rischio
di lasciare in sede tessuto ghiandolare residuo. La dissezione deve raggiungere i
confini della ghiandola mammaria e cioè superiormente i fasci sottoclaveari del
muscolo grande pettorale, medialmente la linea parasternale, lateralmente il muscolo
10
grande dorsale. Particolare attenzione deve essere dedicata al confine inferiore onde
preservare il solco sottomammario e consentire un buon risultato ricostruttivo, ove
previsto.
Mastectomia con risparmio cutaneo (skin sparing mastectomy)
Questo intervento prevede l’asportazione della ghiandola mammaria con il complesso
areola-capezzolo rispettando completamente o in parte la cute soprastante. E’
importante disegnare sulla cute della mammella le incisioni cutanee che verranno
impiegate e il solco sottomammario. Il complesso areola-capezzolo, la cute
soprastante, neoplasie superficiali o incisioni pregresse a scopo bioptico vengono
escissi. L’incisione periareolare è estesa lateralmente verso il quadrante superoesterno per avere una buona esposizione della ghiandola mammaria. Se necessario,
un’incisione ascellare consentirà l’esecuzione della linfoadenectomia. In pazienti con
mammelle particolarmente ptosiche l’incisione cutanea può riprodurre quella
impiegata per le mastopessi. In questo caso successivamente una mastopessi verrà
attuata anche nel seno controlaterale. Si inizia ad isolare la ghiandola mammaria dalla
cute preparando i lembi lungo il piano della fascia superficialis che è relativamente
avascolare. Lo spessore dipende dalla corporatura della paziente: in una paziente
magra può essere di soli 2-3 mm, in una obesa può essere di 5-10 mm. La
preparazione dei lembi, che devono essere sollevati con delicatezza, può anche essere
effettuata con il bisturi elettrico che coagula facilmente i piccoli vasi perforanti. E’
questo il tempo più difficile perchè si deve evitare di preparare lembi troppo sottili e
11
quindi a rischio di necrosi o troppo spessi lasciando tessuto ghiandolare residuo. La
dissezione deve raggiungere i confini della ghiandola mammaria e cioè superiormente
i fasci sottoclaveari del muscolo grande pettorale, medialmente la linea parasternale,
lateralmente il muscolo grande dorsale. Inferiormente la fascia superficialis si fonde
con la fascia profonda e questo corrisponde all’inserzione costale inferiore del
muscolo grande pettorale e al solco sottomammario, precedentemente segnato, in cui
la cute aderisce alla parete addominale. La conservazione del solco sottomammario
facilita molto la successiva ricostruzione. Lateralmente in alto deve essere asportato il
prolungamento ascellare della ghiandola che talvolta si estende sotto il bordo
anteriore del muscolo grande pettorale e, lateralmente in basso, si devono evidenziare
le digitazioni del muscolo dentato anteriore. Iniziando dall’alto si incide la fascia del
muscolo grande pettorale e, seguendo questo piano, si asporta tutta la mammella
raggiungendo i confini suddetti.
Mastectomia nipple-sparing
Un’evoluzione più recente della mastectomia è la nipple-sparing, che prevede la
conservazione dell’areola e del capezzolo con l’irradiazione di questo complesso
anatomico con elettroni. La radioterapia può essere erogata intraoperatoriamente
oppure nei giorni successivi all’intervento. E’ in corso uno studio che valuta l’impatto
di questa tecnica chirurgica sulla qualità di vita delle pazienti e sulla ricaduta locale di
malattia. Requisito importante per la conservazione del complesso areola-capezzolo è
la negatività microscopica intraoperatoria per neoplasia del tessuto retro-areolare.
12
Possono beneficiare di questo tipo di intervento pazienti affette da neoplasie non
infiltranti estese oppure tumori infiltranti estesi, situati in sedi non prossime alla zona
centrale della mammella.
Mastectomia totale
Il termine definisce l’asportazione della ghiandola mammaria e di una losanga di cute
soprastante comprendente areola e capezzolo (mastectomia semplice).
L’incisione cutanea, a losanga, può avere l’asse maggiore orientato nella direzione
più conveniente alla corretta exeresi della neoplasia; sono tuttavia da preferire le
incisioni orizzontali (di Stewart) oppure oblique. Qualunque sia l’incisione chirurgica
scelta per l’intervento, bisogna fare attenzione, ai fini del mantenimento di una buona
funzionalità del braccio, a non interessare con la linea di incisione la cute dell’ascella.
Incisi cute e sottocute inizia la preparazione dei lembi che non devono essere nè
troppo sottili, per il rischio di necrosi successive, nè troppo spessi per evitare di
lasciare tessuto mammario. Il piano della fascia superficiale risulta il più adatto a
questo scopo in quanto fra l’altro relativamente avascolare. Lateralmente si deve
raggiungere la superficie laterale del muscolo grande dorsale; medialmente il margine
dello sterno; superiormente i fasci clavicolari del muscolo grande pettorale e
inferiormente la fascia del retto. La ghiandola viene progressivamente mobilizzata dal
versante mediale a quello laterale asportando se necessario anche la fascia del
muscolo grande pettorale. Se è prevista una ricostruzione immediata il chirurgo
plastico, creando la tasca sottomuscolare, procederà alla sezione delle inserzioni
13
infero-mediali del muscolo grande pettorale. Se il chirurgo oncologo conserva le
connessioni del tessuto sottocutaneo verso il solco sottomammario, la tasca
sottomuscolare potrà essere ampia e sufficientemente espandibile nelle porzioni
inferiori a tutto vantaggio del risultato finale.
Mastectomia totale con asportazione di entrambi i muscoli pettorali
(intervento di Halsted)
Il termine radicale non è più impiegato oggi in quanto il concetto di radicalità va
considerato un obiettivo sia della chirurgia demolitiva che di quella conservativa. Per
quanto riguarda le incisioni cutanee e l’allestimento dei lembi si rimanda a quanto
descritto per la mastectomia totale. Il primo tempo operatorio consiste nella
identificazione della linea di divisione tra la porzione clavicolare e la porzione
omerale dei fasci muscolari del muscolo grande pettorale. Non tutti i chirurghi sono
d’accordo nel separare le due porzioni del muscolo: alcuni preferiscono identificare la
vena cefalica che separa il grande pettorale dal deltoide e sezionare quindi anche la
porzione clavicolare. In genere si lasciano intatti i fasci clavicolari del muscolo dal
momento che la loro asportazione non dà maggiori garanzie di radicalità; d’altro
canto la loro presenza previene la depressione dell’area infraclavicolare, mal
sopportata da molte pazienti, e preserva alcuni collettori linfatici. L’operatore separa
con il dito l’inserzione della porzione omerale del muscolo grande pettorale
recidendola in prossimità dell’omero. Si passa quindi all’isolamento del muscolo
14
piccolo pettorale che viene sezionato all’inserzione del processo coracoide della
scapola dopo aver legato e sezionato le connessioni vascolari arteriose e venose
toraco-acromiali. Il tempo operatorio successivo è costituito dall’accurata dissezione
linfonodale del cavo ascellare. In questo caso il compito dell’operatore sarà agevolato
dalla maggiore esposizione del cavo ascellare ottenuta a seguito della disinserzione di
entrambi i muscoli pettorali. A questo punto i muscoli pettorali vengono distaccati
dalle loro inserzioni costo-sternali con legatura o elettrocoagulazione dei vasi
perforanti intercostali e dei rami comunicanti (evitare le coagulazioni massive,
coagulare con pinze sottili). Il muscolo grande pettorale viene separato inferiormente
dalla fascia del muscolo retto e dell’obliquo esterno. Il pezzo asportato è quindi
costituito dalla ghiandola mammaria, ricoperta dal tessuto sottocutaneo e dalla cute
soprastante, dai muscoli grande e piccolo pettorale e dai linfonodi ascellari in blocco.
A intervento ultimato la parete toracica dovrà apparire come in una preparazione
anatomica, costituita dal solo piano costale denudato, il cavo ascellare costituito dalla
vena con avventizia e dall’arteria omonima fino all’angolo diedro formato dai
muscoli sotto-scapolare e grande dentato. Per il perfetto accollamento della cute al
piano costale vengono posti uno o due drenaggi in aspirazione continua e i lembi
cutanei dell’incisione vengono suturati con punti staccati o in continua.
15
Dissezione ascellare totale
Per dissezione ascellare totale si intende l’asportazione di tutti i linfonodi ascellari
corrispondenti ai 3 livelli di Berg, con o senza asportazione del muscolo piccolo
pettorale. La dissezione linfonodale dell’ascella viene praticata negli interventi
conservativi in continuità con l’exeresi mammaria quando il tumore è situato nel
prolungamento ascellare, altrimenti attraverso un’incisione separata. Nel primo caso
si dispone di una maggiore ampiezza di campo, e a tal fine conviene dilazionare sia il
capitonnage della ghiandola che la sutura cutanea. Quando sia necessario ricorrere a
un’incisione separata, quest’ultima può seguire il margine esterno del muscolo grande
pettorale poco al di sotto di esso, oppure la cute dell’ascella lungo le linee cutanee;
quest’ultima incisione è consigliabile in quanto consente di individuare agevolmente
la vena ascellare e il tendine del muscolo grande dorsale; inoltre il risultato estetico a
distanza è migliore residuando una cicatrice pressoché invisibile. Praticata l’incisione
si allestisce un piccolo lembo cutaneo laterale; si raggiungono il margine esterno del
muscolo grande-dorsale e la porzione laterale del muscolo grande pettorale e la sua
inserzione omerale, e al di sotto di questo il muscolo coraco brachiale e la porzione
laterale del fascio vascolo-nervoso. Lo spessore del lembo in corrispondenza
dell’ascella deve essere sottile per gli stretti rapporti che esistono fra cute e tessuto
cellulo-adiposo ascellare, tanto che si devono riconoscere le ghiandole sudoripare ed i
follicoli piliferi. Si isola quindi il margine del muscolo grande dorsale per tutta la
lunghezza fino al suo tendine bianco che corrisponde alla porzione più laterale della
vena ascellare. In questa fase si evidenziano i nervi intercosto-brachiali che
16
attraversano il tessuto cellulo-adiposo dell’ascella. E’raccomandabile preservarli a
meno che non vi siano voluminosi linfonodi metastatici avendo l’avvertenza di
annotarlo nella descrizione dell’intervento. La loro conservazione in termini di
vantaggio sensitivo è ancora oggetto di studio. Da questo momento la procedura è
identica sia che la dissezione ascellare si accompagni ad un intervento conservativo
che alla mastectomia. Esercitando una lieve trazione verso il basso sul muscolo
grande-dorsale si isolano per tutta la loro lunghezza i vasi ed il nervo toraco-dorsale
che vengono conservati. Aperto l’angolo diedro tra il muscolo sottoscapolare ed i
muscoli dentati anteriori si visualizza, spostando verso l’alto il tessuto adiposo, il
nervo toracico lungo che si prepara per tutta la sua lunghezza da sotto la vena
ascellare sino, in basso, al punto in cui si sfiocca nel muscolo dentato anteriore le cui
digitazioni sono isolate sino a raggiungere il margine laterale del muscolo grande
pettorale. In linea di massima occorre evitare l’eccessiva scheletrizzazione del nervo,
che non aggiunge nulla alla radicalità dell’intervento, e di staccare il tronco nervoso
dalla parete toracica, con maggior rischio di stiramento delle ramificazioni terminali,
nonché di coagulare eccessivamente piccoli vasi in sua prossimità. Si espone il
margine esterno del muscolo pettorale fino a trovare il piano tra quest ultimo e il
sottostante muscolo piccolo pettorale; mediante una valva si divarica verso l’alto il
grande pettorale, manovra che risulta tanto più agevole quanto maggiore è il
rilasciamento muscolare che la narcosi può assicurare. Si disseca quindi il tessuto
adiposo compreso fra i due muscoli che può contenere i linfonodi di Rotter. Si
raggiunge il legamento clavi-coraco-pettorale, che è visibile profondamente, e si
17
sposta medialmente il fascio vascolo-nervoso toraco-acromiale; identificato in alto il
margine del muscolo piccolo pettorale si pratica una piccola incisione nella fascia
clavi-coraco-pettorale, si introduce al di sotto del ventre muscolare l’indice della
mano sinistra a protezione del plesso brachiale e si seziona il muscolo in prossimità
del processo coracoideo (intervento di Patey) ribaltandolo poi verso il basso, legando
e sezionando il suo peduncolo vascolo-nervoso; è importante rispettare durante questa
fase il nervo toracico anteriore “mediale” che può decorrere lateralmente al margine
del muscolo piccolo pettorale o attraversarnele fibre, per evitare la denervazione della
porzione laterale del muscolo grande pettorale. La dissezione del tessuto celluloadiposo ascellare prosegue scoprendo il plesso brachiale e la vena ascellare di cui si
isola la superficie anteriore. Seguendo medialmente la vena si espone la porzione
tendinea del muscolo succlavio al di sotto del quale essa si approfonda: è questo
l’apice dell’ascella (III livello) che contiene i linfonodi ascellari più alti ed i tronchi
linfatici; va isolato con molta accuratezza sezionando il tessuto cellulare sul tendine
del muscolo succlavio stesso e traendolo verso il basso. Conviene contrassegnare
subito con un laccio o un gettone metallico questo punto per facilitare il successivo
esame anatomo-patologico. Analogamente andranno contrassegnati gli altri due livelli
linfonodali. L’isolamento prosegue in senso laterale legando i collaterali venosi ed
arteriosi dei vasi ascellari, liberando così la superficie inferiore della vena ascellare:
la dissezione si ricongiunge con quella fatta in precedenza a livello del nervo toracico
lungo. Le inserzioni costali del muscolo piccolo pettorale vengono sezionate e tutto il
pezzo asportato. Prima di suturare la cute si applica un drenaggio in aspirazione nel
18
cavo ascellare e si controlla accuratamente l’emostasi. Se si desidera conservare
anche il piccolo pettorale, in luogo di sezionare la sua inserzione all’apofisi
coracoide, si isoleranno i suoi margini laterale e mediale. Sul margine laterale in
prossimità della vena va conservato il peduncolo vascolonervoso che raggiunge il
margine laterale del muscolo grande pettorale. Il muscolo piccolo pettorale verrà
quindi spostato medialmente e sollevato, così da avere accesso al II ed al III livello. Il
pezzo di dissezione verrà sfilato al di sotto del ventre muscolare facendo attenzione a
rispettare il peduncolo vascolo-nervoso del muscolo piccolo pettorale. La sua lesione
anche parziale ne può provocare la sclerosi. Le ampie casistiche raccolte hanno ormai
dimostrato come non esiste alcuna differenza sul numero medio dei linfonodi
ascellari esaminati quando si confrontino le mastectomie con o senza asportazione dei
muscoli pettorali con le dissezioni ascellari condotte in continuità o in discontinuità in
associazione alla chirurgia conservativa con o senza asportazione del muscolo piccolo
pettorale.
Dissezione ascellare I livello
L’asportazione dei linfonodi lateralmente al margine del muscolo piccolo pettorale. Si
differenzia dalla precedente per il fatto che,una volta isolato il margine esterno dal
muscolo piccolo pettorale, dopo aver preparato il fascio vascolo-nervoso
toracodorsale e il nervo toracico- lungo, lo si isola verso l’alto, senza entrare nello
spazio fra i due muscoli pettorali, fino a raggiungere la vena ascellare, e si asporta
19
tutto il tessuto cellulo-adiposo che si trova fra il piccolo pettorale, il muscolo
sottoscapolare e il grande- dorsale.
Margini di exeresi nella chirurgia conservativa
Ogni intervento chirurgico conservativo, sia esso un’ampia escissione oppure una
quadrantectomia, dovrebbe consentire l’exeresi di una porzione più o meno ampia di
parenchima mammario con un margine negativo di almeno 1 cm intorno al tumore. Il
patologo con l’esame seriato del settore asportato indicherà se i margini di resezione
siano interessati dalla infiltrazione neoplastica e in questo caso per quale estensione,
oppure, in caso di margine negativo, l’esatta distanza di questo dal tumore. In assenza
di regole precise sono opportune alcune raccomandazioni di carattere generale:
•
in caso di margine/i interessati dalla neoplasia, sia essa in situ che infiltrante,
è ragionevole un intervento chirurgico di rescissione dei margini;
•
in caso di vicinanza del tumore al margine, la cui esatta misura viene indicata
dal patologo,la scelta terapeutica di reintervenire chirurgicamente oppure
affidarsi a un sovradosaggio radioterapico è legata a un’attenta valutazione
dei fattori di rischio legati al controllo locale della malattia quali età della
paziente, presenza di estesa componente intraduttale (EIC), multifocalità, tipo
di crescita tumorale, grading, etc.
Va rilevato che in uno studio randomizzato casi con margini positivi e casi con
margini negativi trattati con radioterapia hanno mostrato un’uguale incidenza di
recidive locali.
20
LA BIOPSIA DEL LINFONODO SENTINELLA
La biopsia del linfonodo sentinella (LS) è in grado di riconoscere un interessamento
metastatico anche minimo (micrometastasi) in pazienti con ascella clinicamente
negativa. Gli studi sul valore predittivo del LS nei confronti di tutti i linfonodi
asportati chirurgicamente e gli studi randomizzati che hanno confrontato la dissezione
ascellare di routine e la dissezione ascellare sulla base dell’istologia del LS hanno
dimostrato la validità della metodica sia per quanto riguarda il valore predittivo
negativo del LS nei confronti degli altri linfonodi ascellari asportati, sia per quanto
riguarda il valore predittivo positivo (raccomandazione tipo A, livello di evidenza I).
La corretta applicazione del metodo LS non può prescindere dalla collaborazione tra
chirurgo, medico nucleare, radiologo e anatomo-patologo: ognuna di queste
competenze ha un ruolo fondamentale nelle diverse fasi della procedura dalla corretta
identificazione, all’isolamento fino all’esame istopatologico del LS. Attraverso
l’ottimizzazione di ognuna delle diverse fasi si raggiunge un adeguato standard di
accuratezza.
Definizione
Il LS è il primo linfonodo (o linfonodi) che riceve linfa direttamente dal tumore
primitivo. Ovvero: LS è ogni linfonodo che riceve direttamente linfa dal parenchima
mammario, quindi dal tumore. I linfonodi ascellari sono raggiunti dalla linfa
attraverso il circolo linfatico superficiale periareolare.
21
Raccomandazioni generali
La metodica del LS nella pratica clinica deve essere condotta da un chirurgo esperto
(che lavori presso un servizio che tratta oltre 150 casi/anno e che tratti personalmente
almeno un caso alla settimana) e da uno specialista in medicina nucleare, che
dovrebbero aver seguito un corso specifico in questa tecnica. Almeno un chirurgo e
un medico nucleare di ogni Centro dovrebbero effettuare una curva di apprendimento
di almeno 30 casi consecutivi con un tutor, praticando la ricerca del LS e la dissezione
ascellare contemporanea con un tasso di identificazione non inferiore al 90% e una
percentuale di falsi negativi non superiore al 3-4%. Il tutor deve avere eseguito
almeno 100 casi con lo standard degli indicatori rispettato. Tutte le fasi della
procedura devono essere accuratamente documentate e annotate. La medicina
nucleare è responsabile per quanto riguarda la preparazione del materiale da inoculare
e l’acquisizione e interpretazione delle immagini linfoscintigrafiche. La dimostrazione
istopatologica dell’interessamento del LS richiede la dissezione totale dell’ascella:
sono in corso studi clinici randomizzati volti a verificare il significato prognostico
della micrometastasi (inferiore ai 2mm) al LS. Allo stato attuale delle conoscenze la
micrometastasi al LS, al di fuori di uno studio clinico, indica la necessità di dissezione
ascellare completa. In caso di presenza di cellule tumorali isolate nel LS la dissezione
ascellare può essere evitata.
22
Indicazioni
Carcinomi mammari infiltranti con diagnosi accertata
La localizzazione del LS deve essere eseguita in donne con carcinoma infiltrante della
mammella accertato biopticamente (B5), o con esame citoaspirativo positivo (C5) o
già sottoposte per carcinoma infiltrante a tumorectomia, ampia resezione o
quadrantectomia. Un esame citoaspirativo sospetto (C4) con quadro strumentale
suggestivo di carcinoma invasivo (U5, R5), può essere indicazione sufficiente per
effettuare la biopsia del LS. I linfonodi ascellari possono essere valutati con indagine
ultrasonografica e, se sospetti, sottoposti a esame citologico su agoaspirato. La
metodica deve essere effettuata prima dell’intervento sulla mammella e può essere
utilizzata anche in caso di mastectomia.
Controindicazioni assolute
- Carcinoma infiammatorio
- Ascella con agoaspirato C5
Controindicazioni relative e controverse
- Chemioterapia primaria o preoperatoria per ridurre il diametro tumorale
Il tasso di identificazione del LS dopo chemioterapia non subisce flessioni.
Non è noto il significato biologico di un down-staging (eventuale negativizzazione del
LS dopo terapia); probabilmente ulteriori studi o metanalisi dei dati esistenti potranno
rimuovere anche questa controindicazione, ma al momento si suggerisce di eseguire la
23
biopsia prima del trattamento chemioterapico, oppure di eseguire la dissezione
ascellare.
- Carcinoma in situ
Non vi è indicazione assoluta alla biopsia del LS. Nei casi in cui il sospetto di
microinvasione sia elevato, ossia grading alto, pattern mammografico ad alto rischio
ed estensione superiore a 5 cm, la metodica è consigliata, mentre può essere
considerata discrezionale e da discutere con la paziente negli altri casi.
- Stato di gravidanza e allattamento
la metodica non comporta problemi teratogenetici e il tasso di migrazione non sembra,
dai pochi dati esistenti, compromesso. Si suggerisce di valutare con la paziente la
situazione prima della fine dell’organogenesi (prime 20 settimane). In caso di
allattamento occorre bloccare la montata lattea prima di procedere all’intervento
chirurgico.
Controindicazioni rimosse
Nei primi anni di indagini scientifiche sulla biopsia del LS sono state
temporaneamente stabilite alcune controindicazioni all’esecuzione della metodica,
quali lesioni mammarie radiologicamente e/o clinicamente multicentriche e donne in
stato di gravidanza o di allattamento. Era stata anche stabilita una dimensione
massima accettabile per il tumore primitivo (Ø <3 cm): in questi casi, oltre al rischio
elevato di metastasi ascellari (60%), si riteneva aumentato il rischio di “salto” del LS
perché totalmente metastatico. Attualmente le controindicazioni sopra citate sono
24
diventate relative: sono in corso studi clinici che sembrano confermare la validità
della metodica nel tumore multifocale e multicentrico (unico drenaggio linfatico verso
l’ascella) e in stato di gravidanza o allattamento. La dimensione massima di 3 cm per
il tumore primitivo non è più considerata valida: ciascun caso va valutato
singolarmente, per la possibile esecuzione della biopsia anche in casi con tumore
mammario di diametro superiore.
Indicazioni alla successiva dissezione ascellare
- Metastasi al LS.
- Micrometastasi al LS (focolai inferiori a 2 cm) (studio randomizzato in corso).
- LS non migrato o non identificato durante l’intervento chirurgico.
Metodiche di identificazione del LS
Le metodiche sperimentate e accreditate per l’identificazione del LS prevedono l’uso
di un colorante vitale (patent blue-V), di un tracciante radioattivo oppure la
combinazione di entrambi i metodi. L’esperienza dei diversi Autori dimostra valori di
affidabilità variabili dal 65-90% per il solo colorante vitale, che sale al 94-99% con il
tracciante radioattivo (combinato o meno con il colorante). E’ consigliabile utilizzare
la metodica combinata in fase di apprendimento: essa permette di “educare” l’occhio
all’identificazione dei collettori linfatici e riduce i tempi operatori.
L’impiego del colorante vitale ha rischi e costi trascurabili.
Il tracciante radioattivo dà maggiori garanzie di successo della tecnica, che
giustificano i costi più elevati e gli eventuali problemi organizzativi.
25
Colorante vitale (Patent Blue-V)
Dopo l’induzione dell’anestesia generale o, se in anestesia locale, dopo l’inoculo di
0,5-1 ml di anestetico locale nella stessa sede di inoculo del tracciante, si procede
all’iniezione subdermica di 0.2-0.4 ml di Patent Blue-V sulla proiezione cutanea della
neoplasia, e si esegue un delicato massaggio dell’area iniettata per agevolare la
progressione del colorante verso il cavo ascellare. Volumi di iniezione maggiori
determinano un tatuaggio dell’area iniettata che tende a persistere a lungo, e non
agevolano il reperimento del LS. Volumi maggiori (4 ml) sono necessari in caso di
inoculo peritumorale o in mammelle molto grandi; anche in questo caso è necessario
massaggiare l’area di iniezione per ottenere una più rapida diffusione del colorante
verso il cavo ascellare. L’intervento può iniziare dopo circa 10 minuti.
La via subdermica offre alcuni vantaggi: il minor volume iniettato rende più agevole
l’exeresi e la valutazione patologica del T, soprattutto in caso di neoplasie di piccole
dimensioni; si riduce, inoltre, il tatuaggio cutaneo per diffusione dall’area tumorale.
L’adozione della stessa via utilizzata per l’iniezione del radiotracciante aumenta la
corrispondenza tra le due metodiche nell’identificazione del LS; infine, da un punto di
vista anatomico e fisiopatologico, mediante la via subdermica il colorante viene
iniettato direttamente nel plesso linfatico subdermico che riveste la maggiore
importanza per quel che riguarda il drenaggio del tumore verso il cavo ascellare
omolaterale.
26
Punto di inoculo
Il colorante vitale può essere iniettato per via subdermica, subareolare o peritumorale.
La sede subdermica e la via subareolare hanno una migrazione più rapida : i linfonodi
ascellari ricevono la linfa dal plesso papillare (superficiale), che è direttamente
connesso con i linfatici intramammari profondi che drenano l’area tumorale, quindi il
colorante raggiunge con maggiore rapidità il LS nel cavo ascellare omolaterale.
La via subareolare offre il vantaggio di non creare rumore di fondo con la captazione
nelle lesioni con sede nel quadrante supero-esterno, vicine all’ascella. Essa permette
inoltre di non interferire visivamente con la traccia di carbone usata in alcuni casi
come repere nelle lesioni non palpabili. Può essere utilizzata nelle lesioni non
palpabili senza metodiche di identificazione della lesione (ultrasonografia o
stereotassi). La sede peritumorale permette l’identificazione del LS nella catena
mammaria interna. La sede intratumorale è sconsigliata per la migrazione difficoltosa:
viene impiegata come metodica di radiolocalizzazione delle lesioni non palpabili
(ROLL) su guida ultrasonografica o stereotassica.
Tracciante radioattivo
L’inoculo deve essere eseguito da due a 24 ore prima dell’intervento chirurgico.
Si usano particelle colloidali di albumina umana di dimensioni comprese tra 20 e 80
nanometri (Nanocoll), marcate con 99mTc. La soluzione contenente il tracciante
radioattivo (0.2 mCi di 99mTc in un volume di 0.2-0.4 ml, seguito da 0.2 ml di
soluzione fisiologica o aria) viene inoculata mediante ago da 25 G. La paziente viene
27
invitata a massaggiare delicatamente, per alcuni minuti, la zona dell’inoculo, onde
facilitare e accelerare il drenaggio linfatico. Nel caso di pazienti obese si consiglia di
aumentare la dose a 0.3-0.4 mCi.
Punto di inoculo
L’iniezione viene eseguita di solito sotto il derma in corrispondenza della lesione
mammaria. Nelle pazienti con neoplasia in sede profonda l’inoculo del tracciante è
peritumorale, in un volume di 0.5 ml, mantenendo invariata la dose di 99mTc.
L’inoculo intratumorale è sconsigliato.
Imaging
La linfoscintigrafia può essere eseguita il giorno precedente l’intervento chirurgico
oppure il giorno stesso, almeno una-due ore prima dell’intervento. La scintigrafia
dinamica, che consente di acquisire immagini a breve distanza dall’iniezione, è
consigliata, ma le immagini devono essere registrate almeno dopo 15’ dall’inoculo e,
se richiesto, dopo 3 e 24 ore. La proiezione obliqua anteriore a 45° permette di
distinguere meglio il punto di inoculo dal LS ascellare. La proiezione anteriore è
ideale per i linfonodi della catena mammaria interna. Per individuare la posizione del
primo linfonodo drenante il tessuto neoplastico vengono effettuate proiezioni obliquoanteriori, mantenendo la superficie della testata della gamma-camera il più possibile
parallela al cavo ascellare; con l’aiuto di una sorgente puntiforme di 57Co si evidenzia
la proiezione cutanea dello stesso linfonodo che viene segnalato con un marker
indelebile
cutaneo.
L’immagine
linfoscintigrafica
disponibile
al
momento
28
dell’intervento è di grande utilità per il chirurgo, poiché consente di rilevare la sede e
la presenza di uno o più linfonodi.
Impiego della sonda
Requisiti tecnici per sonde RGS.
La sonda per chirurgia radioguidata (RGS) converte la radioattività rivelata sia in un
segnale analogico che in un segnale acustico di intensità e frequenza proporzionale
all’attività presente nella regione in esame. Per le applicazioni considerate, una sonda
deve essere caratterizzata da una elevata sensibilità, che consente di rivelare attività
molto ridotte, e da una elevata risoluzione spaziale, che consente di discriminare due
regioni tessutali captanti e vicine. In generale, le sonde sono formate da un rivelatore,
che può essere composto da un cristallo scintillatore [(per es. NaI (TI) o CsI(Tl)] o da
un semiconduttore (CdTe), a sua volta protetto da uno schermo laterale metallico e
dotato di un collimatore, per ridurre l’effetto della radiazione diffusa. Le
caratteristiche geometriche e i tipi di materiale del rivelatore, della schermatura e della
collimazione ne determinano le fondamentali proprietà fisiche, quali l’efficienza, la
sensibilità, l’intervallo di risposta lineare e la risoluzione spaziale. Alcune sonde,
dotate di collimazione variabile, consentono di cambiare la risoluzione spaziale e la
sensibilità. Per le applicazioni della chirurgia radioguidata della mammella la
sensibilità risulta essere una caratteristica fondamentale. I rivelatori a scintillazione
sono tipicamente caratterizzati da un’elevata sensibilità e una discreta risoluzione
spaziale; le sonde a semiconduttore offrono generalmente una sensibilità inferiore ma
29
una migliore risoluzione spaziale, caratteristica questa di rilevante importanza per
potere identificare il LS soprattutto nelle pazienti con un punto di inoculo/tumore
vicino all’ascella. Hanno inoltre minori dimensioni e una maggiore maneggevolezza.
Alcune sonde sono collegate a un analizzatore, attraverso il quale è possibile regolare
vari parametri in funzione delle applicazioni (per esempio la soglia e la larghezza
finestra energetica di acquisizione, la scala di sensibilità), effettuare la calibrazione e
visualizzare il segnale di output (count rate). Un’altra tipologia di sonde dispone di un
microprocessore particolare che, unitamente alla natura del cristallo (CdZnTe),
permette di mantenere la calibrazione pre-impostata. La corretta rivelazione
intraoperatoria del LS dipende anche dal funzionamento e dalla risposta dello
strumento di rivelazione. Fondamentale, in tutte le sonde, è il controllo di qualità da
effettuarsi scadenzato e a registro. Responsabile delle apparecchiature è il medico
nucleare. A questo riguardo è stato messo a punto un opportuno protocollo cui hanno
partecipato le principali società che si occupano della metodica (GISCRIS, AIMN,
AIFM e FONCaM).
Tecnica chirurgica
• Prendere visione delle linfoscintigrafie per acquisire l'informazione: se e quanti
linfonodi sono stati rilevati.
• Verificare la radioattività di fondo della paziente (sull’area epatica oppure un
braccio) e premere background count: in questo modo si elimina il rumore di fondo.
30
• Effettuare una mappatura della cute e confrontarla con i marker segnalati dal medico
nucleare. Con la sonda perpendicolare alla cute eseguire movimenti lenti (non
superiore di 1cm/secondo) in direzione dal tumore/iniezione verso l'ascella
(inclinandola leggermente verso l'ascella).
Per l’individuazione del LS il chirurgo pratica una piccola incisione sulla linea ideale
per la dissezione ascellare. Nei casi di tumore situato al quadrante supero esterno
l’accesso al LS avviene attraverso la stessa breccia chirurgica utilizzata per l’exeresi
del tumore. La ricerca del LS viene eseguita, dopo aver inciso la fascia ascellare,
identificando i vasi linfatici colorati di blu seguiti fino al primo linfonodo drenante
(che appare intensamente colorato di blu) o/e mediante la sonda inserita in una guaina
sterile, che, mossa delicatamente all’interno della breccia chirurgica, permette di
identificare il linfonodo che emette il maggiore segnale.
Generalmente c’è concordanza tra i linfonodi blu e radioattivi (caldi): il LS è il primo
linfonodo blu con radioattività. In alcune circostanze il primo linfonodo caldo non è
blu (di solito perché la dose del colorante è scarsa oppure il tempo di linfodrenaggio
per la singola paziente è lungo): in questo caso il primo linfonodo caldo ma non blu è
classificato come LS.
Altre volte, il primo linfonodo che sembra drenare i linfatici provenienti dal tumore è
blu ma non caldo (spesso perché metastatico oppure molto piccolo e il segnale è
scarso), mentre il primo linfonodo caldo è situato più distalmente dal tumore: è quindi
difficile definire con esattezza quale sia il LS e ambedue devono essere asportati ed
esaminati.
31
La sonda dotata di soglia regolabile deve essere predisposta entro il range di maggior
captazione. Si consiglia di massaggiare la sede di inoculo durante la ricerca per
riempire di colorante i collettori e il linfonodo, aumentando in questo modo il segnale.
In caso di stretta vicinanza della lesione al cavo ascellare è bene collimare la sonda
per evitare la confusione del segnale.
Dopo il reperimento del linfonodo o dei linfonodi (se la scintigrafia ne evidenziava
più di uno con captazione superiore x 10 count/ background), si procede
all’asportazione avendo cura di allacciare i collettori linfatici afferenti ed efferenti.
Una volta identificato il LS lo si allontana dal campo operatorio e si verifica con la
sonda il punto di maggior captazione. Si verifica la captazione residua del cavo
ascellare (deve essere 10 volte inferiore al linfonodo).
L’asportazione di altri linfonodi, non indicati come sentinella, è suggerita solo se alla
palpazione intraoperatoria essi risultano sospetti. E’ necessario che l’eventuale
rimozione di linfonodi sospetti, ma non sentinella, sia segnalata al patologo.
La presenza di linfonodi captanti in sede mammaria interna è evenienza non
frequente. Tuttavia, se il chirurgo desidera esaminare i linfonodi situati in questa sede,
di solito localizzati nel secondo, terzo spazio intercostale, tale identificazione è
possibile attraverso la stessa incisione utilizzata per l’exeresi del tumore nel quadrante
supero interno o per mezzo di una incisione arcuata. Si raggiunge così il punto dove
32
il segnale è più evidente e si asportano i linfonodi captanti per via extra pleurica,
preservando i vasi mammari interni. Poiché l’interessamento dei linfonodi mammari
interni modifica (in circa il 10% dei casi) la terapia adiuvante (medica e/o
radioterapica) la biopsia mammaria interna nei tumori a sede mediale è consigliata.
Monitoraggio di qualità della metodica
Ogni fase della ricerca del LS deve essere accuratamente annotata, con particolare
riferimento alla sede e quantità di colorante iniettato, al numero di impulsi registrati
dalla sonda, al numero di linfonodi asportati ecc. Se nessun LS viene evidenziato è
necessario procedere con la dissezione ascellare. Se nella ricerca del LS il chirurgo
apprezza un linfonodo clinicamente sospetto è opportuno che lo asporti per poterlo
esaminare.
Lesioni non palpabili
Il reperimento di una neoplasia non palpabile può essere effettuato con una delle
tecniche usuali (ROLL, filo uncinato, soluzione di carbone sterile). Il LS si identifica
mediante inoculo del radiofarmaco e/o colorante per via subdermica nel punto di
proiezione cutanea della lesione identificata su guida ultrasonografica o stereotassica.
Qualora si desideri anche il reperimento radioguidato del tumore (metodo ROLL, da
preferirsi rispetto agli altri se contemporaneamente si esegue la biopsia del LS) si
devono utilizzare due inoculi differenti per la localizzazione della lesione mammaria
(intratumorale) e del LS (sottocutanea o subareolare).
33
Radioprotezione nell’impiego dei traccianti nella chirurgia radioguidata della
mammella
I protocolli descritti non presentano particolari problemi di tipo radioprotezionistico,
dato che le attività somministrate sono contenute e che le caratteristiche fisiche del
radioisotopo sono ottimali. Le dosi assorbite dai tessuti sani delle pazienti sono
limitate (dose media assorbita dall’addome e dalla mammella controlaterale minori di
0.5 mGy e 1 mGy, rispettivamente); gli operatori ricevono dosi molto basse, che non
richiedono né una sorveglianza fisica della radioprotezione né una classificazione dei
lavoratori nelle categorie di tipo A o B.
Conclusioni
La scelta di eseguire la dissezione ascellare sulla base dell’esame istologico del LS è
raccomandabile nei casi per i quali esiste indicazione. La paziente deve essere
informata dei benefici e rischi della metodica, in particolare della possibilità,
valutabile nel 3-5% dei casi, che si possa manifestare una ripresa linfonodale ascellare
che renda necessaria, nel tempo, una dissezione ascellare completa differita.
E’ raccomandato un follow-up clinico attento con cadenza semestrale, che consenta di
rilevare tempestivamente una eventuale ripresa linfonodale ascellare. È raccomandato
un consenso informato dedicato.
34
REPERIMENTO ED EXERESI DELLE LESIONI NON PALPABILI
Rientrano in questo capitolo sia le lesioni per le quali le metodiche di diagnosi
impiegate abbiano evidenziato un sospetto, senza acquisire una diagnosi di certezza
citologica o microistologica, sia neoplasie non palpabili per le quali debba essere
attuato un trattamento chirurgico. Nel primo caso il metodo di reperimento impiegato
deve consentire un’exeresi limitata per evitare danni estetici ingiustificati, soprattutto
se si tratta di lesione benigna. Questo atto bioptico deve inoltre prevedere e non
compromettere un eventuale successivo atto terapeutico. In ogni caso ogni paziente
che venga avviata all‘intervento chirurgico per una lesione non palpabile dovrà aver
effettuato un esame mammografico nelle due proiezioni ortogonali standard per
evitare errori nella collocazione spaziale della lesione stessa. E’ opportuno dopo
l’intervento chirurgico eseguire l’esame radiologico del settore di mammella
asportato per verificare la correttezza dell’exeresi, a meno che la lesione non sia
direttamente visibile o palpabile sul tessuto asportato (20 - 30% dei casi). Nel caso sia
stato asportato un settore di mammella dalla cute alla fascia del muscolo pettorale è
sufficiente una sola proiezione radiologica; quando, viceversa, l’escissione della
lesione non è a tutto spessore sono necessarie le due proiezioni ortogonali. La
possibilità di non reperire la lesione durante la biopsia è rara (dell’ordine dello 0.5%),
qualunque sia la metodica di reperimento impiegata. In questi casi è necessario
controllare la paziente con mammografia almeno due mesi dopo l’intervento.
35
Metodo del repere metallico
Si introduce nella sede della lesione sotto guida mammografica o ecografica
un’agocannula che contiene al suo interno un uncino metallico. Verificata
mammograficamente nelle due proiezioni l’esatta collocazione dell’ago, si lascia in
sede il filo con estremità a uncino e si esegue nuovamente la mammografia che
servirà al chirurgo, in sala operatoria, per l’escissione del settore di parenchima
mammario contenente la lesione. L’incisione cutanea, arcuata o radiale, deve
comprendere una piccola losanga di cute intorno al punto di uscita del filo per
limitare la possibilità di dislocazione intraoperatoria. L’escissione, guidata dalla
palpazione del repere, prevede l’asportazione di un cilindro di parenchima mammario
comprendente sia il filo metallico che una porzione di tessuto mammario circostante
l’estremità a uncino del repere metallico stesso. Se la lesione è costituita da
un’opacità di massa o da una distorsione parenchimale, essa può essere con una certa
frequenza palpata durante l’intervento chirurgico all’estremità del filo metallico
consentendo un’exeresi più limitata. La radiografia del settore mammario asportato
permetterà di verificare immediatamente la correttezza e completezza dell’escissione.
Indicazioni. Utile in tutte le lesioni non palpabili soprattutto se la componente
ghiandolare prevale sul tessuto adiposo poiché consente un ancoraggio più saldo
dell’uncino.
Vantaggi. é preciso, economico e rapido. Risulta vantaggioso anche per la ricerca
della lesione nel pezzo operatorio.
36
Svantaggi. Deve precedere di poco l’intervento chirurgico (massimo 48 ore) e quindi
richiede il rispetto di un’accurata programmazione. Seppure raramente, può capitare
che durante l’intervento il repere metallico si sposti dalla sede in cui era stato
collocato. Si può verificare anche l’accidentale sezione del filo metallico con
possibilità di frammenti residui nel parenchina.
Metodo del colorante
E’opportuno impiegare coloranti poco diffusibili (sospensione di polvere di carbone
in acqua distillata) che consentono di dilazionare l’intervento anche di alcune
settimane e creano meno problemi chirurgici non mascherando il campo operatorio.
La polvere di carbone viene lasciata in sede dal radiologo dopo l’effettuazione del
prelievo citologico. In caso di prelievo microistologico la presenza di una piccola
cavità nella sede del prelievo stesso e lungo il tramite dello strumento crea difficoltà
poiché la soluzione può diffondersi eccessivamente. In questo caso è opportuno
posticipare l’iniezione della traccia. Il chirurgo in sala operatoria troverà un piccolo
tatuaggio cutaneo che corrisponde alla proiezione cutanea della lesione se il colorante
è stato introdotto sotto guida ecografica, ma che non corrisponderà alla sede della
lesione se la guida è stata mammografica. In questo ultimo caso infatti lo spot indica
il punto di entrata dell’ago in una delle due proiezioni (cranio-caudale o
lateromediale). L’incisione cutanea deve essere praticata nel quadrante sede della
lesione. L’operatore, incisa la cute ed evidenziata la traccia di carbone, asporterà il
settore di parenchima contenente la lesione dalla cute alla fascia. La metodica
37
richiede una particolare attenzione se il reperimento è stato effettuato con il metodo
stereotassico. In tal caso, infatti, il chirurgo deve calcolare la seconda coordinata in
base alla proiezione cutanea della lesione quale risulta dall’esame mammografico. Per
esempio, per una lesione del quadrante infero-interno lo spot cutaneo potrà trovarsi o
nel quadrante supero-interno (se l’introduzione è avvenuta in compressione craniocaudale) o in quello infero-esterno (se incompressione latero-mediale) fornendo
all’operatore la coordinata rispettivamente verticale nel primo ed orizzontale nel
secondo caso. La seconda coordinata deve essere misurata in base alla distanza in
orizzontale o rispettivamente in verticale della lesione dal capezzolo.
Indicazioni. Le stesse indicazioni del repere metallico, con in aggiunta le lesioni
visibili in una sola proiezione mammografica raggiungibili solo con il metodo
stereotassico.
Vantaggi. é molto utile per il reperimento della lesione nel settore asportato, può
essere impiegata contemporaneamente al prelievo citologico e può precedere di oltre
un mese l’intervento chirurgico.
Svantaggi. L’asportazione della lesione segue in parte i principi della proiezione
cutanea e quindi comporta generalmente l’exeresi di una quantità maggiore di tessuto.
Metodo del tracciante radioattivo
Questo metodo di localizzazione è definito ROLL (Radioguided Occult Lesion
Localization). La metodica prevede l’impiego di macroaggregati di albumina umana
con diametro variabile da 10-150 nm, che vengono coniugati con circa 3.7 Mbq (0.1
38
mC) di Tc99, utilizzato ad un’attività specifica di 74 MBq/mg. Si tratta di particelle
molto più grosse e quindi meno mobili di quelle usate per l’individuazione del
linfonodo sentinella. Il tracciante, una soluzione di 0.05 mg di macroaggregato
coniugato con Tc99, viene introdotto all’interno della lesione mammaria (un piccolo
gruppo di microcalcificazioni o una piccola opacità) sotto controllo stereotassico o
ecografico e rimane, grazie alla sua dimensione, stabilmente nella zona di inoculo.
Per le lesioni nodulari nelle quali l’inoculo venga eseguito sotto guida ecografica la
verifica della centratura della lesione è immediata, mentre per i casi di
microcalcificazioni o per i casi localizzati con un mammografo dotato di apparecchio
per stereotassi un’ulteriore verifica può essere ottenuta iniettando, subito dopo la
sostanza radioattiva, una minima quantità (0.2-0.3 ml) di soluzione radiopaca
idrosolubile. La successiva immagine mammografica consente infatti di verificare se
il mezzo di contrasto è stato iniettato correttamente in corrispondenza della lesione.
L’inoculo può avvenire a breve distanza di tempo dall’intervento chirurgico oppure il
pomeriggio antecedente. La sonda per chirurgia radioguidata è la stessa impiegata per
la ricerca del linfonodo sentinella ed è costituita da un piccolo cilindro metallico al
cui interno è alloggiato un cristallo di ioduro di sodio. La sonda è collegata ad
un’apparecchiatura che, opportunamente calibrata, analizza il segnale captato che
viene tradotto in numero di impulsi evidenziati da un display digitale e in un segnale
acustico. L’intensità e la frequenza del segnale acustico sono direttamente
proporzionali al livello della radioattività rilevata. In questo modo il chirurgo, dopo
aver inserito la sonda in una guaina sterile trasparente, è in grado di individuare la
39
proiezione cutanea della lesione e decidere l’incisione più appropriata. Una volta
incisa la cute, il chirurgo provvede a isolare dal grasso sottocutaneo la ghiandola
mammaria: in questo modo con la sonda risulta agevole identificare il punto di
massima captazione, che corrisponde al centro della lesione. Quando l’esatta
proiezione cutanea della lesione è stata definitivamente identificata, spostando
progressivamente di pochi millimetri la sonda dal centro della lesione verso la
periferia dell’area definita, il segnale va gradualmente riducendosi fino a scomparire
completamente. Il chirurgo può così definire i limiti della resezione chirurgica e
ottenere un pezzo chirurgico a forma sferoidale con la lesione posizionata al centro.
Dopo l’asportazione del pezzo, la sonda viene nuovamente introdotta nel letto
chirurgico per verificare la totale assenza di captazione residua, a dimostrazione della
completa rimozione della lesione. Gli studi sull’attività radioattiva della sostanza
introdotta nella mammella sul personale medico di radiologia, del reparto chirurgico,
sul personale infermieristico della sala operatoria e sullo stesso strumentario
utilizzato nella fase di inoculo e in sala operatoria durante l’intervento chirurgico
(aghi, siringhe, guanti, bisturi, forbici, garze involucro di plastica sterile a protezione
della sonda ecc.) hanno dimostrato che la procedura è sicura in termini di
radioprotezione sia per i bassi livelli di radioattività della sostanza introdotta nella
mammella, che viene rimossa completamente all’atto dell’intervento chirurgico, sia
per la bassa emivita del Tc99. Per quanto riguarda la dose assorbita dagli organi, essa
risulta essere notevolmente inferiore rispetto ad altre indagini radiografiche e in
media è risultata di 0.45 mGy (range 0.05-3.0 mGy). La dose assorbita dalle mani del
40
chirurgo dopo 100 interventi chirurgici eseguiti è risultata di 0.45 mGy: questo valore
rappresenta circa l’1% della dose limite annuale accettata per la popolazione
generale. Non sono quindi richieste misure particolari di radioprotezione.
Contemporaneamente all’individuazione di una lesione mammaria non palpabile con
ROLL è possibile eseguire anche il reperimento del linfonodo sentinella: la
procedura, detta SNOLL (sentinel node and occult lesion localization), utilizza due
radiotraccianti a diverso peso molecolare iniettati direttamente nella lesione
(tracciante per ROLL) e in sede subdermica o peritumorale (tracciante per linfonodo
sentinella).
Indicazioni. La ROLL trova indicazioni nei cluster di microcalcificazioni, nelle
distorsioni o singole opacità. Non è indicata nei casi di lesioni diffuse o
multicentriche.
Vantaggi. é possibile una precisa localizzazione della lesione, indipendentemente dal
punto d’inoculo dell’albumina marcata, e il chirurgo può localizzare con la massima
precisione la lesione durante tutte le fasi dell’intervento. Consente una resezione
mirata e di ottenere, in oltre il 97% dei casi, che la lesione escissa si trovi esattamente
al centro dell’area resecata, indipendentemente dalla struttura anatomica della
mammella.
Svantaggi. Richiede un’accurata programmazione per coordinare medici nucleari,
radiologi e chirurghi. Il costo della sonda è relativamente elevato, tuttavia bisogna
tenere conto che la sonda per chirurgia radioguidata è diventata uno strumento
fondamentale anche in altre procedure interventistiche oncologiche nelle quali la
41
captazione del materiale radioattivo debba essere messa in evidenza: è il caso della
biopsia del linfonodo sentinella, la cui identificazione ha ormai larga applicazione
non solo in senologia ma anche nel melanoma,in ginecologia e nei tumori del
distretto testa-collo.
42
DAY SURGERY
La definizione del termine “Day Surgery” (chirurgia di un giorno) in Italia è ben
codificata dal Decreto del Presidente della Repubblica del 14 gennaio 1997:
Possibilità clinica, organizzativa e amministrativa di effettuare interventi chirurgici
od anche procedure diagnostiche e/o terapeutiche invasive e semiinvasive in regime
di ricovero limitato alle sole ore del giorno, o con eventuale pernottamento (in questo
caso si parladi One Day Surgery), in anestesia locale, locoregionale o generale.
Anche se nell’uso corrente vengono spesso assimilate, chirurgia ambulatoriale e day
surgery non sono sinonimi e richiedono requisiti minimi differenti, operando la
prima, solo in anestesia locale e/o analgesia. La day surgery è dunque chirurgia da
attuare sempre in ambiente protetto e con precisi dettai regolati per legge.
Negli ultimi 20 anni si è assistito ad una continua crescita sia della
chirurgia
ambulatoriale che della day surgery. I primi “free standing ambulatory surgery” sono
nati negli USA intorno al 1970. Venivano accettati per questo tipo di chirurgia
soltanto soggetti sani che dovevano affrontare interventi semplici. Ragioni sociali e
culturali, ma soprattutto di ordine economico, volte al contenimento dei costi sanitari,
sono stati i motivi che hanno determinato e favorito l’espansione di questo nuovo
modo di gestire il paziente chirurgico. Un numero molto elevato di prestazioni
chirurgiche può essere effettuato in day surgery, le patologie che più frequentemente
vengono trattate sono di interesse otorinolaringoiatrico, ginecologico e ortopedico,
gastroenterologico e plastico.
43
Negli USA annualmente circa 25 milioni di pazienti devono subire interventi
chirurgici, eseguiti in oltre il 65% dei casi in regime di day surgery. La day surgery
offre molti vantaggi rispetto al ricovero ordinario, che riguardano: un maggiore
afflusso di pazienti, un tempo fissato per l’intervento, una ridotta domanda di
soggiorno notturno come anche dello staff infermieristico per il weekend, ridotte liste
d’attesa, un risparmio rispetto al costo degli ospedali ordinari, una minore attesa,
minima alterazione della normale routine e ridotti costi a carico della famiglia del
paziente. Accanto a questi vantaggi, bisogna ricordare anche eventuali svantaggi
legati alla day surgery come: nausea, vomito e altre complicanze che possono
subentrare nei pazienti che sono stati dimessi troppo presto dall’anestesia, da un
inadeguato controllo del dolore o da un insufficiente riposo a casa. Queste possibili
complicazioni implicano la necessità di seguire il paziente in day surgery molto
scrupolosamente durante tutto il soggiorno, che comprende l’osservazione preoperatoria, durante l’intervento e post-operatoria, includendo monitoraggio e
osservazione, dimissione e anche il controllo telefonico dopo la dimissione. Tutti
questi elementi sono considerati cruciali ai fini di un’assistenza di elevata qualità e il
raggiungimento di un positivo esito chirurgico. Sebbene vi sia l’opinione comune che
la day surgery si adatti solamente a chirurgie minori, la realtà dei fatti è che si
eseguono chirurgie più complesse che quindi richiedono la presenza di uno staff di
alto livello professionale, capace di soddisfare queste domande.
44
In Italia lo sviluppo della day-surgery non trova una diffusione simile a quella dei
paesi anglosassoni, infatti circa il 20% degli interventi viene trattato in tale regime.
Ciò è dovuto a diversi fattori:
•
la confusa legislazione riguardante la materia che determina uno stato di
incertezza sia negli operatori che negli utenti;
•
il pregiudizio culturale che impedisce la diffusione nella mentalità collettiva
della disciplina di day-surgery; esso è frutto sia della disinformazione, sia
della convinzione che rapidità sia sinonimo di minore precisione;
•
la ancora scarsa confidenza delle nostre strutture pubbliche con il sistema del
DRG’s che abolisce i rimborsi a degenza per trasferirli sul costo delle
prestazioni.
In Italia vi sono linee guida necessarie per l’accreditamento dell’unità di day surgery,
ma mancano linee guida basate sulle regole migliori che riguardano pre-admission e
admission care da presentare ai pazienti nell’unità di day surgery; né vi sono linee
guida che possano migliorare e rendere più appropriato il livello dello staff dedicato
alla day surgery. Nonostante la presenza di questi deterrenti, fattori politici (il
cambiamento della concezione di stato sociale), economici (l’impulso delle
assicurazioni e della sanità privata) e di progresso medico scientifico stanno
spingendo anche l’Italia verso un sempre maggiore utilizzo della day-surgery.
45
Modellli organizzativi di Day surgery
La legislazione italiana codifica tre differenti modelli organizzativi all’interno dei
quali è possibile svolgere attività di day surgery (Linee Guida CSR 2002):
a. presidio autonomo di day surgery (centro chirurgico di day surgery), costituito da
una struttura, pubblica o privata, dedicata all’erogazione di ricoveri a ciclo diurno per
acuti. Tale presidio deve essere funzionalmente collegato ad una struttura ospedaliera
che effettua ricoveri ordinari per acuti situata ad una distanza compatibile con
l’efficace gestione di eventuali complicanze. Devono essere, altresì, definite le
procedure per la gestione delle emergenze nell’ambito della rete dell’emergenzaurgenza. L'attivazione di presidi autonomi di day surgery può essere utilizzata, in via
prioritaria, per consentire la riconversione delle strutture della rete ospedaliera
regionale. In tali presidi vanno previste modalità per assicurare l’effettuazione di
indagini di base nell’ambito della biochimica clinica e dell’ematologia ed
emocoagulazione, nonché le indagini di diagnostica per immagini e di tutti gli altri
servizi che si rendano necessari in relazione alla tipologia delle prestazioni eseguite.
b. unità di day surgery, monospecialistica o plurispecialistica, posta all’interno di
una struttura di ricovero a ciclo continuo pubblica o privata, dedicata all’erogazione
di ricoveri a ciclo diurno per acuti. L’unità di day surgery
può essere costituita da una delle seguenti modalità organizzative:
•
dotazione di spazi di degenza dedicati alla day surgery ed utilizzo
programmato di sale operatorie in comune con altre unità operative;
•
dotazione di spazi di degenza e di sale operatorie dedicati alla day surgery,
46
in relazione ad un elevato volume e alla complessità della casistica trattata;
c. posti letti dedicati nell’ambito delle unità di degenza ordinaria presenti nelle
strutture di ricovero per acuti pubbliche o private.
Garanzie de percorso assistenziale (Linee Guida CSR 2002)
1. Le attività di day surgery richiedono la definizione e l’adozione di specifiche
procedure cliniche ed organizzative per le fasi di ammissione, cura e dimissione del
paziente. Al paziente sono fornite informazioni ed istruzioni relative sia alla fase
preoperatoria che a quella postoperatoria.
2. Per la fase di ammissione al regime di day surgery, sono stabiliti in modo esplicito
i criteri di selezione e di esclusione dei pazienti, sia di natura clinica che sociofamiliari.
3. Va garantita l’adozione di protocolli assistenziali per la fase di cura e per il
monitoraggio perioperatorio.
4. La registrazione dell’attività viene effettuata con le stesse modalità seguite per i
ricoveri ordinari, in particolare attraverso la cartella clinica, il registro nosologico, il
registro di sala operatoria nonché attraverso la compilazione della scheda di
dimissione.
5. All’atto della dimissione è consegnata al paziente una relazione destinata al medico
curante, in cui vengono riportati i dati salienti del ricovero, la terapia, le indicazioni
per la gestione delle eventuali complicanze. Devono essere, altresì, garantiti al
paziente: l'informazione circa i comportamenti da seguire, i riferimenti per ottenere
47
l'assistenza richiesta per i casi di necessità ed urgenza e le modalità dei controlli
successivi.
6. Al fine di garantire la continuità assistenziale la struttura assicura: la raccolta
completa della documentazione clinica, che va resa tempestivamente disponibile, la
pronta reperibilità del medico e lo stretto contatto con il medico di medicina generale.
48
Schema tipo di percorso assistenziale in day surgery
Una prestazione in Day Surgery è articolata in un numero variabile (minimo tre) di
singole giornate di degenza (accessi):
Ricovero - 1° accesso
Il paziente deve giungere al 1° accesso alle ore 8.00 accompagnato da un
accompagnatore/tutore che controfirmerà l’atto di consenso informato al trattamento
di Day Surgery, e garantirà nel post-operatorio il trasporto del paziente al proprio
domicilio, il rispetto delle cure indicate nel foglio di dimissione, le comunicazioni
con il medico reperibile, con il reparto di degenza ordinaria e con il medico di
medicina generale.
Durante il primo accesso verranno effettuate:
* Consegna opuscolo informativo (generale + specifico per procedura)
* Individuazione dell’accompagnatore / tutore e suo consenso informato
* Apertura cartella clinica
* Consenso informato
* Indagini pre-operatorie (elencate nell’opuscolo informativo)
* Visita anestesiologica
* Prenotazione per l’intervento
49
2° accesso
* Il paziente sarà ricoverato in una stanza di degenza dedicata all’attività di Day
Surgery.
* Intervento (informazioni sull’anestesia e sul post-intervento sono contenute
nell’opuscolo informativo).
* Sorveglianza e controllo post-operatorio
* Dimissione (il sanitario deciderà dopo esame clinico la dimissibilità del paziente).
* Al paziente saranno consegnati ricetta e farmaci da praticare a domicilio (la terapia
che sarà praticata nel pre-intra-post-operatorio è indicata nell’ opuscolo informativo).
* Al tutore sarà consegnata una scheda con indicazione del tipo di intervento praticato
ed eventuali altre annotazioni. Il tutore provvederà a consegnare tempestivamente al
medico di base tale documentazione.
* All’accompagnatore/tutore saranno consegnati per iscritto i recapiti telefonici del
chirurgo reperibile e del reparto di degenza.
* Sarà concordata la data del terzo accesso.
3° accesso - Dimissione
* Controllo ambulatoriale
* Compilazione da parte del paziente della scheda per la valutazione del grado di
soddisfazione.
* Chiusura cartella clinica
50
Ulteriori accessi potrebbero rendersi necessari in relazione a specifiche necessità
(consulenze specialistiche, verifica esami, ecc.)
Continuità Assistenziale
Il regime di ricovero in Day Surgery prevede la continuità delle cure anche al di fuori
dell’orario di attività, compresi i giorni festivi mediante:
* Reperibilità telefonica
* Fornitura diretta farmaci necessari
* Attivazione 118
* Controllo telefonico dopo 24 ore (facoltativo)
51
DAY SURGERY E TUMORE DELLA MAMMELLA
Le linee guida FONCaM del 2005 segnalano tra gli indicatori di un’unità senologica,
alla voce “linfonodo sentinella” la dizione : preferibile utilizzo del day surgery; tale
raccomandazione è attualmente recepita solo da poche breast units in Italia. In realtà
l’intervento chirurgico per tumore della mammella, che nella maggioranza dei casi
rappresenta il primo e più importante atto terapeutico, ha subito negli ultimi decenni
una drastica riduzione della sua aggressività, pur conservando tutta la sua efficacia.
Se, per quanto riguarda il tumore primitivo, il passaggio dai devastanti interveti di
Hamsted all’attuale ampia exeresi del nodulo tumorale fa ormai parte della storia
della chirurgia senologica, più recentemente l’introduzione, come standard di
trattamento, della tecnica del linfonodo sentinella ha permesso di ridurre
l’aggressività anche sul cavo ascellare. Sulla base di questi presupposti, le pazienti
attualmente sono molto più propense a sottoporsi a procedure meno invasive e tale
approccio chirurgico è potenzialmente il più adatto al day surgery.
A livello legislativo la Conferenza Stato Regioni, nel formulare le linee guida del
2002, stila un elenco di prestazioni erogabili in day surgery includendo le voci di
seguito riportate, relative sia a interventi sulla mammella che sui linfonodi ascellari.
52
INTERVENTI SUI TEGUMENTI
Mastotomia
Biopsia a cielo aperto della mammella
Asportazione o demolizione di tessuto della mammella, SAI
Asportazione locale di lesione della mammella
Quadrantectomia della mammella
Mastectomia subtotale
Asportazione di tessuto ectopico della mammella
Asportazione del capezzolo
Mastectomia semplice monolaterale
Impianto di protesi monolaterale
Impianto di protesi bilaterale
Mastopessi
Innesto a spessore parziale nella mammella
Innesto a tutto spessore nella mammella
Trasposizione del capezzolo
Altra riparazione o ricostruzione del capezzolo
Revisione di protesi della mammella
Rimozione di protesi della mammella
Inserzione di espansore tessutale nella mammella
Rimozione di espansore tessutale dalla mammella
Altri interventi sulla mammella
INTERVENTI SUL SISTEMA EMATICO E LINFATICO
Incisione di strutture linfatiche
Asportazione di linfonodi cervicali profondi
Asportazione di linfonodi mammari interni
Asportazione di linfonodi ascellari
Asportazione semplice di altre strutture linfatiche
Asportazione di linfonodi regionali
Figura 2 : Elenco delle prestazioni erogabili in day surgery
(Tratto da : Atti Conf. Stato Regioni 2002)
53
Attualmente in Italia il day surgery non rappresenta il regime di ricovero più
utilizzato per trattare il tumore della mammella, anche in quei casi in cui l’interveto,
per aggressività e per durata, non porrebbe nessuna controindicazione alla dimissione
dopo poche ore. La British Association of Day Surgery (BADS) ha anch’essa
prodotto una lista di procedure da esegure in DS in cui ha incluso anche la biopsia del
linfonodo sentinella. Negli USA, dove la motivazione economica è ancora più forte,
l’utilizzo del day surgery per il trattamento chirurgico del tumore della mammella è
praticato con una certa frequenza dai primi anni ’90 e sono eseguiti in day surgery
anche la mastectomia e la linfoadenectomia ascellare radicale.
Già da tempo sono noti gli studi randomizzati che evidenziano i vantaggi della
dimissione precoce sulla ripresa fisica e psicologica della paziente e sui costi, ma per
quanto riguarda in maniera specifica il day surgery, non esistono attualmente studi
randomizzati e controllati che confrontino il DS con il ricovero ospedaliero nel
tumore della mammella. Disponiamo solo di studi osservazionali analizzati
accuratamente nella review del 2009 degli autori Marla e Stallard (Marla S., Stallard
S. Int.J Surg 7 (2009) 318-323).
Si può osservare in primis che le pazienti arruolate abbracciano un range di età molto
ampio da 17 anni a 90 anni. I criteri più frequentemente utilizzati in letteratura per
l’arruolamento dei casi sono, oltre naturalmente all’operabilità, la distanza
dall’ospedale dell’alloggio della paziente, la disponibilità di un accompagnatore e di
un aiuto a domicilio. Nella casistica di Marrazzo (Marrazzo A, Chir Ital
54
2007;59:687–91) è stato individuato come criterio di esclusione anche il volume
tumorale maggiore di 3 cm; Carcano (Chirurgia 2005;18:323–5), nel suo studio
ammette al trattamento in DS solo i casi in cui è possibile eseguire chirurgia
conservativa.
Friedman (Ann Ital Chir 2004;75(525):8) e Goodman (Arch Surg 1993;128:1149–
52) riportano percentuali molto basse di pazienti che hanno rifiutato il DS (1,1% e
1,4%) preferendo il ricovero ordinario; al contrario nel lavoro di Marchal et al (Eur J
Surg Oncol 2005;31:495–9) tale percentuale sale al 13,9 %.
In letteratura sono riportati studi in cui sono presenti tutti gli approcci chirurgici per il
tumore della mammella in day surgery, come è ben evidente nella tabella riassuntiva
adattata da Marla e Stallard.
Figura 3: Studi sul day surgery nei casi di tumore della mammella
(Tratto da Marla S., Stallard S. Int.J Surg 7 (2009) 318-323)
55
Un parametro interessante valutato da quasi tutti gli studi clinici è la percentuale di
dimissione entro i tempi previsti dal regime di day surgery, rispetto alle pazienti in
cui il DS è stato trasformato in pernottamento, tale percentuale è compresa tra l’86%
ed il 100%.
Casi in cui dopo la dimissione c’è stata una quasi immediata riammissione in
ospedale per complicanze post-operatorie immediate o precoci sono riferiti solo da
alcuni autori che riportano riammissioni nel 6-7% delle pazienti (Dravet et.al. Ann
Chir, 2000;125:668–76.; Carcano, Chirurgia 2005;18:323–5), le cause di
riammissione precoce riferite erano nausea, vomito, dispnea, complicanze della
sutura.
Altro parametro analizzato da alcuni lavori scientifici è stato il tasso di re-interventi;
Athey (Ann R Coll Surg Engl 2005;87:96–8) riporta 24 casi su 165 pazienti (14%) in
cui è stato necessario intervenire nuovamente con un ampliamento dei margini o una
mastectomia, l’autore non specifica se il secondo intervento è stato eseguito
nuovamente in day surgery. Carcano riporta 25 pazienti (28%) che hanno dovuto
subire in un secondo tempo la dissezione ascellare, di queste, 6 sono state ri-operate
in day surgery. Nello studio di Marrazzo del 2007 invece la percentuale di secondo
intervento è del 40% e la linfoadenectomia ascellare radicale viene eseguita solo in
regime di ricovero.
I sintomi più spesso riferiti nel post operatorio sono stati nausea e vomito riferiti in un
minimo di 0,8% dei casi fino ad un massimo del 12,2% dei casi a secondo degli studi.
56
Il vomito incoercibile in alcuni casi è stata la causa della permanenza delle pazienti
per la notte (0,8-5,4%).
Il dolore è l’altro sintomo sempre presente dopo l’intervento e solitamente viene
controllato con farmaci analgesici. Nelle casistiche di Dravet (Ann Chir
2000;125:668–76) e di Marchal (Eur J Surg Oncol 2005;31:495–9) tale sintomo
rappresenta la causa di non dimissione della paziente nel 1-2% dei casi; è però
importante segnalare che le casistiche riportate dai due autori Francesi
comprendevano casi di dissezione ascellare in cui il dolore è significativamente più
intenso.
Le complicanze della ferita chirurgica nel loro insieme (infezione, ematoma, etc.) si
presentano con la stessa frequenza riportata in letteratura per gli interventi eseguiti in
regime di ricovero ordinario. Non ci sono dati relativi alla gestione dei drenaggi.
Figura 4: Frequenza di dimissione dal regime di day surgery e principali complicanze postoperatorie negli studi presenti in letteratura
(Tratto da Marla S., Stallard S. Int.J Surg 7 (2009) 318-323)
57
Per quanto riguarda la valutazione di parametri di tipo psico-sociali, lo studio di
Margolese et. al. su 55 casi (Ann Surg Oncol 2000;7:181–7) è l’unico presente in
letteratura che utilizza dei test validati per la valutazione della qualità di vita dopo
day surgery. Con una scala di distress psicologico e un Emotional Adjustment Index,
l’autore dimostra che le pazienti trattate in day surgery presentano un minor di stress
psicologico (p < 0.009) e un miglior adattamento emozionale (p <0.05). Nello stesso
studio è stato inoltre valutato il livello di soddisfazione delle pazienti, 22 delle 55
pazienti (40%) avrebbero preferito trascorrere la notte in ospedale; nel gruppo di
controllo 4 pazienti ricoverate su 35 (12%) avrebbero preferito andare a casa il giorno
stesso dell’intervento. Per quanto riguarda la soddisfazione delle pazienti il dato di
Margolese contrasta però con la maggior parte degli altri lavori che mettono spesso in
evidenza pazienti soddisfatte nel 90 - 100% dei casi.
L’aspetto economico dell’approccio in day surgery rappresenta attualmente un
argomento di interesse primario analizzato in alcuni studi presenti in letteratura. Il
risparmio economico utilizzando il day surgery per il trattamento del tumore della
mammella è stato calcolato compreso tra il 40% e l’85% rispetto al ricovero
ordinario. Già nel 1993 Goodman et.al (Arch Surg 1993;128:1149–52) ha dimostrato
che i costi dell’intervento in sé non differiscono molto in day surgery, ma i successivi
2-3 giorni di ospedalizzazione determinano un costo aggiuntivo di 3000 dollari.
Carcano et.al. più recentemente, ha calcolato nel suo lavoro del 2005 un risparmio di
850 euro per ogni intervento in day surgery.
58
In conclusione i dati della letteratura, pur senza fornire elevati livelli di evidenza
scientifica per l’assenza di studi randomizzati e controllati, confermano che il
trattamento chirurgico del tumore della mammella può essere eseguito, soprattutto nei
casi di tumori di piccolo volume, in day surgery. Inoltre la tecnica del linfonodo
sentinella è particolarmente adatta al DS. I vantaggi di tale approccio oltre ad essere
economici, sono soprattutto legati ad una più rapida ripresa psico-fisica della
paziente. I rischi principali sono invece l’impossibilità di dimettere nei tempi previsti
per la presenza di nausea, vomito o dolore intensi, il rischio di nuovo ricovero
precoce e la possibilità di doversi sottoporre ad un secondo intervento soprattutto nei
casi di linfonodo sentinella positivo. Il day surgery infatti non è compatibile con
l’esame estemporaneo del linfonodo sentinella, quindi si deve attendere l’esame
istologico definitivo per decidere sull’eventuale linfoadenectomia.
59
MATERIALI E METODI
Nel periodo che va da gennaio 2005 ad aprile 2011 presso l’unità di senologia
(breast unit) del Dipartimento di Ginecologia, Perinatologia e Riproduzione
Umana dell’Università degli Studi di Firenze sono state sottoposte ad interveto
chirurgico per patologie oncologiche della mammella 297 pazienti, in 70 casi è
stato scelto il regime di ricovero in day surgery.
Nel Dipartimento è presente un’ unità di day surgery monospecialistica come
definita dalla normativa vigente (CSR 2002). Tale unità operativa dispone di posti
letto in un reparto separato dalle degenza ordinaria, di sale operatorie e liste di
attesa differenti rispetto alle pazienti in cui è richiesto il pernottamento in
ospedale. Ad ogni paziente in attesa di ricovero in day surgery viene consegnato
un opuscolo informativo in cui sono illustrate le caratteristiche del servizio
(Allegato)
La paziente viene dichiarata idonea al day surgery solo dopo attenta valutazione
dello specialista in anestesia e del chirurgo, i due medici compilano una cartella di
day surgery (Allegato). Infine la paziente viene informata dettagliatamente dei
rischi e dei benefici della procedure ed invitata a firmare un consenso scritto che è
parte integrante della cartella di day surgery (Allegato).
I criteri di esclusione della paziente dal day surgery sono di seguito espressi.
60
Criteri di esclusione dal regime di Day Surgery
Criteri Clinici di Esclusione
•
anamnesi di shock anafilattico
•
diabete insulino-dipendente
•
pregresse sindromi convulsive
•
coagulopatia a rischio emorragico
•
infarto del miocardio nell’ultimo anno
•
trattamento dialitico
•
patologia psichiatrica limitante
•
epatopatia in fase itterica/ascitica
•
peso < di 80 Kg
Criteri Logistici e Socio-familiari
•
luogo di residenza non superiore ai 100 km. e/o > 1 ora di auto.
•
possibilità di utilizzo di un auto privata
•
telefono in casa
•
disponibilità di un adulto accompagnatore in grado di assolvere alle
prescrizioni
61
L’età media delle pazienti sottoposte in DS ad interveto chirurgico per patologie
oncologiche della mammella è 59, 8 anni (mediana 60 anni) con range che va da
24 anni a 93 anni.
All’esame clinico senologico in 30 casi si trattava di un nodulo palpabile (43%),
in 38 casi la lesione non era palpabile (54%), in 2 (3%) casi l’unico segno clinico
era la secrezione ematica monoorifiziale dal capezzolo.
Gli accertamenti strumentali eseguiti dalle pazienti prima dell’interveto sono stati:
mammografia in 49 pazienti (70%), ecografia mammaria in 36 donne (51,6%).
Per quanto riguarda la diagnostica invasiva, 53 pazienti (76%), prima
dell’intervento, si sono sottoposte a biopsia della lesione sopetta. La Core- Biopsy
è stata eseguita con ago Tru-cut da 14 G (Precisa Hospital Service, Roma Italy)
sotto guida ecografica. Nel gruppo delle pazienti che non si sono sottoposte a core
biopsy, 3 pazienti (4%) sono state sottoposte ad esame citologico mediante
aspirazione con ago sottile (FNAC, Fine Needle Aspiration Cytology) presso altra
strutura; 9 pazienti (13%) avevano già una diagnosi istologica da un recente
intervento; 5 pazienti (7%) hanno avuto accesso all’intervento senza diagnosi
istologica. A questo ultimo gruppo gruppo di 5 pazienti appartengono tre pazienti
rispettivamente di 87,88 e 93 anni per le quali si è ritenuto di poter eseguire
direttamente una biopsia escissionale in day surgery; le rimanenti 2 pazienti
avevano eseguito esami strumentali suggestivi rispettivamente per papilloma
intraduttale alla duttogalattografia e fibroadenoma all’ecografia e mammografia,
la diagnosi istologica sul pezzo chirugico ha invece evidenziato un carcinoma
duttale ed un tumore filloide.
62
Tecnica di diagnosi isto-citologica pre-chirurgica
CORE BIOPSY
F.N.A.C.
PRECEDENTE CHIRURGIA
NESSUN ESAME
n
53
3
9
5
%
76 %
4 %
13 %
7 %
Tabella I: Diagnosi invasiva pre-chirurgica
La core biopsy, rispetto all’aspirazione con ago sottile, permette di disporre di
numerose informazioni aggiuntive che orientano l’operatore sul tipo di intervento:
neoplasia in situ o infiltrante, tipo istologico, grading e espressione dei fattori
biologici (recettori per estrogeni, progesterone, di Ki67 e c-erbB2).
Tutte le pazienti con diagnosi di carcinoma sono state sottoposte ad una attenta
valutazione ecografica anche del cavo ascellare. Per tale valutazione sono stati
utilizzati i parametri ecografici di valutazione dei linfonodi proposti dalla nostra
breast unit in precedenti studi (Susini T. , Nori J. et.al. The Breast 18 (2009) 103–
108). L’utilizzo di tali informazioni ha permesso di escludere dall’approccio in
day surgery le pazienti da noi ritenute ad alta probabilità di presentare una
positività dei linfonodi ascellari poiché la nostra breast unit non esegue ad oggi
interventi di dissezione ascellare radicale (ALND, Axillary Lymph Node
Dissection) in day surgery.
63
Le indicazioni all’intervento nella nostra casistica sono riassunte nella tabella.
INDICAZIONE
Carcinoma infiltrante di nuova insorgenza
Carcinoma in situ
Recidiva su cicatrice
Margini di escissione non adeguati
Filloide
Radial Scar
Papilloma ad alta proliferazione
Nodulo d.n.d.d.
NUMERO
28
19
7
3
5
4
2
2
PERCENT.
40 %
27 %
10 %
4 %
7 %
6 %
3 %
3 %
Tabella II: Indicazioni all’intervento
La maggior parte dei casi è rappresentata da carcinomi infiltranti (40%) o in situ
(27%) di nuova insorgenza. L’approccio in day surgery è stato inoltre utilizzato
per i casi in cui l’intervento si limitava ad un completamento di un precedente atto
chirurgico come nel caso di recidive sulla cicatrice o di recente escissione
chirurgica di neoplasia con distanza del tumore dai margini del pezzo operatorio
non soddisfacente . Altre indicazioni riguardano il tumore filloide e la radial scar.
Il tipo di intervento chirurgico eseguito più frequentemente sulla mammella è
stato l’ampia exeresi della lesione tumorale in 53 casi (77%), seguita dalla
quadrantectomia in 8 casi (11%), ampliamento dei margini di precedente exeresi
in 3 casi (4%), asportazione di recidiva su cicatrice in 3 casi (4%), infine siamo
ricorsi in un caso al day surgery per applicare la tecnica sperimentale di
termoablazione in una donna di 76 anni in condizioni cliniche ad alto rischio
operatorio. Nel caso di lesioni non palpabili, l’individuazione della lesione
durante l’intervento è stata facilitata dal posizionamento sotto guida ecografica di
un filo di repere metallico o mediante la tecnica ROLL. In nessun caso sono stati
applicati drenaggi.
64
TIPO DI INTERVENTO
AMPIA EXERESI
QUADRANTECTOMIA
AMPLIAMENTO MARGINI
ASPORTAZ. RECIDIVA SU CICATRICE
DUTTOGALATTOFORECTOMIA
TERMOABLAZIONE CON RADIOFREQ.
NUMERO
53
8
3
3
2
1
PERCENT.
77%
11%
4%
4%
3%
1%
Tabella III: Tipo di intervento eseguito in day surgery
Il tipo di anestesia utilizzata per gli interventi è stata esclusivamente anestesia
locale in 38 casi (54 %) ed anestesia locale associata a sedoanalgesia in 32 casi
(46%).
Nel periodo che va da gennaio 2005 a dicembre 2009 la nostra unità operativa
senologica non ha mai effettuato, per motivi tecnico-organizzativi, la biopsia del
linfonodo sentinella (SLNB) in regime di day surgery.
65
Le caratteristiche istopatologiche dei 70 casi sottoposti ad intervento in day
surgery sono espresse nelle tabelle seguenti.
ISTOTIPO
numero
percent.
DUTTALE INFILTRANTE
25
35,7 %
DUTTALE IN SITU
14
20 %
LOBULARE INFILTRANTE
7
10 %
LOBULARE IN SITU
4
5,7 %
11
15,7 %
FILLOIDE
5
7,1 %
NEGATIVO PER TUMORE
4
5,7 %
ALTRI
N
16
26
8
Grading
G1
G2
G3
%
32%
52%
16%
Fattori prognostici biologici
positivo
debole
49
3
ER
29
15
Pg R
2
13
Ki 67
4
7
c-erbB2
negativo
5
15
27
32
Dimensioni del Tumore
Tis
18
32,1 %
T1a
8
14,2 %
T1b
11
19,6 %
T1c
12
21,4 %
T2
6
10,7 %
T3 - T4
1
1,8 %
T1
Figura 5 : Caratteristiche isto-patologiche di tutti i casi operati in Day Surgery
66
Dal mese di gennaio 2010 nella nostra unità senologica è stato possibile eseguire
in day surgery anche la biopsia del linfonodo sentinella. I criteri con cui sono state
selezionate le pazienti per l’intervento conservativo associato a biopsia del
linfonodo sentinella, sono quelli riconosciuti dalle linee guida FONCaM; il di
diametro del nodulo tumorale era sempre inferiore o uguale a 3 cm. Dopo aver
selezionato le pazienti idonee alla biopsia del linfonodo sentinella associata ad
intervento conservativo, abbiamo proposto ad un gruppo di 20 pazienti di
sottoporsi all’intervento i regime di day surgery dopo aver illustrato loro i pro ed i
contro tale tipo di approccio. Di queste 20 pazienti 18 hanno accettato il DS
(90%).
Da gennaio 2010 ad aprile 2011, le pazienti operate in regime di day surgery per
patologie oncologiche della mammella sono state 31 e di queste 18 pazienti (59%)
sono state sottoposte a intervento conservativo sulla mammella e biopsia del
linfonodo sentinella per carcinoma infiltrante della mammella. L’età media delle
pazienti sottoposte ad interveto conservativo sulla mammella e SLNB è 54 anni
(mediana 53,5 aa) con un range che va da 33 a 81 anni.
Le 13 pazienti che non sono state sottoposte ad alcun intervento sull’ascella erano
affette da neoplasie in situ in 5 casi (16%), neoplasie a basso potenziale evolutivo
(filloide a basso grado, papilloma intraduttale con iperplasia) in 2 casi (6%),
recidive cutanee 1 caso (3%), oppure l’età della paziente (range 79 – 93 anni)
controindicava a priori la linfoadenectomia (16%).
67
DAY SURGERY 2010-11
16%
3%
ETA' AVANZATA
6%
RECIDIVA
BASSO GRADO
DUTTALE IN SITU
59%
LIN
13%
SENTINELLA
3%
Figura 6: Attività chirurgica in day surgery da gennaio 2010 ad aprile 2011
Nello stesso periodo (gennaio 2010 – aprile 2011) la nostra Unità Senologica ha
eseguito 20 interventi conservativi di quadrantectomia o ampia exeresi associati a
biopsia del linfonodo sentinella in regime di ricovero ordinario (RO). Il gruppo
delle 20 pazienti in ricovero ordinario ha un’età media 57 anni (mediana 58 aa) e
presenta le stesse caratteristiche cliniche del gruppo operato in DS.
La paziente prima di sottoporsi all’intervento con SLNB è stata convocata presso
il reparto di Medicina Nucleare dell’Azienda Ospedaliero Universitaria di Careggi
(AOUC) il pomeriggio precedente l’intervento, oppure la mattina dell’intervento
alle ore 7:30 a.m. (se l’intervento veniva effettuato tra le ore 10 a.m. e le ore 1
p.m.). E’ stato somministrato tracciante radioattivo (particelle colloidali di
albumina umana di dimensioni tra 20 e 80 nanometri (Nanocoll) marcate con
tecnezio 99 (99mTc)) in sede sub-dermica nel quadrante interessato dalla
68
neoplasia e successivamente, dopo 30 minuti, è stato eseguito il primo tentativo di
acquisire le immagini mediante scintigrafia. Se non era ancora possibile
individuare uno o più linfonodi ipercaptanti in sede ascellare, veniva effettuata
una
seconda
scintigrafia
dopo
2-3
ore. Le
proiezioni
utilizzate
per
l’individuazione del linfonodo sentinella sono state l’anteriore e l’obliqua. In
nessun caso il LS è stato individuato nella catena mammaria esterna. In nessun
caso non è stato individuato alcun LS. L’intervento chirurgico è stato eseguito
entro un massimo 24 ore dalla somministrazione del tracciante, per localizzare il
linfonodo è stata utilizzata durante l’intervento la sonda gamma.
A seconda della localizzazione della neoplasia primitiva, l’asportazione del LS è
avvenuta mediante il prolungamento dell’incisione sulla mammella, oppure con
una seconda incisione di 1,5 - 2cm nel cavo ascellare.
Il linfonodo o i linfonodi individuati come captanti sono stati denominati
linfonodi sentinella e, nel caso di pazienti operate in DS, inviati all’esame
istologico definitivo. Il rispetto di tempi chirurgici più rigidi in regime di day
surgery non consente di analizzare il linfonodo sentinella con esame istologico
estemporaneo.
L’esame istologico è stato eseguito in primis su sezioni da 200 micron
perpendicolari all’asse lungo. E’ stata osservata una delle sezioni previa
colorazione con Ematossilina Eosina; se non si osservavano cellule neoplastiche
si procedeva ad un ulteriore taglio in sezioni di 50 micron e si effettuava la
colorazione con EE e l’analisi immuno-istochimica con le citocheratine. Con
questa tecnica è possibile individuare anche micrometastasi e cellule tumorali
isolate.
69
Nel caso in cui all’esame istologico definitivo del linfonodo sentinella è stata
evidenziata positività per infiltrazione neoplastica, la paziente è stata richiamata
per eseguire la linfoadenectomia ascellare omolaterale fino al terzo livello in
regime di ricovero ordinario. In caso di micrometastasi o di cellule tumorali
isolate, l’approccio è stato concordato con la paziente dopo una riunione
collegiale con oncologo e radioterapista.
70
ANALISI DEI DATI E COMMENTO DEI RISULTATI
Lo scopo del nostro lavoro è in primis individuare tutti i campi di applicazione del
regime di ricovero in day surgery nei casi di patologia neoplastica della mammella
presso la nostra Unità Senologica. Inoltre, di particolare interesse clinico è
l’analisi di quei casi in cui è stato possibile l’uso della tecnica della biopsia del
linfonodo sentinella senza la necessità del ricovero notturno.
La prima considerazione da fare riguarda l’età delle pazienti: nel periodo di tempo
preso in esame è stato possibile trattare in DS pazienti di tutte le face di età, con
un range che va dai 24 ai 93 anni. Nelle nostra casistica non è stato individuato
nessun limite di età oltre il quale controindicare il DS. Nella paziente anziana la
possibilità di eseguire un intervento conservativo, con tempi chirurgici ridotti e
spesso in anestesia locale, rappresenta un grosso vantaggio. Nell’anziana con
tumore della mammella sono frequentemente presenti altre malattie sistemiche
associate (malattie cardiovascolari e respiratorie in primis), pertanto la fase del
risveglio dall’anestesia generale può rappresentare un momento molto critico.
Nella donna anziana, inoltre, il ruolo della linfoadenectomia ascellare radicale per
tumore della mammella è messo in forte discussione da tutta la letteratura
scientifica. Secondo i dati scientifici a nostra disposizione la dissezione ascellare,
nei casi in cui è indicata, determina un aumento dell’aspettativa di vita a 10 o 20
anni, ma aumenta contemporaneamente l’incidenza di complicanze postoperatorie, la morbilità, compromettendo non raramente la qualità. Per questi
motivi l’approccio in DS in cui non è prevista la dissezione ascellare, è
particolarmente adatto nella paziente anziana. Le pazienti giovani, al di sotto dei
71
40 anni, nella nostra casistica, sono in netta prevalenza pazienti con neoplasie in
situ o tumori filloidi a basso grado. In questo caso l’approccio in DS è dettato dal
fatto che l’intervento standard per queste patologie è di tipo conservativo e non
prevede alcuna indagine sull’ascella. Dal 2010 inoltre è stato possibile mettere a
punto la tecnica del linfonodo sentinella anche in DS, di conseguenza è stato
possibile ammettere a tale procedura pazienti nella fascia di età di massima
incidenza del carcinoma infiltrante, tali pazienti nei periodi precedenti venivano
trattate in ricovero ordinario.
Per le motivazioni appena esposte la distribuzione in percentuale degli interventi
in DS nelle varie face di età risulta differente nel periodo gennaio 2010 - aprile
2011, rispetto ai periodi precedenti in cui le pazienti tra i 40 ed i 60 anni andavano
più spesso a ricovero ordinario. Tale concetto è espresso anche graficamente.
ATTIVITA' DEL DS PRIMA E DOPO SLNB (% per fasce di eta')
25
20
15
10
5
0
20
30
40
ETA' (anni)
50
60
70
2005-2009
2010-2011
>80
Figura 7: Percentuale di interventi in DS nelle diverse fasce di età
(confronto tra periodo 2010-2011 e periodo precedente)
72
Seconda conseguenza dell’introduzione della tecnica della biopsia del linfonodo
sentinella in DS è stato l’incremento progressivo del totale casi trattati in DS
rispetto al RO nel corso dei diversi anni di attività.
60
50
40
13
5
11
4
21
8
30
20
DAY SURGERY
45
34
37
31
45
INPATIENT SURGERY
28
10
10
7
0
2005
2007
2009
2011
APRILE
Figura 8: Numero di interventi nei diversi anni di attività D.S. vs R.O.
% INPATIENT - %OUTPATIENT
2011 aprile
2010
2009
2008
INPATIENT SURGERY
2007
DAY SURGERY
2006
2005
0%
20%
40%
60%
80%
100%
Figura 9: Percentuale di interventi in DS o RO in anni successivi
73
Il primo dato da rilevare è la percentuale di pazienti che ha accettato il DS dopo
aver letto l’opuscolo informativo relativo al regime di DS ed aver avuto un
colloquio che illustrasse vantaggi e svantaggi di tale approccio nella loro
patologia.
I principali vantaggi illustrati nel colloqui sono stati:
•
Liste d’attesa più brevi
•
Pernottamento a domicilio
I principali svantaggi illustrati alla paziente sono stati:
•
Impossibilità di esame estemporaneo con rischio aumentato di un secondo
intervento
•
Necessità di maggiore aiuto a casa
•
Rischio di nuovo ricovero per dolore o altre complicanze post operatorie
Su 20 pazienti a cui è stato proposto il 90% (18 pz) ha accettato il DS, le due
pazienti che hanno preferito dormire in ospedale hanno segnalato come principale
motivo la paura di dolore e complicanze precoci nel post-operatorio. Le pazienti
che hanno scelto il DS hanno riferito le seguenti motivazioni:
•
usufruire di una lista d’attesa più breve 10 pazienti (55,5%),
•
poter dormire a casa 8 pazienti (44,5%).
Il tempo che è trascorso dalla prima visita presso la nostra breast unit
all’intervento di quadrantectomia con SLNB in regime di DS è in media 15 giorni
(range 10 - 20 giorni); la stessa prestazione in ricovero ordinario ha tempi di attesa
in media di 40 giorni ( range 20 - 60 gg).
74
Prima della dimissione il chirurgo e l’anestesista compilano l’ultima parte della
cartella clinica (Alegato) in cui si valutano alcuni parametri clinici (segni vitali,
deambulazione, dolore, nausea e vomito, sanguinamento, diuresi), ad ogni
parametro viene attribuito un punteggio, il punteggio complessivo indica la
dimissibilità o meno. Nelle 18 pazienti tutti i parametri alla dimissione erano
quasi sempre ottimali: dolore moderato in 3 casi (18%), nausea moderata in 3 casi
(18%). Non c’è stato nessun caso di passaggio al ricovero ordinario, quindi il
100% delle pazienti è stato dichiarato idoneo alla dimissione ed inviato a
domicilio entro le ore 18:00 del giorno dell’intervento.
Al momento della dimissione sono stati sempre prescritti antidolorifici da
somministrare ad orario fisso per i primi due giorni del post-operatorio; i farmaci
prescritti sono stati ketorolac- trometamina e/o paracetamolo.
Il primo controllo ambulatoriale dopo la dimissione è stato programmato dopo 5 7 giorni dall’intervento, in tale occasione sono state poste alla paziente alcune
domande relative a sintomi soggettivi ed al livello di soddisfazione per la
procedura in DS. Le risposte raccolte sono state inserite nella scheda riportata
nella pagina seguente.
75
Questionario di Gradimento
DAY SURGERY PER TUMORE DELLA MAMMELLA
INTERVENTO CONSERVATIVO E BIOPSIA DEL LINFONODO SENTINELLA
N° Cartella DS
___________________
Età della Paziente
___________________
Motivo di scelta del DS
□ Lista di attesa breve
□ Pernottamento a Domicilio
□ Altro __________________________
Valutazione al primo controllo
Giornata post-operatorio _________
Dolore riferito in 1° e 2° giorno
□ Minimo
□ Moderato
□ Severo
Nausea riferita in 1° e 2° giorno
□ Minima
□ Moderata
□ Severa
Vomito in 1° e 2° giorno
□ NO
□ SI
N°
Telefonate ai numeri di riferimento
□ NO
□ SI
N°
Motivo della chiamata _________________________________________________________
Farebbe nuovamente il DS
□ NO
□ SI
Consiglierebbe ad altri il DS
□ NO
□ SI
Livello di soddisfazione complessiva per il DS
□ Molto
□ Abbastanza
□ Sufficiente
□ Scarso
□ Insufficiente
76
I dati raccolti con la compilazione delle schede di gradimento sono illustrati nelle
tabelle seguenti
SINTOMI
DOLORE
NAUSEA
VOMITO
TELEFONATE
Farebbe di Nuovo DS
Consiglierebbe DS
Soddisfazione
N.
PERC.
Minimo
7
39 %
Moderato
10
55,5 %
Severo
1
5,5 %
Minima
14
78 %
Moderata
4
22 %
Severa
0
NO
18
100 %
SI
0
0
N.
Percent.
NO
12
67 %
SI
6
33 %
Dolore
3
17 %
Medicazione
2
11 %
Altro
1
5 %
NO
2
11 %
SI
16
89 %
NO
2
11 %
SI
16
89 %
Molto
1
5%
Abbastanza
12
67 %
Sufficiente
4
22%
Scarso
0
Insufficiente
1
5%
Tabelle IV e V: Risultati dei dati raccolti alla prima visita di controllo post-operatoria
77
Dai dati raccolti si evidenzia che il dolore post-operatorio, anche in caso di
dimissione così precoce, è ben controllabile a domicilio con la terapia medica,
infatti se viene riferito come moderato o grave complessivamente nel 61% dei casi
(11 donne), in realtà porta a ricontattare la struttura di riferimento solo in 3 casi
(16,7%). La nausea ed il vomito sono sintomi ben tollerati dopo l’anestesia locale
o la sedo-analgesia e non sono mai stati causa di telefonata al medico. Altre cause
per le quali le pazienti hanno ricontattato il medico prima della visita di controllo
programmata sono state correlate alla gestione della medicazione chirurgica, in un
caso la paziente ha riferito uno stato ansioso come motivo della chiamata. Solo
due pazienti nella nostra casistica non farebbero nuovamente il day surgery e non
lo consiglierebbero ad altri, le motivazioni addotte sono in un caso l’eccessivo
aggravio sui familiari conviventi e nell’altro caso il dolore post-operatorio non
perfettamente controllato nei primi 2 giorni. Questa ultima paziente ha dato come
giudizio complessivo al DS insufficiente.
La maggioranza delle pazienti ha riferito abbastanza soddisfacente il ricovero in
regime di DS (12 donne, 67%).
Un altro importante aspetto che differenzia nettamente gli interventi di BLNS in
day surgery, rispetto al ricovero ordinario è l’impossibilità tecnica di eseguire
l’esame estemporaneo sul linfonodo sentinella. In DS non è possibile decidere se
eseguire direttamente la linfoadenectomia ascellare radicale (ALND, Axillary
Lymph Node Dissection ) durante lo stesso intervento, senza spettare l’esito
dell’esame definitivo. Tale rischio è solo in parte ridotto da una corretta e accurata
valutazione preoperatoria. L’esito dell’esame istologico definitivo sul linfonodo
sentinella, nella nostra casistica, è il determinate principale che ha portato le
78
pazienti ad un nuovo intervento. Nel grafico sono illustrate le risposte istologiche
sui linfonodi. In tutti i casi in cui erano presenti metastasi linfonodali è stato
sempre effettuato un nuovo intervento di ALND in regime di ricovero ordinario.
Nei casi in cui all’esame innunocitochimico si evidenziavano micrometastasi (1
caso) o cellule tumorali isolate (2 casi), l’approccio veniva sempre concordato con
la paziente dopo una riunione collegiale con oncologo e radioterapista. Nel caso
della micrometastasi è stato deciso di eseguire la ALND, nei due casi di cellule
tumorali isolate è stato deciso un approccio medico e radioterapico omettendo il
secondo intervento.
ISTOLOGIA LINFONODO SENTINELLA
2
1
C ELLULE TUMO RALI ISO LATE
MIC RO METASTASI
L.S. PO SITIVO
3
L.S. NEGATIVO
12
Figura 10: Risposte dell’esame istologico del linfonodo sentinella
Nel complesso 14 pazienti (78%) non hanno subito nessun ulteriore intervento
chirurgico, 4 pazienti (22%) hanno subito un secondo interveto che in 2 casi
(11%) oltre alla ALND ha compreso anche l’ampliamento dei margini di
escissione chirurgica della lesione primitiva.
79
RE-OPERATION
2; 11%
2; 11%
14; 78%
NO RE-O PERATIO N
RE-O PERATIO N: ALND
RE- O PERATIO N: ALND + RE-EXCISIO N O F MARGINS
Figura 11: Interveto di dissezione ascellare radicale per sentinella positivo
Questi dati possono essere confrontati con i dati relativi ad interventi chirurgici
analoghi, eseguiti dalla nostra equipe in regime di RO. Se si analizza tutta la
casistica della nostra equipe,
la ALND viene eseguita durante lo stesso
intervento, a causa di un esame estemporaneo positivo sul linfonodo sentinella nel
18% dei casi. Possiamo affermare quindi che scegliendo l’approccio in DS
dobbiamo prevedere circa un 18% in più di pazienti che eseguono due interventi a
causa dell’impossibilità di eseguire l’esame estemporaneo. Questo dato è da
tenere in considerazione oltre che per l’acquisizione del consenso informato,
anche per il calcolo dei costi.
80
L’ultimo aspetto che abbiamo analizzato nel nostro gruppo di 18 pazienti
sottoposte a SLNB è quello dei costi sanitari. Facendo una somma dei costi, il
trattamento del tumore della mammella con interveto conservativo e SLNB in
regime di day surgery costa il 40% in meno rispetto al ricovero ordinario. Il costo
complessivo dell’interveto in DS però deve prevedere anche la probabilità del
18% di un nuovo intervento in regime di ricovero ordinario causato dalla non
esecuzione dell’esame istologico estemporaneo. Inoltre va considerata la
percentuale di casi in cui l’esame estemporaneo è negativo, ma l’esito dell’esame
definitivo è positivo e quindi anche nel caso di RO è necessario eseguire un
nuovo intervento (circa il 4% dei casi). Considerando tutte queste variabili
abbiamo stimato che la scelta di eseguire la quadrantectomia e la biopsia del
linfonodo sentinella in regime di day surgery permette un risparmio complessivo
nella nostra casistica di circa il 25 %.
81
CONCLUSIONI
Il lavoro presentato ha messo in evidenza come il regime di ricovero in day surgery,
nel caso di donne affette da tumore della mammella, non solo è realizzabile, ma è
anche accettato favorevolmente dalla paziente e presenta alcuni vantaggi rispetto al
ricovero ordinario. Sicuramente sono ormai consolidate alcune indicazioni relative ai
casi in cui l’intervento è limitato alla nodulectomia più o meno allargata, come
avviene nel tumore in situ o in altre lesioni a rischio evolutivo. Nell’ottica di
modulare il più possibile l’aggressività chirurgica, riveste un ruolo fondamentale la
valutazione pre-operatoria della paziente. Dalla nostra esperienza l’esame più utile, in
caso di sospetto diagnostico clinico, radiologico e/o ecografico, risulta essere la
biopsia eco-guidata. In questo modo è possibile disporre di informazioni sulla
istologia e le caratteristiche biologiche del tumore. Lo studio ecografico delle
caratteristiche dei linfonodi ascellari è un altro importante passaggio per decidere
l’approccio chirurgico. Se tale approccio è di tipo conservativo e la paziente non è ad
alto rischio di infiltrazione ascellare è proponibile il day surgery. Naturalmente la
scelta viene sempre concordata con la paziente dopo un colloquio in cui si fornisce
materiale informativo.
Un aspetto importante è l’applicabilità del day surgery in età avanzata. La paziente
anziana è per definizione “fragile” e spesso si presenta con una o più patologie
sistemiche concomitanti, pertanto l’ospedalizzazione prolungata può metterla a
rischio di infezioni ospedaliere e complicanze legate all’immobilizzazione. Il
82
pernottamento al proprio domicilio riduce il disorientamento spazio-temporale tipico
dell’anziano ospedalizzato. Il rapido ritorno nel proprio ambiente familiare permette
di riprendere più precocemente le attività della vita quotidiana.
Il day surgery, nelle strutture che dispongono di letti di degenza e sale operatorie
dedicate, sicuramente offre liste di attesa più brevi della degenza ordinaria, poiché
l’utilizzo delle strutture, dei presidi e degli ambienti è a più rapido ricambio e non è
richiesto personale per la degenza notturna. Nel caso del tumore della mammella la
differenza nei tempi di attesa rispetto al ricovero ordinario, nella nostra esperienza,
non influisce minimamente sulla progressione della malattia neoplastica, ma ha un
enorme impatto psicologico sulla paziente. Le liste di attesa più brevi si dimostrano la
prima motivazione per la quale la paziente, messa in condizione di scegliere, opta per
il DS. Al contrario, il timore di non saper gestire in modo ottimale il post-operatorio
rappresenta il motivo principale di scelta del pernottamento.
La selezione della paziente in modo accurato da parte del chirurgo e dell’anestesista
rappresenta il presupposto fondamentale per poter effettuare la dimissione dopo
alcune ore dall’intervento. La valutazione pre-operatoria permette di raggiungere un
tasso di dimissibilità di circa il 100% in linea con numerosi studi in letteratura.
La possibilità di eseguire l’intervento in anestesia locale, eventualmente associata ad
una lieve sedazione a scopo analgesico, rappresenta sicuramente un’altra delle
condizioni che permettono la dimissione precoce. L’anestesia meno profonda rende
l’intervento effettuabile anche nella paziente anziana con patologie associate e quindi
a rischio anestesiologico elevato.
83
La maggioranza delle pazienti che sono state sottoposte a biopsia del linfonodo
sentinella ci ha riferito un buon livello di soddisfazione dopo la dimissione e afferma
che sceglierebbe nuovamente il DS. Questo dato è in linea con studi analoghi, ma
bisogna sottolineare che solitamente la paziente affetta da patologia oncologica, tende
a scegliere sempre le metodiche che già conosce. Anche le pazienti sottoposte a
ricovero ordinario, se interrogate, nella maggioranza dei casi, affermano che
sceglierebbero nuovamente il pernottamento.
La biopsia del linfonodo sentinella, pur richiedendo un discreto impegno
organizzativo, è adatta day surgery e si presta ad alcune considerazioni . Di fronte a
vantaggi evidenti in termini di liste di attesa e soddisfazione della paziente per la
dimissione precoce, va considerata l’impossibilità di eseguire l’esame istologico
estemporaneo. L’esame intra-operatorio, in un numero non trascurabile di casi,
permette di completare il trattamento con la dissezione ascellare, senza necessità di
un secondo ricovero e un secondo intervento. Al contrario la scelta del day surgery
pone la paziente di fronte ad un rischio più alto di doversi sottoporre ad un secondo
intervento dopo l’esame istologico definitivo sul linfonodo sentinella. Questo aspetto
deve essere bene illustrato nel consenso informato.
La nostra equipe chirurgica non esegue la dissezione ascellare e non posiziona mai
drenaggi da gestire a domicilio se la paziente viene operata in day surgery, bisogna
però sottolineare che in letteratura esistono studi sul DS che utilizzano anche tali
tecniche con buoni risultati in termini di dimissibilità, e basso tasso di complicanze.
84
L’aspetto economico è sicuramente molto interessante ed attuale. L’utilizzo del day
surgery, soprattutto nei casi in cui è richiesta la biopsia del linfonodo sentinella,
presenta dei costi inferiori rispetto al ricovero ordinario, anche se si considera il tasso
di re-interveto decisamente più alto. La dimissione precoce comporta un maggiore
costo sociale nell’immediato post-operatorio; la paziente, nei primi giorni, necessita
di un’assistenza domiciliare più assidua. In letteratura esistono studi clinici che
valutano anche i costi dell’assistenza infermieristica a domicilio, molto più difficili da
valutare sono i costi indiretti sostenuti dai conviventi.
In conclusione, l’applicabilità a tutte le fasce di età, la riduzione dei costi sanitari, la
riduzione delle liste d’attesa, la riduzione della morbilità, la riduzione dell’impatto
psicologico della degenza ospedaliera sulla paziente affetta da carcinoma della
mammella sono i vantaggi più evidenti del regime di ricovero in day surgery.
85
BIBLIOGRAFIA
Parkin DM, Bray F, Ferlay J, Pisani P.;Estimating the world cancer burden: Globocan
2000. Int J Cancer 2001;94:153-6.
Colditz GA, Baer HJ, Tamimi RM. Breast cancer. In: Schottenfeld D, Fraumeni JF,
Jr., eds. Cancer epidemiology and prevention. New York: Oxford University Press,
2006:995-1012.
Parkin DM, Whelan SL, Ferlay J, Teppo L,Thomas DB. Cancer incidence in
fivecontinents. Volume VIII. IARC Scientific Publ.No. 155. Lyon, France:
International Agency forbResearch on Cancer, 2002.
Ries LAG, Eisner MP, Kosary CL, et al. SEERCancer Statistics Review, 1975-2002.
Bethesda,MD: National Cancer Institute, 2005.
K McPherson, C M Steel, J M Dixon, ABC of Breast Diseases Breast cancer—
epidemiology, risk factors, and genetics, 2000
Linee Guida FONCAM 2008
Bouchardy C, Fioretta G, Verkooijen HM, etal. Recent increase of breast cancer
incidence among women under the age of forty. Br J.Cancer 2007;96:1743-6.
Heck KE, Pamuk ER. Explaining the relation between education and postmenopausal
breast cancer. Am J Epidemiol 1997;145:366-72
Levi F, Bosetti C, Lucchini F, Negri E, La Vecchia C. Monitoring the decrease in
breast cancer mortality in Europe. Eur J Cancer Prev 2005;14:497-502.
Levi F, Lucchini F, Negri E, Zatonski W, Boyle P, La Vecchia C. Trends in cancer
mortality in the European Union and accession countries, 980-2000. Ann Oncol
2004;15:1425-31.
Marla S, Stallard S. Systematic review of day surgery for breast cancer International
Journal of Surgery 7 (2009) 318–323
Conferenza Stato Regioni “Linee guida per l’organizzazione delle attività di Day
surgery” Repertorio Atti n. 1516 del 1° agosto 2002 come rettificato con Atto
Repertorio n. 1518 del 25 settembre 2002
UK breast cancer incidence statistics. Cancer Research UK, 2007.
86
Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J
Clin 2005;55:74–108.
Gurusamy K, Junnarkar S, Farouk M, Davidson BR. Meta-analysis of randomized
controlled trials on the safety and effectiveness of day-case laparoscopic
cholecystectomy. Br J Surg 2008;95:161–8.
The NHS plan: a plan for investment a plan for reform. Available from: Department
of
Health
http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAn
dGuidance/Browsable/DH_4112374; 2005.
Jackson I, McWhinnie D. BADS directory of procedures. London: The British
Association of Day Surgery; 2007.
Bonnema J, van Wersch AM, van Geel AN, Pruyn JF, Schmitz PI, Paul MA, et al.
Medical and psychosocial effects of early discharge after surgery for breast cancer:
randomised trial. BMJ 1998;316:1267–71.
Bundred N, Maguire P, Reynolds J, Grimshaw J, Morris J, Thomson L, et al.
Randomised controlled trial of effects of early discharge after surgery for breast
cancer. BMJ 1998;317:1275–9.
Purushotham AD, McLatchie E, Young D, George WD, Stallard S, Doughty J, et al.
Randomized clinical trial of no wound drains and early discharge in the treatment of
women with breast cancer. Br J Surg 2002;89:286–92.
Bonnema J, vanWersch AM, van Geel AN, Pruyn JF, Schmitz PI, Uyl-de Groot CA,
et al. Cost of care in a randomised trial of early hospital discharge after surgery for
breast cancer. Eur J Cancer 1998;34:2015–20.
Wells M, Harrow A, Donnan P, Davey P, Devereux S, Little G, et al. Patient, carer
and health service outcomes of nurse-led early discharge after breast cancer surgery:
a randomised controlled trial. Br J Cancer 2004;91:651–8.
Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, et al.
Metaanalysis of observational studies in epidemiology: a proposal for reporting.
JAMA 2000;283:2008–12.
Downs SH, Black N. The feasibility of creating a checklist for the assessment of the
methodological quality both of randomised and non-randomised studies of health care
interventions. J Epidemiol Community Health 1998;52:377–84.
87
Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. Guideline for
prevention of surgical site infection. AJIC Am J Infect Control 1999;27:97–134.
Barillari P, Leuzzi R, Bassiri-Gharb A, D’Angelo F, Aurello P, Naticchioni E.
Ambulatory surgical treatment for breast carcinoma. Minerva Chir 2001;56: 55–9.
Friedman D, Gianetta E, Giaminardi E, Aicardi M, Bachi V. Definitive breast cancer
surgery as an outpatient: rationale and our experience. Ann Ital Chir 2004;75(525):8
[discussion 529].
Dravet F, Belloin J, Dupre PF, Francois T, Robard S, Theard JL, et al. Role of
outpatient surgery in breast surgery. Prospective feasibility study. Ann Chir
2000;125:668–76.
Guihard P, Dravet F, Ricaud-Couprie M, Doutriaux-Dumoulin I, Classe JM. Surgical
management of non-palpable breast lesions in ambulatory care. J Gynecol Obstet Biol
Reprod 1999;28:330–4.
Benfatto G, Zanghi G, Catalano F, Di Stefano G, Fancello R, Mugavero F, et al. Day
surgery for breast cancer in the elderly. Giornale di Chirurgia 2006;27:49–52.
Ranieri E, Caprio G, Fobert MT, Civitelli L, Ceccarelli F, Barberi S, et al. One-day
surgery in a series of 150 breast cancer patients: efficacy and cost-benefit analysis.
Chir Ital 2004;56:415–8.
Lindqvist R, Stenbeck M, Diderichsen F. Does hospital discharge policy influence
sick-leave patterns in the case of female breast cancer? Health Policy 2005;72:65–71.
Kambouris A. Physical, psychological, and economic advantages of accelerated
discharge after surgical treatment for breast cancer. Am Surg 1996;62:123–7.
Case C, Johantgen M, Steiner C. Outpatient mastectomy: clinical, payer, and
geographic influences. Health Serv Res 2001;36:869–84.
Warren JL, Riley GF, Potosky AL, Klabunde CN, Richter E, Ballard-Barbash R.
Trends and outcomes of outpatient mastectomy in elderly women. J Natl Cancer Inst
1998;90:833–40.
Ferrante J, Gonzalez E, Pal N, Roetzheim R. The use and outcomes of outpatient
mastectomy in Florida. Am J Surg 2000;179(253):9 [discussion 259–60].
Dooley WC. Ambulatory breast cancer surgery. Ann Surg Oncol 2000;7:174–5.
88
Hoehn JL. Definitive breast cancer surgery as an outpatient: a rational basis for the
transition. Semin Surg Oncol 1996;12:53–8.
Allard NC. Day surgery for breast cancer: effects of a psychoeducational telephone
intervention on functional status and emotional distress. Oncol Nurs Forum
2007;34:133–41.
Tan JC, McCready DR, Easson AM, Leong WL. Role of sentinel lymph node biopsy
in ductal carcinoma-in-situ treated by mastectomy. Ann Surg Oncol 2007;14:638.
Dalton EP. Increasing patient satisfaction through outpatient breast surgery. Adm
Radiol 1995;14:44–6.
Athey N, Gilliam AD, Sinha P, Kurup VJ, Hennessey C, Leaper DJ. Day-case breast
cancer axillary surgery. Ann R Coll Surg Engl 2005;87:96–8.
Carcano G, Uccella L, Ferrari A, Rovera F, Dionigi G, Limonta G, et al. Breast
cancer surgery as an outpatient in Italy: is it possible? Chirurgia 2005;18:323–5.
Dooley WC. Ambulatory mastectomy. Am J Surg 2002;184:545–8.
Goodman AA, Mendez AL. Definitive surgery for breast cancer performed on an
outpatient basis. Arch Surg 1993;128:1149–52.
Marchal F, Dravet F, Classe JM, Campion L, Francois T, Labbe D, et al.
Postoperative care and patient satisfaction after ambulatory surgery for breast cancer
patients. Eur J Surg Oncol 2005;31:495–9.
Margolese RG, Lasry JC. Ambulatory surgery for breast cancer patients. Ann Surg
Oncol 2000;7:181–7.
McManus SA, Topp DA, Hopkins C. Advantages of outpatient breast surgery. Am
Surg 1994;60:967–70.
Seltzer MH. Partial mastectomy and limited axillary dissection performed as a same
day surgical procedure in the treatment of breast cancer. Int Surg 1995;80:79–81.
Marrazzo A, Taormina P, David M, Riili I, Lo Gerfo D, Cas, et al. Surgical treatment
of early breast cancer in day surgery. Chir Ital 2007;59:687–91.
Gan TJ, Meyer TA, Apfel CC, Chung F, Davis PJ, Habib AS, et al. Society for
ambulatory anesthesia guidelines for the management of postoperative nausea and
vomiting. Anesth Analg 2007;105:1615–28.
89
ALLEGATO
CARTELLA CLINICA DI DAY SURGERY
Opuscolo informativo
sul regime di ricovero
in Day Surgery
Modulo di appuntamento
per la pre-ospedalizzazione
I
Cartella di Day Surgery
Pag. 1
Cartella di Day Surgery
Pag. 2
II
Cartella di Day Surgery
Pag. 3
Cartella di Day Surgery
Pag. 4
III
Relazione clinica di dimissione
IV