CAPITOLATO SPECIALE PER LA FORNITURA IN “SERVICE” DI 9 SISTEMI
DIAGNOSTICI PER VIROLOGIA (MARKERS SIEROLOGICI EPATITE A, B, C, HIV,
ANTITREPONEMA, IMMUNOBLOT HCV/HIV, HCV RNA QUALITATIVO, HCV RNA
QUANTITATIVO, HBV DNA QUANTITATIVO, HIV RNA QUANTITATIVO, HCV
GENOTIPO, HIV GENOTIPO DI RESISTENZA, ESTRATTORE AUTOMATICO DNA/RNA) –
DIPARTIMENTO DI LABORATORIO, COMPRENDENTE GLI ANALIZZATORI, GLI
ACCESSORI, I RELATIVI REAGENTI E MATERIALI DI CONSUMO NECESSARI NONCHE’
IL SERVIZIO DI ASSISTENZA TECNICA ATTO A GARANTIRE LA FUNZIONALITA’ DEL
SISTEMA STESSO.
Atti 1446/2005 – all. 1
Articolo 1
-
oggetto del capitolato
Articolo 2
-
sistema oggetto della fornitura
Articolo 3
-
durata del contratto
Articolo 4
-
carichi di lavoro
Articolo 5
-
offerta
Articolo 6
-
aggiudicazione e validazione del Sistema
Articolo 7
-
modalità di consegna delle apparecchiature e dei reagenti
Articolo 8
-
eventuali aggiornamenti tecnologici
Articolo 9
-
norme di sicurezza
Articolo 10
-
controlli/vizi sulle forniture
Articolo 11
-
garanzie
Articolo 12
-
penalità/risoluzione contrattuale
Articolo 13
-
cauzione definitiva
Articolo 14
-
pagamento fatture
Articolo 15
-
controversie
2
Articolo 1) Oggetto del capitolato
Il presente capitolato ha per oggetto la fornitura, in “Service”, di 9 Sistemi diagnostici per
Virologia (markers sierologici epatite A, B, C, HIV, Antitreponema - Immunoblot HCV/HIV HCV RNA qualitativo - HCV RNA quantitativo - HBV DNA quantitativo - HIV RNA
quantitativo - HCV genotipo - HIV genotipo di resistenza - estrattore automatico DNA/RNA)
d'ora in poi denominati Sistemi, da utilizzarsi presso il Dipartimento di Laboratorio di questo
Ente. Tali Sistemi comprendono l'acquisizione degli analizzatori unitamente agli accessori, da
installarsi a cura della ditta aggiudicataria, i relativi reagenti (compresi i reagenti ausiliari),
calibratore/i, materiali di controllo, sieri per controllo di qualità interno, diluenti, materiali di
consumo, acqua, materiale di cancelleria necessari, nonché il servizio di assistenza tecnica atto
a garantire la funzionalità del Sistema stesso.
I Sistemi, nella vigenza del contratto, dovranno essere conformi alle prescrizioni imposte dalla
legislazione in vigore in Italia e dal presente capitolato.
Articolo 2) Sistemi oggetto della fornitura
La fornitura, suddivisa in 9 lotti, ha per oggetto 9 Sistemi le cui caratteristiche devono
rispondere alle esigenze del Laboratorio, descritte negli allegati sotto elencati:
Analizzatori
Reagenti/carichi di lavoro
All. A.0, A.1 (lotti 1-9)
All. B.0 (lotti 1-9)
Ogni Sistema deve comprendere:
2.1 analizzatori, di ultima generazione e di nuova produzione, unitamente agli accessori
necessari al buon funzionamento degli stessi, compresi i gruppi di continuità che
garantiscano l’operatività per almeno 30 minuti; tali analizzatori dovranno rispondere alle
specifiche indicate negli allegati A.0 e A.1, di ciascun lotto.
2.2 il servizio di assistenza, che deve assicurare:
installazione del Sistema e successiva disinstallazione a fine periodo contrattuale o di
prova se la stessa risultasse negativa;
manutenzione preventiva e di emergenza, coperte da contratto full risk, escluse le
manutenzioni routinarie periodiche e giornaliere che verranno effettuate dal Laboratorio,
come previsto dai manuali d’uso, che dovranno essere redatti in lingua italiana;
aggiornamenti gratuiti di programma e/o di analizzatori;
calibrazione periodica degli analizzatori e/o accessori del Sistema, con rilascio delle
relative attestazioni (norme ISO 9001:2000 o equivalente), effettuata in coincidenza con la
manutenzione preventiva e/o in occasione di interventi sulle parti critiche del Sistema;
eventuali consultazioni telefoniche con tempo massimo di risposta alla chiamata non
superiore all’ora. Nel caso di malfunzionamento degli analizzatori o accessori, l’intervento
del personale di assistenza deve essere effettuato entro 24 (ventiquattro) ore lavorative
dalla segnalazione, dal lunedì al sabato compreso. Ove il guasto non sia riparato entro 24
(ventiquattro) ore lavorative dalla chiamata, dovranno essere immediatamente assicurate,
senza aggravio economico, soluzioni alternative, da concordare con il Responsabile del
Laboratorio, per consentire lo svolgimento dell’attività del Laboratorio stesso;
corso di addestramento all’uso del Sistema per almeno 6 persone, da effettuare con
modalità e tempi da concordare con il Responsabile del Laboratorio di Analisi Chimico
Cliniche e Microbiologia.
3
2.3 fornitura di reagenti (compresi i reagenti ausiliari), calibratore/i, diluenti, materiali di
controllo, sieri per Controllo di Qualità interno (Ditta indicata dal
Laboratorio),materiali di consumo, acqua distillata e materiale di cancelleria occorrenti
per l’effettuazione delle determinazioni analitiche secondo le specifiche indicate
nell'allegato B.0 di ciascun lotto.
2.4 La ditta dovrà presentare:
solo per il lotto 1, due offerte economiche, relative a diverse ipotesi operative:
A) un sistema atto ad eseguire il completo carico di lavoro in una unica sede;
B) due sistemi atti ad eseguire il completo carico di lavoro in due sedi distinte
(Padiglione Bosisio del P.O. Ospedale Maggiore Policlinico – via F. Sforza
35, Milano e Padiglione Devoto del P.O. Commenda-Regina Elena – via
Commenda 9, Milano).
In caso di aggiudicazione di tipo B, l’Ente si riserva la prerogativa, quando fosse
raggiunto il consolidamento, di chiedere il ritiro della strumentazione in eccesso
ed uno sconto di almeno il 10%.
per i restanti lotti l’offerta dovrà essere formulata come alla lettera A.
Articolo 3) Durata del contratto
Il contratto avrà la durata di 1096 (millenovantasei) giorni, pari a 3 anni, con possibilità di
proroga per un periodo massimo di 180 (centottanta) giorni, pari a sei mesi, alle medesime
condizioni contrattuali.
La data di decorrenza del contratto sarà stabilita nella delibera di aggiudicazione definitiva,
verosimilmente entro 60 (sessanta) giorni dalla data di validazione del Sistema, come previsto
dal successivo art. 6.
L’amministrazione si riserva la facoltà di procedere al rinnovo contrattuale per un periodo che
non potrà eccedere i tre anni, in ogni caso previa verifica della disponibilità della ditta
aggiudicataria, secondo le norme vigenti in materia.
Articolo 4) Carichi di lavoro
I carichi di lavoro annuali di ciascun sistema, suddivisi per tipologia di esame ed elencati
nell'allegato B.0 di ciascun lotto, sono puramente indicativi e potranno subire variazioni in più
o in meno nel corso della fornitura senza che la ditta aggiudicataria possa sollevare eccezioni di
sorta.
I carichi di lavoro per ogni analita comprendono anche il numero di determinazioni/anno
relative ai materiali di controllo.
Nel computo dei quantitativi in parola non è conteggiato il numero di determinazioni relative
alle calibrazioni in quanto strettamente vincolate alle caratteristiche del Sistema proposto per
cui il relativo reagente dovrà essere fornito a titolo gratuito.
Articolo 5) Offerta
Le ditte concorrenti dovranno presentare distinte offerte, tecnica ed economica, entrambe in
busta chiusa, firmate sui lembi di chiusura con indicato sulle medesime rispettivamente
“Offerta tecnica” e “Offerta economica”. Una terza busta dovrà contenere la documentazione
amministrativa richiesta nel bando e nel disciplinare di gara. Sulla busta in parola dovrà essere
indicato “Documentazione amministrativa”. Le tre buste dovranno essere contenute in un unico
plico sul quale dovrà essere indicata, oltre alla ragione sociale della ditta, la scritta
“PUBBLICO INCANTO PER LA FORNITURA IN “SERVICE” DI 9 SISTEMI
DIAGNOSTICI PER VIROLOGIA”.
4
5.1 Offerta tecnica
L’offerta tecnica, sottoscritta dal legale rappresentante, dovrà essere completa, per ciascun
lotto, di tutta la documentazione richiesta nel presente capitolato e dovrà indicare quanto di
seguito specificato:
5.1.1 per gli analizzatori e accessori dei medesimi:
numero e tipo di analizzatori e relativi accessori che le ditte offerenti intendono installare,
allegando il relativo materiale descrittivo; dovranno essere forniti analizzatori ed accessori
nuovi, corrispondenti all’ultimo modello e versione immessi sul mercato; dovrà inoltre
risultare il loro utilizzo positivo, per la determinazione degli analiti richiesti, presso altre
strutture sanitarie. Per quanto sopra dovrà essere fornita la relativa documentazione;
caratteristiche tecniche, funzionali e potenzialità degli analizzatori offerti, che dovranno
essere conformi alle specifiche degli allegati A.0 e A.1 di ciascun lotto, fermo restando la
compilazione della corrispondente scheda tecnica riassuntiva identificata all'allegato A.3 di
ciascun lotto;
gamma completa degli esami che il Sistema proposto è in grado di effettuare, oltre a quelli
indicati nell'allegato B.0 di ciascun lotto, che devono essere comunque garantiti alla data di
presentazione dell’offerta;
tempi tecnici necessari per eventuali opere o altri interventi essenziali per l’installazione
(opere edili, elettriche, idrauliche o quant’altro la ditta ritenga indispensabile per il buon
funzionamento del Sistema, previa visione dei locali destinati all’installazione). La Ditta
dovrà farsi rilasciare certificazione di avvenuto sopralluogo e presa visione a firma del
Responsabile del Settore Ingegneria Clinica, da allegare all’offerta tecnica. Tali opere, a
carico della ditta aggiudicataria, dovranno essere preventivamente concordate con il
Responsabile del Laboratorio che si attiverà per le relative autorizzazioni da parte della
Direzione Sanitaria, del Settore Ingegneria Clinica e del Servizio Prevenzione e Protezione
dell’Ente.
5.1.2 per il servizio di assistenza:
sede, numero di telefono, fax ed indirizzo e-mail cui rivolgersi, numero dei tecnici addetti
al servizio e nominativo del referente responsabile del servizio stesso;
elenco di tutti i pezzi di ricambio che verranno forniti per il corretto svolgimento della
manutenzione ordinaria a carico del Laboratorio;
impegno ad organizzare il corso di addestramento come indicato all’ultimo paragrafo del
punto 2.2;
che gli oneri derivanti dall’eventuale collegamento tra il Sistema e la Sede del Servizio di
manutenzione saranno a carico della Ditta aggiudicataria.
5.1.3 per i reagenti:
che le caratteristiche tecniche sono conformi alle specifiche dell'allegato B.0 di ciascun
lotto, fermo restando la compilazione della corrispondente scheda tecnica riassuntiva
identificata all'allegato B.1 di ciascun lotto.
Nel determinare la quantità di confezioni necessarie per effettuare il numero stimato di
test/anno, di cui alle predette schede riassuntive, dovranno essere considerati:
il rendimento effettivo, e non teorico, di ciascun kit, eliminando quindi eventuali
dispersioni imputabili alla strutturazione funzionale del Sistema proposto;
la stabilità dei reattivi a bordo dello strumento, tenendo conto dei carichi di lavoro
previsti per ogni singolo analita e frequenza di esecuzione;
elenco e quantitativi dei reagenti, per ciascun analita, necessari per l’effettuazione delle
calibrazioni che saranno forniti a titolo gratuito.
5
per ciascun prodotto proposto dovranno essere allegate all’offerta la metodica, la scheda
tecnica in lingua italiana e la scheda informativa in materia di sicurezza, come previsto dal
DM 7/9/2002.
5.1.4 per i prodotti/materiali complementari e calibratori, sieri per CQI:
elenco dei prodotti/materiali complementari, CQI, unitamente ai quantitativi dei medesimi
necessari per l’effettuazione delle determinazioni stimate che saranno forniti a titolo
gratuito, quali reagenti ausiliari, calibratore/i, diluenti, materiali di controllo, sieri per CQI
e materiali di consumo indicati nell’allegato B.0 di ciascun lotto;
gli adeguati quantitativi di acqua necessari per l’effettuazione delle determinazioni stimate
che saranno forniti a titolo gratuito; si precisa che l’acqua dovrà essere qualitativamente
idonea, dal punto di vista chimico fisico e batteriologico, all'esecuzione delle
determinazioni analitiche richieste; tale fornitura potrà avvenire o tramite apposito sistema
di trattamento collegabile alla rete idrica del Laboratorio oppure in contenitori idonei
(preferibilmente in materiale plastico);
gli adeguati quantitativi del materiale di consumo per la/e stampante/i (toner/cartuccia); si
precisa che le stampe regolarmente effettuate sono quelle relative a: riepiloghi giornalieri
dei risultati dei pazienti, dati di calibrazione, risultati giornalieri del controllo interno di
qualità e relativi elaborati mensili.
5.1.5 per gli aspetti qualitativi
dichiarazione di impegno a mantenere, per tutta la durata del contratto, livelli qualitativi del
Sistema sovrapponibili a quelli riscontrati nella fase di validazione.
5.2
Offerta economica
L’offerta economica dovrà indicare tra l’altro quanto di seguito specificato:
5.2.1 per gli analizzatori:
a solo scopo conoscitivo il valore commerciale degli analizzatori ed accessori offerti.
5.2.2 per ciascuna tipologia di determinazione
nome commerciale del kit/reagente, il relativo numero di codice catalogo, il numero dei
pezzi per confezione proposta con il numero (quantità) di determinazioni effettuabili con la
medesima confezione;
quantità di confezioni necessarie, che dovranno corrispondere a quanto indicato nella
scheda All.B.1 di ciascun lotto, per la realizzazione del numero di determinazioni previste
in ragione d’anno nell'allegato B.0 di ciascun lotto;
prezzo di ciascuna confezione;
importo totale di spesa.
5.2.3 per il lotto:
totale complessivo di spesa del Sistema.
I dati di cui ai precedenti punti 5.2.1, 5.2.2 e 5.2.3 dovranno essere forniti con le modalità
indicate nello schema/guida All. D al presente capitolato speciale.
I prezzi offerti, fissati al momento dell’aggiudicazione, resteranno fissi ed invariati per
l’intero periodo della fornitura. Tali prezzi si intendono onnicomprensivi degli
analizzatori, accessori complementari, assistenza tecnica, reagenti (compresi i reagenti
ausiliari), calibratore/i (compresi i relativi reagenti), diluenti, materiali di controllo,
materiali di consumo, acqua, materiale di cancelleria oltre ad eventuali altri oneri di
spesa, I.V.A. esclusa.
6
Articolo 6) Aggiudicazione e validazione del Sistema
6.1
aggiudicazione provvisoria
L’aggiudicazione sarà effettuata, in via provvisoria, a favore della ditta che avrà
presentato l’offerta economicamente più vantaggiosa, previa valutazione e verifica
della documentazione/offerta tecnica, per accertare positivamente la rispondenza di
quanto proposto rispetto a quanto richiesto agli allegati A.0, A.1 e B.0 di ciascun lotto e
l'attribuzione del punteggio di cui all'allegato A.2 di ciascun lotto per le caratteristiche
qualitative.
6.2 aggiudicazione definitiva
Per esigenze di salvaguardia della continuità, qualità ed affidabilità dell’attività del
Laboratorio, l’aggiudicazione definitiva sarà subordinata all’esito positivo di un
periodo di prova, necessario per la validazione del Sistema, da eseguire “in parallelo”
all’utilizzo delle procedure esistenti, della durata di 60 (sessanta) giorni come termine
massimo, dalla data del collaudo tecnico delle apparecchiature ed accessori componenti
il Sistema.
L’aggiudicazione definitiva sarà effettuata verosimilmente entro 60 (sessanta) giorni
dalla data di validazione funzionale del Sistema.
6.3 validazione funzionale del Sistema
Per la validazione l’Ente, tramite il Servizio farmaceutico e/o il Laboratorio, si riserva
la facoltà si richiedere elementi integrativi circa i contenuti tecnici del Sistema, fino a
conseguire la perfetta conoscenza e la corretta interpretazione di quanto proposto dalla
ditta concorrente.
Le modalità di validazione del Sistema ed il numero di determinazioni previsto per ogni
analita sono indicati nell'allegato C di ciascun lotto.
La ditta dovrà fornire per ciascun lotto, a titolo gratuito, tutto l’occorrente: reagenti
(compresi i reagenti ausiliari), calibratore/i, materiali di controllo per gli analiti indicati
al punto 5.1.4, diluenti, materiale di consumo, acqua e materiale di cancelleria pari al
quantitativo stimato per l’esecuzione, per ogni analita, dello specifico numero di
determinazioni previste. Il Servizio farmaceutico potrà richiedere, qualora risultasse
indispensabile per il completamento della prova, un ulteriore quantitativo comunque
non superiore al 50% (cinquanta per cento) del precedente che dovrà essere fornito
senza alcun costo per l’Ente.
A fronte della validazione da farsi a cura del Laboratorio, di concerto con il Servizio
farmaceutico per quanto di rispettiva competenza, in contraddittorio con un
rappresentante qualificato della ditta, dovrà essere sottoscritto apposito verbale
predisposto dal Laboratorio.
Dopo la validazione del Sistema e fino alla data di decorrenza del contratto le
apparecchiature, compresi gli accessori, resteranno presso il Laboratorio e saranno
considerate “in prova” per cui la ditta aggiudicataria dovrà fornire tutto il materiale
occorrente, nonché l’assistenza tecnica, alle condizioni ed ai prezzi di cui all’offerta,
per un importo di spesa limite di 2/12 della globale spesa annua.
Qualora l’esito della validazione risultasse negativo, ovvero non dovesse confermare le
prestazioni richieste, la ditta dovrà provvedere a sue spese alla disinstallazione del
Sistema, entro 20 giorni massimo dalla data di comunicazione dell’esito, previo
7
accordo con il Settore Ingegneria Clinica. Conseguentemente, con analoga procedura,
si provvederà a favore della seconda ditta migliore offerente in graduatoria.
Articolo 7) Modalità di consegna delle apparecchiature e dei reagenti
7.1 modalità di consegna, installazione, collaudo e ritiro al termine del contratto
La Ditta che avrà proposto l’offerta economicamente più vantaggiosa entro 30 (trenta)
giorni dalla data della richiesta/ordine, dovrà consegnare, a proprie spese e rischio, le
apparecchiature e gli accessori componenti ciascun Sistema oggetto della presente gara,
presso le sedi indicate all’articolo 2.4, previo accordo con il Settore Ingegneria Clinica.
La Ditta si farà carico dell’onere del trasporto dell’analizzatore, della sua installazione,
della rimozione e trasporto alla discarica dei relativi imballaggi.
Entro 15 (quindici) giorni dalla consegna la Ditta dovrà effettuare, su richiesta del
Servizio Ingegneria Clinica, preventivamente concordata con il Servizio di Prevenzione
e Protezione, unitamente al Laboratorio, per quanto di loro competenza, tutte le
operazioni di messa in funzione e di collaudo tecnico delle apparecchiature e accessori
per il quale dovrà essere sottoscritto apposito verbale predisposto dal Settore
Ingegneria Clinica.
A collaudo eseguito e superate positivamente le relative prove di validazione del
Sistema, lo stesso sarà considerato idoneo a tutti gli effetti e verrà confermata
formalmente l’aggiudicazione definitiva.
Al termine del contratto, la Ditta aggiudicataria dovrà provvedere, a sue spese, alla
disinstallazione del Sistema ed al suo ritiro entro 20 (venti) giorni massimo dalla
richiesta del Settore Ingegneria Clinica.
7.2 modalità di consegna di reagenti e materiale di consumo
La Ditta aggiudicataria dovrà effettuare le consegne franco magazzini del Servizio
Farmaceutico sito in Commenda, 9 - Milano - dal lunedì al giovedì, dalle ore 8,30 alle
ore 15,30 ed al venerdì dalle ore 8,30 alle ore 12,30.
La merce dovrà essere consegnata a seguito dell’emissione di regolare ordine da parte
del Servizio Farmaceutico, nelle quantità e qualità descritte nell’ordine stesso,
frazionamento ove richiesto, entro sette giorni dalla data di trasmissione dell’ordine.
Eventuali richieste di consegna urgente, che saranno trasmesse “via fax”, dovranno
essere evase entro 24 (ventiquattro) ore lavorative dalla trasmissione.
Qualora ciò non fosse possibile, il fornitore provvederà a darne tempestiva
comunicazione al Servizio Farmaceutico, il quale potrà concordare la consegna di
almeno un acconto, in attesa della consegna del saldo.
Al momento della consegna, i prodotti dovranno avere una validità residua di almeno 3
(tre) mesi.
Ogni confezione di ciascun prodotto dovrà contenere, redatte in lingua italiana, le
istruzioni circa la modalità di utilizzo, di conservazione e le indicazioni circa la
stabilità del materiale.
I documenti di trasporto devono obbligatoriamente indicare tra l’altro: data e numero di
ordine emesso dal Servizio Farmaceutico, il numero del lotto di produzione dei singoli
prodotti, ove previsto e quant’altro indicato dalle norme della legislazione vigente. Nel
medesimo documento, ovvero in apposita scheda allegata allo stesso, dovranno essere
specificati obbligatoriamente, oltre ai numeri dei lotti di produzione, la data di
scadenza dei medesimi, nonché il numero di confezioni per ogni lotto.
La Ditta deve garantire che vengano rigorosamente osservate le idonee modalità di
conservazione dei materiali anche durante la fase di trasporto.
8
Con la prima consegna dei reagenti, ove previsto, la Ditta dovrà rassegnare al Servizio
Farmaceutico la scheda di sicurezza (in triplice copia ed in lingua italiana) e curare
l’aggiornamento della medesima durante tutta la fornitura.
L’aggiudicataria si impegna, in caso di dismissione, a qualsiasi titolo, degli analizzatori
installati presso il Laboratorio, a ritirare le confezioni fornite e non ancora utilizzate,
per le quali dovrà essere emessa nota di accredito.
Articolo 8) Eventuali aggiornamenti tecnologici
Eventuali variazioni nelle caratteristiche del Sistema (strumentazione, reagenti o kit
diagnostici, materiali di consumo) che dovessero intervenire nel periodo di validità del
contratto, dovranno essere approvate dal Responsabile del Laboratorio di concerto con i
Responsabili del Settore Ingegneria Clinica, del Servizio Prevenzione e Protezione e del
Servizio Farmaceutico, per quanto di rispettiva competenza e non comportare costi
aggiuntivi.
La Ditta potrà proporre, ferme restando le condizioni stabilite nella gara e nel punto
precedente, nuovi kit, analizzatori ed accessori analoghi a quelli oggetto della fornitura, che
presentino migliori caratteristiche di rendimento e funzionalità.
In caso di obsolescenza dei test o metodiche per documentati motivi scientifici, bioetici o
legislativi, l’Ente tramite il Responsabile del Laboratorio, potrà richiedere alla Ditta i
necessari conseguenti adeguamenti.
La Ditta aggiudicataria si impegna a fornire, ove previsto, ulteriori analiti dosabili sul
Sistema oggetto della presente gara, su richiesta dell’Ente.
Articolo 9) Norme di sicurezza
Gli apparecchi, unitamente agli accessori, dovranno essere conformi alle norme nazionali
nonché alle normative UE in vigore all’atto della consegna e mantenute per tutta la durata della
fornitura, ancorché emanate successivamente alla formulazione dell’offerta.
Il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori,
onde garantire la sicurezza degli operatori e dell’ambiente.
I prodotti forniti dovranno essere rispondenti alla disciplina nazionale e alle normative UE
comunque applicabili in materia di tutela del lavoro e di tutela dell’ambiente.
La fornitura dei reagenti dovrà essere accompagnata dalla Scheda Informativa in materia di
sicurezza come previsto da DM 7 settembre 2002.
Articolo 10) Controlli/vizi sulle forniture
L’accettazione della merce, da parte del Servizio Farmaceutico, non solleva il fornitore dalle
responsabilità delle proprie obbligazioni in ordine a difetti od imperfezioni, a vizi apparenti ed
occulti della merce consegnata, non potuti rilevare al momento della consegna, ma accertati in
seguito.
Il fornitore per le singole consegne dichiarate non accettabili dovrà procedere, su
comunicazione del Servizio Farmaceutico all’immediato ritiro della merce anche se tolta
dall’imballaggio originario e sostituirla, entro 24 (ventiquattro) ore lavorative, con altra della
qualità prescritta. Nel caso in cui il fornitore non proceda alla tempestiva sostituzione, la merce
rimarrà a disposizione del fornitore, senza alcuna responsabilità da parte dell’Ente per eventuali
degradamenti o deprezzamenti che la merce dovesse subire. Decorsi 20 giorni la merce potrà
essere smaltita ai sensi di legge ed il costo dello smaltimento sarà addebitato alla Ditta.
9
Per assicurare la continuità dell’attività del Laboratorio, L’Ente, tramite il Servizio
Farmaceutico di concerto con il Laboratorio stesso, si riserva il diritto di acquistare presso altre
Ditte/Strutture sanitarie i prodotti ovvero le prestazioni occorrenti in danno del fornitore
inadempiente. Resterà a carico dell’Azienda inadempiente la differenza per l’eventuale maggior
prezzo sostenuto dall’Ente rispetto a quello convenuto in gara, ovvero il costo totale della
prestazione nell’ipotesi in cui quest’ultima venga acquistata presso altra Struttura sanitaria,
oltre ad ogni altro maggiore onere o danno comunque derivante all’Ente a causa
dell’inadempienza.
Articolo 11) Garanzie
La Ditta aggiudicataria si impegna a stipulare, in un primo tempo, con decorrenza dalla data di
consegna del sistema e per la durata del periodo di prova e poi per tutta la durata del periodo
contrattuale, copertura assicurativa con un massimale annuo complessivo di almeno
€ 1.500.000,00 e, per singolo sinistro, non inferiore a € 500.000,00 per tutti i danni a persone o
cose che potessero derivare dall’uso del Sistema.
Copia della polizza assicurativa dovrà essere trasmessa all’U.O. Approvvigionamenti entro 15
(quindici) giorni dalla comunicazione dell’aggiudicazione provvisoria e successivamente entro
15 (quindici) giorni dalla comunicazione dell’aggiudicazione definitiva.
L’Ente non si ritiene comunque responsabile per danni derivanti da atti vandalici ecc. che
dovessero danneggiare il Sistema, per i quali la Ditta aggiudicataria potrà comunque stipulare
polizza assicurativa.
Resta fermo quanto previsto per il furto per il quale comunque la Ditta manleva da ogni
responsabilità l’Ente.
Articolo 12) Penalità/risoluzione contrattuale
Ogni contestazione circa eventuali inadempienze da parte della Ditta aggiudicataria in ordine
alla esecuzione dell’appalto verrà dall’Ente formalizzata, su segnalazione scritta del Servizio
Farmaceutico o del Settore Ingegneria Clinica o del Laboratorio, secondo la rispettiva
competenza in ordine all’inadempienza, con nota in cui potrà essere concesso termine per
controdedurre.
Qualora le eventuali giustificazioni addotte dalla Ditta non fossero ritenute accettabili
dall’Ente, quest’ultimo, a suo insindacabile giudizio, potrà sanzionare l’inadempienza con una
penalità da un minimo di € 500,00 ad un massimo di € 10.000,00 IVA esente, ai sensi
dell’art. 15 DPR 633/72.
La compensazione della penalità sarà effettuata mediante trattenuta sul primo pagamento, a
favore della Ditta, successivo alla data della comminazione della sanzione.
L’Ente si riserva la facoltà di risolvere il contratto, dopo che siano state formalizzate n. 3
contestazioni, fatto salvo comunque il diritto al risarcimento del danno a favore della
Fondazione IRCCS Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena.
Con la risoluzione del contratto l’Ente incamererà la cauzione approvvigionandosi quindi
presso altri fornitori in danno dell’aggiudicatario.
Articolo 13) Cauzione definitiva
La Ditta aggiudicataria dovrà procedere alla costituzione del deposito cauzionale nella misura
del 5%(cinque percento) dell’importo netto di aggiudicazione (calcolato sul triennio).
Il deposito cauzionale dovrà essere costituito secondo le seguenti modalità:
in contanti;
in Titoli di Stato o garantiti dallo Stato con l’aumento del 10% per lo scarto d’uso;
10
mediante fideiussione bancaria;
mediante polizza assicurativa rilasciata da imprese di assicurazione regolarmente
autorizzate all’esercizio del ramo cauzioni.
La durata del deposito cauzionale non può essere inferiore a tre anni a far tempo dalla data di
aggiudicazione della fornitura.
Il deposito costituito in contanti, in Titoli di Stato o garantiti dallo stato dovrà essere effettuato
presso il tesoriere dell’Ente Banca Regionale Europea, sportello di Via Francesco Sforza, 35,
Milano, oppure presso qualsiasi altro Istituto abilitato all’esercizio del credito, purché lo stesso
si impegni incondizionatamente, su semplice richiesta di questo Ente, a versare quanto ricevuto
al tesoriere.
Tale impegno dovrà risultare da dichiarazione rilasciata dall’istituto di credito.
Per il deposito costituito in contanti, presso il Tesoriere dell’Ente, verrà istituito un libretto di
risparmio al portatore: gli interessi che matureranno sul medesimo saranno di spettanza della
ditta fornitrice.
Nel caso di deposito prestato in Titoli, gli importi delle cedole maturate competono al
prestatore della cauzione.
Il deposito cauzionale costituito tramite fideiussione bancaria o polizza assicurativa dovrà
prevedere espressamente la rinuncia al beneficio della preventiva escussione del debitore
principale e la sua operatività entro quindici giorni a semplice richiesta scritta
dell’Amministrazione.
Articolo 14) Pagamento fatture
Le fatture emesse dovranno essere rassegnate alla Fondazione IRCCS Ospedale Maggiore
Policlinico, Mangiagalli e Regina Elena - Via F. Sforza, 28 - Milano.
Il pagamento, a mezzo mandato, sarà effettuato a 90 gg. dalla data ricevimento fattura. In caso
di ritardato pagamento saranno riconosciuti gli interessi secondo quanto indicato dall’art. 1284,
C.1 del codice civile, con decorrenza dal novantesimo giorno dalla data prevista per il
pagamento della fattura.
Articolo 15) Controversie
Per ogni controversia inerente sia lo svolgimento della gara sia la stipulazione e l’esecuzione
del conseguente contratto, il Foro competente è esclusivamente quello di Milano.
Allegati
Gli allegati A.0), A.1), A.2), A.3), B.0), B.1), C), D) di ciascun lotto, costituiscono parte
integrante del presente capitolato.
11
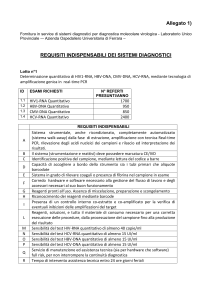
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire tutti i test immunochimici indicati nell'allegato B.0,
attualmente eseguiti dal laboratorio, in chemiluminescenza, CMIA, MEIA, mediante analizzatori
completamente automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
soddisfare la richiesta di refertazioni quotidiane prioritarie e pertanto garantire un idoneo ed
efficace backup;
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema dovrà avere la configurazione di seguito descritta:
a) Sistema con cadenza analitica complessiva non inferiore a 400 test/ora
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere interfacciato con il programma gestionale del Laboratorio; per la realizzazione di tale
interfacciamento il Sistema deve essere corredato di idoneo hardware, le cui specifiche
tecniche dovranno essere richieste alla Società informatica fornitrice del software gestionale
del Laboratorio (Metafora)
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della
qualità.
12
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
completamente automatico
accesso random
caricamento continuo per campioni e consumabili
riconoscimento positivo di campioni e reagenti
utilizzo contemporaneo di tubi primari (5-7-10 ml) e coppette secondarie
gestione campioni urgenti
posizioni per almeno 20 parametri in linea
Tecnologia: MEIA, chemiluminescenza, CMIA, Elettrochemiluminescenza
monitoraggio automatico di reagenti e consumabili
teleassistenza
lettore di codice a barre in grado di leggere almeno i codici: Interleaved 2 di 5, Codice 128,
Codice 39, codabar
Gestione campioni
-
sensore di livello
rilevazione automatica del coagulo/fibrina
possibilità di diluizione automatica,
possibilità di esecuzione di test riflessi
assenza di carry-over tra campioni
Gestione reagenti
-
marcati CE
reagenti pronti all’uso in confezione di almeno 100 test
comparto dei reagenti a temperatura controllata
Calibrazione
-
calibrazione mediante Curva Standard/ Master
memorizzazione di 3 o più curve di calibrazione
durata minima 15 giorni
Gestione controlli
-
gestione automatica del Controllo di Qualità Interno (CQI) con elaborazione statistica e
grafica dei dati in tempo reale
valutazione dei risultati dei controlli mediante le regole di Westgard
esportazione file dei controlli
13
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori per
scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Collegamento con Host Computer del Laboratorio
-
il Sistema dovrà essere completo di moduli di interfacciamento bidirezionale per il collegamento con il
Sistema di gestione informatizzato, installato presso il laboratorio (“Concerto” della società Metafora)
-
la ditta dovrà altresì farsi carico del software necessario per rendere operativo tale
interfacciamento
le modalità dell’interfacciamento dovranno tenere conto delle esigenze operative del Laboratorio
e dovranno pertanto essere concordate con il Responsabile del laboratorio
ogni analizzatore deve essere in grado di leggere il bar-code del campione, richiedere e ricevere
la programmazione delle richieste in tempo reale e trasmettere i risultati delle analisi, sia in
modalità real-time che in batch, contemporaneamente ai cicli operativi e su richiesta
dell’operatore
per i moduli di interfacciamento devono essere presi accordi con la Società che gestisce
l’informatizzazione del Laboratorio
-
-
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del Settore
Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione
1. la diffusione sul mercato nazionale e internazionale in enti di uguale rilevanza clinicoscientifica
2. rappresentatività e grado di eccellenza dei risultati ottenuti nel programma del Controllo di
Qualità esterno della Regione Lombardia.
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
14
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Cadenza analitica dell’analizzatore
Tempo uscita primo risultato
Durata delle curve di calibrazione.
Più curve di calibrazione memorizzabili
Possibilità di eseguire tutti gli analiti richiesti su di un unico analizzatore
PUNTI 16
CARATTERISTICHE ANALITICHE
Confezione e stabilità dei reagenti, pronti all’uso , compresi calibratori e controlli
Possibilità di dosaggio quantitativo di HbsAg
Possibilità di rilevare diversi determinanti antigenici o epitopi (mutanti) di HBsAg
PUNTI 14
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Referenze tecnico-scientifiche e know-how della Ditta medesima
Rappresentatività e grado di eccellenza dei risultati ottenuti nel programma del
Controllo di Qualità esterno della Regione Lombardia
PUNTI 20
15
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Disponibilità di tutti gli analiti richiesti nell’allegato B.0
si no
Tecnologia
___________________________________
Configurazione del Sistema
___________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Cadenza analitica complessiva (test/ora)
n°_____________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
16
Caratteristiche analizzatore:
Livello di automazione:
-
completamente automatico
si no
-
accesso random
si no
-
caricamento continuo per campioni
si no
-
caricamento continuo per consumabili
si no
-
riconoscimento positivo dei campioni
si no
-
riconoscimento positivo dei reagenti
si no
-
utilizzo contemporaneo di tubi primari ( 5-7-10 ml )
e coppette secondarie
si no
-
possibilità di dosaggi urgenti
si no
-
n° parametri in linea
-
monitoraggio reagenti e consumabili
-
codici a barre leggibili
n.____________
si no
____________________________
Gestione Campioni
-
sensore di livello
si no
-
rilevazione automatica coagulo/fibrina
si no
-
diluizione automatica
si no
-
test riflessi
si no
-
carry over fra campioni
si no
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
-
comparto dei reagenti a temperatura controllata
si no
17
Calibrazione
-
calibrazione mediante Curva Standard/ Master
si no
-
memorizzazione di 3 o più curve di calibrazione
si no
-
durata minima 15 giorni
si no
Gestione Controlli
-
elaborazione statistica e grafica in tempo reale
si no
-
valutazione con regole di Westgard
si no
-
esportazione file dei controlli
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Collegamento con Host Computer
-
fornitura moduli di interfacciamento bidirezionale con “Concerto”
si no
-
fornitura di un software necessario per rendere operativo
l’interfacciamento
si no
capacità di richiesta e ricezione delle richieste e trasmissione dei
risultati:
in modalità real-time
in modalità batch
in contemporanea ai cicli operativi
su richiesta dell’operatore
si
si
si
si
-
no
no
no
no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
18
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analiti richiesti: HBsAg, AntiHBs, AntiHBc, AntiHBc IgM, HBeAg, AntiHbe, AntiHAV,
AntiHAV IgM, AntiHIV, Anti Treponema Pallidum
Frequenza di esecuzione: quotidiana (lunedì-sabato)
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
HBsAg
Sensibilità analitica:< 0.05 UI/ml
Specificità clinica: >99%
Carico di lavoro: 77000 test/anno
L’azienda deve essere contemplata per il test in oggetto nella valutazione esterna della regione
Lombardia e ISS
AntiHBs
Sensibilità analitica: standard di riferimento OMS 1:100000
Specificità clinica: >95%
Carico di lavoro: 20000 test/anno
L’azienda deve essere contemplata per il test in oggetto nella valutazione esterna della regione
Lombardia e ISS
AntiHBc
Sensibilità analitica:<0.6 PEI/ml
Specificità clinica: >99%
Carico di lavoro: 13000 test/anno
AntiHBc IgM
Sensibilità analitica: <4PEI/ml
Specificità: >99%
Doppio cut-off in grado di rilevare infezioni acute e riattivazioni di patologia cronica
Carico di lavoro: 4500 test/anno
HBeAg
Sensibilità analitica: <0.5 PEI/ml
Specificità clinica: >99%
Carico di lavoro: 3000 test/anno
19
AntiHBe
Sensibilità analitica: <0.45 PEI/ml
Specificità clinica: >99%
Carico di lavoro: 5000 test/anno
AntiHAV
Sensibilità analitica: >99%
Specificità clinica: >99%
Carico di lavoro:4000 test/anno
AntiHAV IgM
Sensibilità analitica: >99%
Specificità clinica: >99%
Carico di lavoro: 800 test/anno
AntiHIV
Terza generazione
Reagenti HIV 1 /2 rilevanti gruppo M/ 0 / Ag. p.24
Sensibilità analitica: >99%
Specificità clinica: >99%
Carico di lavoro: 61000 test/anno
L’azienda deve essere contemplata per il test in oggetto nella valutazione esterna della regione
Lombardia e ISS
Anti HCV
Ultima generazione
Sensibilità > 99.5%
Specificità >99%
Carico di lavoro 77000 test/anno
L’azienda deve essere contemplata per il test in oggetto nella valutazione esterna della regione
Lombardia e ISS
Anti Treponema Pallidum
Sensibilità >99.5%
Specificità >99%
Carico di lavoro:45000 test/anno
L’azienda deve essere contemplata per il test in oggetto nella valutazione esterna della regione
Lombardia e ISS
20
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HBsAg
Sensibilità analitica
____________
Specificità clinica:
____________
Azienda contemplata per il test in oggetto nella valutazione
esterna della Regione Lombardia e ISS
si no
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
AntiHBs
Sensibilità analitica
____________
Specificità clinica:
____________
Azienda contemplata per il test in oggetto nella valutazione
esterna della Regione Lombardia e ISS
si no
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
AntiHBc
Sensibilità analitica
____________
Specificità clinica
____________
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
21
AntiHBc IgM
Sensibilità analitica
____________
Specificità
____________
Doppio cut-off
____________
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
HBeAg
Sensibilità analitica
____________
Specificità clinica
____________
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
AntiHBe
Sensibilità analitica
____________
Specificità clinica
____________
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
AntiHAV
Sensibilità analitica
____________
Specificità clinica
____________
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
22
AntiHAV IgM
Sensibilità analitica
____________
Specificità clinica
____________
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
AntiHIV
Generazione
____________
Reagenti rilevanti gruppo M/ 0/ Ag. p.24
____________
Sensibilità analitica
____________
Specificità clinica
____________
Azienda contemplata per il test in oggetto nella valutazione
esterna della Regione Lombardia e ISS
si no
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
Anti HCV
Generazione
_____________
Sensibilità
_____________
Specificità
_____________
Azienda contemplata per il test in oggetto nella valutazione
esterna della Regione Lombardia e ISS
si no
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
23
Anti Treponema Pallidum
Sensibilità analitica
____________
Specificità clinica
____________
Azienda contemplata per il test in oggetto nella valutazione
esterna della Regione Lombardia e ISS
si no
test reali per confezione
n°
____________
test reali per singola tanica/cartuccia
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta ________________________________________
24
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A, EPATITE B,
EPATITE C, HIV, ANTITREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà:
alla verifica del CV % nella serie e interserie per valori pari a circa il doppi del cut-off in
ognuno degli analiti in oggetto (200 dosaggi)
alla verifica dei risultati ottenuti su 50 campioni da pazienti noti in confronto ai test in uso nel
Laboratorio
alla verifica della sensibilità mediante pannelli di sieroconversione e qualificazione (BBI) e
pannelli derivati da diluizioni scalari di materiali noti
alla valutazione della specificità (> 99.5%) nel tempo su almeno 5000 donatori verosimilmente
nell’ambito della validazione funzionale del sistema
25
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI MARKERS EPATITE A,
EPATITE B, EPATITE C, HIV, ANTI TREPONEMA
(Lotto 1)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1)
ANALITA HBsAg
Fabbisogno: 77000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
2)
ANALITA Anti HBs
Fabbisogno: 20000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
3)
ANALITA Anti HBc
Fabbisogno: 13000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
26
4)
ANALITA IgM ANTI HBc
Fabbisogno: 4500 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
5)
ANALITA HBeAg
Fabbisogno: 3000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
6)
ANALITA ANTI HBe
Fabbisogno: 5000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
7)
ANALITA ANTI HAV
Fabbisogno: 4000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
27
8)
ANALITA IgM ANTI HAV
Fabbisogno: 800 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
9)
ANALITA ANTI HIV
Fabbisogno: 61000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
10) ANALITA ANTI HCV
Fabbisogno: 77000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
11) ANALITA ANTI TREPONEMA PALLIDUM
Fabbisogno: 45000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
28
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell'allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della qualità.
29
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di
lavaggio e incubazione
capacità di processare almeno 30 campioni a seduta
assenza di carry-over tra campioni
liberamente programmabile
necessità di minima manutenzione
Gestione reagenti
-
marcati CE
reagenti pronti all’uso
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del Settore
Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
- il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale in
enti di uguale rilevanza clinico- scientifica
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
30
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Liberamente programmabile
Termostato regolabile
Numero di campioni dosabili in una seduta analitica
PUNTI 12
CARATTERISTICHE ANALITICHE
Numero e tipologia di bande HCV
Numero e tipologia di bande HIV
PUNTI 14
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Prodotto riconosciuto e accreditato a livello internazionale
Rappresentatività e grado di eccellenza dei risultati ottenuti nel programma del
Controllo di Qualità esterno della Regione Lombardia
PUNTI 20
31
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
___________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
Cadenza analitica complessiva
n° ___________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
Caratteristiche analizzatore:
Livello di automazione:
Il sistema fornito deve permettere l’esecuzione completamente automatica
delle fasi di lavaggio e incubazione
si no
-
campioni a seduta
__________
-
assenza di carry-over tra campioni
si no
-
liberamente programmabile
si no
-
Necessità di minima manutenzione
-
si no
32
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
33
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HCV immunoblot
Frequenza di esecuzione: settimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Carico di lavoro/campioni anno n.
HCV Immunoblot
600
Analiti richiesti: - HIV1/2 immunoblot
Frequenza di esecuzione: settimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Carico di lavoro/campioni anno n.
HIV 1/2 Immunoblot
100
34
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HCV Immunoblot
test reali per confezione
n°
____________
confezioni offerte
n°
____________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
HIV 1/2 Immunoblot
Firma del legale rappresentante della ditta _______________________________________
35
SISTEMA DIAGNOSTICO PER LA DETERMINAZIONE DI HCV/HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà :
alla verifica dei risultati ottenuti su 50 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
36
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV /HIV Immunoblot
(Lotto 2)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HCV
Immunoblot
Fabbisogno: 600 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
€ __________________
Importo totale di spesa
2) ANALITA HIV 1/2 Immunobolt
Fabbisogno: 100 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
37
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell'allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere interfacciato con il programma gestionale del Laboratorio; per la realizzazione di tale
interfacciamento il Sistema deve essere corredato di idoneo hardware, le cui specifiche tecniche
dovranno essere richieste alla Società informatica fornitrice del software gestionale del
Laboratorio (Metafora)
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della qualità.
38
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di
amplificazione e rivelazione degli acidi nucleici
-
qualora il sistema lo richiedesse deve essere fornito uno strumento per estrazione degli acidi
nucleici completamente automatico
capacità di processare almeno 40 campioni a seduta
assenza di carry-over tra campioni
disponibilità di software dedicato
necessità di minima manutenzione
lettore di codice a barre in grado di leggere almeno i codici: Interleaved 2 di 5, Codice 128,
Codice 39, codabar
-
Gestione reagenti
-
marcati CE
reagenti pronti all’uso
Scarichi
- il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Collegamento con Host Computer del Laboratorio
-
il Sistema dovrà essere completo di moduli di interfacciamento bidirezionale per il collegamento con il
Sistema di gestione informatizzato, installato presso il laboratorio (“Concerto” della società Metafora)
-
la ditta dovrà altresì farsi carico del software necessario per rendere operativo tale
interfacciamento
le modalità dell’interfacciamento dovranno tenere conto delle esigenze operative del Laboratorio
e dovranno pertanto essere concordate con il Responsabile del laboratorio
ogni analizzatore deve essere in grado di leggere il bar-code del campione, richiedere e
ricevere la programmazione delle richieste in tempo reale e trasmettere i risultati delle analisi,
sia in modalità real-time che in batch, contemporaneamente ai cicli operativi e su richiesta
dell’operatore
per i moduli di interfacciamento devono essere presi accordi con la Società che gestisce
l’informatizzazione del Laboratorio
-
-
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del
Settore Ingegneria Clinca dell’Ente e del Responsabile del Laboratorio
39
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale
in enti di uguale rilevanza clinico- scientifica
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
40
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Principio del metodo (PCR,PCR real time, TMA)
Modalità e tempi di preparazione del campione
Descrizione del sistema di controllo della contaminazione
Descrizione del sistema di controllo della inibizione
Tempo di esecuzione del dosaggio
Numero di campioni dosabili in una seduta analitica
PUNTI 20
CARATTERISTICHE ANALITICHE
Sensibilità del metodo
Possibilità di eseguire il genotipo a partire dall’amplificato
PUNTI 10
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Referenze tecnico-scientifiche e know-how della Ditta medesima
Numero degli ambienti necessari per l’esecuzione dei tests
PUNTI 20
41
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
___________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
Cadenza analitica complessiva
n°_____________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
42
Caratteristiche analizzatore
Livello di automazione:
Il sistema fornito deve permettere l’esecuzione completamente automatica
delle fasi di amplificazione e rivelazione degli acidi nucleici
si no
-
strumento per estrazione degli acidi nucleici completamente automatico
si no
-
campioni a seduta
__________
-
disponibilità di software dedicato
si no
-
necessità di minima manutenzione
si no
-
assenza di carry-over tra campioni
si no
-
codici a barre leggibili
si no
-
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Collegamento con Host Computer
-
fornitura moduli di interfacciamento bidirezionale con “Concerto”
si no
-
fornitura di un software necessario per rendere operativo
l’interfacciamento
si no
capacità di richiesta e ricezione delle richieste e trasmissione dei
risultati:
in modalità real-time
in modalità batch
in contemporanea ai cicli operativi
su richiesta dell’operatore
si
si
si
si
-
43
no
no
no
no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
44
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HCV RNA Qualitativo
Frequenza di esecuzione: bisettimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Sensibilità analitica
Carico di lavoro/ campioni anno n.
HCV RNA Qualitativo
< 50 UI/ml
2500
45
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HCV RNA qualitativo
Sensibilità analitica
____________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta
____________________________________
46
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà :
alla verifica del CV % nella serie ed interserie su 50 dosaggi
alla verifica dei risultati ottenuti su 50 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
alla verifica della sensibilità mediante pannelli di sieroconversione e qualificazione (BBI)
47
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Qualitativo
(Lotto 3)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HCV
RNA Qualitativo
Fabbisogno: 2500 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
48
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell'allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere interfacciato con il programma gestionale del Laboratorio; per la realizzazione di tale
interfacciamento il Sistema deve essere corredato di idoneo hardware, le cui specifiche tecniche
dovranno essere richieste alla Società informatica fornitrice del software gestionale del
Laboratorio (Metafora)
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della qualità.
49
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di
amplificazione e rivelazione degli acidi nucleici
-
qualora il sistema lo richiedesse deve essere fornito uno strumento per estrazione degli acidi
nucleici completamente automatico
capacità di processare almeno 40 campioni a seduta
assenza di carry-over tra campioni
disponibilità di software dedicato
necessità di minima manutenzione
lettore di codice a barre in grado di leggere almeno i codici: Interleaved 2 di 5, Codice 128,
Codice 39, codabar
-
Gestione reagenti
-
marcati CE
reagenti pronti all’uso
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Collegamento con Host Computer del Laboratorio
-
il Sistema dovrà essere completo di moduli di interfacciamento bidirezionale per il collegamento con il
Sistema di gestione informatizzato, installato presso il laboratorio (“Concerto” della società Metafora”)
-
la ditta dovrà altresì farsi carico del software necessario per rendere operativo tale
interfacciamento
le modalità dell’interfacciamento dovranno tenere conto delle esigenze operative del Laboratorio
e dovranno pertanto essere concordate con il Responsabile del laboratorio
ogni analizzatore deve essere in grado di leggere il bar-code del campione, richiedere e
ricevere la programmazione delle richieste in tempo reale e trasmettere i risultati delle analisi,
sia in modalità real-time che in batch, contemporaneamente ai cicli operativi e su richiesta
dell’operatore
per i moduli di interfacciamento devono essere presi accordi con la Società che gestisce
l’informatizzazione del Laboratorio
-
-
50
Ingombro
- il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del
Settore Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
- il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale
in enti di uguale rilevanza clinico- scientifica
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
51
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Principio del metodo (PCR real time, bDNA)
Modalità e tempi di preparazione del campione
Descrizione del sistema di controllo della contaminazione
Descrizione del sistema di controllo della inibizione
Numero di campioni dosabili in una seduta analitica
PUNTI 16
CARATTERISTICHE ANALITICHE
Possibilità di quantizzare con la stessa efficienza tutti i principali genotipi
Elevata riproducibilità
PUNTI 14
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato ed internazionale in Enti di uguale rilevanza clinicoscientifica
Referenze tecnico-scientifiche e know-how della Ditta medesima
Numero degli ambienti necessari per l’esecuzione dei tests
PUNTI 20
52
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
__________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Cadenza analitica complessiva
n°___________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
53
Caratteristiche analizzatore:
Livello di automazione:
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di
amplificazione e rivelazione degli acidi nucleici
si no
-
strumento per estrazione degli acidi nucleici completamente automatico
si no
-
campioni a seduta
__________
-
Disponibilità di software dedicato
si no
-
Necessità di minima manutenzione
si no
-
assenza di carry-over tra campioni
si no
-
codici a barre leggibili
si no
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Collegamento con Host Computer
-
fornitura moduli di interfacciamento bidirezionale con “Concerto”
fornitura di un software necessario per rendere operativo
l’interfacciamento
capacità di richiesta e ricezione delle richieste e trasmissione dei
risultati:
in modalità real-time
in modalità batch
in contemporanea ai cicli operativi
su richiesta dell’operatore
54
si no
si no
si
si
si
si
no
no
no
no
Ingombro
-
peso complessivo
Kg ______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg ______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
55
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HCV RNA Quantitativo
Frequenza di esecuzione: settimanale/ bisettimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Sensibilità analitica
Carico di lavoro/campioni anno n.
HCV RNA Quantitativo
650 UI/ml
2100
56
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HCV RNA quantitativo
Sensibilità analitica
____________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta _______________________________
57
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà:
alla verifica del CV % nella serie ed interserie su 50 dosaggi
alla verifica dei risultati ottenuti su 50 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
alla verifica della sensibilità mediante pannelli di sieroconversione e qualificazione (BBI)
58
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV RNA Quantitativo
(Lotto 4)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HCV
RNA Quantitativo
Fabbisogno: 2100 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
59
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell’allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere interfacciato con il programma gestionale del Laboratorio; per la realizzazione di tale
interfacciamento il Sistema deve essere corredato di idoneo hardware, le cui specifiche tecniche
dovranno essere richieste alla Società informatica fornitrice del software gestionale del
Laboratorio (Metafora)
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della
qualità.
60
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di
amplificazione e rivelazione degli acidi nucleici
-
qualora il sistema lo richiedesse deve essere fornito uno strumento per estrazione degli acidi
nucleici completamente automatico
capacità di processare almeno 40 campioni a seduta
assenza di carry-over tra campioni
disponibilità di software dedicato
necessità di minima manutenzione
lettore di codice a barre in grado di leggere almeno i codici: Interleaved 2 di 5, Codice 128,
Codice 39, codabar
-
Gestione reagenti
-
marcati CE
reagenti pronti all’uso
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Collegamento con Host Computer del Laboratorio
-
il Sistema dovrà essere completo di moduli di interfacciamento bidirezionale per il collegamento con il
Sistema di gestione informatizzato, installato presso il laboratorio (“Concerto” della società Metafora”)
-
la ditta dovrà altresì farsi carico del software necessario per rendere operativo tale
interfacciamento
le modalità dell’interfacciamento dovranno tenere conto delle esigenze operative del
Laboratorio e dovranno pertanto essere concordate con il Responsabile del laboratorio
ogni analizzatore deve essere in grado di leggere il bar-code del campione, richiedere e
ricevere la programmazione delle richieste in tempo reale e trasmettere i risultati delle analisi,
sia in modalità real-time che in batch, contemporaneamente ai cicli operativi e su richiesta
dell’operatore
per i moduli di interfacciamento devono essere presi accordi con la Società che gestisce
l’informatizzazione del Laboratorio
-
-
61
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del
Settore Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale
in enti di uguale rilevanza clinico- scientifica
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
62
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Principio del metodo (PCR real time, bDNA)
Modalità e tempi di preparazione del campione
Descrizione del sistema di controllo della contaminazione
Descrizione del sistema di controllo della inibizione
Numero di campioni dosabili in una seduta analitica
PUNTI 16
CARATTERISTICHE ANALITICHE
Possibilità di quantizzare con la stessa efficienza eventuali mutanti farmaco resistenti
Elevata riproducibilità
PUNTI 14
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Referenze tecnico-scientifiche e know-how della Ditta medesima
Numero degli ambienti necessari per l’esecuzione dei tests
PUNTI 20
63
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
__________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Cadenza analitica complessiva
n°___________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
64
Caratteristiche analizzatore:
Livello di automazione:
Il sistema fornito deve permettere l’esecuzione completamente automatica
delle fasi di amplificazione e rivelazione degli acidi nucleici
si no
-
strumento per estrazione degli acidi nucleici completamente automatico
si no
-
campioni a seduta
__________
-
disponibilità di software dedicato
si no
-
necessità di minima manutenzione
si no
-
assenza di carry-over tra campioni
si no
-
codici a barre leggibili
si no
-
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Collegamento con Host Computer
-
fornitura moduli di interfacciamento bidirezionale con “Concerto”
-
fornitura di un software necessario per rendere operativo
-
si no
l’interfacciamento
si no
capacità di richiesta e ricezione delle richieste e trasmissione dei
risultati:
in modalità real-time
in modalità batch
in contemporanea ai cicli operativi
su richiesta dell’operatore
si
si
si
si
65
no
no
no
no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
66
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HBV DNA Quantitativo
Frequenza di esecuzione: bisettimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Sensibilità analitica
Carico di lavoro/campioni anno n.
HBV DNA Quantitativo
2000 UI/ml
3800
67
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HBV DNA quantitativo
Sensibilità analitica
____________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta _____________________________________
68
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà :
alla verifica del CV % nella serie ed interserie su 50 dosaggi
alla verifica dei risultati ottenuti su 50 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
alla verifica della sensibilità mediante pannelli di sieroconversione e qualificazione (BBI)
69
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HBV DNA Quantitativo
(Lotto 5)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HBV
DNA Quantitativo
Fabbisogno: 3800 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
70
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell'allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinca dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere interfacciato con il programma gestionale del Laboratorio; per la realizzazione di tale
interfacciamento il Sistema deve essere corredato di idoneo hardware, le cui specifiche tecniche
dovranno essere richieste alla Società informatica fornitrice del software gestionale del
Laboratorio (Metafora)
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della
qualità.
71
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di
amplificazione e rivelazione degli acidi nucleici
-
qualora il sistema lo richiedesse deve essere fornito uno strumento per estrazione degli acidi
nucleici completamente automatico
capacità di processare almeno 40 campioni a seduta
assenza di carry-over tra campioni
disponibilità di software dedicato
necessità di minima manutenzione
lettore di codice a barre in grado di leggere almeno i codici: Interleaved 2 di 5, Codice 128,
Codice 39, codabar
-
Gestione reagenti
-
marcati CE
reagenti pronti all’uso
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Collegamento con Host Computer del Laboratorio
-
il Sistema dovrà essere completo di moduli di interfacciamento bidirezionale per il collegamento con il
Sistema di gestione informatizzato, installato presso il laboratorio (“Concerto” della società Metafora)
-
la ditta dovrà altresì farsi carico del software necessario per rendere operativo tale
interfacciamento
le modalità dell’interfacciamento dovranno tenere conto delle esigenze operative del Laboratorio
e dovranno pertanto essere concordate con il Responsabile del laboratorio
ogni analizzatore deve essere in grado di leggere il bar-code del campione, richiedere e
ricevere la programmazione delle richieste in tempo reale e trasmettere i risultati delle analisi,
sia in modalità real-time che in batch, contemporaneamente ai cicli operativi e su richiesta
dell’operatore
per i moduli di interfacciamento devono essere presi accordi con la Società che gestisce
l’informatizzazione del Laboratorio
-
-
Ingombro
- il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del
Settore Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
72
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale
in enti di uguale rilevanza clinico- scientifica
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
73
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Principio del metodo (PCR real time, bDNA)
Modalità e tempi di preparazione del campione
Descrizione del sistema di controllo della contaminazione
Descrizione del sistema di controllo della inibizione
Numero di campioni dosabili in una seduta analitica
PUNTI 16
CARATTERISTICHE ANALITICHE
Possibilità di quantizzare con la medesima efficienza tutti i sottotipi di HIV 1 (A-F e
HIV 0)
Elevata riproducibilità
PUNTI 10
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Referenze tecnico-scientifiche e know-how della Ditta medesima
Numero degli ambienti necessari per l’esecuzione dei tests
PUNTI 20
74
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
__________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Cadenza analitica complessiva
n°___________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
75
Caratteristiche analizzatore:
Livello di automazione:
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi
di amplificazione e rivelazione degli acidi nucleici
si no
-
strumento per estrazione degli acidi nucleici completamente automatico
si no
-
campioni a seduta
__________
-
disponibilità di software dedicato
si no
-
necessità di minima manutenzione
si no
-
assenza di carry-over tra campioni
si no
-
codici a barre leggibili
si no
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
Scarichi
-
si no
contenitori appositi per scarichi liquidi e solidi
Collegamento con Host Computer
-
fornitura moduli di interfacciamento bidirezionale con “Concerto”
si no
-
fornitura di un software necessario per rendere operativo
l’interfacciamento
si no
capacità di richiesta e ricezione delle richieste e trasmissione dei
risultati:
in modalità real-time
in modalità batch
in contemporanea ai cicli operativi
su richiesta dell’operatore
si
si
si
si
-
no
no
no
no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
76
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
77
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HIV RNA Quantitativo
Frequenza di esecuzione: bisettimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Sensibilità analitica
Carico di lavoro campioni/anno
HIV RNA Quantitativo
< 50 cp/ml
1700
78
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HIV RNA quantitativo
Sensibilità analitica
____________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta _______________________________________
79
SISTEMA DIAGNOSTICO PER L’ESECUZIONEDI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà :
alla verifica del CV % nella serie ed interserie su 50 dosaggi
alla verifica dei risultati ottenuti su 50 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
alla verifica della sensibilità mediante pannelli di sieroconversione e qualificazione (BBI)
80
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV RNA Quantitativo
(Lotto 6)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HIV
RNA Quantitativo
Fabbisogno: 1700 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
81
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell'allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della
qualità.
82
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di lavaggio e
incubazione
-
capacità di processare almeno 30 campioni a seduta
assenza di carry-over tra campioni
liberamente programmabile
necessità di minima manutenzione
Gestione reagenti
-
marcati CE
reagenti pronti all’uso
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del Settore
Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale
in enti di uguale rilevanza clinico- scientifica.
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
83
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Principio del metodo (PCR ,LIPA)
Modalità e tempi di preparazione del campione
Possibilità di automatizzare la metodica
Numero di campioni dosabili in una seduta analitica
PUNTI 12
CARATTERISTICHE ANALITICHE
Possibilità di utilizzare l’amplificato ottenuto con la metodica HCV RNA qualitativo
Capacità di riconoscere i principali 6 genotipi e i relativi più comuni sottotipi HCV
PUNTI 14
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Prodotto riconosciuto e accreditato a livello internazionale
Numero degli ambienti necessari per l’esecuzione dei tests
PUNTI 20
84
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
__________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
Caratteristiche analizzatore:
Livello di automazione:
-
Il sistema fornito deve permettere l’esecuzione completamente automatica delle fasi di lavaggio e
incubazione
si no
-
campioni a seduta
__________
-
assenza di carry-over tra campioni
si no
-
liberamente programmabile
si no
-
necessità di minima manutenzione
si no
-
codici a barre leggibili
si no
85
Gestione Reagenti
-
marcatura CE
si no
-
pronti all’uso
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
86
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HCV genotipo
Frequenza di esecuzione: settimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Sensibilità analitica
Carico di lavoro/campioni anno n.
HCV Genotipo
500 UI/ml
700
87
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HCV genotipo
Sensibilità analitica
____________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta ___________________________________
88
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà :
alla verifica dei risultati ottenuti su 50 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
89
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HCV Genotipo
(Lotto 7)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HCV
genotipo
Fabbisogno: 700 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
90
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire il test con i requisiti indicati nell'allegato B.0,
mediante analizzatori automatici.
Al fine di garantire la continuità dello standard di servizio attuale, il Sistema deve:
consentire una gestione razionale del carico di lavoro e del personale dedicato
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della
qualità.
91
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
Il sistema fornito deve permettere l’esecuzione automatica delle fasi di amplificazione, sequenza
e interpretazione
-
Semplicità di utilizzo
necessità di minima manutenzione
librerie del software interpretativo delle sequenze aggiornato periodicamente
Gestione reagenti
-
tecnologia di sequenziamento a primers marcati
possibilità di rilevare le farmacoresistenze degli inibitori delle proteasi, della retrotrascrittasi
e della fusione
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del
Settore Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Aspetti organizzativi
-
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Referenze: verrà presa in considerazione la diffusione sul mercato nazionale e internazionale
in enti di uguale rilevanza clinico-scientifica.
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
92
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Sistema approvato FDA
Possibilità di interrompere e riprendere la procedura ad ogni step
Disponibilità di sistema di back up di sicurezza dei dati
Manutenzione giornaliera a basso impatto
PUNTI 16
CARATTERISTICHE ANALITICHE
Possibilità di kit completi per altri virus (HCV, HBV)
Facile interpretazione dei referti
PUNTI 14
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Diffusione sul mercato nazionale in Enti di uguale rilevanza clinico-scientifica
Prodotto riconosciuto e accreditato a livello internazionale
Supporto specialistico dell’Azienda
PUNTI 20
93
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Configurazione del Sistema
__________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
Caratteristiche analizzatore:
Livello di automazione:
-
Il sistema fornito deve permettere l’esecuzione automatica delle fasi di amplificazione, sequenza
e interpretazione
si no
-
semplicità di utilizzo
si no
-
necessità di minima manutenzione
si no
-
librerie del software interpretativo delle sequenze aggiornato periodicamente si no
94
Gestione Reagenti
si no
-
tecnologia di sequenziamento a primers marcati
-
possibilità di rilevare le farmacoresistenze degli inibitori delle proteasi, della retrotrascrittasi
e della fusione
si no
Scarichi
-
contenitori appositi per scarichi liquidi e solidi
si no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
95
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: HIV genotipo
Frequenza di esecuzione: settimanale
I reagenti devono essere distribuiti da ditte dotate di un sistema operativo di assicurazione di
qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
Carico di lavoro/campioni anno n.
HIV Genotipo
250
96
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
All. B.1) Caratteristiche del sistema: Reagenti/ Scheda tecnica riassuntiva da compilare
HIV genotipo di resistenza
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta ____________________________________
97
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di laboratorio
All. C) Modalità di validazione del sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà :
alla verifica dei risultati ottenuti su 10 campioni da Pazienti noti in confronto ai test in uso nel
Laboratorio
98
SISTEMA DIAGNOSTICO PER L’ESECUZIONE DI HIV Genotipo di resistenza
(Lotto 8)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA HIV genotipo di resistenza
Fabbisogno: 250 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
99
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.0) Caratteristiche generali del Sistema
Il Sistema deve essere in grado di eseguire i test indicati nell'allegato B.0, mediante analizzatore
completamente automatico.
Il Sistema, indipendentemente dalla configurazione proposta, dovrà presentare le seguenti ulteriori
caratteristiche:
-
avere peso e dimensioni compatibili con la struttura e gli spazi disponibili presso il Laboratorio
(necessario un sopralluogo) a insindacabile giudizio del Settore Ingegneria Clinica dell’Ente e del
Responsabile del Laboratorio
-
essere corredato di tutti gli accessori necessari al suo buon funzionamento
-
essere interfacciato con il programma gestionale del Laboratorio; per la realizzazione di tale
interfacciamento il Sistema deve essere corredato di idoneo hardware, le cui specifiche tecniche
dovranno essere richieste alla Società informatica fornitrice del software gestionale del
Laboratorio (Metafora)
-
essere prodotto e distribuito da ditte dotate di un sistema operativo di assicurazione della
qualità.
100
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Dipartimento di Laboratorio
Requisiti indispensabili
All. A.1) Caratteristiche del Sistema: Analizzatore
Livello di automazione
-
completamente automatico
processazione contemporanea di almeno 24 campioni
assenza di carry-over tra campioni
lettore di codice a barre in grado di leggere almeno i codici: Interleaved 2 di 5, Codice 128,
Codice 39, codabar
Gestione reagenti
-
marcati CE
comparto dei reagenti a temperatura controllata
Scarichi
-
il materiale biologico o comunque pericoloso dovrà essere eliminato in appositi contenitori
per scarichi liquidi e solidi, onde garantire la sicurezza degli operatori e dell’ambiente
Collegamento con Host Computer del Laboratorio
-
il Sistema dovrà essere completo di moduli di interfacciamento bidirezionale per il collegamento con il
Sistema di gestione informatizzato, installato presso il laboratorio (“Concerto” della società Metafora)
-
la ditta dovrà altresì farsi carico del software necessario per rendere operativo tale
interfacciamento
le modalità dell’interfacciamento dovranno tenere conto delle esigenze operative del Laboratorio
e dovranno pertanto essere concordate con il Responsabile del laboratorio
ogni analizzatore deve essere in grado di leggere il bar-code del campione, richiedere e
ricevere la programmazione delle richieste in tempo reale e trasmettere i risultati delle analisi,
sia in modalità real-time che in batch, contemporaneamente ai cicli operativi e su richiesta
dell’operatore
per i moduli di interfacciamento devono essere presi accordi con la Società che gestisce
l’informatizzazione del Laboratorio
-
-
101
Ingombro
-
il Sistema proposto dovrà avere peso e dimensioni compatibili con la struttura e gli spazi
disponibili presso il Laboratorio (necessario un sopralluogo) a insindacabile giudizio del
Settore Ingegneria Clinica dell’Ente e del Responsabile del Laboratorio
Gruppo/i di continuità
-
il Sistema dovrà essere corredato di gruppo/i di continuità che assicurino una autonomia
operativa di almeno 30 primi.
Certificazione
- Conformità dell’analizzatore offerto ai sensi del D.lgs. 8.9.2000 n.332 (attuazione della
direttiva 98/79/CE relativa ai dispositivi medico-diagnostici in vitro)
102
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Laboratorio di Laboratorio
All. A.2) Caratteristiche del Sistema da sottoporre a punteggio
CARATTERISTICHE STRUMENTALI
Tecnologia
Tempo di processazione
Possibilità di processare contemporaneamente campioni di diversa natura (plasma,
liquor, espettorato..)
Controllo interno
Quantità di campione di partenza variabile
Ingombro
PUNTI 27
CARATTERISTICHE ANALITICHE
Reagenti pronti all'uso
Qualità dell’estratto
Stabilità dei reagenti a bordo
PUNTI 8
CARATTERISTICHE ORGANIZZATIVE
Impatto dell’inserimento del Sistema nella realtà operativa del Laboratorio
Impegno temporale nella gestione manuale dei campioni
Prodotto riconosciuto e accreditato a livello internazionale
PUNTI 15
103
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Dipartimento di Laboratorio
All. A.3) Scheda Tecnica riassuntiva da compilare
Caratteristiche generali del Sistema
Tecnologia
__________________________________
Configurazione del Sistema
__________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Compatibilità dell’ingombro con struttura
e spazi del Laboratorio
allegare certificazione di avvenuto sopralluogo
Dotazione di tutti gli accessori necessari al
buon funzionamento
si no
Disponibilità hardware per interfacciamento
si no
Sistema di assicurazione qualità:
__________________________________
si no
Certificato? (se SI allegare copia documento)
Caratteristiche analizzatore:
Livello di automazione:
-
automatico
si no
-
assenza di carry-over tra campioni
si no
104
Gestione reagenti
-
marcati CE
si no
-
comparto dei reagenti a temperatura controllata
si no
Scarichi
-
si no
contenitori appositi per scarichi liquidi e solidi
Collegamento con Host Computer
-
fornitura moduli di interfacciamento bidirezionale con “Concerto”
si no
-
fornitura di un software necessario per rendere operativo
l’interfacciamento
si no
capacità di richiesta e ricezione delle richieste e trasmissione dei
risultati:
in modalità real-time
in modalità batch
in contemporanea ai cicli operativi
su richiesta dell’operatore
si
si
si
si
-
no
no
no
no
Ingombro
-
peso complessivo
Kg______________
-
dimensioni complessive
_________________
si no
Gruppo/i di continuità
-
peso
Kg______________
-
dimensioni
_________________
Firma del legale rappresentante della ditta
105
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Dipartimento di Laboratorio
All. B.0) Caratteristiche del Sistema: Reagenti/carichi di lavoro
Analita richiesto: DNA/RNA
Frequenza di esecuzione: quotidiana
I reagenti devono essere prodotti e distribuiti da ditte dotate di un sistema operativo di
assicurazione della qualità già certificato sul modello ISO 9001:2000 o equivalente.
Analita
DNA/RNA
Carico lavoro/determinazioni anno n.
5000
106
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Dipartimento di Laboratorio
All. B.1) Scheda tecnica da compilare per ogni singolo analita
analita
_________________
test reali per confezione
n°
____________
confezioni offerte
n°
____________
Firma del legale rappresentante della ditta _________________________
Alla presente dovrà essere allegata la scheda tecnica (package insert) di ciascun prodotto.
107
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA
(Lotto 9)
Dipartimento di Laboratorio
All. C) Modalità di validazione del Sistema
Al fine di valutare l’idoneità e la capacità del Sistema a raggiungere, mantenere e riprodurre le
prestazioni dichiarate nelle schede tecniche fornite dalla ditta offerente e richieste dal capitolato,
durante il periodo di prova il laboratorio procederà:
alla verifica dei risultati ottenuti su 100 campioni da Pazienti noti in confronto ai test in uso
nel Laboratorio
108
SISTEMA DIAGNOSTICO ESTRATTORE AUTOMATICO PER DNA/RNA.
(Lotto 9)
Dipartimento di Laboratorio
SCHEMA
GUIDA
All. D) SCHEDA ECONOMICA dei reagenti/prodotti necessari per effettuare le determinazioni
corrispondenti al fabbisogno stimato in ragione d’anno per ciascun analita.
Tipo e valore commerciale delle apparecchiature ed accessori offerti:
______________________________________________________________________________
____________________________________________________________________
__________
1) ANALITA ESTRAZIONE
DNA/RNA
Fabbisogno: 5000 determinazioni/anno
Nome commerciale del kit/reagente
Codice catalogo
__________________
__________________
Pezzi per confezione
n. ________________
Numero di determinazioni effettuabili
con una confezione
Quantitativo di confezioni necessario
n. _______________
n. _______________
Prezzo cad. confezione
€ ________________
Importo totale di spesa
€ __________________
Totale complessivo di spesa del lotto
€ __________________
Firma del legale rappresentante della ditta
____________________________
109