Cinetica chimica
1
Reazione di Briggs Rauscher
a) Come varia nel tempo la composizione chimica di
un sistema?
b) Qual è il meccanismo secondo cui avviene una
reazione chimica?
c) Come è possibile modificare la velocità di una
reazione chimica?
d) Quanto tempo impiega un sistema a raggiungere
l’equilibrio chimico?
2
Reazione di Briggs Rauscher
a) Il cambiamento di colore nella reazione di BriggsRauscher è attribuibile alla formazione/scomparsa di
I2 molecolare durante la reazione.
b) Il meccanismo è complesso e la concentrazione di I2
determina una via radicalica o una via non radicalica.
c) Mediante variazione della concentrazione dei
reagenti o mediante aggiunta di opportuni
‘interferenti’. Nell’esperienza di laboratorio è stato
aggiunto un antiossidante (l’acido ascorbico
contenuto nel succo di limone).
d) Circa 10 minuti
3
Cinetica
La cinetica chimica studia la velocità e i meccanismi
delle reazioni chimiche.
Durante una reazione chimica le nuvole elettroniche di
reagenti e prodotti vengono modificate: i legami dei
reagenti si spezzano e i legami dei prodotti si
formano.
Non sempre reazioni spontanee da un punto di vista
termodinamico (ΔG < 0) avvengono in un tempo
praticamente utile.
4
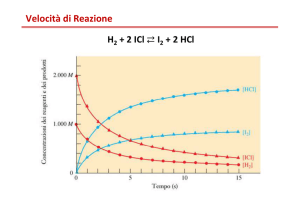
Velocità di reazione
Si misura determinando la variazione della
concentrazione dei reagenti (o dei prodotti) in
un intervallo di tempo prefissato.
Varia con il procedere della reazione: solitamente
ad una concentrazione di reagenti maggiore,
corrisponde una velocità maggiore.
Dipende dalle caratteristiche dei reagenti, poiché
ogni sostanza ha una tendenza peculiare a
trasformarsi.
5
Esempio
Consideriamo la decomposizione del perossido di
idrogeno:
Se si considerano intervalli di
tempo infinitesimi:
è la tangente alla curva
6
Velocità di reazione
Data la reazione:
La velocità può essere espressa da una qualsiasi delle
seguenti quattro quantità:
Il segno – indica scomparsa del reagente, il segno +
formazione del prodotto.
Si misura in mol L-1s-1.
7
Teoria degli urti efficaci
Perché una reazione si verifichi i reagenti devono
scontrarsi.
Gli urti devono soddisfare alcuni requisiti (urti efficaci):
• Corretto orientamento dell’urto
• Sufficiente energia per produrre la trasformazione
Gli urti efficaci sono soltanto una piccola percentuale
degli urti totali.
8
Energia di attivazione (Ea)
E’ l’energia (Ea) che le particelle dei reagenti devono
accumulare nell’urto per potersi trasformare in
prodotti.
La variazione dell’energia in funzione della coordinata
di reazione, e l’Ea di una reazione, possono essere
riportate in un grafico che rappresenta il profilo
della reazione .
Prende il nome di complesso attivato la specie chimica
che si forma nel momento della collisione: i vecchi
legami non sono ancora completamente rotti e i
nuovi legami sono solo parzialmente formati.
9
Reazione esotermica
10
Reazione endotermica
11
Ea: energia di attivazione
12
Fattori determinanti la velocità
La velocità di reazione aumenta se aumentano:
• Concentrazione dei reagenti (in soluzione)
• Temperatura
• Superficie di contatto tra i reagenti (reazioni
eterogenee)
Può essere modulata con variazioni di solvente
(reazioni omogenee), sfruttando i legami deboli
intermolecolari.
13
Fattori determinanti la velocità
La velocità di reazione diminuisce se aumentano:
• Dimensioni e ramificazione dei reagenti
Attacco facile : ingombro sterico scarso
Attacco difficile : ingombro sterico elevato
14
Meccanismo di reazione
E’ la successione di trasformazioni che portano dai
reagenti alla formazione dei prodotti finali.
Solitamente le reazioni:
• Procedono a stadi
• Sono scomponibili in reazioni elementari
• Lo stadio lento determina la velocità della reazione
• Gli urti efficaci sono solitamente bimolecolari
15
Reazione elementare
Una reazione chimica si definisce elementare se
avviene in un unico passaggio coinvolgendo
contemporaneamente più specie chimiche.
Esistono due tipi principali di reazioni elementari:
monomolecolari (es.: A2 → 2A) e bimolecolari (es.:
2A → B + C, oppure A + B → C + D).
Tutte le reazioni elementari sono mono o
bimolecolari, mentre non è vero il contrario.
16
Legge cinetica
La velocità di una reazione coincide con la velocità del
suo stadio lento. Ad esso corrisponde la maggior
energia di attivazione.
In una catena di
montaggio: la velocità
di consegna delle auto
è determinata dalla
velocità
con
cui
l’operaio più lento
assembla i suoi pezzi.
17
Legge o equazione cinetica
La velocità di una reazione dipende dalla concentrazione
dei reagenti dello stadio lento: la relazione che la
definisce prende il nome di legge cinetica.
Viene determinata sperimentalmente e può essere
rappresentata, genericamente:
v = k ∙ [A]m ∙ [B]n ∙ [C]p …
k è la costante cinetica della reazione, dipende solo da T
A, B, C sono i reagenti
m, n, p rappresentano l’ordine della reazione rispetto a
ciascuno dei reagenti e NON coincidono con i
coefficienti stechiometrici della reazione considerata.
18
Equazione di Arrhenius
La velocità di una reazione dipende esclusivamente
dalla temperatura:
(equazione di Arrhenius)
Ea = energia di attivazione
A = fattore preesponenziale o fattore di frequenza
Sia Ea che A devono essere ricavati da misure
sperimentali di k.
19
Ordine di una reazione
E’ l’esponente a cui deve essere elevata la
concentrazione di ciascun reagente, nella legge
cinetica di una reazione.
L’ordine deve essere definito per ciascuno dei reagenti
coinvolti.
Va sempre determinato sperimentalmente.
L’ordine globale di una reazione è dato dalla somma
degli ordini riferiti a ciascun reagente.
20
Ordine di una reazione
L’ordine delle reazioni elementari, rispetto a ciascun
reagente,
coincide
con
il
coefficiente
stechiometrico di quel reagente.
Ciò vale solo nel caso di reazioni elementari.
Se esse sono reazioni bimolecolari, ma non
elementari - es. SN1 -, occorre determinare prima il
meccanismo, e poi lo stadio lento della reazione.
21
Legge o equazione cinetica
Per reazioni aventi cinetica del primo ordine la legge
cinetica dipende dalla concentrazione di un solo
reagente:
Reazione: A → B
– Legge cinetica: v = k [A]
Per reazioni aventi cinetica del secondo ordine la legge
cinetica dipende dalla concentrazione di due reagenti
o dal quadrato della concentrazione dell’unico
reagente:
Reazione: 2A → prodotti – Legge cinetica v = k [A]2
Reazione: A + B → prodotti – Legge cinetica: v = k [A][B]
22
Leggi cinetiche
Le equazioni cinetiche possono essere risolte (legge
integrata) in modo da fornire le funzioni relative alla
variazione di [A] nel tempo.
23
Esempio: Sostituzione nucleofila
E’ una reazione in cui un alogenuro alchilico (R-X)
subisce l’attacco di un nucleofilo (Nu-: specie ricca di
elettroni). Si forma un nuovo legame tra residuo
alchilico e nucleofilo, mentre si rompe il legame tra
residuo alchilico e alogeno.
R-X + Nu- → R-Nu + XTali reazioni procedono, a seconda dell’ingombro sterico
di R, con due meccanismi differenti.
24
SN2: sostituzione nucleofila del
secondo ordine
E’ il meccanismo seguito dai substrati stericamente poco
ingombrati.
Avviene in un unico stadio ed è una reazione elementare
bimolecolare: i due reagenti collidono e il legame R-X
viene rotto contemporaneamente alla formazione del
legame R-Nu:
R-X + Nu- → R-Nu + XLa legge cinetica, v = k [R-X] [Nu-], è del secondo ordine
globale e del primo ordine rispetto a ciascun reagente.
Dipende da entrambi i reagenti.
25
SN2: profilo di reazione
Attacco facile : ingombro sterico scarso
26
SN1: sostituzione nucleofila del primo
ordine
E’ il meccanismo seguito dai substrati stericamente molto
ingombrati.
Avviene in due stadi:
1) Dissociazione monomolecolare del substrato in ioni:
R-X→ R+ + Xstadio lento
2) Attacco del nucleofilo sul carbocatione preformato R+ :
R+ + Nu- → R-Nu
stadio veloce
v = k [R-X] la legge cinetica è del primo ordine globale e
del primo ordine rispetto all’unico reagente dello
stadio lento. Non dipende dalla concentrazione di Nu-.
27
SN1: profilo di reazione
Attacco difficile : ingombro sterico elevato
28
Catalizzatori
Aumentano la velocità di una reazione, senza
parteciparvi: non vengono consumati.
Determinano un cambiamento di meccanismo che
abbassa la barriera di Ea (dello stadio lento), ma non
cambia gli stati energetici iniziale e finale di reagenti
e prodotti: le reazioni avvengono a temperature
minori e a velocità maggiori.
Legandosi al substrato di partenza, possono produrre
intermedi di reazione che vengono distrutti in uno
stadio successivo.
Possono essere riutilizzati per molti cicli di reazione.
29
Esempio: il dentifricio d’elefante
Figura 7.20 Una minuscola quantità di catalizzatore – in questo caso ioduro di potassio in
soluzione acquosa – può accelerare la decomposizione del perossido di idrogeno ad acqua
e ossigeno. a) Il palloncino si gonfia molto lentamente in assenza del catalizzatore. b) Il
palloncino si gonfia rapidamente in presenza del catalizzatore.
30
Catalizzatori
Figura 7.21 La presenza del catalizzatore
consente un diverso percorso di reazione,
caratterizzato da minore energia di attivazione.
32
Catalizzatori
• Catalisi eterogenea: processo Haber per la
sintesi dell’ammoniaca
2Fe + N2 → 2 FeN
1° stadio
2 FeN + 3 H2 → 2 NH3 + 2 Fe
2° stadio
• Catalisi omogenea: Uso di acidi nella sintesi
degli esteri (esterificazione di Fisher – sintesi
dell’aroma di banana)
33
Marmitte catalitiche
Decomporre idrocarburi incombusti, monossido
di carbonio e ossidi di azoto
35
Marmitte catalitiche
• Struttura a nido d’ape in ceramica rivestita da metalli
di transizione (Pt, Rh, Ir)
2 CO (g) + O2 (g) → 2 CO2 (g)
2 NO (g→ N2 (g) ) + O2 (g)
• Idrocarburi incombusti vengono ossidati a CO2 e H2O
• Gli ossidi di azoto vengono decomposti a diazoto e
diossigeno
36
Catalizzatori biologici: enzimi
Processi biologici: avvengono a basse temperature,
alcuni sono molto veloci (combustione intracellulare
del glucosio).
Enzimi: grosse proteine che cambiano struttura in
funzione della necessità.
Funzionano con un meccanismo ad ‘adattamento
indotto’ : quando il substrato si lega all’enzima, in
modo specifico (modello semplificato chiaveserratura), l’enzima modifica la sua struttura
tridimensionale in modo da aumentare la selettività
nei confronti del substrato.
37
Chiave - serratura
Figura 7.26 Secondo il modello dell’azione
enzimatica
detto
«chiave-serratura»
il
substrato giusto viene riconosciuto grazie alla
sua capacità di adattarsi al sito attivo come una
chiave alla serratura.
38
Esempio: chimotripsina
E’ un enzima che idrolizza selettivamente i legami
peptidici di una proteina tra gli amminoacidi molto
idrofobici (Phe (fenilalanina), Trp (triptofano), Tyr
(tirosina)) e quelli seguenti.
Es. Phe - Lys
E’ prodotta dal pancreas e fa parte degli enzimi coinvolti
nella catena digestiva delle proteine.
40
41
42
43
44
45