I composti aromatici
Evoluzione del concetto di composti aromatici
Inizialmente, la definizione di composti aromatici è
stata assegnata facendo riferimento al loro odore più o
meno intenso. Con il passare del tempo, la definizione non ha più
identificato composti dall’odore intenso, ma piuttosto
tutta una serie di composti che contengono almeno
un’unità strutturale a sei atomi di carbonio, con il
massimo numero di insaturazioni, a cui è stato dato il
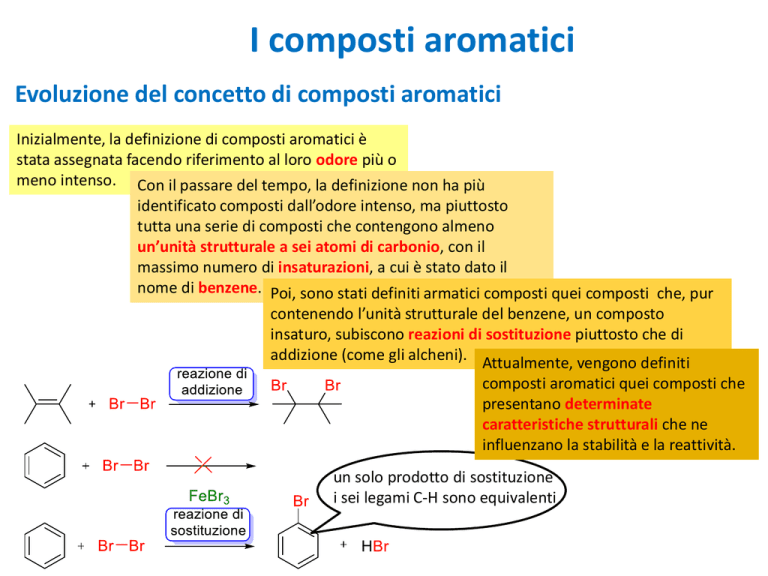
nome di benzene. Poi, sono stati definiti armatici composti quei composti che, pur
contenendo l’unità strutturale del benzene, un composto
insaturo, subiscono reazioni di sostituzione piuttosto che di
addizione (come gli alcheni). Attualmente, vengono definiti
composti aromatici quei composti che
presentano determinate
caratteristiche strutturali che ne
influenzano la stabilità e la reattività.
un solo prodotto di sostituzione
i sei legami C-H sono equivalenti
Struttura del benzene
La prima struttura per il benzene fu proposta nel 1865 da August Kekulé (1829-1896).
benzene di Kekulé:
- miscela di due composti, in rapido equilibrio (tanto rapido da
impedire l’isolamento delle due strutture separate);
- ogni atomo di idrogeno legato a un atomo di carbonio e gli
atomi di carbonio legati l’uno all’altro attraverso legami singoli
e doppi alternati.
equilibrio
tendenza a dare reazioni di sostituzione
In questo modo venivano spiegate
alcune osservazioni sperimentali - reattività del benzene piuttosto che di addizione (come gli alcheni) e
particolare stabilità
- formula molecolare
?
Rispetto al valore calcolato per la struttura di
Kekulè, infatti, il calore di idrogenazione (–H°)
del benzene, ottenuto sperimentalmente, è
inferiore di 36,5 kcal · mole–1.
Intorno agli anni '30, con l'impiego di nuove tecniche di analisi, fu
possibile stabilire che il benzene ha una struttura planare e che i
sei legami carbonio-carbonio hanno tutti la stessa lunghezza,
senza nessuna alternanza di legami semplici e doppi.
Inoltre, con l’avvento della quantomeccanica, i legami
molecolari sono stati sviluppati secondo due nuovi punti di vista,
che hanno portato all’elaborazione della teoria della risonanza
e della teoria degli orbitali molecolari, permettendo così di
spiegare, nei dettagli, la struttura del benzene.
Il benzene secondo la teoria della risonanza
Secondo la teoria della risonanza, le due strutture
di Kekulé non sono in equilibrio fra di loro, ma
sono due formule limite di risonanza.
Spesso, si usa uno dei
due disegni seguenti:
modello
space filling
mappa di potenziale
elettrostatico
La differenza fra il calore di idrogenazione ottenuto sperimentalmente e quello calcolato sulla base
delle strutture di Kekulé (36,5 kcal · mole–1), strutture in cui gli elettroni sono localizzati, è detta
energia di risonanza.
In pratica, l'energia di risonanza è una misura della stabilità della struttura con elettroni delocalizzati
rispetto a quella con elettroni localizzati.
Mappe di potenziale elettrostatico
elettronegatività
densità elettronica
nelle molecole
Le mappe di potenziale elettrostatico
mappe di potenziale sono dei modelli che mostrano come è
distribuita la carica all’interno di una
elettrostatico
molecola.
Queste mappe sono codificate con diversi colori che indicano aree ad alta e bassa densità elettronica.
Le zone ricche di elettroni sono colorate in rosso, quelle carenti in blu. Le aree con una densità
elettronica intermedia variano dall’arancione, al giallo, al verde, al blu.
potenziale
elettrostatico
più negativo
potenziale
elettrostatico
più positivo
esempio
ione idronio
(H3O+)
acqua
(H2O)
ione idrossido
(HO-)
La teoria della risonanza riesce a spiegare l’insolita stabilità del benzene
e dei suoi derivati.
Il benzene viene rappresentato come un ibrido di due strutture
che contribuiscono in misura equivalente.
Anche il ciclobutadiene e il cicloottatetraene, che possono essere
rappresentati come un ibrido di due strutture, dovrebbero essere
composti aromatici
ibrido di risonanza
del ciclobutadiene
ibrido di risonanza
del cicloottatriene
Il ciclobutadiene e il cicloottatetraene, tuttavia, non sono composti aromatici
Aromaticità: criteri
Regola di Hückel
Un composto è aromatico quando soddisfa i seguenti criteri:
essere ciclico
tutti gli atomi che fanno parte del ciclo devono avere un orbitale p (ibridazione sp2)
essere planare, in modo da favorire la sovrapposizione continua di tutti gli orbitali p dell'anello
possedere un numero di elettroni delocalizzati su tutto il ciclo pari a 4n + 2 (dove n = 0, 1, 2, 3, 4, ecc.)
Un idrocarburo aromatico è più stabile dell’analogo idrocarburo aciclico
avente lo stesso numero di elettroni p
stabilità
esempio
1,3,5-esatriene
cicloesene
cicloesadiene
ciclico, non planare,
4 atomi del ciclo non hanno elettroni p
non aromatico
ciclico, non planare,
2 atomi del ciclo non hanno elettroni p
non aromatico
non ciclico,
tutti gli atomi hanno elettroni p
(6 elettroni π), per n = 1, 4(1) + 2 = 6
non aromatico
[10]annulene
ciclico, non planare
tutti gli atomi del ciclo hanno elettroni p
(10 elettroni π), per n = 2, 4(2) + 2 = 10,
non aromatico
Per annuleni s’intendono quei composti
idrocarburici monociclici caratterizzati da
strutture con legami semplici e doppi
alternati.
Le dimensioni dell’anello in questi composti
sono indicate da un numero fra parentesi
quadre che precede il termine annulene.
modello ball & stick
vista dall'alto
modello ball & stick
vista da un lato
benzene
ciclico, planare,
tutti gli atomi del ciclo hanno elettroni p
(6 elettroni π), per n = 1, 4(1) + 2 = 6
aromatico
[18]annulene
18 elettroni
per n = 4, 4(4) + 2 = 18
Composti policiclici
naftalene
10 elettroni
per n = 2, 4(2) + 2 = 10
Composti aromatici eterociclici
piridina
6 elettroni
per n = 1, 4(1) + 2 = 6
pirrolo
6 elettroni
per n = 1, 4(1) + 2 = 6
furano
6 elettroni
per n = 1, 4(1) + 2 = 6
Cationi e anioni aromatici
generazione del catione ciclopropilico:
reazione del 3-clorociclopropene con antimonio(V) cloruro
H
+
Cl
SbCl5
H
H +
H
SbCl6
H
Generazione dell’ anione ciclopentadienilico:
reazione del ciclopentadiene con sodio ammide
H
+
H
NaNH2
H
H Na + NH3
........
H
H
pKa
H
16
H
H2O
15,7
Idrocarburi antiaromatici
Se il numero di elettroni p presenti nell’anello è uguale a 4n il composto viene detto
antiaromatico
4 elettroni p
8 elettroni p
n=1
n=2
4(1) = 4
4(2) = 8
Un idrocarburo antiaromatico è meno stabile dell’analogo idrocarburo aciclico
avente lo stesso numero di elettroni p
stabilità
Nomenclatura dei derivati del benzene
Benzeni monosostituiti
nome sostituente
fluorobenzene
benzene
nitrobenzene
nome d’uso
toluene
anisolo
benzonitrile
anilina
acetofenone
acido benzoico
fenolo
benzaldeide
stirene
Anelli benzenici legati a un gruppo alchilico
Il gruppo alchilico ha un numero di atomi
di carbonio inferiore a quello del benzene
Il gruppo alchilico ha un numero di atomi
di carbonio superiore a quello del benzene
alchilbenzeni
fenilalcani
fenile
sec-butilbenzene
2-fenileptano
benzile
Anelli benzenici legati a una catena carboniosa contenente altri gruppi funzionali
3-(3-metossifenil)butanale
(E)-2-fenil-2-butene
Benzeni disostituiti
prefissi
orto (o-)
meta (m-)
o-bromonitrobenzene
m-bromonitrobenzene
para (p-)
p-bromonitrobenzene
sostituenti in ordine alfabetico
numeri
6
5
12
3
4
1-bromo-2-nitrobenzene
6
5
1
2
3
6
5
1
2
3
4
4
1-bromo-3-nitrobenzene 1-bromo-4-nitrobenzene
Benzeni contenenti un sistema aromatico monosostituito
che presenta una propria denominazione
acido o-bromobenzoico
Benzeni con tre o più sostituenti
numerare gli atomi di carbonio dell’anello in modo da assegnare ai sostituenti i numeri più bassi
sostituenti in ordine alfabetico
413
2
3
5
6
2
41
5
6
1,2,4-tribromobenzene
non
1,3,4-tribromobenzene
Reattività dei composti aromatici
Sostituzione elettrofila aromatica (SEAr)
Alcune reazioni di SEAr
Meccanismo
stadio lento
cicloesadienil carbocatione
la carica positiva si concentra nelle posizioni
orto e para rispetto al punto di attacco
stadio veloce
Alogenazione
Cl2
Br2
FeCl3
FeBr3
AlCl3
esempio
clorobenzene
bromobenzene
Meccanismo
complesso acido-base
cicloesadienil carbocatione
Nitrazione
Meccanismo
nitrobenzene
cicloesadienil carbocatione
Solfonazione
Meccanismo
Acilazione di Friedel-Crafts
acetofenone
Meccanismo
Alchilazione di Friedel-Crafts
Meccanismo
Alogenuri metilici e alchilici 1°
esempio: cloruro di metile
carbocatione
instabile
Meccanismo
Alogenuri alchilici 2° e 3°
esempio: cloruro di t-butile
Effetto dei sostituenti sulla SEAr
effetto sulla velocità della reazione
effetto sull’orientamento della reazione
orto
meta
para
benzene
(sei atomi di carbonio equivalenti)
benzene monosostituito
(tre posizioni diverse)
Effetto dei sostituenti sulla velocità della SEAr
aumentano la densità elettronica dell'anello
aromatico rispetto a quella del benzene
Attivanti
l'anello viene detto attivato
più nucleofilo del benzene
diminuiscono la densità elettronica dell'anello
aromatico rispetto a quella del benzene
fortemente attivanti
moderatamente attivanti
debolmente attivanti
fortemente disattivanti
moderatamente disattivanti
Disattivanti
l'anello viene detto disattivato
meno nucleofilo del benzene
debolmente disattivanti
Sostituente
–NH2
–NHR
–NR2
–OH (–O-)
–OR
Effetto sulla velocità di reazione
Effetto sull’orientamento
Fortemente attivanti
orto/para orientanti
–NHCOR
–OCOR
-R (alchile)
Moderatamente attivanti
Debolmente attivanti
-H (standard di riferimento)
-Cl
-Br
-CHO
–COR
–COOH
-COOR
-CN
-CF3
Debolmente disattivanti
Moderatamente disattivanti
meta orientanti
–SO3H
–NO2
+
+
– NH3, – NH2R, –+NHR2, –+NR3
Fortemente disattivanti
Sostituenti fortemente attivanti
donano elettroni all'anello per risonanza
rendendolo un nucleofilo molto più forte
del benzene
anilina
fenolo
anisolo
elettronegatività
C
2,5
competizione tra effetto di risonanza ed effetto induttivo
N
3.0
O
3.5
elementi dello
stesso periodo
effetto di
risonanza
prevale su
effetto
induttivo
Sostituenti moderatamente attivanti
l'atomo legato direttamente all'anello, contenente un doppietto
elettronico non condiviso, è legato anche a un gruppo
elettronattrattore. La cessione di elettroni all'anello si trova così a
competere con la cessione di elettroni al gruppo elettronattrattore.
cessione di elettroni al carbonile
cessione di elettroni all’anello
cessione di elettroni al carbonile
cessione di elettroni all’anello
Sostituenti debolmente attivanti
agiscono attraverso l'effetto
induttivo elettrondonatore
toluene
Sostituenti fortemente disattivanti
attirano con forza elettroni dall'anello
sia per effetto induttivo sia per
effetto di risonanza.
esempio
nitrobenzene
Sono fortemente disattivanti
anche i gruppi
In questi casi, l'effetto disattivante è dovuto alla
presenza di una carica positiva sull'atomo di azoto
che genera un forte effetto induttivo
elettronattrattore
Sostituenti moderatamente disattivanti
nella maggior parte dei casi,
contengono un atomo di
carbonio legato, con un legame
multiplo, ad un elemento più
elettronegativo
Sono moderatamente disattivanti
anche sostituenti in cui al carbonio
legato all'anello aromatico sono uniti
elementi fortemente elettronattrattori
per effetto induttivo
benzaldeide
benzonitrile
Le mappe di potenziale elettrostatico riportate di seguito mostrano come la
densità elettronica nell'anello aromatico vada diminuendo passando dal
benzene, alla benzaldeide, all'acido benzensolfonico, allo ione anilinio.
benzene
benzaldeide
acido benzensolfonico
Ione anilinio
Sostituenti debolmente disattivanti
I sostituenti debolmente disattivanti sono
quelli che devono la loro azione all'effetto
induttivo elettronattrattore. In questo gruppo
si trovano gli alogeni.
clorobenzene
fenolo
elettronegatività
C
2,5
Cl
3.0
Br
2.8
competizione tra effetto di risonanza ed effetto induttivo
elementi di
periodi diversi
effetto di
induttivo
prevale su
effetto di
risonanza
Effetto dei sostituenti sull’orientamento della SEAr
Composizione della miscela di reazione?
isomero orto
o
1,2-disostituito
isomero meta
o
1,3-disostituito
isomero para
o
1,4-disostituito
attivanti
alogeni
disattivanti
disattivanti
orto/para
orientanti
orto/para
E+
orientanti
meta
orientanti
Dato che la posizione del legame tra l'elettrofilo e uno degli atomi di carbonio dell'anello
viene definita nello stadio che porta alla formazione del cicloesadienil carbocatione,
lo stadio lento della reazione, per capire come i sostituenti riescano a controllarel’orientamento
della sostituzione elettrofila aromatica è necessario prendere in esame l'effetto dei sostituenti
in questa fase della reazione, valutandolo in termini di stabilizzazione o destabilizzazione della
carica positiva.
Le reazioni esaminate sono:
la nitrazione dell'anisolo, contenente un sostituente fortemente attivante
la nitrazione del nitrobenzene, contenente un sostituente fortemente disattivante
la nitrazione del clorobenzene, contenente un sostituente debolmente disattivante
35%
2%
63%
percentuali relative
6%
91%
3%
percentuali relative
9%
0%
91%
percentuali relative
anisolo attacco alla posizione orto
particolarmente stabile
tutti gli atomi hanno
l’ottetto completo
attacco alla posizione para
attacco alla posizione meta
particolarmente stabile
tutti gli atomi hanno
l’ottetto completo
nitrobenzene attacco alla posizione orto
particolarmente instabile
la carica positiva si trova su un atomo di carbonio
legato a un gruppo fortemente elettron-attrattore
attacco alla posizione para
particolarmente instabile
la carica positiva si trova su un atomo di carbonio
legato a un gruppo fortemente elettron-attrattore
attacco alla posizione meta
clorobenzene
attacco alla posizione orto
più stabile
attacco alla posizione para
attacco alla posizione meta
più stabile