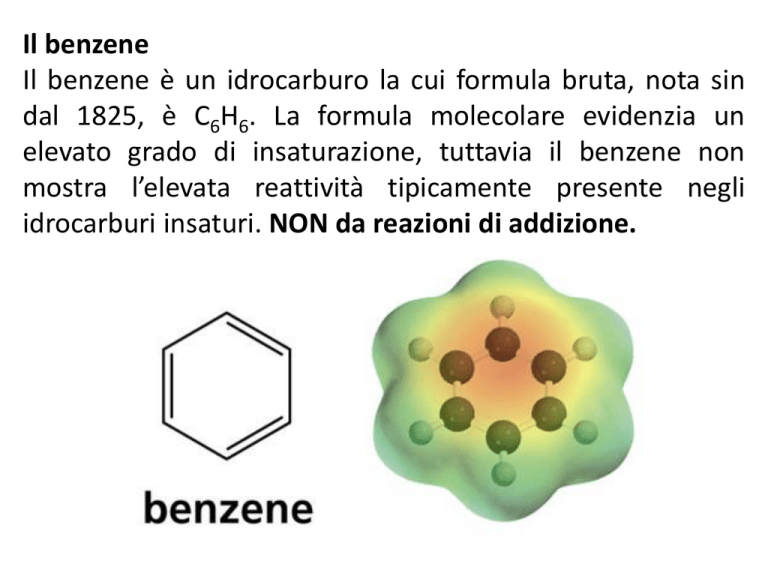
Il benzene
Il benzene è un idrocarburo la cui formula bruta, nota sin
dal 1825, è C6H6. La formula molecolare evidenzia un
elevato grado di insaturazione, tuttavia il benzene non
mostra l’elevata reattività tipicamente presente negli
idrocarburi insaturi. NON da reazioni di addizione.
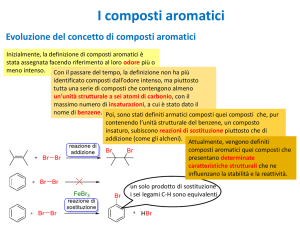
Aromaticità
Il benzene è il capostipite di tutta una classe di composti
che presentano nella propria struttura molecolare un
anello a sei atomi di carbonio con un sistema di elettroni p
delocalizzati.
Molti di questi composti sono caratterizzati da particolari
fragranze, e per questo motivo, quando sono stati isolati, a
partire dal XIX secolo, è stato dato loro il nome di composti
“aromatici”.
Attualmente, nella terminologia chimica, l’aggettivo
“aromatico” non individua una specie caratterizzata da un
odore gradevole, ma un composto che abbia reattività e
caratteristiche strutturali analoghe a quelle del benzene.
La risonanza
Il benzene è una molecola coniugata con elettroni p delocalizzati.
La descrizione della risonanza nel benzene viene fatta con due
strutture di Lewis equivalenti definite strutture limite di risonanza.
La struttura reale del benzene è rappresentata dall’ ibrido di
risonanza.
Delocalizzazione elettronica
I sei carboni del benzene sono ibridati sp2, hanno geometria planare
con gli angoli di legame di 120°.
Ogni atomo di carbonio ha un orbitale p che si estende sotto e sopra il
piano della molecola definito dai legami σ.
I 6 orbitali p adiacenti si sovrappongono, delocalizzando i 6 elettroni
sui sei atomi dell’anello e rendono il benzene una molecola coniugata.
La delocalizzazione elettronica π viene normalmente rappresentata
con due ciambelle sopra e sotto il piano dell’anello benzenico.
Caratteristiche del benzene
•Molecola ciclica e planare
•Tutti i carboni ibridati sp2
•Tutti i legami C-C hanno la stessa lunghezza
Resonance energy of benzene
Resonance (or delocalization) energy is the amount of energy needed to
convert the true delocalized structure into that of the most stable contributing
structure. The empirical resonance energy can be estimated by comparing the
enthalpy change of hydrogenation of the real substance with that estimated for
the contributing structure.
The complete hydrogenation of benzene to cyclohexane via 1,3cyclohexadiene and cyclohexene is exothermic; 1 mole benzene delivers
208.4 kJ (49.8 kcal).
Hydrogenation of one double bond delivers 119.7 kJ (28.6 kcal), as can be
deduced from the last step, the hydrogenation of cyclohexene
This measured resonance energy is
the difference between the
hydrogenation energy of three 'non-resonance' double bonds and the
measured hydrogenation energy:
(3 × 119.7) − 208.4 = 150.7 kJ/mol (36 kcal).
Note: The values used here are from the article of Wiberg, Nakaji, Morgan
(1993). Values from other sources may differ.
In the Soviet Union, resonance theory —
especially as developed by Linus Pauling —
was attacked in the early 1950s as being
contrary to the Marxist principles of dialectical
materialism, and in June 1951 the Soviet
Academy of Sciences under the leadership of
Alexander
Nesmeyanov
convened
a
conference on the chemical structure of
organic compounds, attended by 400
physicists, chemists, and philosophers, where
"the pseudo-scientific essence of the theory of
resonance was exposed and unmasked"
Alexander Nikolayevich Nesmeyanov
(Russian: Александр Николаевич
Несмеянов) (September 9, 1899,
Moscow - January 17, 1980, Moscow)
was a prominent Soviet chemist and
academician (1943) specializing in
organometallic chemistry. He obtained
his degree in chemistry in 1920 from
Moscow State University where he
thereafter
served
as
lecturer,
professor, and eventually rector.
He was the President of the Soviet
Academy of Sciences in 1951–1961.
As the rector of the Moscow State
University in 1948–1951, he oversaw
the construction of its new campus at
Sparrow Hills. He was twice awarded
the title Hero of Socialist Labor (1969,
1979).
Requisiti per l’aromaticità
Un composto per poter essere classificato come aromatico
deve soddisfare i seguenti criteri:
•Nuvola elettronica π ininterrotta. Questo richiede che la
molecola sia ciclica, planare e con tutti gli atomi ibridati sp2
•Numero dispari di coppie di elettroni π
Regola di Hückel
Perchè un composto planare e ciclico sia
aromatico, la sua nuvola continua di elettroni
deve contenere (4n + 2) π elettroni, dove n è un
numero intero positivo compreso lo zero.
Annuleni
Gli idrocarburi monociclici con un’alternanza di legami singoli e
doppi sono chiamati annuleni.
Il ciclobutadiene non è aromatico perché non ha un numero dispari
di coppie di elettroni.
Il ciclooctatetraene non è aromatico perché non ha un numero
dispari di coppie di elettroni e tra l’altro non è planare.
Esempi
Il ciclopropene non è aromatico perché possiede un carbonio ibridato
sp3 e quindi perde il requisito indispensabile della nuvola π
ininterrotta.
Il catione ciclopropenile è aromatico: numero dispari di coppie
elettroniche π (una), tutti i carboni sono ibridati sp2 (compreso il
carbonio carico positivamente) quindi rispetta i 2 requisiti per
l’aromaticità.
L’anione ciclopropenile non è aromatico perché ha un numero pari
(2) di coppie elettroniche π.
Esempi
Anche il cicloeptatriene e il ciclopentadiene, come il
ciclopropene, non sono molecole aromatiche per la presenza di
un carbonio ibridato sp3 che interrompe la coniugazione
Idrocarburi policiclici aromatici
Esistono anche idrocarburi policiclici aromatici. Per stabilire se un
idrocarburo policiclico è aromatico si applicano gli stessi criteri visti
per gli idrocarburi monociclici.
Naftalene, fenantrene e crisene sono esempi di idrocarburi
policiclici aromatici.
Composti eterociclici aromatici
Esistono composti aromatici che non sono idrocarburi in quanto
contengono uno o più atomi diversi dal carbonio. Si definiscono
composti eterociclici.
Un composto eterociclico è un composto ciclico in cui uno o più
atomi
dell’anello
sono
diversi
dal
carbonio.
L’atomo diverso dal carbonio si chiama eteroatomo.
Gli elementi comunemente presenti sono azoto, ossigeno e zolfo.
La piridina
La piridina è un composto eterociclico aromatico.
Tutti gli atomi dell’anello, compreso l’azoto, sono ibridati sp2 e ogni
atomo possiede un orbitale p.
La coppia elettronica di non legame presente sull’azoto è in un
orbitale sp2 e non partecipa al sistema π.
La piperidina è un composto organico di formula (CH2)5NH. È
un'ammina eterociclica con un anello a sei termini con cinque
unità metilene e un atomo di azoto. È un liquido incolore,
fumante, con un odore descritto come ammoniacale, pepato; il
nome deriva dal genere Piper, che è la parola latina per pepe.
La piperina è l'alcaloide responsabile del gusto piccante del pepe
nero .
Con il termine alcaloide si intende una sostanza organica di
origine vegetale avente gruppi amminici tali da impartire alla
struttura un carattere basico, e dotata di grandi effetti
farmacologici in relazione all'assunzione di piccole dosi di
sostanza .
(E,E)-1-[5-(1,3-benzodioxol-5-il)-1-oxo-2,4pentadienil]piperidina
Il pirrolo
Anche il pirrolo è aromatico. La coppia di elettroni solitaria presente
sull’atomo di azoto, ibridato sp2, si trova in un orbitale p e quindi
partecipa al sistema π.
In totale abbiamo 3 coppie elettroniche π (2 per ogni doppio legame
C-C e una sull’atomo di azoto).
Delocalizzazione elettronica nel pirrolo
Le strutture limite di risonanza mostrano chiaramente
come gli elettroni della coppia solitaria partecipano al
sistema π del pirrolo.
Furano
Anche nel furano, l’ossigeno è ibridato sp2. Delle 2 coppie solitarie,
solo quella presente nell’orbitale p partecipa al sistema π del
furano.
L’altra coppia è localizzata in un orbitale sp2.
Altri composti eterociclici aromatici
Esistono composti eterociclici aromatici policiclici come la
chinolina e l’indolo. Inoltre è possibile la presenza di più
eteroatomi come nella purina e nella pirimidina.
La pirazina
eterociclico
è
un
composto
organico
aromatico
La piperazina è un composto eterociclico esa-atomico in
cui sono presenti due atomi di azoto in posizione 1,4.
La pteridina è un composto organico aromatico eterociclico. Deriva
formalmente dalla fusione di un anello di pirimidina e uno di
pirazina.
Le flavine (dal latino flavus, giallo), sono un gruppo di
composti organici basati sulla pteridina.
Struttura della isoalloxazina in forma ossidata
Riboflavina
La molecola è costituita da tre anelli condensati, che
formano il cosiddetto il gruppo isoallosazinico della
flavina, il quale è a sua volta legato al ribitolo (aldolo a
cinque atomi di carbonio, ovvero il composto derivato
dalla riduzione del ribosio) tramite l'atomo di azoto (N)
dell'anello centrale.
FMN: flavin mononucleotide
FAD: flavin adenin dinucleotide
FAD: flavin adenin dinucleotide
Ricapitolando
Perché un composto sia aromatico esso deve:
1.Essere ciclico
2.Essere planare
3.Possedere una nuvola continua di elettroni π (deve
essere totalmente coniugato)
4.Possedere 4n+2 elettroni π (un numero dispari di
legami π)
Antiaromaticità
Un composto è antiaromatico se è planare, ciclico e possiede una
nuvola continua di elettroni π, ma contiene un numero pari di
coppie di elettroni π.
Un composto antiaromatico è meno stabile di un composto con
elettroni π localizzati.
Reattività del benzene
Il benzene, per la presenza di elettroni p, si comporta da nucleofilo.
Reagisce quindi con elettrofili formando un intermedio carbocationico
(figura 1).
Questo stadio è analogo al primo stadio della reazione di addizione
elettrofila degli alcheni (figura 2).
Reattività del benzene
L’intermedio carbocationico può, in linea di principio,
evolvere in 2 modi:
•a) Dare reazione di addizione con il nucleofilo (stesso
meccanismo degli alcheni). In questo caso si forma un
prodotto finale non più aromatico.
•b) Dare reazione di eliminazione (il nucleofilo Z- si
comporta da base strappando un protone al carbonio
che ha legato l’elettrofilo). In questo caso il prodotto
della reazione è aromatico.
Reazione di sostituzione elettrofila aromatica
Riassumendo: il percorso b corrisponde a un reazione di addizione
elettrofila mentre il percorso a corrisponde a un reazione di
sostituzione elettrofila. Il benzene da solo reazioni di sostituzione
elettrofila.
Meccanismo generale
Quindi quando il benzene, o generalmente un composto
aromatico, reagisce con un elettrofilo (Y+) si forma un prodotto di
sostituzione: un idrogeno viene sostituito dall’elettrofilo.
La reazione è definita sostituzione elettrofila aromatica.
Sostituzione elettrofila aromatica
Sono 5 le reazioni di sostituzione elettrofila
aromatica:
•Alogenazione: un idrogeno è sostituito da un atomo
di alogeno.
•Nitrazione: un idrogeno è sostituito da un gruppo
nitro (NO2).
•Solfonazione: un idrogeno è sostituito da un
gruppo solfonico (SO2H).
•Alchilazione: un idrogeno è sostituito da un gruppo
alchilico (R).
•Acilazione: un idrogeno è sostituito da un gruppo
acile (RC=O).
Meccanismo
Tutte queste reazioni procedono secondo lo stesso
meccanismo generale a due stadi.
•reazione
con
l’elettrofilo
e
formazione
dell’intermedio carbocationico;
•una base strappa il protone dall’intermedio con
conseguente rigenerazione del sistema aromatico.
Meccanismo generale della reazione
di sostituzione elettrofila aromatica
Generazione dell’elettrofilo
I cinque tipi di reazione di sostituzione elettrofila aromatica
differiscono solo per la natura dell’elettrofilo (Y+) e per il
modo con cui quest’ultimo è generato.
Infatti nei meccanismi che di seguito andremo a delineare
dobbiamo prevedere una reazione iniziale che riguarda la
produzione dell’elettrofilo.
Alogenazione
E’ possibile sostituire un atomo di idrogeno del benzene con un
atomo di bromo, cloro oppure iodio
Generazione dell’elettrofilo
Nella reazione di bromurazione e clorurazione è necessaria la
presenza di un acido di Lewis (FeBr3 oppure FeCl3).
L’acido di Lewis, accettando una coppia elettronica dalla molecola di
alogeno, indebolisce il legame alogeno-alogeno, rendendo
disponibile l’elettrofilo necessario a far partire la reazione di
sostituzione.
Generazione dell’elettrofilo
Nella reazione di iodurazione, l’elettrofilo I+ viene ottenuto
per aggiunta di un agente ossidante (ad esempio acido
nitrico, HNO3).
Nitrazione
La reazione di nitrazione è realizzata con acido nitrico in
presenza di acido solforico come catalizzatore.
Nitrazione
A cosa serve l’acido solforico?
Tra l’acido nitrico e l’acido solforico avviene una reazione acido base
secondo il meccanismo delineato in seguito con formazione dello
ione nitronio, un potente elettrofilo.
Nota bene: acido nitrico e acido solforico sono acidi di forza
differente. L’acido solforico, più forte, accetta una coppia di elettroni
dall’acido nitrico che quindi si comporta da base.
Formazione del nitrobenzene
Lo ione nitronio reagisce poi secondo il meccanismo
generalmente delineato in precedenza portando alla
formazione del nitrobenzene.
Solfonazione
La solfonazione viene realizzata con acido solforico concentrato
a caldo. E’ l’unica tra le reazioni di sostituzione elettrofila
aromatica ad essere reversibile.
Acilazione e alchilazione
Le reazioni di alchilazione e acilazione di Friedel-Crafts
consentono di introdurre sull’anello aromatico rispettivamente
un gruppo alchile (R) oppure un gruppo acile (RC=O). Sono
importanti reazioni che consentono di introdurre una catena
carboniosa sull’anello aromatico.
Acilazione: lo ione acilio
Nella reazione di acilazione, l’elettrofilo è lo ione acilio che si
forma per reazione di un cloruro acilico con un acido di Lewis
come AlCl3.
Alchilazione
Nella reazione di alchilazione si genera un carbocatione alchilico
per reazione tra un alogenuro alchilico e un acido di Lewis.
La reazione tra il carbocatione e il benzene porta alla formazione
di un alchilbenzene.
Nel caso in cui il benzene è “sostituito”, qual è l’effetto del
sostituente sulla reattività dell’anello aromatico?
La reattività aumenta o diminuisce?
La posizione occupata dal
sostituente E2 è casuale?
SOSTITUENTI ATTIVANTI E DISATTIVANTI.
I SOSTITUENTI CHE ATTRAGGONO GLI
ELETTRONI
DELL’ANELLO
DI
RISONANZA
BENZENICO
SONO
DISATTIVANTI,
QUELLI
CHE
LI
RESPINGONO SONO ATTIVANTI.
Effetto dei sostituenti sulla reattività
La velocità di una reazione di sostituzione elettrofila aromatica
dipende molto da un eventuale sostituente già presente sull’anello
aromatico.
Un sostituente capace di donare elettroni all’anello aromatico
facilita da un punto di vista cinetico la reazione di sostituzione
elettrofila ed è definito attivante.
Un sostituente a richiamo elettronico diminuisce la velocità di
reazione ed è definito disattivante.
Effetti del sostituente
I principali effetti “elettronici” che un sostituente può esercitare
sull’anello aromatico sono di due tipi:
INDUTTIVO – si esercita attraverso elettroni s ed è
causato dalle caratteristiche relative di elettronegatività.
• + i: quando il sostituente può spingere elettroni s
verso l’anello aromatico.
• - i : quando il sostituente può attrarre elettroni s
dall’anello aromatico.
MESOMERICO (o di risonanza) – si esercita attraverso gli
elettroni p e può essere rappresentato da strutture di risonanza.
• + m: quando il sostituente può trasferire elettroni p verso
l’anello aromatico.
• - m: quando il sostituente può estrarre elettroni p dall’anello
aromatico.
Effetto di risonanza
La donazione elettronica può verificarsi anche quando l’anello aromatico è
legato a un gruppo in grado di donare elettroni per risonanza (esempio l’anisolo).
Esistono poi casi in cui il sostituente richiama elettroni per
risonanza.
Sostituenti fortemente attivanti: donano elettroni per
risonanza e richiamano elettroni per effetto induttivo.
Sostituenti attivanti
Sostituenti debolmente attivanti: donano elettroni per
effetto induttivo.
Nota bene: la donazione o il richiamo elettronico è molto
più efficace quando avviene per risonanza e non per effetto
induttivo.
Sostituenti disattivanti
Sostituenti disattivanti: rendono l’anello benzenico meno
reattivo nella reazione di sostituzione elettrofila.
Gli alogeni sono debolmente disattivanti: donano elettroni
per risonanza, richiamano elettroni per effetto induttivo.
Sostituenti disattivanti
Effetti dei sostituenti sull’orientazione
Il sostituente già presente determina la posizione del nuovo sostituente
Due sono le possibili orientazioni:
•il sostituente orienta orto-para (si forma una miscela dell’isomero orto
e dell’isomero para);
•il sostituente orienta meta (si forma solo l’isomero meta).
L’ossidrile fenolico esercita effetto elettron-attrattore
sull’anello ma, per l’effetto mesomerico, le posizioni
meno impoverite di elettroni sono le posizioni orto e para.
OH
OH
OH
-OH è attivante e orto-para orientante
OH
Il doppietto elettronico dell’azoto del gruppo amminico
è delocalizzato nell’anello.
Ciò produce due effetti:
1. le ammine aromatiche sono meno basiche delle
ammine alifatiche,
2. La densità elettronica è maggiore nelle posizioni 2, 4 e 6
dell’anello che nelle posizioni 3 e 5.
NH2
NH2
NH2
-NH2 è attivante e orto-para orientante
NH2
L’effetto elettron-attrattore e l’effetto mesomerico
impoveriscono di elettroni sopratutto le posizioni
2,4 e 6 dell’anello aromatico.
O
N
O
O
N
O
O
N
O
-NO2 è disattivante e meta orientante
O
N
O
I gruppi alchilici legati al benzene aumentano la
disponibilità di cariche elettriche negative delocalizzate
nell’anello aromatico
H
H C H
- effetto induttivo, attivante e orto-para orientante
CH3
NOMENCLATURA
LA POSIZIONE DEI SOSTITUENTI PUÒ ESSERE INDICATA COME
orto, meta, para
Quando sono
presenti piu’ di due
sostitenti si usano i
numeri
ARENI
È IL NOME DELLA CLASSE
•
•
GRUPPO ARILE (AR)
IMPORTANTI SONO IL GRUPPO FENILE E QUELLO BENZILE