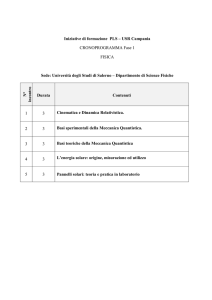
CAMPUS ESTIVO DI MATEMATICA, FISICA E
ASTROFISICA
17-23 luglio 2016
BARDONECCHIA
INTRODUZIONE ALLA MECCANICA
QUANTISTICA
Donatella Crosta
(SAIt )
Indice
Introduzione
Lo sviluppo storico
I fatti sperimentali e le idee:
Spettro del corpo nero e la relazione di Planck
Effetto fotoelettrico e la spiegazione da parte di Einstein
Diffusione Compton
Spettro dell’idrogeno e la quantizzazione di Bohr
L’aspetto ondulatorio della materia e la lunghezza d’onda di
de Broglie
Il fallimento dei concetti familiari :
esperimento delle due fenditura di Feynman
una nuova rappresentazione degli oggetti fisici
Il principio di Heisenberg :
il postulato di misura
Nucleo essenziale del “formalismo” matematico :
Paradossi quantistici:“il barile di polvere” e “il gatto di Schrődinger”
“collasso della funzione d’onda”o riduzione dello stato
La fisica quantistica è completa ?
Correlazione quantistica o “entanglement”:
particelle che si intrecciano
“olismo”
La non separabilità:
paradosso EPR e teorema di Bell
Conclusioni
2
Introduzione
“Penso di poter tranquillamente dire che nessuno capisce la meccanica
quantistica”
Richard Feynman
“Nelle scienze esatte è lecito presupporre che sarà sempre possibile
comprendere la natura, non bisogna però fare alcuna assunzione a
priori sul significato della parola “comprendere”
Werner Heisenberg
Capire significa ricondurre a schemi mentali noti ciò che cerchiamo di
comprendere, però i nostri schemi mentali sono basati sull’esperienza e noi
abbiamo esperienza solo del mondo classico: la nostra intuizione non ci aiuta
quindi a capire la meccanica quantistica ( Feynman, 1965 ).
Tutte le scienze hanno una struttura comune ed ogni teoria si basa su un
insieme di regole, assiomi o postulati , combinando i quali si creano nuove
asserzioni, leggi o teoremi: l’insieme di questi costituiscono la teoria.
I matematici sono liberi di scegliere i postulati in modo del tutto arbitrario,
secondo criteri di ragionevolezza; i fisici invece scelgono i postulati facendosi
guidare dagli esperimenti : infatti lo scopo della fisica è quello di descrivere la
natura attraverso osservazioni.
Cercherò di seguire, per quanto possibile, quest’ultimo approccio per non
perdersi in un formalismo troppo astratto che può far perdere di vista l’aspetto
fisico, anche se comunque dovremo utilizzarlo in forma molto semplice.
Pensiamo allora ad un atomo, il più semplice, l’atomo di idrogeno: questo
sistema ci ricorda quello formato da Sole e Terra. Immaginiamo che l’analogia
sia esatta e domandiamoci se questo tipo di analogia è appropriata.
Allora l’elettrone deve possedere una traiettoria ben definita, come quella di
un pianeta, ma per l’elettromagnetismo dovrebbe perdere energia emettendo
luce fino a “precipitare” sul nucleo! Cosa che non accade: gli atomi sono
struttura stabili.
Che lezione trarre?
Nel mondo dell’ infinitamente piccolo quasi niente obbedisce alle leggi della
fisica classica (meccanica per gli oggetti materiali, elettromagnetismo per i
3
fenomeni elettromagnetici e termodinamica per i trasferimenti di calore e di
moto)
La fisica quantistica quindi costringe ad una rottura netta sia con l’intuito sia
con le rappresentazioni semplici e “ragionevoli” del mondo che ci circonda,
utilizzando entità astratte che disturbano il nostro senso della realtà.
Nonostante le difficoltà legate all’interpretazione, essa è diventata una teoria
che è alla base di quasi tutte le branche della fisica moderna, avendo
applicazioni in vari settori: dalla fisica delle particelle, all’astrofisica,
all’elettronica, alla fisica dei solidi.
Lo sviluppo storico
Verso la seconda metà del XIX secolo c’era la convinzione che la meccanica
"classica" (Newton e sviluppi successivi), l’elettromagnetismo ( equazioni di
Maxwell) e la termodinamica (Carnot, Joule ) riuscissero spiegare tutti i
fenomeni naturali anche quelli ancora di difficile interpretazione. Tuttavia negli
ultimi anni del secolo, e nei primi di quello successivo, vennero eseguiti
alcuni esperimenti che in alcun modo potevano essere inquadrati nei modelli
precedenti. Questi fenomeni riguardavano il mondo dell’infinitamente piccolo
( struttura intima della materia e interazioni materia ed energia, stabilità degli
atomi)
Queste scoperte portarono ad una rivoluzione del pensiero scientifico
paragonabile a quella del XVII secolo con Galilei e Newton.
In un primo momento i fisici cercarono dei modelli "ad hoc" per le varie classi
di fenomeni. Non si trattava di un ritorno all’aristotelismo, ma di un tentativo di
descrivere in un modo completamente nuovo ciò che si osservava
sperimentalmente. Tutti questi modelli sviluppati "ad hoc", avevano però un
punto fondamentale in comune: l’energia doveva essere "quantizzata". In
pratica i vari sistemi fisici possono scambiare energia soltanto in quantità ben
definite: a pacchetti o "quanti". Il quanto elementare di energia è legato ad
una costante universale la costante h, che oggi chiamiamo costante di
Planck e che vale 6.62618·0-34J s. Planck fu il primo ad introdurla per
spiegare lo spettro di corpo nero.
Solo in un secondo momento, a partire dagli anni 20 del XX secolo si
cominciò a sviluppare una teoria organica che portò alla moderna meccanica
quantistica. La nuova fisica dà una visione probabilistica della realtà
microscopica in contrasto con la visione deterministica del mondo
4
macroscopico dato dalla fisica classica. Gli stessi concetti di realtà fisica e di
misura delle grandezze fisiche hanno subito un mutamento radicale.
Il 14 dicembre 1900 alla Physikalische Gesellschaft di Berlino, Max Planck
affermò che ci si poteva liberare dei paradossi che infestavano la teoria
classica dell’emissione e assorbimento della luce da parte di corpi materiali:
l’energia raggiante poteva esistere solo sotto forma di pacchetti di energia
discreti. Questa può essere considerata la nascita della fisica quantistica.
Cinque anni dopo Albert Einstein applicò con successo l’idea dei quanti di
luce per spiegare l’effetto fotoelettrico. Nel 1913 Niels Bohr estese l’idea di
Planck alla descrizione dell’energia meccanica degli elettroni in un atomo e
nel 1925 Louis de Broglie diede un’interpretazione delle orbite quantizzate di
Bohr; subito dopo Werner Heisenberg e Erwin Schrödinger formularono due
diverse teorie, rispettivamente la meccanica matriciale e la meccanica
ondulatoria che pur essendo diverse dal punto di vista matematico,
esprimevano gli stessi concetti dal punto di vista fisico.
IL CORPO NERO
Nell’Universo è presente radiazione e materia; quando la radiazione incontra
la materia viene in parte assorbita, ma se non venisse anche riflessa come
nel caso ad esempio della Terra, che riceve continuamente energia dal Sole,
aumenterebbe la propria temperatura progressivamente, cosa che invece,
ad eccezione di qualche piccola oscillazione, non accade. Quindi
l’assorbimento è accompagnata dall’emissione
La legge di Stefan-Boltzamann esprime la quantità di energia emessa in un
tempo Δt da un corpo alla temperatura T
ΔQ/ Δt = εσA T4
1)
dove A è l’area della superficie raggiante,
ε è il coefficiente di emissione (o assorbimento ) che può assumere valori
compresi tra 0 e 1 a seconda delle caratteristiche fisiche della superficie: una
superficie avente il massimo di emittanza pari a 1 è detto corpo nero.
σ vale 5,67 · 10-8 W / m²K4 ed è chiamata costante di Stefan-Boltzmann
in onore di Stefan che scoprì sperimentalmente la legge 1) nel 1879 e
Boltzmann che la ricavò teoricamente subito dopo.
Un corpo nero è un sistema fisico formato da una cavità con un piccolissimo
foro, tale che la radiazione che vi entra ha bassa probabilità di uscirne. La
frazione di energia che esce dal foro prende il nome di radiazione del corpo
nero e dipende esclusivamente dalla temperatura delle pareti.
5
L’esperimento mostra che fino ad una certa temperatura la cavità appare
nera, verso i 600°C comincia ad emettere luce di colore rosso scuro, al
crescere della temperatura la luce diventa sempre più intensa fino a diventare
di colore bianco.
Se, per diverse temperature, si registra l’intensità della radiazione alle varie
lunghezze d’onda si ottiene il grafico di fig.1.
Si nota che il valore della lunghezza d’onda λmax a cui corrisponde il
massimo di intensità cresce in proporzione con la temperatura T secondo
la legge di Wien
λmax T = 2,898·10- ³
m·K
2)
fig.1
Il grafico di fig.1 mostra lo spostamento del massimo di emissione verso
lunghezze d’onda più corte all’aumentare della temperatura secondo la legge
di Wien:
6
Le spiegazioni
Secondo la legge classica, modello proposto da Rayleigh e Jeans, gli
atomi della superficie interna della cavità si comportano come piccole
antenne capaci di assorbire e riemettere la radiazione . Le previsioni
classiche sono in accordo con i dati sperimentali solo per valori grandi della
lunghezza d’onda, questo modello però porta a prevedere che la radiazione
aumenti con il diminuire della lunghezza d’onda e che quindi l’energia
emessa sia infinità! ( catastrofe ultravioletta ) . Se questo fosse vero,
aprendo semplicemente un forno da cucina saremmo investiti da una
radiazione ultravioletta mortale di potenza infinita.
La legge di Rayleigh- Jeans sull’andamento dell’intensità della radiazione
emessa in funzione della lunghezza d’onda è espressa come
P ( λ, T ) = 2πckB T/ λ4
3)
Dove kB = 1,381 10ˉ²³ J/ K è la costante di Boltzmann
Nel 1899 Planck fece l’ipotesi che lo scambio di energia tra radiazione e
materia non avvenisse in modo continuo ma discreto, cioè per multipli interi
di una quantità minima fondamentale di energia, quanto, la cui energia è
proporzionale alla frequenza della radiazione secondo la relazione
E = hν
4)
dove h è la costante di Planck, il cui valore è
h= 6,62618 -10-34 J s
poiché la costante di Planck ha le dimensioni fisiche di un’energia per un
tempo, ossia di un’azione, fu chiamata quanto d’azione*.
Nonostante questo successo Planck in un primo tempo considerava
l’introduzione dei quanti un artificio di calcolo: infatti presentando i suoi
risultati al congresso della Società tedesca di Fisica il 14 dicembre del 1900
definì la quantizzazione “ un atto di disperazione” . Negli anni successivi
la quantizzazione si sarebbe rivelata la caratteristica fondamentale dei
fenomeni microscopici.
*Il significato di “azione”
L’azione è definita come prodotto tra variazione di energia e intervallo di tempo ΔEΔt o
come prodotto tra variazione di quantità di moto e variazione di posizione ΔpΔx. E’ una
7
grandezza della fisica classica per mezzo della quale si possono spiegare alcune
proprietà dei corpi come ad esempio il caso del moto di una particella su un piano
inclinato per cui si dimostra che esiste una particolare traiettoria (cicloide ) per la quale
l’azione è minima ( principio di minima azione formulato da P.L.M. de Maupertuis nel
1747).
Un altro esempio si ha in ottica nel principio di Fermat nel caso di un raggio che
subisce una rifrazione passando da un mezzo ad un altro
Spettro della luce bianca emessa dal filamento di una lampada
Lo studio delle proprietà del corpo nero permette di comprendere i
meccanismi di emissione delle sorgenti astronomiche ed anche di sorgenti ad
una determinata temperatura quali, ad esempio, il filamento di una lampada
fig.2
Il grafico di fig.2 mostra l’intensità di emissione di una lampada ad
incandescenza ; il massimo è collocato nell’ infrarosso eppure la lampada
8
emette luce visibile; questo perché, come si vede dal grafico la funzione si
estende fino a 0.3 micron che comprende l’intervallo di lunghezze d’onda del
visibile. In base a quanto detto sopra si può vedere come a lunghezze d’onda
dell’infrarosso l’energia emessa sia maggiore di quella emessa a lunghezze
d’onda dell’ultravioletto.
EFFETTO FOTOELETTRICO
La teoria ondulatoria della radiazione elettromagnetica entrò in crisi verso la
fine del XIX secolo con gli esperimenti condotti da H. Hertz ( 1857-1894) e
da P.Lenard (1862-1947) che pubblicò i risultati nel 1902 e ricevette il premio
Nobel nel 1905.
Questi esperimenti mostrarono un effetto nuovo nell’interazione della luce
con la materia : l’effetto fotoelettrico, che consiste nel far incidere un fascio
di luce di lunghezza d’onda opportuna su una superficie metallica che in
determinate condizioni può espellere elettroni.
Nel 1900 Lenard dimostrò che quando la luce incide su una superficie
metallica, l’energia cinetica degli elettroni estratti , fotoelettroni, non dipende
dall’intensità della luce assorbita dalla lastra, che determina invece il numero
degli elettroni emessi.
La fig.3 mostra l’apparato sperimentale per lo studio dell’effetto fotoelettrico.
Fig.3
9
La luce ultravioletta colpisce il catodo C posto in un tubo a vuoto; tra C ed A
vi è una differenza di potenziale che può essere variata , gli elettroni emessi
quindi possono essere sia accelerati sia rallentati . Tramite un potenziometro
si può modificare sia il segno sia il modulo del potenziale dell’anodo. L’anodo
A , in corrispondenza quindi di un valore Vo del potenziale , potenziale
d’arresto , può respingere tutti gli elettroni, arrestandoli. In questa situazione
l’amperometro A segna l’eventuale passaggio di corrente.
1° esperimento
Si regola il potenziale ad un valore V0 ,chiamato potenziale d’arresto, in
corrispondenza del quale l’anodo può respingere tutti i fotoelettroni
causandone l’arresto. In questa situazione di equilibrio l’energia totale del
sistema è nulla : l’energia potenziale negativa che arresta i fotoelettroni
eguaglia la loro energia cinetica
Ecinmax = e Vo
5)
dove e è la carica dell’elettrone
La fig.4 mostra l’andamento della corrente in funzione della differenza di
potenziale quando la lastra è colpita da luce di lunghezza d’onda fissata.
Fig.4
i
I3
I2
I1
ν>ν0
V0
V
10
Si nota che il valore limite della corrente è direttamente proporzionale
all’irraggiamento I (energia assorbita nell’unità di tempo per unità di
superficie perpendicolare alla direzione della luce) mentre il potenziale
d’arresto e quindi l’Energia cin max degli elettroni è indipendente
dall’irraggiamento
Le spiegazioni
Secondo la fisica classica : se la luce è un’onda elettromagnetica,
l’elettrone sotto l’azione del campo elettrico oscillante si mette ad oscillare e
se acquista energia sufficiente riesce a sfuggire dalla superficie del metallo.
Aumentando l’irraggiamento dovrebbe aumentare l’energia cinetica massima
dell’elettrone espulso, ma ciò non accade .
Secondo l’ipotesi dei fotoni: Einstein nel 1905 riprese l’ipotesi di Planck
dimostrando che gli atomi del materiale acquistano l’energia non con
continuità ma a pacchetti di energia denominati fotoni , ciascuno dei quali
possiede un’energia pari a
E= hv
6)
quindi ciascun elettrone può essere emesso solo se il singolo fotone cede
una quantità di energia sufficiente a strappare l’elettrone dalla superficie del
metallo: questo particolare valore dell’energia è chiamato lavoro di
estrazione Wo .
Se si aumenta quindi l’intensità della radiazione, aumenta solo il numero dei
fotoni ma non la loro energia e quindi neppure quella degli elettroni.
2° esperimento
Si fa variare la frequenza della luce incidente, si osserva che l’effetto
fotoelettrico non avviene se la frequenza non supera un valore minimo detto
frequenza di soglia vo che è sempre lo stesso qualunque sia l’intensità
della luce
11
fig.5
La fig.5 mostra l’andamento dell’energia cinetica e quindi del potenziale
d’arresto al variare della frequenza della radiazione incidente.
Le spiegazioni
Secondo la fisica classica, se la luce è un’onda gli elettroni possono
sempre essere espulsi: è sufficiente fornire l’energia necessaria e cioè luce di
intensità elevata, ma ciò non accade, l’effetto fotoelettrico non avviene se la
frequenza è minore della frequenza di soglia.
Secondo l’ipotesi dei fotoni : l’elettrone, per spezzare il legame che lo tiene
legato all’atomo deve acquistare una quantità minima di energia, detta
energia o lavoro di estrazione Wo . Se il fotone non cede un’energia E= h v
almeno uguale a Wo l’elettrone non riesce ad abbandonare la superficie.
Un fotone di frequenza maggiore cederà all’elettrone una quantità maggiore
di energia, ma l’elettrone, per poter sfuggire dal metallo, dovrà cederne una
parte , Wo , a seconda del tipo di materiale
Legge dell' effetto fotoelettrico da parte di Einstein
h v = Wo + E cin max
7)
questa legge non è altro che una legge di conservazione dell’energia per
l’interazione di un fotone di frequenza v ed un elettrone appartenente ad una
sostanza caratterizzata da un lavoro di estrazione Wo . l’eventuale
12
eccedenza di energia , h v - Wo la si ritrova sotto forma di energia cinetica
dell’elettrone come si può osservare dalla fig.5
APPLICAZIONI DELL’EFFETTO FOTOELETTRICO
Dispositivo ad accoppiamento di carica ( CCD )
Vengono usati nelle fotocamere digitali al posto della pellicola , nelle videocamere digitali
negli scanner ed in astronomia.
Con luce visibile una “matrice” CCD è formata da uno strato semiconduttore di Silicio e da
un certo numero di elettrodi, tale matrice è divisa in parti, pixel, ciascuno dei quali cattura
un’immagine. Una fotocamera può averne fino a dieci milioni. Consideriamo un pixel: un
fotone colpisce il silicio producendo elettroni per effetto fotoelettrico, che rimane
intrappolato all’interno del pixel a causa del potenziale applicato, quindi il numero di
elettroni intrappolati è proporzionale al numero di fotoni e quindi all’intensità della luce in
quel punto. L’informazione sul colore avviene mediante filtri o prismi che separano i colori
Cancelli automatici
Un’unità trasmittente invia un fascio di infrarossi ( IR ) attraverso il vano apertura, che
viene raccolto da un’unità ricevente fornita di fotodiodo ( dispositivo che , colpito da una
radiazione elettromagnetica, restituisce una differenza di potenziale proporzionale alla
radiazione incidente ). Se un ostacolo intercetta il fascio impedisce alla luce di raggiungere
l’unità ricevente e la corrente nel fotodiodo diminuisce. Questa variazione di corrente viene
rilevata da un dispositivo elettronico che blocca la chiusura del cancello.
Astronomia
v. foto in scuola estiva /fotoelettrico/corponero_astronomia
Fotomoltiplicatori elettronici
I fotomoltiplicatori elettronici sono dispositivi che rivelano la presenza di un flusso
luminoso con una sensibilità complessiva molto elevata, sfruttando contemporaneamente
il fenomeno della fotoemissione e quello della emissione secondaria. Il principio di
funzionamento di un fotomoltiplicatore è indicato in figura.
La luce incidente su un catodo fotoemissivo (fotocatodo) che provvede all'emissione di
elettroni in numero proporzionale al numero dei fotoni incidenti
13
(in medi a l ' emi s s i one di un el et t r one puòcor r i s ponder e al l ' i nci denza di 10÷20 f ;otglioni )
elettroni così emessi sono convogliati (per mezzo di un opportuno potenziale acceleratore)
verso l'elettrodo. Di denominato dinodo. Gli elettroni che giungono sul dinodo Di cedono la
loro energia cinetica provocando l'emissione secondaria di altri elettroni dal dinodo stesso
(ad un elettrone incidente o primario possono corrispondere anche più di 10 elettroni
secondari). Gli elettroni secondari emessi dal dinodo Di vengono convogliati e quindi
moltiplicati (sempre per emissione secondaria) dal dinodo successivo e così via fino
all'ultimo elettrodo raccoglitore che è l'anodo. È evidente quindi che da una piccola
quantità di luce mediante il fotomoltiplicatore si può ottenere una apprezzabile intensità di
corrente: si può giungere ad una sensibilità di alcuni ampere/lumen. Il fotocatodo è
costituito da un supporto rivestito di uno strato di materiale fotosensibile come ad esempio
l'antimoniuro di cesio, l'ossido di rame-berillio e l'ossido di argento-magnesio.
L'amplificazione complessiva A del sistema di moltiplicazione elettronica, ossia il
rapporto tra il numero di elettroni raccolti dall'anodo e quello degli elettroni emessi dal
fotocatodo, dipende dal rendimento di raccolta e dal coefficiente di emissione secondaria
di ogni dinodo. Il rendimento di raccolta g è il rapporto tra il numero di elettroni incidenti
in un dinodo ed il numero di elettroni emessi dal dinodo precedente;
LA DIFFUSIONE COMPTON
La teoria venne definitivamente accettata nel 1924, quando Arthur Compton
(1892-1962 ) scoprì un fenomeno legato all’esistenza dei fotoni.
Secondo la teoria della relatività ad un’onda elettromagnetica che trasporta
energia, E, è associata una quantità di moto p= E/c : infatti nella teoria della
relatività l’energia di una particella è data da
E² =p²c² + ( mc² ) ²
8)
Nel caso di particella con massa a riposo nulla come il fotone
si ottiene:
E² =p²c² →
E = pc
9)
e quindi
p = E /c
10)
quindi un fotone possiederà una quantità di moto
p = hν/c = h/λ
11)
dove λ è la lunghezza d’onda della radiazione
14
L’esperimento che Compton realizzò consiste nell’inviare un fascio di raggi X
di lunghezza d’onda λ contro un bersaglio costituito di atomi di carbonio
La fig.6 è una rappresentazione schematica dell’effetto Compton
Il fotone giunge da sinistra ed urta l’elettrone in quiete; dopo l’urto il fotone si
muove lungo una direzione che forma un angolo φ con la direzione prima
dell’urto
fig.6
Si osservò che i raggi diffusi avevano una lunghezza d’onda λ’ maggiore
della lunghezza d’onda λ dei raggi incidenti. La differenza tra le lunghezze
d’onda non dipende dal materiale del bersaglio, ma dipende unicamente dall’
angolo φ secondo la legge determinata da Compton
λ’ – λ = λo (1 – cos φ )
12)
dove λo = h / mc =2.4 · 10 ˉ¹² m. prende il nome di lunghezza d’onda
Compton
15
Se φ = 0 il fotone diffuso ha la stessa lunghezza d’onda di quello incidente,
ossia non c’è interazione.
Se φ = 90° allora λ’ – λ = λo
Se φ = 180°, cioè per radiazione diffusa all’indietro. la differenza è massima
Le spiegazioni
Secondo la teoria elettromagnetica classica : gli elettroni dovrebbero
oscillare con la stessa frequenza della radiazione incidente ed emettere a
loro volta radiazioni di frequenza uguale a quella della radiazione incidente
Secondo l’ipotesi dei fotoni : l’urto avviene in modo simile ad un urto tra
palle da biliardo; ammettendo che valgano le leggi di conservazione
dell’energia e della quantità di moto :
hν = hν’ + Ecin
13)
dove hν è l’energia del fotone incidente
hν’ l’energia del fotone diffuso
Ecin ll’energia cinetica acquistata dall’elettrone
LO SPETTRO DELL’ATOMO DI IDROGENO
Spettri di emissione degli atomi
Sul finire del XIX secolo furono effettuati esperimenti che consistevano nel far
passare scariche elettriche nei gas ed analizzando la luce emessa.
Analizzando allo spettroscopio si evidenzia uno spettro a righe di emissione
del gas: cambiando il gas cambia il tipo di spettro
Un fascio di luce che incide su un prisma viene scomposto nelle sue
componenti monocromatiche dando luogo, su uno schermo posto dietro il
prisma , ad uno spettro continuo di tutti i colori dal rosso
fino al violetto.
Oltre gli spettri di emissione si hanno spettri di assorbimento che si
ottengono quando la luce bianca viene fatta passare attraverso un elemento.
16
Il confronto tra spettro di emissione e d assorbimento di una stesso elemento
mostra che le righe di emissione hanno la stessa posizione di quelle di
assorbimento, ciò significa che ogni elemento assorbe lo stesso tipo di
radiazione che è in grado di emettere ( principio di inversione dello
spettro )
La fotografia mostra lo spettro di emissione del mercurio
Gli spettri di un elemento rappresentano un “messaggio” sulla struttura
dell’atomo di quell’elemento.
Il primo passo per decifrare questo messaggio fu fatto da Balmer ( 18251898 ) che nel 1885 riuscì ad esprimere le frequenze ν delle
righe dello spettro dell’atomo di idrogeno con la seguente formula, detta
serie di Balmer
ν = R ( 1 / 4 – 1 / n² )
n = 3, 4, 5,…
14)
Dove R = 3,2881·10 15 Hz è la costante di Rydberg
17
Negli anni successivi Lyman, Paschen e Brackett scoprirono altre serie di
righe rispettivamente nell’ultravioletto e nell’infrarosso
In conclusione l’intero spettro dell’atomo di idrogeno può essere espresso
dalla formula
ν = R ( 1 / m² - 1 / n² )
15)
dove per m = 1, 2 ,3 ,4 si hanno rispettivamente le serie di Lyman, Balmer,
Paschen e Brackett ed n assume valori interi maggiori di m.
LA “QUANTIZZAZIONE” DI BOHR
In questi anni si svilupparono i modelli dell’atomo “plum pudding” di Thomson
( 1865-1940 ), lo scienziato che scoprì l’elettrone, modello che fu
abbandonato per il modello di Rutherford, che tuttavia non riusciva a spiegare
due fatti:
1) secondo l’elettrodinamica classica un elettrone, ruotando, irraggia
energia quindi alla fine dovrebbe cadere sul nucleo; il tempo previsto
per perdere tutta l’energia è dell’ordine del centomilionesimo di
secondo !
2) la frequenza di rotazione dovrebbe diventare sempre più grande con il
diminuire del raggio dell’orbita e la radiazione emessa dovrebbe dar
luogo ad uno spettro continuo in disaccordo con i fatti sperimentali
Niels Bohr (1885-1962 ) nel 1911, riprendendo l’ipotesi dei quanti, enunciò i
seguenti postulati:
1) l’elettrone ruota su orbite stazionarie senza perdere energia
2) le orbite stazionarie sono caratterizzate da avere un momento angolare
L multiplo intero della costante di Planck secondo la seguente formula
(quantizzazione del momento angolare)
L = n h / 2π
n= 1, 2, 3 …..
16)
18
3) un elettrone può passare da un’orbita stazionaria ad un’altra di energia
inferiore, emettendo un quanto di radiazione di frequenza ν, secondo la
relazione
Efin – Ein = hν
17)
I primi due postulati sono in pieno contrasto con la fisica classica: il primo
ammette che una carica elettrica possa ruotare senza irraggiare, il secondo
introduce la quantizzazione per le orbite, escludendo quindi infinite orbite, il
terzo spiega il meccanismo dell’irraggiamento
L’ ASPETTO ONDULATORIO DELLA MATERIA
La teoria di Bohr non soddisfaceva completamente i fisici nel periodo tra il
1913 ed il 1925 : infatti non spiegava alcuni fatti ( ad esempio l’intensità delle
righe spettrali ) ed era incongruente in quanto faceva uso di alcune leggi della
fisica classica ma ne rinnegava altre.
Tra il 1925 ed il 1927 per opera di alcuni fisici quali de Broglie, Heisenberg,
Schrödinger, Born, Pauli, Dirac ed altri si sviluppò una nuova teoria, la
meccanica quantistica, che riuscì a spiegare con successo tutti i fenomeni
atomici conosciuti
Lunghezza d’onda di de Broglie
L’idea di de Broglie ( 1892-1987 ) fu il punto di partenza per la costruzione
della meccanica quantistica. De Broglie prese come modello le orbite
elettroniche di Bohr per il suo modello di onde. Immaginò che ogni elettrone,
muovendosi lungo un’orbita, fosse accompagnato da un’onda. La prima
orbita quantica portava una sola onda, la seconda due e così via: quindi la
lunghezza della prima onda sarà uguale alla lunghezza della prima orbita
2πr1, quella della seconda uguale alla metà della lunghezza della seconda
orbita 2πr2 /2 e così via.
Le relazioni introdotte da Einstein per i fotoni
E = hν = ħ2π / T= ħω
p=h/λ
18 )
si applicano anche ad una particella, come un elettrone
19
Quindi per de Broglie l’aspetto corpuscolare dei fenomeni è una
manifestazione di una legge generale che vale sia per la radiazione sia per la
materia.
Per l’elettrone nell’atomo la meccanica classica prevede un’orbita chiusa,
quindi perché sia stabile, l’onda associata all’elettrone dovrà richiudersi su se
stessa, quindi, come detto sopra, la lunghezza dell’orbita deve essere uguale
ad un numero intero di lunghezze d’onda (v.fig.7).
Fig. 7
2π rn = n λ
19 )
dove rn è il raggio dell’orbita
le orbite risultano così quantizzate ; confrontando 18 ) e 19) si ottiene
2π rn = n h / p
20)
m v rn = n h / 2π
21)
che coincide con la quantizzazione del momento angolare 16) vista
precedentemente.
20
Esperimento di Davisson e Germer
Le ipotesi di de Broglie vennero confermate da un esperimento realizzato nel
1927 da Davisson e Germer.
Essi inviarono contro un bersaglio di nichel un fascio di elettroni ( v. fig.8 )
con lunghezza d’onda dello stesso ordine di grandezza del passo reticolare,
misurarono la distribuzione degli elettroni e trovarono una distribuzione di
elettroni con massimi e minimi disposti regolarmente
fig.8
21
La fig.9 mostra il confronto tra le figure di diffrazione ottenute con elettroni,
a sinistra, e con raggi X, a destra. Dato che la lunghezza d’onda è
confrontabile con quella dei raggi X di eguale energia si possono confrontare
le figure create sullo stesso bersaglio
fig.9
Questo risultato poteva essere spiegato solo come interferenza delle “onde
con lunghezza d’onda di de Broglie” associate agli elettroni.
Heisenberg dirà:luce e materia sono fenomeni fisici unitari; la loro apparente
doppia natura deriva soltanto dalla sostanziale insufficienza del nostro
linguaggio.
L’equazione d’onda di Schrödinger
De Broglie non elaborò però subito una teoria matematica del fenomeno; nel
1926, circa un anno dopo la sua pubblicazione, un fisico austriaco Erwin
Schrödinger scrisse un’equazione generale per le onde di de Broglie
dimostrandone la validità per ogni tipo di moto elettronico. Questa equazione
è molto simile alle equazioni d’onda relative alla propagazione delle onde
sonore e delle onde elettromagnetiche: ne riparleremo più avanti.
I risultati, relativi ai livelli energetici dell’atomo di idrogeno,ottenuti sulla base
22
dell’equazione di Schrödinger sono identici a quelli ottenuti in base alla teoria
di Bohr, ma cambia notevolmente l’aspetto fisico. Secondo Bohr si avevano
orbite circolari ed ellittiche su cui ruotano gli elettroni puntiformi, secondo
Schrödinger invece il moto degli elettroni era governato dalle onde di de
Broglie a tre dimensioni che circondavano il nucleo atomico e le cui
frequenze di vibrazione erano determinato da forze elettriche e magnetiche.
Il fallimento dei concetti familiari
La fisica quantistica, come abbiamo detto, si basa su un formalismo
matematico potente ma non trasferibile in linguaggio comune; cerchiamo
quindi di esporla in modo semplice non tralasciandone ovviamente il rigore.
Ricordiamo che la fisica classica distingue essenzialmente due categorie di
oggetti; i corpuscoli da una parte e le onde dall’altra.
I corpuscoli sono entità puntiformi, localizzate in una regione di spazio
ristretta, le onde non sono localizzate con precisione.
Le onde non trasportano materia, trasmettono energia ed informazione.
Le onde sono in grado di “sovrapporsi”, mentre due corpuscoli sono incapaci
di farlo.
Sembrerebbe quindi che non ci sia una parentela tra onda e corpuscolo: per
ogni fenomeno fisico ci si può chiedere . appartiene al campo delle onde o
dei corpuscoli? Interrogativo che ha raggiunto l’apice nel XIX sec: la luce è
un’onda o un corpuscolo?
L’esperimento delle due fenditure
Questo esperimento, del quale Feynman diceva che riassumeva l’essenza
dell’anomalia quantistica, dimostra in definitiva che questi due approcci,
ondulatorio e corpuscolare, devono essere superati.
Immaginiamo una macchina che lanci palline, con stessa velocità ma in
direzioni casuali verso un “muro” in cui vi sono due fenditure parallele e
ravvicinate. Collochiamo, oltre il muro, alcune scatole dove vengono raccolte
le palline che oltrepassano il muro passando attraverso una delle due
fenditure. v.fig.1
23
fig.1
Se, dopo aver lanciato un gran numero di palline, si contano quelle raccolte,
si ottiene un campionamento che indica come varia la probabilità di arrivo al
variare del punto di impatto.
La probabilità P12 che una pallina arrivi in una certa scatola quando le due
fenditure sono aperte è la somma della probabilità P1 che arrivi quando è
aperta solo la fenditura 1 e della probabilità P2 che arrivi quando è aperta
solo la fenditura 2
P12 = P1 + P2
Cioè la pallina deve passare o dalla fenditura 1 o dalla 2 per poter arrivare
ad una certa scatola
Ripetiamo lo stesso esperimento utilizzando delle onde
Si ottiene un risultato molto diverso da quello ottenuto con le palline:
compaiono le “frange di interferenza”: v. fig2
24
Fig.2
L’esperimento delle due fenditure quindi ci permette di stabilire il tipo di
oggetto con cui abbiamo a che fare: onde se da luogo a interferenza,
corpuscoli in caso contrario.
25
Ripetiamo ora l’esperimento utilizzando degli elettroni. v.fig.3
fig.3
Un cannone elettronico invia elettroni su una lastra su cui si aprono due
fenditure; al di là della lastra è presente un rivelatore
Se immaginiamo che gli elettroni siano corpuscoli ci aspettiamo di ritrovare lo
stesso risultato ottenuto nel caso delle palline: ma sullo schermo si osservano
frange di interferenza, segno di un comportamento ondulatorio. Riduciamo
l’intensità del cannone in modo che gli elettroni fuoriescano uno alla volta: si
constata che ogni elettrone arriva in un punto ben preciso, ma all’accumularsi
degli impatti si osservano nuovamente le frange di interferenza . v.fig.4
26
Fig.4
Non sono corpuscoli (danno luogo a interferenza),ma neanche onde
(vengono rivelati come macchioline che accumulandosi danno luogo a figure
di interferenza)
Ripetendo più volte l’esperimento aprendo entrambe o una sola delle due
fenditure si osserva che gli stati “aperto” o “chiuso” delle due fenditure
condizionano la distribuzione spaziale degli elettroni sullo schermo; non
possiamo dire attraverso quale fenditura passano gli elettroni
27
Ripetendo l’esperimento cercando di individuare la fenditura attraverso cui
passa l’elettrone, otteniamo un comportamento identico a quello delle palline.
v. fig.5
fig.5
Non è quindi possibile osservare l’interferenza identificando
contemporaneamente la fenditura attraverso cui passa l’elettrone.
Conclusioni dell’esperimento
I risultati dell’esperimento sono validi per tutte le entità chiamate “particelle”
1) se si utilizza un dispositivo che rende i cammini indistinguibili si
manifesta il carattere ondulatorio, se invece si utilizza un dispositivo che
permette di distinguere i cammini si evidenzia il carattere corpuscolare
2) le particelle sono state in qualche modo “disturbate”dalla misura: ogni
misura sembra interagire tra l’oggetto microscopico su cui si effettua la
misura e lo strumento, che è macroscopico.
28
“Il punto cruciale sta nel riconoscimento del fatto che qualunque tentativo
di analisi, inteso nel modo proprio della fisica classica dell’individualità dei
processi atomici, risulterebbe frustrato, in quanto condizionato dal quanto
di azione, dall’ineliminabile interazione tra gli oggetti atomici e gli strumenti
di misura”.
( Niels Bohr )
Questa concezione dell’operazione di misura non esisteva nella fisica
classica.
Che senso ha allora parlare delle proprietà di un oggetto microscopico
finché su di esso non è stata effettuata una misura ? Questo interrogativo
sulla realtà delle cose al di fuori della misura o dell’osservazione, ce lo
saremo già posti quando ci siamo domandati se la lampadina del
frigorifero sia davvero spenta quando la porta è chiusa.
Riprenderemo più avanti questo aspetto con il “postulato di misura”
3) un esperimento appare parziale e finalizzato. Uno strumento di misura
rende evidente una particolare grandezza, ma non un’altra.
Approfondiremo più avanti questo aspetto analizzando il “principio di
complementarità”
la natura della strumentazione determina quindi la tipologia dei fenomeni
osservati
4) il concetto di traiettoria fondamentale in fisica classica, crolla. Infatti
osservando le frange di interferenza non siamo in grado di dire quale
percorso hanno seguito le particelle.
5) l’idea classica per cui le condizioni iniziali e le forze in gioco permettono
di determinare il moto di una particella viene meno. infatti non sappiamo
dire anticipatamente con certezza in quale punto la particella colpirà lo
schermo.
Nella meccanica ondulatoria di Schrödinger il ruolo dell’onda è assunto dalla
funzione d’onda, ψ, e, nell’esperimento della doppia fenditura si parla di
sovrapposizione delle due funzioni d’onda che si hanno quando è aperta
ognuna delle due fenditure: ma si tratta di onde di probabilità e non di onde
nel senso classico del termine.
Secondo l'interpretazione di Max Born quest'onda indica la probabilità di
trovare la particella in un determinato punto e dal punto di vista matematico
questo valore è dato da | ψ|2.
Questa interpretazione probabilistica di ψ è lo strumento per creare il legame
tra le formule della fisica quantistica e l'osservazione dell'esperimento: è per
così dire il primo passo dell'interpretazione
29
Una nuova rappresentazione degli oggetti fisici
Tutte le particelle a volte presentano aspetti ondulatori a volte corpuscolari :
questa ambiguità, sviluppata da Bohr nel 1927 consiste nel dire che questi
due aspetti sono complementari.
Questo concetto sfociò nelle discussioni dell’epoca a proposito
dell’”interpretazione” della fisica quantistica provocando la divisione del
gruppo dei fondatori: Planck, Einstein, Schrödinger e de Broglie da una parte
e Heisenberg, Pauli, Born e Dirac dall’altra.
E’ evidente che nel comportamento dell’elettrone c’è un aspetto riconducibile
a quello ondulatorio. Se l’esperimento viene realizzato con le onde
l’interferenza viene spiegata con l principio di sovrapposizione.
Qual è allora l’equivalente dell’altezza di un’onda nell’acqua per l’elettrone?
E’ l’ampiezza di probabilità dove “ampiezza” ricorda l’aspetto ondulatori e
“probabilità” anticipa l’interpretazione del formalismo che verrà data in
seguito. Un’ ampiezza di probabilità non è altro che un numero complesso
il cui valore è funzione delle coordinate spaziali e temporali come l’altezza di
un’onda nell’acqua dipende dalla posizione e dal tempo.
Sia a1 l’ampiezza di probabilità nel caso in cui sia aperta solo la fenditura 1 e
P1, la probabilità che l’elettrone compaia in un punto M dello schermo, sia
data dal modulo elevato al quadrato di a1 e analogamente se si apre la
fenditura 2 :
P1 = | a1 |2
e
P2 = | a2 | 2
Se sono aperte entrambe le fenditure la probabilità P12
compaia in un punto M dello schermo sarà:
P12 = | a1 + a2 |
che un elettrone
2
Il quadrato di una somma non è uguale alla somma dei quadrati, di
conseguenza la probabilità P12 non è uguale alla somma delle probabilità P1
e P2 .
In particolare la probabilità P12 che un elettrone si manifesti in un punto in
cui a1 e a2 sono opposte è nulla: sono le frange scure dove non compare
alcun elettrone come l’equivalente caso delle onde nell’acqua.
30
Teniamo conto di questa descrizione in termini probabilistici del fatto che gli
elettroni, se numerosi, producono una figura di interferenza, quando si
esporrà la sostanza del formalismo quantistico.
Il principio di Heisenberg
Werner Heisenberg è stato uno dei uno dei padri della fisica quantistica; nel
1928 scoprì che ci sono casi in cui due grandezze fisiche non possono
essere determinate nello stesso tempo e con precisione o meglio non
possono essere predeterminate con precisione: non solo non si può sapere
cosa accade in certi fenomeni, ma pare che la stessa natura non si decida a
fare delle scelte. Quindi il principio di Heisenberg, chiamato di
“indeterminazione”, contrariamente a quanto spesso si afferma implica una
limitazione della precisione delle misura solo in un senso lontano dalla
accezione comune del termine.
Questo principio può essere dimostrato in modo rigoroso a partire da una
caratteristica degli “operatori” che il formalismo quantistico associa a ogni
tipo di misura: la loro non commutatività. Questo termine indica la
dipendenza dei risultati sperimentali dall’ordine cronologico in cui vengono
utilizzati gli strumenti.
Già il filosofo greco Zenone di Elea più di 2000 anni fa, si era posto il
problema: una freccia in volo non si poteva trovare, in alcun momento, in un
punto determinabile con precisione, perché se così fosse il moto non sarebbe
possibile. Heisenberg propose un esempio analogo, quello di voler colpire un
oggetto con un proiettile, ma questo presuppone di conoscere la traiettoria
(insieme delle posizioni occupate successivamente dal proiettile ) di
quest’ultimo, cioè di vederlo e quindi dovrà essere illuminato. La luce però
esercita una “pressione di radiazione” minuscola per gli oggetti macroscopici
ma “gigantesca” per una particella. Da qui il dilemma : o si irraggia la
particella perturbando così la sua traiettoria o non la si irraggia , e non si
saprà nulla sulla sua traiettoria.
C’è anche un’ altra considerazione da fare: in base alle leggi dell’ottica, per
poter “vedere” la particella la luce dovrà avere una lunghezza d’onda dello
stesso ordine di grandezza della particella stessa e se questa è piccola
anche la lunghezza d’onda sarà piccola , quindi trasporterà una “grande “
energia e l’impulso trasferito sarà grande; se viceversa, per avere un
trasferimento di energia “piccolo” invio un fascio di luce con piccola
frequenza, quindi grande lunghezza d’onda, non si riuscirà a “vedere”
31
l’elettrone. Una riduzione dell’indeterminazione sulla posizione della particella
comporta quindi un aumento dell’indeterminazione sulla sua velocità.
In generale questa conclusione viene riassunta dicendo che non si possono
conoscere contemporaneamente la posizione e la velocità di una particella
quantistica.
Ma questa formulazione è discutibile perché presuppone che ogni particella
sia un corpuscolo e lascia intendere che esistano una posizione esatta ed
una velocità esatta.
Il modo corretto di interpretare il principio di Heisenberg non consiste nel dire
che è impossibile determinare contemporaneamente posizione e velocità ma
nell’affermare che esse non possiedono mai questi due attributi
contemporaneamente, non è possibile preparare uno stato di un sistema che
abbia contemporaneamente valori ben definiti per due osservabili.
Come per l’indeterminazione anche la complementarità introdotta da Bohr,
accennata precedentemente, non è un principio ma può essere ricavato dagli
assiomi. Il principio di complementarità può essere enunciato nel seguente
modo:
non è possibile conoscere contemporaneamente tutte le proprietà che un
oggetto può avere.
Tornando al principio di Heisenberg, questo non è quindi una limitazione della
nostra possibilità di conoscenza ; nel quadro quantistico la posizione o
l’impulso possono essere misurati con una precisione grande a piacere,
semplicemente le misure di queste grandezze effettuate su sistemi fisici
preparati nello stesse condizioni non daranno gli stessi risultati. Sono
statisticamente “dispersi”. Il principio di Heisenberg stabilisce che il prodotto
tra la dispersione sulla misura della posizione e la dispersione sul valore
dell’impulso non può mai essere nullo, deve essere maggiore o uguale a un
numero diviso per 4π
ΔxΔp ≥ h/4π
Δx indica la precisione della misura dell’osservabile posizione
Δp la precisione della misura dell’osservabile quantità di moto e
ħ = h / 2π ( h “tagliata”)
La costante di Planck
la costante di Planck h e ha il valore di 6,62 · 10-34 J s, costante introdotta da
Planck nel 1900 per la spiegazione del problema del corpo nero. La costante
32
di Planck è una costante universale ed è diventata l’emblema del mondo
quantistico. Rappresenta l’ ”azione” , una grandezza fisica che ha le
dimensioni di un’energia per un tempo o di un impulso per una lunghezza e
la cui esistenza significa che due sistemi possono interagire solo se si
scambiano ”qualcosa” che non può essere ridotto a niente. E’ da questa
costante che il mondo quantistico trae la sua strana specificità: un universo in
cui la costante fosse nulla sarebbe banalmente classico
L’effetto tunnel
Un fenomeno reso possibile dal principio di H.eisenberg è l’effetto tunnel.
Andiamo sulle Alpi, lanciamo una pallina verso la cima di una montagna, via
via che sale perde velocità, perde energia cinetica ed aumenta quella
potenziale gravitazionale in modo che l’energia totale resti costante: o. la
pallina riesce ad oltrepassare la vetta o tornerà indietro: è stata riflessa da
una “barriera di potenziale”. La meccanica classica impedisce ad una palina
che non possegga una velocità sufficientemente elevata di oltrepassare la
“vetta”. In fisica quantistica è diverso. La violazione di questa legge della
fisica classica da luogo all’effetto tunnel, identificato nel1928 da George
Gamow relativamente ad un fenomeno del campo della radioattività : una
particella può apparire dall’altra parte di una barriera di energia anche se, per
le leggi della meccanica classica, non dovrebbe essere in grado di
oltrepassare. E’ come se questa barriera, la nostra montagna, fosse
“bucata”da un tunnel attraverso il quale la particella, dopo vari tentativi, riesce
a passare.
La fisica quantistica non dice che tutte le particelle riescono a passare ,
dimostra che la probabilità che una particella ha di passare, e l’esperienza lo
dimostra, non è rigorosamente nulla.
L’effetto tunnel interviene per esempio nel campo dell’elettronica: ci sono
diversi dispositivi basati sulla possibilità che un elettrone attraversi per effetto
tunnel zone proibite dalla meccanica classica, come ad esempio il
microscopio ad effetto tunnel.
33
Nucleo essenziale del “formalismo” matematico
La fisica quantistica si basa su un formalismo matematico estremamente
rigoroso :vediamo di esporne il nucleo essenziale.
Una proprietà che accomuna tutte le tipologie di onde è il principio di
sovrapposizione , la fisica quantistica la riprende, la generalizza dandole una
portata molto ampia.
Un sistema fisico è definito da un certo numero di caratteristiche che sono
identiche per tutti i sistemi dello stesso tipo e da altre grandezze che possono
variare da uno all’altro. In fisica classica l’insieme di queste quantità forma lo
“stato” del sistema, per esempio della particella, cui evoluzione temporale
determinata dalla legge fondamentale della dinamica di Newton.
Come rappresentare l’equivalente di questo stato nella fisica quantistica?
Formalizziamo maggiormente l’esperimento delle due fenditure di cui
avevamo dato una spiegazione abbozzata. Rappresentiamo lo stato di un
sistema fisico per mezzo di alcune entità, indicate con a, b, c…. che
debbano soddisfare due proprietà
1) vale il principio di sovrapposizione, nel senso che se a e b sono due
stai possibili anche lo stato (a + b ) è uno stato possibile del sistema.
Generalizziamo cioè il principio di sovrapposizione delle onde a qualunque
sistema fisico
2) queste quantità possono essere moltiplicate per un numero qualunque,
come nel caso delle onde si può parlare di onda di ampiezza doppia o tripla
rispetto ad un’altra
Le entità matematiche che soddisfano a queste due proprietà sono i
vettori e l’insieme dei vettori si chiama spazio vettoriale. Chiameremo quindi
le entità a, b, c …che rappresentano i diversi stati possibili vettori di stato (
funzione d’onda in una vecchia terminologia ). Le osservabili fisiche, cioè ciò
che si può misurare, sono descritte tramite operatori lineari.
I vettori di stato sono il mezzo con cui il formalismo quantistico rappresenta
gli stati fisici dei sistemi e sono funzioni dello spazio e del tempo; questa è
l’idea fondamentale della fisica quantistica: impone l’addizione a tutti.
Bisogna però chiarire il significato di vettore che non è quello classico
( oggetto nello spazio ordinario caratterizzato da modulo e direzione). Uno
spazio vettoriale matematico è una costruzione astratta che può avere come
non avere nulla a che fare con lo spazio ordinario: questi spazi vettoriali usati
per definire gli spazi quantistici sono chiamati spazi di Hilbert; uno spazio di
Hilbert può avere un numero di dimensioni finito o infinito.
34
Paradossi quantistici: “il barile di polvere” e “il gatto di Schrődinger
Come sopra detto Il formalismo della fisica quantistica opera in spazi vettoriali
astratti ( spazi di Hilbert) che possono avere un numero infinito di dimensioni
e quindi molto lontani dallo spazio fisico dove avvengono gli eventi che il
formalismo pretende di descrivere. Si crea quindi una distanza tra la
rappresentazione dei fenomeni ed i fenomeni stessi.
A partire dal 1935 Einstein e Schrödinger per evidenziare l’aspetto
paradossale del principio di sovrapposizione idearono ciascuno un
esperimento mentale: “il barile di polvere ( Einstein) e “il gatto di Schrödinger
(Schrödinger ).
Il barile di polvere. Ad un barile di polvere da sparo instabile chimicamente è
accoppiato un atomo radioattivo la cui disintegrazione rilascia energia
sufficiente ad innescare l’esplosione. Dal momento che la disintegrazione può
essere prevista solo n modo probabilistico il vettore di stato dell’atomo è la
sovrapposizione dello stato atomo disintegrato e dello stato atomo non
disintegrato. Analogamente lo stato del barile sarà la sovrapposizione di
barile esploso e barile non esploso . Ma nel mondo macroscopico
sovrapposizioni di stato del genere non esistono
Il gatto di Schrődinger. Immaginiamo una scatola all’interno della quale si
trovi un gatto ed immaginiamo uno strumento in grado di rivelare l’emissione
di una particella da parte di un atomo radioattivo che si disintegra, collegato
ad un martello che, in caso di disintegrazione dell’atomo,si abbatte su una
fiala, posta nella scatola, contenete un gas mortale provocandone la rottura e
la morte istantanea del gatto.
Il vettore di stato del sistema ( scatola+gatto+martello+fiala) è complesso ed
è dato dalla sovrapposizione dello stato
Atomo disintegrato – martello abbassato – fiala rotta –gatto morto
e dello stato
atomo non disintegrato – martello alzato – fiala intatta – gatto vivo
Finché non si compie un’osservazione il gatto è né vivo né morto
Schrődinger, dal suo punto di vista, introduce la “soggettività” , assenza o
presenza di un “osservatore”
Spieghiamo cosa succede quando ci sono sovrapposizioni di stati.
Consideriamo una particella che può esistere in due stati diversi rappresentati
rispettivamente dal vettore di stato a e b
35
Fig.6
L’apparecchiatura è schematicamente rappresentata nella figura 6
La particella proviene da sinistra attraverso il canale I e viene diretta nel
canale A se si trova nello stato a e nel canale B se ritrova nello stato b.
Dobbiamo descrivere anche lo stato della particella dal punto di vista
spaziale, cioè specificare in quale canale (I, A o B) si trova ricorrendo ai
vettori di stato indicati con I, A, B .
Lo stato completo della particella che specifica il suo stato interno e la sua
localizzazione sarà dato dal prodotto dei vettori I,A,B con i vettori di stato
interni a, b
Con questa notazione una particella che si trova nello stato interno a ed è
situata nel canale I sarà rappresentata dal prodotto aI.
Avremo quindi
aI → aA
bI → bB
per il principio di sovrapposizione: anche (a + b ) è un possibile stato interno
della particella e si avrà
(a + b ) I → aA + bB
Cioè il suo vettore di stato si ottiene sommando membro a membro le due
relazioni precedenti
Come si può interpretare il membro di destra ?
E’ a combinazione di due termini, canale A e canale B,, ma se la particella è
indivisibile non può ripartirsi nei due canali; anche uno strumento posto
all’uscita dei canali rivelerebbe particella in A o in B, mai in entrambi
36
Si possono dare altre interpretazioni ma dire cosa sia lo stato di
sovrapposizione (a + b ) nessuno lo sa realmente, e questo è ciò che rende
la fisica quantistica così difficile da interpretare Ci dice semplicemente che se
ripetiamo molte volte l’esperimento partendo dallo stato (a + b ) I all’uscita
troveremo la particella nello stato a e nel canale A nella metà dei casi e nello
stato b e nel canale B nell’altra metà.
La fisica quantistica fornisce solo delle probabilità, finché la misura non è
stata effettuata la grandezza che quantifica la proprietà fisica non è
rigorosamente definita.
“collasso della funzione d’onda” o riduzione dello stato
Ripensiamo all’esperimento precedente .
Prima della misura lo stato della particella era dato da ( aA + bB ). Se la
particelle viene rivelata nel canale A nello stato a, dopo la misura il suo stato
è diventato aA, il suo stato interno e la sua localizzazione sono ben definiti,
ciò significa che la sovrapposizione quantistica è stata distrutta dalla misura,
la misura ha in qualche modo costretto il vettore di stato a perdere uno dei
suoi termini. Si dice che è avvenuta una riduzione dello stato o collasso
della funzione d’onda
Effettuando una misura, otteniamo
quindi un’informazione parziale:
sappiamo che dopo la misurazione la particella è localizzata in un certo
canale ma non abbiamo informazioni sulle probabilità che aveva a priori di
essere rivelata in un determinato canale. In altre parole non si può affermare
che la particella rivelata in un canale vi si trovasse già prima della misura.
Il vettore di stato della particella prima della misura contiene tutte le
possibilità del sistema e fornisce solo la probabilità che la misura dia come
risultato un valore o un altro.
Il problema della misura in fisica quantistica porta ad interrogarsi su ciò che
si intende per realtà.
La riduzione dello stato sembra una regola “appiccicata” sul formalismo
matematico per stabilire una connessione tra sistemi fisici ed i risultati
sperimentali, però le previsioni che consente di fare sono sempre in accordo
con le osservazioni anche se pone dei problemi sull’interpretazione.
In primo luogo se il formalismo quantistico è completo, cioè se è vero che
il vettore di stato contiene tutto ciò che è possibile sapere di un sistema
quantistico, bisogna ammettere che un fenomeno non può essere interpretato
come se fornisse informazioni riguardanti le proprietà che avrebbero gli
oggetti in sé.
In secondo luogo ci si può chiedere se la riduzione di stato sia un
espediente o un effetto fisico reale. Ciò ha portato a discussioni e diatribe tra i
37
fisici che hanno dimostrato come questo principio porti a situazioni
paradossali come quello ideato da de Broglie
La fisica quantistica è completa ?
De Broglie enunciò il paradosso che porta il suo nome nel 1959 turbato dalla
riduzione dello stato.
Consideriamo una scatola contenente un elettrone. Prima di qualsiasi
osservazione la probabilità di trovare l’elettrone è circa la stessa in qualunque
punto della scatola, perché il vettore di stato che lo rappresenta occupa tutto
il volume. Supponiamo di dividere la scatola in due parti di uguale volume, A
e B, con una doppia parete scorrevole; il vettore di stato ora si distribuisce in
A e in B con probabilità ½ di trovarlo in A o in B. Portiamo la scatola B a
grande distanza dalla A, apriamo la scatola A, l’elettrone è al suo interno,
sappiamo quindi con certezza che non si trova nella scatola B, quindi il suo
vettore di stato in B è nullo.
Il buon senso ci fa dire che l’elettrone si trovava in A già da quando la
scatola era stata suddivisa: il vettore di stato non è stato annullato dalla
misura, è sempre stato nullo .
Ma la fisica quantistica non dice così: il vettore di stato è distribuito
equamente nelle due scatole.
Se la fisica quantistica è completa bisogna ammettere due cose:
1) il fatto di rivelare la particella nella scatola A ha annullato (a distanza) Il
vettore di stato della scatola B.
2) fino a quando la misura non è stata effettuata l’elettrone non era
localizzato in una sola scatola : aleggiava nelle due scatole come un
“fantasma diluito”.
Alcuni fisici hanno tentato di rendere le cose più accettabili ritenendo che la
fisica quantistica sia incompleta; consente di fare previsioni giuste quindi è
predittivamente completa, ma i vettori di stato non contengono la totalità
dell’informazione, tralasciano di considerare alcuni parametri supplementari,
le variabili nascoste. Nel caso della scatola, il fatto di dire che l’elettrone
osservato in A era già in A prima dell’apertura equivale a introdurre un
nuovo parametro che il vettore di stato non conteneva.
E’ giusto pensare che la fisica quantistica sia incompleta ? Questa domanda
è alla base della controversia tra Niels Bohr ed Albert Einstein
38
Correlazione quantistica o “entanglement”
L’idea dell’ entanglement risale a Einstein, ma Bohr la ignorò: erano entrambi
di fine ingegno e celebri restano le loro discussioni. Bohr accettava
completamente la teoria quantistica mentre Einstein ne era profondamente
scettico.
Il fenomeno dell’ entanglement è la caratteristica essenziale della meccanica
quantistica,ciò che la rende diversa dalla meccanica classica: mette in
discussione la comprensione di ciò che è reale nel mondo fisico.
Quando abbiamo a che fare con una coppia di particelle pensiamo che sia un
sistema separabile, cioè riteniamo di poter trattare separatamente ognuna
delle particelle. Einstein spiegò a Bohr il fatto che in meccanica quantistica si
può conoscere tutto di un sistema ma nulla delle sue singole componenti, ma
non venne compreso né da Bohr né da generazioni di pubblicazioni
scientifiche seguenti.
Il tutto è la somma delle parti ? La fisica quantistica ci ha insegnato a diffidare
delle idee più ovvie
Particelle che si intrecciano
Immaginiamo due particelle che si muovono una contro l’altra fino a
collidere. Prima dell’urto ciascuna particella è descritta da un vettore di stato,
ma come descrivere la coppia nel suo insieme ?
Classicamente siamo portati a scrivere la somma dei due vettori di stato
individuali, ma la fisica quantistica descrive la coppia di particelle con il
prodotto dei due vettori di stato individuali.
Dal calcolo, che per ovvie ragioni tralasciamo, risulta che dopo la collisione,
quando le particelle sono molto lontane tra loro, il vettore di stato della coppia
non può essere scomposto in due vettori di stato, ognuno corrispondente a
una particella: solo la coppia, e non i suoi elementi, ne possiede uno definito;
questo vettore di stato ha intrecciato le particelle.
Questo fenomeno, chiamato correlazione quantistica o entanglement
scoperto da Schrődinger negli anni ’30 implica conseguenze importanti e
nello stesso tempo di difficile comprensione.
Per cercare di capire questo concetto consideriamo la seguente situazione.
Abbiamo due particelle identiche, “particella 1” e “particella 2” prodotte
insieme da una sorgente che si allontanano in direzioni opposte: ognuna
delle due è caratterizzata dal suo stato interno (a o b ) e dalla sua
localizzazione e supponiamo che non si possano trovare nello stesso stato
interno. Si dice allora che gli stati interni sono “correlati” nel senso che la
39
conoscenza di uno è sufficiente a conoscere l’altro senza la necessità di
effettuare una misura.
I vettori di stato vengono spesso indicati con la lettera ψ, allora
ψ1 (a) rappresenta la particella 1 nello stato a e analogamente per l’altra
particella. Se la particella 1 si trova nello stato a e la particella 2 nello stato b
il vettore di stato della coppia sarà
ψ12 = ψ1 (a) x ψ2 (b)
Se invece la particella 2 si trova nello stato a e la particella 1 in quello b
avremo
Ψ21 = ψ2 (a) x ψ1 (b)
Lo stato interno di ogni particella è ben definito, non possiamo però sapere a
priori quale delle due situazioni si realizzerà: le due situazioni sono
egualmente possibili. Di conseguenza il reale vettore di stato della coppia è
dato dalla somma dei vettori di stato corrispondenti a ognuna delle due
possibilità
Ψcoppia = ψ12 + ψ21
Qui si manifesta “l’intreccio”: non si può isolare una parte che si riferisce alla
particella 1 dall’altra che si riferisce alla particella 2: la conoscenza di Ψcoppia
non permette di conoscere lo stato individuale di ognuna delle due particelle
della coppia.
La descrizione del “tutto” non implica quella delle sue parti. Viceversa la
descrizione delle parti non permette di ottenere quella dell’insieme
La non separabilità
Einstein non ha mai accettato, pur essendo un fisico rivoluzionario, alcune
conclusioni cui porta la fisica quantistica.
Le sue obiezioni erano essenzialmente di due ordini: in primo luogo una
buona teoria fisica doveva eliminare il caso e in secondo luogo Einstein
teneva all’idea di realismo: le parti più piccole devono esistere
oggettivamente, come gli oggetti macroscopici che noi li osserviamo o meno.
Sulla base di queste considerazioni Einstein concludeva che la fisica
quantistica era incompleta; le sue obiezioni culminarono nel 1935 con il
40
celebre articolo, detto “EPR” dalle iniziali degli autori, Einstein, Podolsky e
Rosen.
Il paradosso EPR e teorema di Bell
In questo articolo propose un esperimento mentale che voleva mostrare che
la teoria quantistica non ci dice tutto quello che dobbiamo aspettarci dal una
buona teoria fisica.
Facciamo un semplice esempio.
Mettiamo due carte, una blu ed una verde, ognuna in una busta sigillata,
diamone una ad Alice ed una a Bob. Quando Alice apre la sua busta e scopre
il colore la probabilità che sia blu è uguale a quella che sia verde : il risultato
è ovviamente “anticorrelato” con quello che otterrà Bob. Non si manifesta
alcun paradosso: non è certamente il fatto che Alice prenda conoscenza
della sua carta a determinare il colore della carta di Bob: al colore della carta
di Bob è associato un elemento di realtà fisica, basta chiedere ad Alice il
risultato che ha ottenuto.
La conclusione di EPR è che almeno uno dei seguenti concetti è
incompatibile con la fisica quantistica
1) località einsteniana : nessun effetto si può propagare più
velocemente della luce; la fisica quantistica potrebbe essere non –
locale
2) completezza : la fisica quantistica potrebbe essere non completa
nel senso che il vettore di stato non determina tutte le informazioni
che possiamo conoscere di un oggetto.
3) realismo : lo stato quantistico potrebbe non essere un’entità fisica e
quindi non sarebbe vincolato dalla località.
La speranza di EPR era che la fisica quantistica fosse incompleta, cioè che
fosse possibile aggiungere delle informazioni al vettore di stato, le cosiddette
“variabili nascoste”, che potessero spiegare le misteriose correlazioni che si
vengono a creare quando Alice e Bob compiono le loro osservazioni. Questo
sogno non potrà essere accettato in modo accettabile per Einstein. Nel 1935,
dopo il lavoro di EPR, il fisico irlandese John Bell avanzò l’idea che le due
particelle entangled, a prescindere dalla loro distanza continuino a costituire
un’unità, un sistema. La misurazione di una delle due particelle modifica lo
stato dell’altra: le due particelle non hanno un’esistenza autonoma. Nel 1964
Bell con il teorema che porta il suo nome mette in luce il contrasto tra il
modello e le previsioni della fisica quantistica.
Secondo questo teorema esiste una contraddizione fra la fisica quantistica e i
41
modelli che funzionano con l’aiuto delle variabili nascoste, detti anche teorie
realistiche locali. Si chiamano “locali” perché in esse le proprietà dei sistemi
dipendono da cosa accade a loro, dalle misurazioni eseguite; le proprietà
osservate sono indipendenti dalle misurazioni eseguite in altri sistemi. Sono
anche dette “realistiche” perché i risultati delle osservazioni sono ricondotti a
proprietà reali dei sistemi.
Secondo Bell quindi qualunque completamento della fisica quantistica è
necessariamente “non locale” in senso einsteniano :
la fisica quantistica è non-locale oppure non-realista
dove “non-locale” è inteso in senso einsteniano e con “non realista” si
intende che non si assegna una realtà fisica al vettore di stato
Esistono formulazioni locali non-realiste, formulazioni non- locali realiste e
formulazioni non-locali non-realiste: Allo stato attuale non sembrano esserci
motivi evidenti per la scelta di un tipo di formulazione piuttosto che di un altro:
sono tutte accettabili e danno gli stessi risultati nell’analisi degli esperimenti.
Conclusioni
Abbiamo visto quanto la fisica quantistica lasciò perplesso anche uno dei
padri fondatori: Einstein. Oggi ne abbiamo una visione più chiara ed è
possibile presentarla con un formalismo matematico potente ed elegante,
anche se comunque è difficile da capire fino in fondo.
Questa teoria ha le conseguenze di una nuova “rivoluzione copernicana”;
allora l’uomo ha scoperto di non essere al centro dell’universo, qui l’uomo
scopre di non essere neppure in grado di afferrare la realtà: la sua mente e i
suoi sensi sono “classici”, il mondo è quantistico. Questo ha conseguenze
che si spingono oltre la fisica per sconfinare nella filosofia: attenzione però i
moderni fisici sono tutt’altro che filosofi e la fisica quantistica è il faticoso
risultato di un solidissimo metodo scientifico nato con Galileo.
La rivoluzione portata non è rimasta senza conseguenze pratiche: nuove
invenzioni e applicazioni stanno emergendo: dal computer
quantistico alla crittografia quantistica, alla metrologia quantistica.
Inizia un’era dove la tecnologia quantistica avrà un ruolo sempre più
importante
42
E’ bene notare che la fisica quantistica, nonostante il principio di
indeterminazione, la probabilità e i problemi di un sua interpretazione, è la
teoria il cui accordo con le prove sperimentali è il più preciso di tutta la
storia della fisica
43
BIBLIOGRAFIA
I principi fisici della teoria dei quanti - Werner Heisenberg
La Fisica di Feynman - Richard Feynman, Robert Leighton, Matthew Sands
Il velo di Einstein - Anton Zeilinger
Meccanica quantistica, caos e sistemi coplessi. - Lorenzo Maccone e Luca
Salasnich
Piccolo viaggio nrl mondo dei quanti - E'tienne Klein
Meccanica quantistica. - Leonard Susskind- Art Friedman
Trent'anni che sconvolsero la fisica. - George Gamov
Fisica quantistica per poeti - Leon M. Lederman- Christopher T.Hill
Atomi, Nuclei e Particelle - Enrico Fermi a cura di Vincenzo Barone
44